Примерная программа наименование дисциплины «Химия» Рекомендуется для направления подготовки
| Вид материала | Примерная программа |
- Примерная программа наименование дисциплины «Биологическая химия» Рекомендуется для, 320.36kb.
- Примерная программа наименование дисциплины «Неорганическая и аналитическая химия», 341.23kb.
- Примерная программа наименование дисциплины «Органическая и физколлоидная химия» Рекомендуется, 351.38kb.
- Примерная программа наименование дисциплины неорганическая химия рекомендуется для, 263.82kb.
- Примерная программа наименование дисциплины аналитическая химия рекомендуется для направления, 147.22kb.
- Примерная программа наименование дисциплины Химия Рекомендуется для направления (ий), 371.07kb.
- Примерная программа наименование дисциплины Химия Рекомендуется для направления (ий), 333.3kb.
- Примерная программа наименование дисциплины землеустройство рекомендуется для направления, 171.22kb.
- Примерная программа наименование дисциплины Алгебра и теория чисел Рекомендуется для, 486.84kb.
- Примерная программа наименование дисциплины физиология и этология животных рекомендуется, 514.63kb.
1.2.3. Разделы курса «Общая и неорганическая химия» и виды занятий (час)
| № п/п | Наименование раздела курса | Лекц. | Практ. зан. | Лаб. зан. | СРС | Всего |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 1 | Основные законы и понятия химии. Эквивалент. Закон эквивалентных отношений | 2 | | 4 | 8 | 14 |
| 2 | Строение атома и химическая связь. | 2 | 2 | | 8 | 12 |
| 3 | Энергетика химических реакций | 2 | 2 | | 8 | 12 |
| 4 | Скорость химических реакций. Химическое равновесие. | 2 | | 4 | 8 | 14 |
| 5 | Растворы. | 2 | | 12 | 8 | 22 |
| 6 | Окислительно-восстановительные реакции. | 2 | | 8 | 8 | 12 |
| 7 | Комплексные соединения | 2 | 2 | 8 | 8 | 20 |
| 8 | Периодический закон и периодическая система Д.И.Менделеева | 2 | 2 | | 8 | 14 |
| 9 | Биогенные химические элементы | 2 | 4 | 8 | 8 | 22 |
1.2.4. Лабораторный практикум курса «Общая и неорганическая химия»
| № п/п | № раздела курса | Наименование лабораторных работ | Трудоемкость (час) |
| 1 | 2 | 3 | 4 |
| 1 | 1 | Определение молярной массы эквивалента элемента и сложного соединения. | 4 |
| 2 | 4 | Скорость химических реакций. | 4 |
| 3 | 5 | Приготовление растворов. | 4 |
| 4 | 5 | Ионные равновесия в растворах. Гидролиз солей. | 4 |
| 5 | 5 | Буферные растворы. | 4 |
| 6 | 7,8, 9, | Свойства элементов и соединений. Окислительно-восстановительные реакции. Комплексные соединения. | 22 |
1.2.5. Практические занятия курса «Общая и неорганическая химия»
| № п/п | № раздела курса | Наименование лабораторных работ | Трудоемкость (час) |
| 1 | 2 | Строение атома и химическая связь | 2 |
| 2 | 3 | Энергетика химических реакций. | 2 |
| 3 | 7 | Комплексные соединения | 2 |
| 4 | 8 | Периодический закон и периодическая система Д.И. Менделеева. | 2 |
| 5 | 9 | Биогенные химические элементы | 4 |
1.2.6. Примерная тематика курсовых и проектных работ: Выполнение курсовых и проектных работ не предусмотрено.
1.2.7. Учебно-методическое и информационное обеспечение
курса «Общая и неорганическая химия»
а) основная литература
- Алексашин А.Ю., Шпак Н.Е. Общая химия. – М.: Дашков и К, 2010.- 256 с.
- Ардашников Е.И. Сборник задач по неорганической химии. – М.: Академия, 2008. – 208 с.
- Ахметов Н.С. Общая и неорганическая химия. – М: Высшая школа, 2006.- 743 с.
- Батраков В.В. Практикум по общей и неорганической химии. – М.: КолосС, 2007. – 464 с.
- Вольхин В.В. Общая химия.- СПб.: Лань, 2009.-464 с.
- Глинка Н.Л. Задачи и упражнения по общей химии.- М.: Интеграл-пресс, 2009.- 240 с.
- Глинка Н.Л. Общая химия.- М.: Юрайт,2010. – 886 с.
- Гринвуд Н.Н., Эрншо А. Химия элементов.– М.: Бином, 2008.- В 2-х томах 1 том – 600 с., 2 том – 666 с.
- Егоров В.В. Теоретические основы неорганической химии: Краткий курс для студентов с/х ВУЗов. – СПб.: Лань, 2005. - 192 с.
- Коровин В.Н. Общая химия.- М.: Высшая школа,2009. -377 с.
- Лидин Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами.- М.: Бином,2010. – 230 с.
- Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с.
- Неорганическая химия./ Под ред. Ю.Д.Третьякова – М.:Академкнига,2007.- 1209 с.
- Общая и неорганическая химия./ под ред. А.Ф.Воробьева., т.2 Химические свойства неорганических веществ.- М.: ИКЦ «Академкнига», 2007.-544 с.
- Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник.- М.: Высшая школа, 2009 – 560 с.
- Павлов Н.Н., Фролов В.И. Сборник задач и упражнений по общей и неорганической химии. – М.: Дрофа, 2005. – 240 с.
- Угай Я.А. Общая и неорганическая химия.- М.: Высшая школа, 2007. – 527 с.
- Хомченко Г.П., Цитович И.К. Неорганическая химия: Учебник для с.-х. вузов. – СПб: ИТК ГРАНИТ, 2009. – 464 с.
б) дополнительная литература
- Гаршин А.П. Неорганическая химия в схемах, рисунках, таблицах, химических реакциях.- СПб.: Лань, 2003.- 288с.
- Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по химии: Учеб. Пособие для студентов. – М.: Астрель, 2004.- 383 с.
- Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия.- М.: Химия, 2001.- 588 с.
- Князев Д.А., Смарыгин С.Н. Неорганическая химия. 3-е изд. испр., М.: Дрофа, 2004. – 592 с.
- Контрольные задания по курсу общей, неорганической и аналитической химии для студентов заочных факультетов./ Новиков В.Е., Леонова Л.А., Егоров В.В., Воробьева Н.И., Сильвестрова И.Г. и др.- М.: ФГОУ ВПО МГАВМиБ, 2009. – 42 с.
- Лабораторный практикум по аналитической химии.:Учеб.-методич. пособие./ Простов Ю.П., Леонова Л.А., Новиков В.Е. – М.: МГАВМиБ им. К.И.Скрябина, 2000. – 68 с.
- Неорганическая химия. Химия элементов. Учеб. для вузов. В 2-х кн. / Третьяков Ю.Д., Мартыненко Л.И., Григорьев А.Н., Цивадзе А.Ю.- М.: Химия, 2001. – 1055 с.
- Общая и неорганическая химия. Методические указания. Изд. 3-е, перераб. и дополнен./ Леонова Л.А., Новиков В.Е., Егоров В.В., Сильвестрова И.Г., Воробьева Н.И. и др.- М.: ФГОУ ВПО МГАВМиБ, 2009. – 57 с.
- Общая, неорганическая и аналитическая химия. Учебно-методическое пособие для студентов-заочников./ Егоров В.В., Новиков В.Е., Леонова Л.А., Воробьева Н.И., Варламова Е.А., Сильвестрова И.Г., Смольянинова Л.Г.Ефимова Г.Р. – М.: МГАВМиБ, 2005.- 310 с.
- Павлов Н.Н. Общая и неорганическая химия. – М.: Дрофа, 2002.- 448 с.
- Сборник задач и упражнений по общей и неорганической химии: учеб.-методич. пособие)./ Леонова Л.А., Новиков В.Е., Егоров В.В.,Сильвестрова И.Г.,Смольянинова Л.Г.- М.: ФГОУ ВПО МГАВМиБ, 2007. - 102 с.
- Слесарев В.И. Химия: Основы химии живого: Учебник для вузов.- СПб.: Химиздат, 2001.- 784 с.
- Химия: учеб.- методич. пособие./ Воробьева Н.И., Егоров В.В., Леонова Л.А. , Сильвестрова И.Г.и др.- М.: ФГОУ ВПО МГАВМиБ, 2005. – 185 с.
в) программное обеспечение Электронный учебник «Открытая химия 2.5» ООО «Физикон» 2001-2002
в) базы данных, информационно-справочные и поисковые системы
Ресурсы Интернета по химии
Открытый колледж
ссылка скрыта. college.ru/chemistry/index/php.
Рубрикон : энциклопедии, словари, справочники
ссылка скрыта. en. edu. ru/db/msg/7030/sp/3368/2794/2761/
1.2.8. Материально-техническое обеспечение дисциплины:
Стандартные учебные химические лаборатории, лекционная и весовая комнаты, оснащенные наглядными пособиями, установками и приборами, необходимыми для проведения практических занятий (вытяжные шкафы, технические и аналитические весы, термостаты, иономеры, центрифуги и др.)
Оборудование специализированных химических лабораторий: проекционное оборудование, периодические таблицы химических элементов Д.И. Менделеева, таблицы растворимости и электрохимический ряда напряжений металлов, классные доски.
1.2.10. Методические рекомендации по организации изучения дисциплины:
Успешное усвоение материала дисциплины обеспечивается активной учебной деятельностью студентов как во время аудиторных занятий, так и в процессе самостоятельной работы, на которую отводится около 50% всего времени учебной работы. Оба вида учебной деятельности тесно взаимосвязаны.
Наряду с выполнением индивидуальных домашних заданий рекомендуется также проводить проверку самостоятельной работы студентов путем опроса в лаборатории перед началом лабораторной работы и путем проведения контрольных работ. Каждый модуль дисциплины рекомендуется завершать устным коллоквиумом, что способствует успешной психологической подготовке студентов к экзамену.
Текуший контроль знаний студентов осуществляется путём устного собеседования при допуске к выполнению лабораторных работ, защиты отчётов по ним, путем опроса в начале практических занятий и решения задач у доски.
Промежуточный контроль знаний студентов осуществляется путем проведения тестов, включающих вопросы и задания по отработанным разделам.
Итоговый контроль знаний, умений и навыков студентов осуществляется на зачете, который проводится в конце учебного года.
Преподавателям рекомендуется регулярно проверять самостоятельную работу студентов, проводить тестирование по разделам 1, 2, 4, 5, 7, 9 и контрольные работы: № 1 по разделам 1-4; №5– 7; № 3 – 8, 9, а также предлагать написание рефератов по разделам 2, 8 и 9. Рекомендуется более углублённое изучение раздела 9 на факультативных занятиях.
Варианты тестовых заданий для итогового контроля по курсу общей и неорганической химии.
I.Базовый уровень (задания средней сложности).
1. Какие элементарные частицы входят в состав ядра атома:
1) протоны, электроны; 2) электроны, нейтроны;
3) протоны, нейтроны; 4) электроны, позитроны.
2. В молекуле какого соедин.ения одновременно существуют ковалентные и ионные связи?
1) сульфат натрия; 2) оксид фосфора (V);
3) хлорметан; 4) нитробензол
3. Химическая связь наиболее прочная в молекуле:
1) фтороводород; 2) хлороводород
3) бромоводород; 4) иодоводород.
4. Порция аммиака массой 12,75 г занимает объем (л., н.у.) равный
1) 8,16 2) 15,9
3) 9,67 4) 16,8
5. Формула водородного соединения с электронной формулой атома 1s22s22p63s23p63d104s24p64d105s25p4 - это:
1) ЭН; 2) ЭН2;
3) ЭН3; 4) ЭН4.
6. Чему равно ионное произведение воды.
1) 10-8; 2)10-10;
3) 10-14; 4) 10-20.
7. Концентрация каких частиц минимальна в водном растворе Н3РО4?
1) Н+; 2) РО43-;
3) Н2РО4-; 4) НРО42-.
8. Рассчитать отношение концентраций слабой кислоты и ее соли (Са : Сs) в буферном растворе, если рН = 1,74 и рКа = 3,74.
1) 2:1; 2) 100:1;
3) 1:2; 4) 1:100.
9. В 0,5 л раствора содержится 2 моль неэлектролита. Каким осмотическим давлением будет обладать этот раствор при Т = 273 К. (R = 0,082 латм/мольК)
1) 22,4 атм; 2) 11,2 атм;
3) 44,8 атм; 4) 89,5 атм.
10. В 120 г 10 % раствора сульфата магния растворили еще 12 г сульфата магния. Массовая доля сульфата магния в полученном растворе:
1) 20; 2) 15,6;
3) 18,18; 4) 16,2.
11. Что значит раствор глюкозы с массовой долей 0,15?
1) в 100г раствора 15г глюкозы и 100г воды; 2) в 90г раствора 15г глюкозы и 90г воды;
3) в 100г раствор 0,15г глюкозы и 100г воды; 4) в 100г раствора 85г воды и 15г глюкозы.
12. Растворимость газов при увеличении температуры и давления:
1)- увеличивается, уменьшается; 2) - уменьшается, не влияет;
3)- не влияет, увеличивается; 4)-уменьшается, увеличивается.
13. При какой температуре (to C) замерзает 20%-ный раствор глюкозы С6Н12О6?
( К (Н2О) = 1,86º).
1) -2,58; 2)-2,07;
3) -0,2; 4)- 0,75.
14. Найти степень диссоциации хлорноватистой кислоты НС1О в 0,2 н растворе
(К(НС1О) = 5 ∙ 10-8).
1) 510-4 ; 2) 2510-8;
3) 10-8; 4) 10-4 .
15. Рассчитать тепловой эффект следующей химической реакции:
СН4(г) + 2О2(г) = СО2(г) +2Н2О(г)
ΔНº (СН4)(г) = -74,9 кДж/моль; ΔНº (СО2)(г) = -395,4 кДж/моль,
ΔНº (Н2О)(г) = -241,0 кДж/моль.
1) – 561,5 кДж; 2) + 802,5 кДж;
3) +561,5 кДж; 4) – 802,5 кДж.
16. Определить, какая реакция будет протекать самопроизвольно, если:
1) ΔG > 0; 2) ΔG < 0;
3) ΔН = Т ΔS; 4) ΔН > 0; Т ΔS < 0.
17. При каких условиях равновесие в системе N2O4 ⇄ 2NO2, ∆H > 0
сместится влево:
1) повышение давления и повышение температуры;
2) повышение давления и понижение температуры;
3) понижение давления и повышение температуры;
4) понижение давления и понижение температуры.
18. Выражение Кравн для реакции: 4НС1 + О2 ⇄ 2Н2О + С12
1) Кравн =
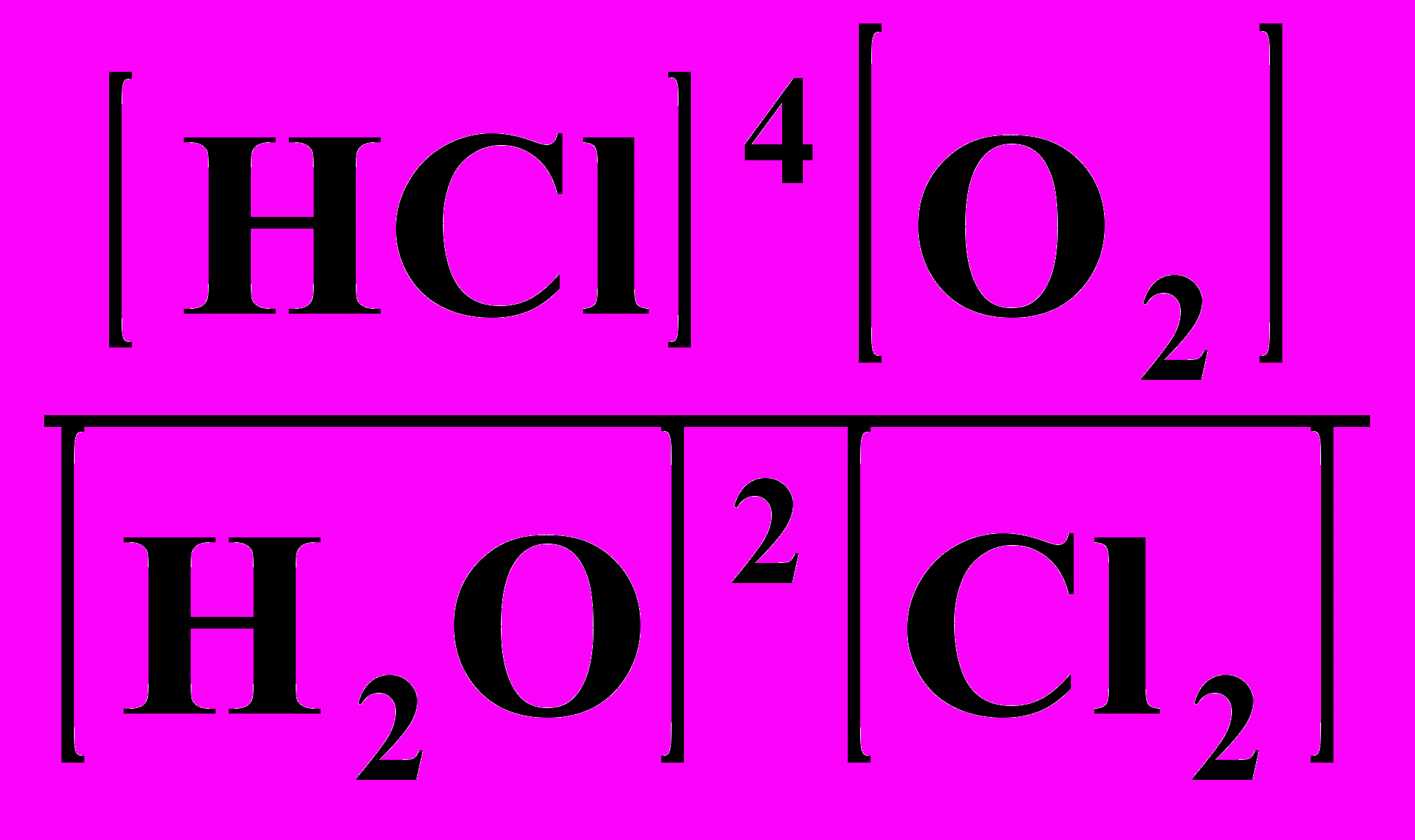 ; 2) Кравн =
; 2) Кравн = 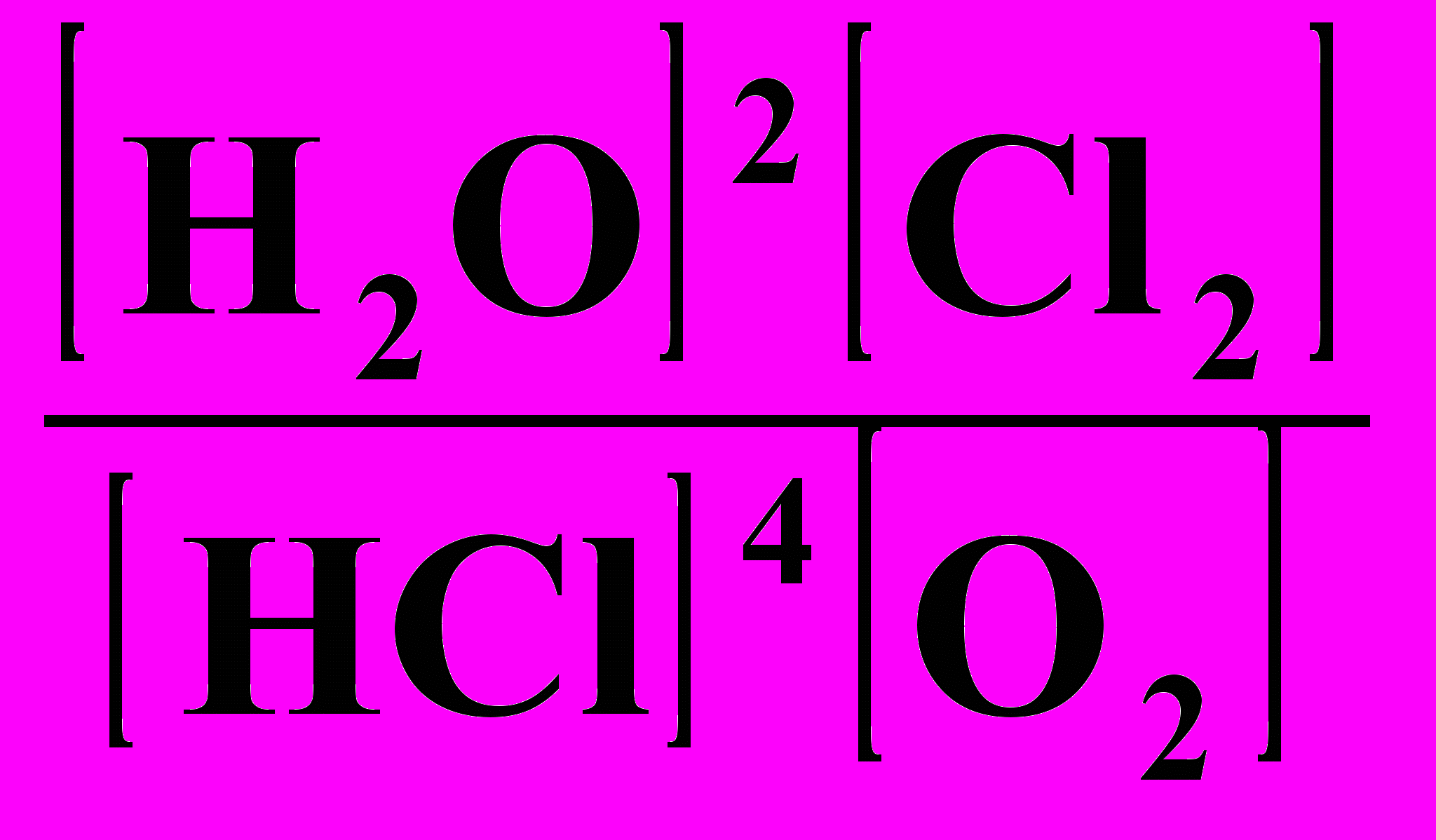 ;
;3) Кравн =
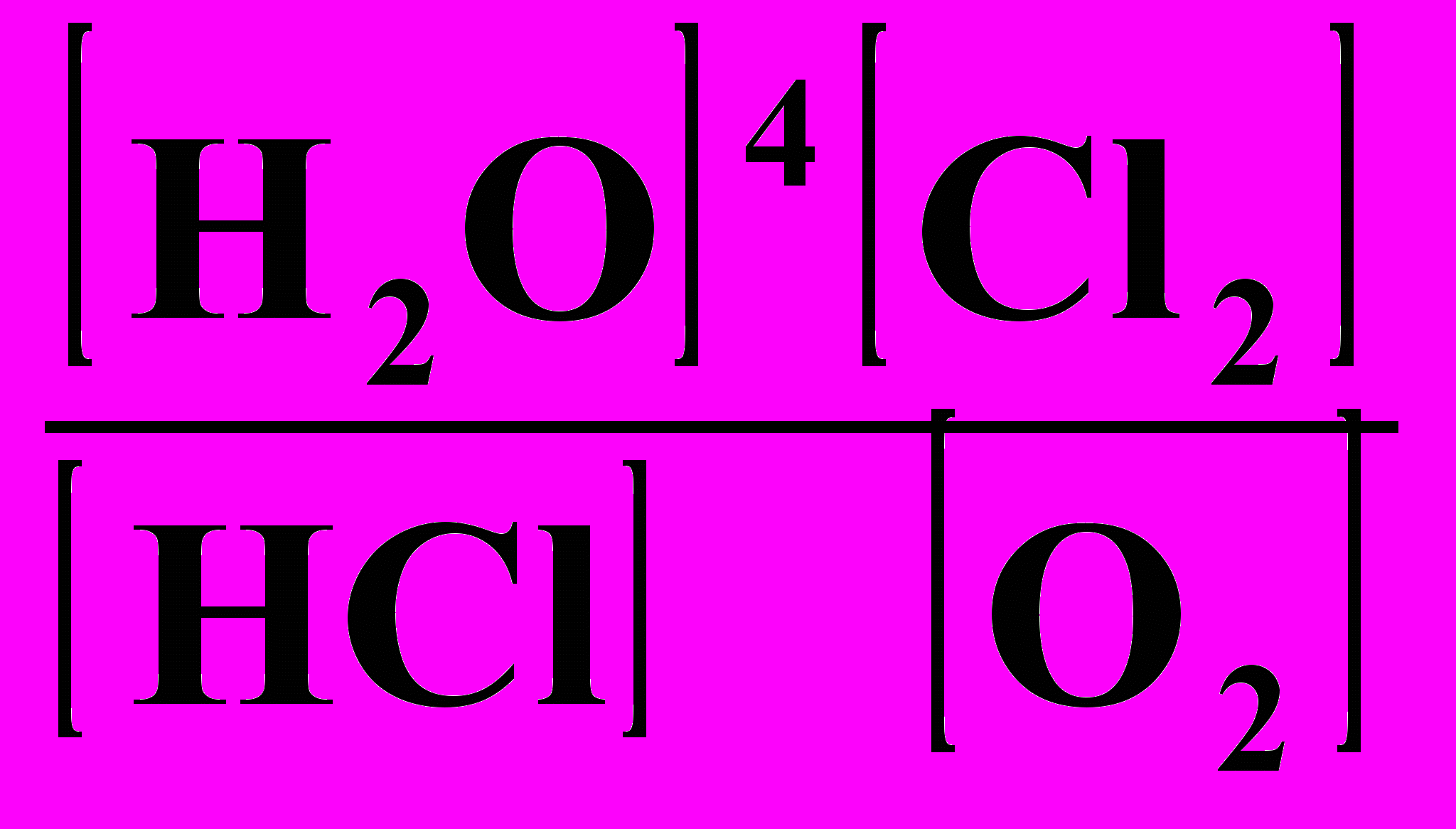 ; 4) Кравн =
; 4) Кравн = 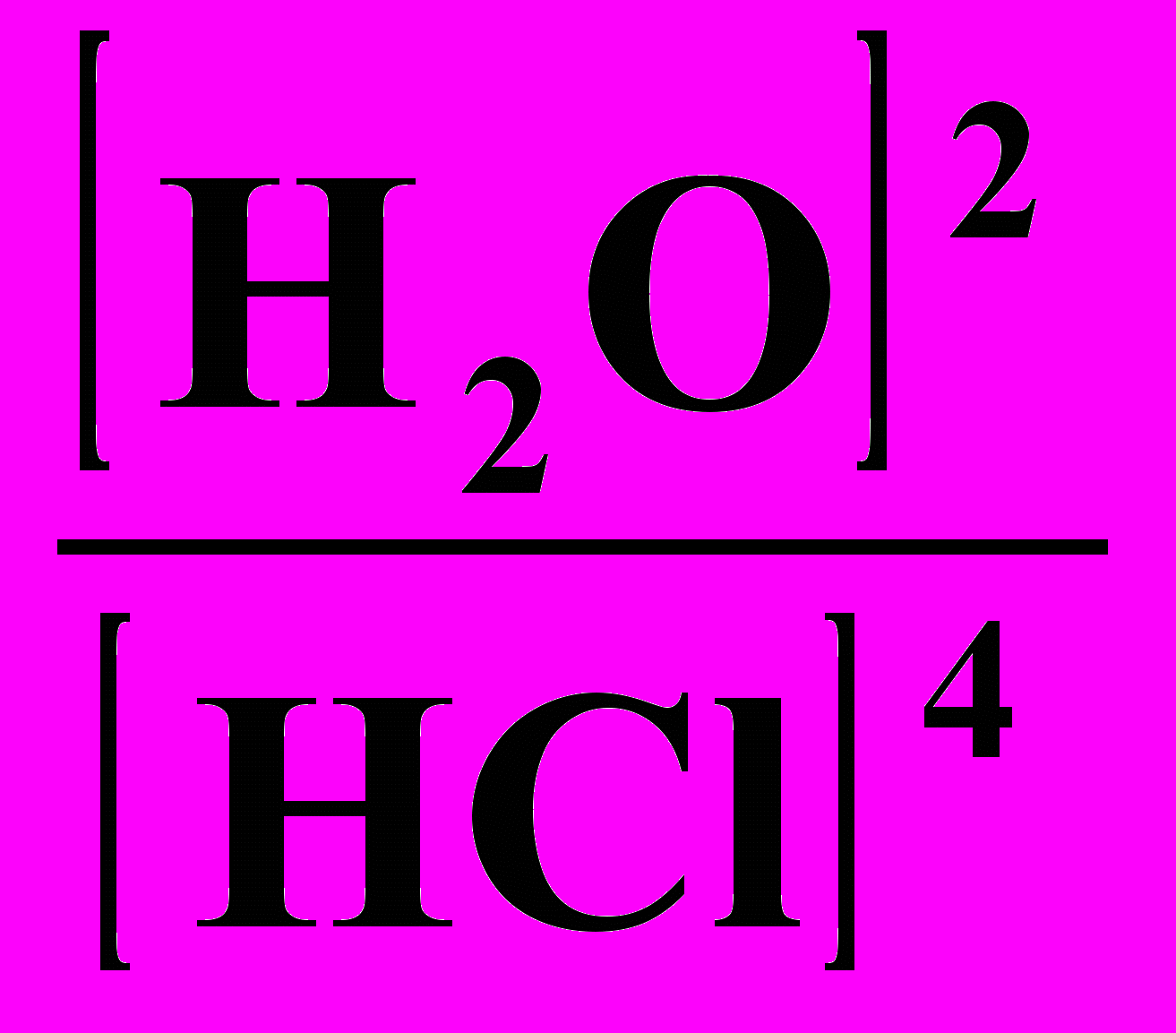 .
.19. Факторы, влияющие на скорость химической реакции. Зависимость скорости химической реакции от концентрации на примере реакции : 2СО + О2 = СО2
1) V = k·[СО][О2]; 2) V = k·[СО];
3) V = k·[СО]2 [О2]; 4) V = [СО]2[О2].
20. При взаимодействии оксидов натрия и кальция с серной кислотой образуются:
1) Na2SO4 и CaS; 2) Na2SO3 и CaSO4;
3) Na2SO4 и CaSO4; 4) Na2S и CaSO4.
II. Продвинутый уровень (задачи повышенной сложности).
1. Формула водородного соединения с электронной формулой атома 1s22s22p63s23p63d104s24p64d105s25p4 - это:
1) ЭН; 2) ЭН2; 3) ЭН3; 4) ЭН4.
2. Общее число электронов в ионе Сr3+ равно:
1) 21; 2) 24; 3) 27; 4) 52.
3. Химическая связь наиболее прочная в молекуле:
1) фтороводород; 2) хлороводород; 3) бромоводород; 4) иодоводород.
4. При действии избытка соляной кислоты на сплав железа с медью выделилось 224 мл газа (н.у.). Вычислить массу сплава, если известно, что железа в нем содержалось 20 %.
1) 2,8 г; 2) 20 г; 3) 0,56 г; 4) 3,4 г.
5. Рассчитать тепловой эффект следующей химической реакции:
СН4(г) + 2О2(г) = СО2(г) +2Н2О(г)
ΔНº (СН4)(г) = -74,9 кДж/моль,
ΔНº (СО2)(г) = -395,4 кДж/моль,
ΔНº (Н2О)(г) = -241,0 кДж/моль.
1) 638,4 кДж; 2) 563,5 кДж; 3) 713,3 кДж; 4) 472,3 кДж.
6. Кр для реакции 2SO2 + O2 = 2SO3, если равновесные концентрации SO2, O2, SO3 равны соответственно 0,5; 0,3; 0,1 моль/л.
1) 0,075; 2) 13,3; 3) 6,67; 4) 0,15.
7. Веществами Х1, Х2, Х3, Х4 в цепочке превращений
+H2O +HCl эл.ток + HNO3 tº
Na → X1 → X2 → X1 → X3 → X4 являются:
1) Na2O, NaCl, NaOH, NaNO3; 2) NaOH, NaCl, NaNO3, Na2O;
3) NaOH, NaClO, NaOH, NaNO3; 4) NaOH, NaCl, NaNO3, NaNO2.
8

 . При каких условиях равновесие в системе N2O4 2NO2, ∆H > 0
. При каких условиях равновесие в системе N2O4 2NO2, ∆H > 0сместится влево:
1) повышение давления и повышение температуры;
2) повышение давления и понижение температуры;
3) понижение давления и повышение температуры;
4) понижение давления и понижение температуры.
9. В системе 2 NO2 2NO + O2 равновесные концентрации веществ (моль/л) равны: [NO2] = 0,12, [NO] = 0,48, [O2] = 0,24. Вычислить константу и исходную концентрацию NO2.
1) 1,92; 0,36; 2) 0,38; 0,06; 3) 3,84; 0,6; 4) 0,19; 0,24.
10. Почему растворы неэлектролитов содержащих 1 моль любого вещества в 1 л, имеют одно и тоже осмотическое давление?
1) зависит от числа молекул воды;
2) зависит от числа ионов в растворе;
3) зависит от числа молекул неэлектролитов;
4) зависит от числа молекул воды и неэлектролитов.
11. В 0,5 л раствора содержится 2 моль неэлектролита. Каким осмотическим давлением будет обладать этот раствор.
1) 22,4 атм; 2) 11,2 атм; 3) 44,8 атм; 4) 89,6 атм.
12. В 120 г 10 % раствора сульфата магния растворили еще 12 г сульфата магния. Массовая доля сульфата магния в полученном растворе.
1) 20; 2) 15,6; 3) 18,18; 4) 16,2.
13. Вычислить степень гидролиза ацетата калия в 0,1 М растворе.
(К(СН3СООН) = 1,8 ∙ 10-5).
1) 5,5 ∙ 10-3; 2) 5,56 ∙ 10-3; 3) 5,5 ∙ 10-8; 4) 5,56 ∙ 10-8.
14. Чему равно ионное произведение воды.
1) 10-8; 2)10-10; 3) 10-14; 4) 10-20.
15. Степень диссоциации одноосновной кислоты равно 0,4. Какое суммарное число ионов приходится в ее растворе на каждые 100 нераспавшихся молекул (ответ округлите до целых).
1) 111; 2) 67; 3) 133; 4) 200.
16. Концентрация каких частиц минимально в водном растворе Н2РО4?
1) Н+; 2) РО43-; 3) Н2РО4-; 4) НРО42-.
17. Рассчитать отношение концентраций слабой кислоты и ее соли (Са : Сs) в буферном растворе, ели рН = 1,74 и рКа = 3,74.
1) 2:1; 2) 100:1; 3) 1:2; 4) 1:100.
18. Найти какой объем будет занимать водород массой 20 г при нормальных условиях.
1) 22,4 л; 2) 112 л; 3) 200 л; 4) 224 л.
19. При определенных условиях и углекислый газ, и оксид кремния (IV) могут взаимодействовать с любым веществом из следующего набора:
1) Н2О, КОН, СаО; 2) Na2CO3, Mg, C;
3) HCl, CaCO3, Ca(OH)2; 4) Na2SiO3, NaOH, O2.
