Задачи: дать представление о форме различных орбиталей; обобщив полученные знания, заполнить таблицу "Распределение электронов по энергетическим уровням"
| Вид материала | Документы |
СодержаниеВопрос классу (работа с ПСХЭ Д. И. Менделеева). На данный вопрос ученики отвечают письменно в течение трёх минут и сдают ответы учителю. |
- Н. Н. Носова Цель: привитие у читателей интереса к книге. Задачи: Вигровой форме обобщить, 27.92kb.
- Предмет, задачи, методы цитологии, 128.36kb.
- 0 Распределение "свободных" электронов по энергиям, 497.38kb.
- -, 47.24kb.
- Задачи: дать представление о болезни «игромания»; воспитание нравственных основ личности;, 157.03kb.
- Задачи дисциплины дать основы: -принципов построения подсистем защиты в кс различной, 44.27kb.
- Те исследуется угловое распределение и энергетический спектр электронов при облучении, 18.67kb.
- Урока: урок обобщения и систематизации знаний, 141.29kb.
- Задачи дисциплины дать основы: -принципов построения подсистем защиты в ос различной, 42.33kb.
- Дать детям представление о речевом этикете, как о правилах поведения в различных ситуациях;, 241.98kb.
11 класс.
Состояние электронов в атоме.
Цели:
- обобщить и углубить знания о строении атома;
- сформировать понятия “энергетический уровень” и “электронная орбиталь”;
- закрепление навыков написания электронно-графических формул первых 20 элементов;
- углубить понимание периодичности как основного критерия расположения элементов в ПСХЭ Д.И. Менделеева и причины повторяемости их свойств.
Задачи:
- дать представление о форме различных орбиталей;
- обобщив полученные знания, заполнить таблицу “Распределение электронов по энергетическим уровням”;
- продолжить формирование навыков работы с обучающими компьютерными программами.
Ход урока.
Вывести на доску (экран) изображение планетарной модели атома (в данном случае – гелия) Резерфорда-Бора. Задать вопрос: “Что такое состояние электрона в атоме?”


 е–
е– 
Энергия
В пространстве
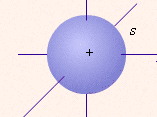
| Близкие по значению энергии связи с ядром электроны образуют энергетический уровень, или электронный слой |
| Совокупность различных положений в пространстве – электронное облако |

-
 вероятность нахождения электрона в этой области пространства (W)
вероятность нахождения электрона в этой области пространства (W)составляет примерно 10%

 - W ≈ 20%
- W ≈ 20%-W ≈ 30%
Эти различные значения вероятности нахождения электрона в пространстве вокруг ядра описываются принципом неопределённости Гейзенберга: нельзя одновременно с большой точностью определить положение электрона в пространстве и его энергию. Чем точнее определяется один из этих параметров, тем больше погрешность в определении второго. [“Уроки химии Кирилла и Мефодия”: тема 3, урок 18: медиа-лекция к уроку].
Но есть область пространства, в которой вероятность нахождения электрона максимальна, – орбиталь.
Строение энергетических уровней.
Е



 5 d-орбиталей 7 f-орбиталей
5 d-орбиталей 7 f-орбиталей три p-орбитали
три p-орбитали 4
 одна s-орбиталь
одна s-орбиталь 5 d-орбиталей
5 d-орбиталей три p-орбитали
три p-орбитали 3
 одна s-орбиталь
одна s-орбиталь три p-орбитали
три p-орбитали 2
 одна s-орбиталь
одна s-орбиталь1
 одна s-орбиталь
одна s-орбитальГраничные поверхности орбиталей (“Открытая химия 2.6”, глава 2, п.2.2).

Квантовые числа электронов
главное
побочное
магнитное
спиновое



| | № энергетического уровня 1 – 7 | Характеризует подуровни 0 – 3 | Число орбиталей на подуровне – ℓ … 0 … + ℓ | Спиновый момент – ½ или + ½ |
| | ||||
| значения | ||||
| определяет | энергию электронов данного уровня: чем больше n, тем больше Е | форму атомных орбиталей ℓ = 0:  - s - s ℓ = 2:  - p - pℓ = 3:  - d - dℓ = 4:  - f - f | положение орбитали в пространстве относительно внешнего электрического или магнитного поля | п  араллельно или непараллельно магнитному полю от движения электрона вокруг ядра ориентировано магнитное поле самого электрона араллельно или непараллельно магнитному полю от движения электрона вокруг ядра ориентировано магнитное поле самого электрона |
Разные состояния электронов в атоме неравноценны и объясняются 4 закономерностями.
1. Правило Клечковского. Атом стремится к минимальному значению суммы главного и побочного квантовых чисел (n + ℓ →0); если для разных состояний такая сумма одинакова, то сначала заполняется состояние с меньшим значением n.
Например: 21Sc: заполняется сначала 3d-орбиталь (для неё n + ℓ = 3 + 2 = 5), а не 4p-орбиталь (для неё тоже n + ℓ = 4 + 1 = 5), потому что для неё значение n меньше.
2. Принцип Паули. В атоме не может быть двух электронов с одинаковыми значениями всех четырёх квантовых чисел. На каждой орбитали может находиться не более двух электронов: у них одинаковы все квантовые числа, кроме ms.
Число электронов на энергетическом уровне:
N = 2n2.
3. Правило Гунда. Электроны располагаются на одинаковых орбиталях так, чтобы их суммарное спиновое число было максимальным:
| ↑ | ↑ | ↑ |
| ↑ | ↓ | ↑ |
| ↑↓ | ↑ | |
но НЕ так!
Например: чем объяснить то, что у атома хрома конфигурация внешнего электронного слоя …4s13d5, а не …4s23d4? Здесь происходит провал электрона, то есть, согласно правилу Гунда, атом стремится к максимальному спину электронов, который и достигается в большей степени в конфигурации …4s13d5:
| ↑ |
| ↑ | ↑ | ↑ | ↑ | ↑ |
| ↑↓ |
| ↑ | ↑ | ↑ | ↑ | |
| ↑↓ |
4s2 3d4 4s1 3d5
не так а ТАК
Наиболее устойчивы конфигурации наполовину или полностью заполненные: f14, d5, d10.
Задания.
1. Работа учеников у доски.
Ученики пишут на доске по одной электронно-графической формуле элементов: из II, III и IV периодов: N, Na и Kr.
2. Вопрос классу (работа с ПСХЭ Д. И. Менделеева).
У каких элементов может происходить провал электрона? (у элементов побочных подгрупп I и VI групп, так как им нужен один электрон с s-подуровня для того, чтобы наполовину или полностью заполнить d-подуровень). Двойной провал электрона может происходить у платины.
3. На данный вопрос ученики отвечают письменно в течение трёх минут и сдают ответы учителю.
Если бы мы могли фотографировать положение электрона в пространстве вокруг ядра со сколь угодно большой частотой, какие другие его параметры в это же время нельзя было бы точно определить? (масса, импульс, скорость, энергия). Каким соотношением связаны масса и энергия?
Тест.
1.В атоме состояние электрона определяется его:
- энергией;
- спином;
- характером движения;
- энергией и положением в пространстве.
2. Принцип неопределённости Гейзенберга утверждает, что невозможно одновременно точно определить энергию электрона и его:
- спин;
- положение в пространстве;
- массу;
- скорость.
3. Суммарный спин максимален у электронов атома:
- гелия;
- лития;
- бериллия;
- бора.
4. Вероятность нахождения электрона выше в области, обозначенной цифрой:
 - 1;
- 1;- 2;
- 3;
- вероятность одинакова во всех областях.
5. Утверждение о том, что в атоме не может быть двух электронов с одинаковым набором всех четырёх квантовых чисел – это…
- принцип Паули;
- правило Клечковского;
- принцип минимума энергии;
- правило Гунда.
6. Тот факт, что у атома скандия сначала заполняется 3d-орбиталь, а не 4p-, объясняется:
- правилом Гунда;
- правилом Клечковского;
- принципом минимума энергии;
- принципом неопределённости Гейзенберга.
7. p-орбиталь имеет форму:
- шара;
- объёмной восьмёрки;
-четырёхлепестковую;
- слишком сложную для изображения.
8. Форму атомных орбиталей характеризует:
- главное квантовое число;
- побочное квантовое число;
- магнитное квантовое число;
- спиновое квантовое число.
9. В формуле для подсчёта числа электронов на энергетическом уровне
N = 2n2 символ “n” обозначает:
- № энергетического уровня;
- число электронов на подуровне;
- число подуровней на данном уровне;
- число неспаренных электронов.
10. Максимальное количество электронных пар, которые могут находиться на 3-м энергетическом уровне, если на нём есть одна s-, три p- и пять d-орбиталей, равно:
- 4;
- 9;
- 18;
- 16.
11. Элемент со строением внешнего энергетического уровня в основном состоянии …3s23p4 находится в ПСЭМ в группе №:
- 2;
- 4;
- 6;
- 8.
12. Число электронов на предвнешнем энергетическом уровне атома меди равно:
- 10;
- 11;
- 17;
- 18.
13. Два электрона, находящиеся на 3s-подуровне, отличаются:
- энергией;
- скоростью;
- значением побочного квантового числа;
- значением спинового квантового числа.
14. Облако электрона с побочным квантовым числом, равным 1, имеет форму:
- объёмной восьмёрки;
- шара;
- побочное квантовое число не может быть равно 1;
- четырёхлепестковую.
15. Максимальное число электронов на f-подуровне равно:
- 5;
- 14;
- 7;
- 10.
