IV. свойства неорганических веществ
| Вид материала | Документы |
- Рабочая программа по дисциплине "Химическая технология неорганических веществ " Направление:, 112.47kb.
- Задачи урока: Образовательные: Закрепить на практике знания о классах неорганических, 211.06kb.
- Методические указания к выполнению лабораторной работы по курсу «Основные направления, 102.41kb.
- Получение топлив из угля, 241.18kb.
- Рабочая программа дисциплины приборы и методы исследования в технологии неорганических, 249.27kb.
- «показатели качества воды и их определение» введение, 948.44kb.
- Гоу впо «Московский государственный открытый университет», 483.26kb.
- Лабораторная работа №2 Важнейшие классы неорганических соединений, 88.03kb.
- Реферат по курсу технологии неорганических веществ на тему: Технология неконцентрированной, 289.65kb.
- Технология переработки отходов производств, использующих высокочистый кремний 05. 17., 277.13kb.
4.9. Галогены
К галогенам относятся химические элементы главной подгруппы VII группы – фтор, хлор, бром, иод и астат. На внешнем энергетическом уровне атомов этих элементов имеется по семь электронов – ns2np5. Галогены – типичные неметаллы, в ряду которых от фтора к астату неметаллические (окислительные) свойства ослабевают, а металлические (восстановительные) свойства усиливаются. Химическая активность от фтора к иоду падает. Молекулы галогенов двухатомны. При обычных условиях фтор и хлор – газы, бром – жидкость, иод и астат – твердые вещества.
Найдите в справочной литературе данные о физических свойствах галогенов и занесите их в таблицу по образцу.
-
Галоген
Свойства
Фтор
Хлор
Бром
Иод
Астат
Формула, атомный номер
Относительная
молярная масса
Агрегатное состояние
Внешние признаки
Плотность
Температура плавл., оС
Температура кипен., оС
Области применения
В свободном виде в природе галогены вследствие высокой химической активности не встречаются.
Фтор и его соединения
Опыт 1. Получение фтороводорода и его взаимодействие со стеклом. Небольшой кусочек стекла покройте тонким слоем расплавленного воска или парафина. Иглой или другим острым предметом процарапайте на покрытии рисунок или надпись. В небольшую фарфоровую чашку поместите фторид натрия или фторид кальция (20-25 г) и прилейте (опыт проводить обязательно в вытяжном шкафу!) свежеприготовленный (горячий) раствор серной кислоты (4:1), быстро перемешайте смесь и накройте стеклянной пластинкой на несколько часов. В чашке протекает реакция обмена:
CaF2 + H2SO4 = CaSO4 + 2HF.
Выделяющийся фтороводород реагирует в зоне рисунка или надписи с оксидом кремния, входящим в состав стекла, с образованием тетрафторида кремния:
4HF + SiO2 = 2H2O + SiF4.
В результате на стекле проявляется соответствующий рисунок или надпись. Этот процесс называется травлением стекла. Промойте стекло проточной водой и снимите с него воск или парафин. В месте реакции фтороводорда со стеклом, оно становится матовым. Кроме указанных процессов протекает реакция между тетрафторидом кремния и фтороводородом с образованием комплексного соединения – фторокремниевой кислоты:
SiF4 + 2HF = H2[SiF6].
Получение и свойства хлора
Опыты 1-5. Получение микроколичеств хлора различными методами. а) Поместите в пробирки по крупинке дихромата калия, диоксида марганца, перманганата калия, смеси хлорида натрия и диоксида марганца. В первые три пробирки добавьте по 2 капли концентрированной соляной кислоты, в последнюю – каплю воды и две капли концентрированной серной кислоты. Осторожно, не делая глубокого вздоха, определите запах выделяющегося хлора и запишите уравнения реакций:
K2Cr2O7 + 14HCl = 2KCl + 2CrCl3 + 7H2O + 3Cl2;
MnO2 + 4HCl = MnCl2 + 2H2O + Cl2;
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 8H2O + 5Cl2;
2NaCl + MnO2 + 3H2SO4 = 2NaHSO4 + MnSO4 + 2H2O + Cl2.
После завершения опыта опустите все пробирки в кристаллизатор с раствором тиосульфата натрия, который "нейтрализует" остатки хлора (см. раздел 4.8. Сера).
б) Налейте в электролизер (прибор для электролиза растворов) насыщенный раствор поваренной соли и включите его на несколько секунд. По запаху определите выделяющийся на аноде хлор:
2NaCl + 2H2O → 2NaOH + H2 + Cl2 (электролиз).
Изучив свойства хлора, предложите химический метод доказательства выделения этого газа в процессе электролиза растворов солей хлороводородной кислоты.
Опыты 6-17. Свойства хлора. а) Безопасно и очень быстро можно продемонстрировать получение и свойства хлора даже без вытяжного шкафа несколькими способами. Вариант 1. Заранее, до получения хлора приготовьте все необходимые материалы и вещества: прибор для получения водорода, готовый к работе; две лакмусовые бумажки (одна – сухая, вторая – влажная), прикрепленные к концу длинной стеклянной палочки или проволоки; кусочек ватки, смоченный в растворе иодида натрия, так же прикрепленный к концу длинной стеклянной палочки или проволоки; длинный пучок очищенной от изоляции тонкой медной проволоки; красный фосфор (массой около 0,1 г) в ложечке для сжигания веществ; кусочек ваты, смоченный в горячем скипидаре и отжатый между листами фильтровальной бумаги, так же прикрепленный к концу длинной стеклянной палочки или проволоки; ватный тампон, смоченный в растворе тиосульфата натрия, которым закрывают сосуд для исключения утечки из него газа; стакан с водой.
Эксперименты проводите в указанной последовательности в течение нескольких секунд, внимательно наблюдая и запоминая условия и признаки всех реакций. С одной стороны, это сократит время проведения опыта, с другой – предотвратит выход избытка хлора из сосуда. Запись уравнений реакций, условий протекания, внешних признаков и выводы сделаете после завершения всего эксперимента.
В высокий цилиндр или иной сосуд из бесцветного прозрачного стекла высотой 50-60 см и объемом около 1000 мл поместите кучкой сухой перманганат калия массой 3-4 г. По стенке сосуда прилейте к перманганату калия 10-12 мл концентрированной соляной кислоты и закройте отверстие сосуда тампоном, смоченным раствором тиосульфата натрия. Наблюдайте (на белом фоне) постепенное заполнение сосуда хлором, отмечая при этом агрегатное состояние и цвет. Когда сосуд заполнится хлором наполовину, проведите быстро, акцентируя внимание на все признаки реакций, следующие взаимодействия. В промежутках между реакциями затыкайте сосуд ватным тампоном, смоченным раствором тиосульфата натрия. Опустите в сосуд газоотводную трубку от прибора для получения водорода, который предварительно зажгите (рис. 37). Водород продолжает гореть в хлоре.
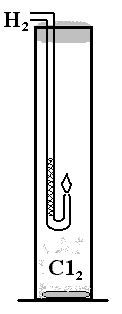
Рис. 37. Горение водорода в хлоре.
Опустите на секунду в сосуд одновременно лакмусовые бумажки. (Влажная бумажка обесцветится, сухая – нет). Опустите на секунду ватку, смоченную раствором иодида калия. (Вата окрашивается в коричневый цвет). Опустите в сосуд на несколько мгновений пучок предварительно нагретой медной проволоки. (В сосуде появляется бурый дым). Опустите в сосуд красный фосфор. (Фосфор воспламеняется). Горящий фосфор погасите в стакане с водой или песком. Опустите в сосуд вату, смоченную горячим скипидаром. (В сосуде с хлором скипидар обугливается и воспламеняется с выделением обильной копоти). Примечание. Вместо скипидара для демонстрирования взаимодействия хлора с органическими веществами можно провести реакцию с ацетиленом. Для этого поместите в ложечку для сжигания веществ кусочек карбида кальция капните на него 2-3 капли воды и внесите (осторожно!) в сосуд с хлором. Ацетилен воспламеняется и сгорает с выделением обильной сажи. После завершения всех реакций первым делом залейте в сосуд 100-200 мл раствора (5%) тиосульфата натрия, закройте сосуд ватным тампоном и поставьте его в вытяжной шкаф. Теперь можно оформить в тетради результаты эксперимента и записать уравнения реакций:
H2 + Cl2 = 2HCl;
Cl2 + 2KI = 2KCl + I2¯;
Cl2 + Cu = CuCl2;
3Cl2 + 2Р = 2РCl3; 5Cl2 + 2Р = 2РCl5;
Cl2 + НС≡СН ® 2HCl + 2С.
Если все операции данного эксперимента проводить строго по методике, каждый раз закрывая отверстие сосуда ватным тампоном с тиосульфатом натрия, то весь опыт длится всего несколько минут и является совершенно безопасным, так как хлор не выходит за пределы сосуда. В то же время ученики наглядно видят реакции хлора с водородом, красителями, металлами, неметаллами и органическими соединениями.
Вариант 2. Для проведения опыта соберите установку (рис. 38). В колбу унифицированного прибора поместите 5-7 г перманганата калия, в делительную воронку – 20-25 мл концентрированной соляной кислоты в хлоркальциевые трубки поместите последовательно две лакмусовые бумажки, из которых одна смочена водой; кусочек ваты, смоченный раствором иодида калия; порошок меди; кусочек красного фосфора.
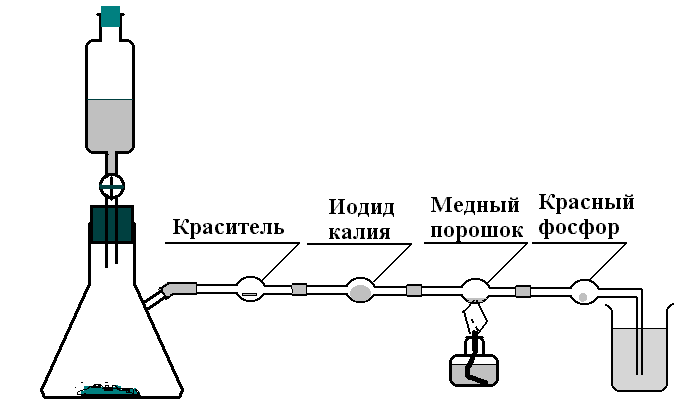
Рис. 38. Установка для демонстрирования свойств хлора.
Последнюю хлоркальциевую трубку соедините с промывалкой или поместите в стакан с раствором тиосульфата натрия. Все соединения прибора должны быть герметичными. Батарею хлоркальциевых трубок укрепите в лапке штатива так, чтобы трубку с медью можно было бы нагреть горелкой. Быстро выпустите в колбу с перманганатом калия 7-10 мл соляной кислоты и закройте кран делительной воронки. Наблюдайте на белом фоне образование хлора в колбе и его выход в хлоркальциевые трубки. Обратите внимание, что влажная лакмусовая бумажка обесцвечивается быстрее. Вата с иодидом калия приобретает бурый цвет. Как только хлор попадет в трубку с медью, нагрейте металл, а при первых признаках реакции (бурый дым) прекратите нагревание. В последней трубке фосфор воспламеняется. Избыток хлора поглощается раствором тиосульфата натрия. Данный вариант опыта по изучению свойств хлора в условиях школы безопасен и нагляден. После его проведения и обсуждения результатов, проводится оформление в тетради и запись уравнений реакций.
Опыты 18-27. Свойства хлорной воды. а) Приготовьте раствор хлорной воды одним из указанных ниже способов (см. Раздел 6.1. Растворы). Обратите внимание на цвет раствора и (осторожно!) его запах. Опустите в раствор хлорной воды кусочек лакмусовой бумажки, она обесцвечивается. Проверьте, все ли красители обесцвечиваются хлорной водой. Для этого воспользуйтесь полосками цветной бумаги и окрашенных тканей.
б) Поместите в пробирку небольшую порцию порошка меди (0,1 г) и залейте хлорной водой. Отставьте смесь в вытяжной шкаф и проведите наблюдение через некоторое время. Проведите аналогичные опыты с порошками алюминия, цинка, оксида меди и фосфора. Опишите ваши наблюдения и запишите уравнения соответствующих реакций.
в) Добавьте несколько капель хлорной воды к раствору иодида калия. Раствор приобретает бурый цвет вследствие выделения иода:
2KI + Cl2 = 2KCl + I2¯.
г) В полученную смесь добавьте избыток хлорной воды, раствор обесцвечивается:
I2 + Cl2 = 2IСl.
д) Добавьте несколько капель хлорной воды к концентрированному раствору пероксида водорода, наблюдается вспенивание:
Cl2 + 3H2O2 = 2HCl + 2H2O + О2.
Сделайте вывод об окислительных свойствах газообразного хлора и хлора в составе хлорной воды.
Получение и свойства соляной кислоты
Опыты 1-7. Получение хлороводорода и растворение его в воде.
а) Поместите в пробирку чуть влажный хлорид натрия массой 10-15 г. Подберите к этой пробирке пробку с газоотводной трубкой. Закрепите пробирку в штативе. Газоотводную трубку направьте в стакан с водой так, чтобы ее конец не касался жидкости, а находился на расстоянии 1-2 мм от ее поверхности (рис. 39).
Налейте в пробирку с солью 6-8 мл концентрированной серной кислоты и немедленно закройте пробкой с газоотводной трубкой.
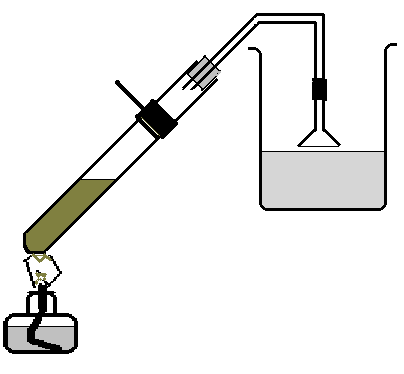
Рис. 39. Установка для получения и растворения хлоровдорода в воде.
Наблюдайте выделение газа в пробирке по реакции:
NaCl + H2SO4 = NaНSO4 + HCl.
Наблюдайте выход хлороводорода из газоотводной трубки прибора и его растворение в воде.
При каких условиях в реакции получения хлороводорода образуется нормальный сульфат натрия?
Почему на воздухе мы видим хлороводород в виде тумана (пара), хотя по справочникам это бесцветный газ?
Почему газоотводную трубку от прибора для получения хлороводорода при получении соляной кислоты не рекомендуется опускать в воду, а устанавливать на минимальном расстоянии от поверхности жидкости?
б) Проведите качественные реакции на ионы водорода и хлора в полученном растворе. Для этого воспользуйтесь лакмусом или метиловым оранжевым и раствором нитрата серебра:
HCl
 Н+ + Cl- (среда кислая);
Н+ + Cl- (среда кислая);Cl- + Ag+ = AgCl¯ (белый творожистый темнеющий на свету осадок, нерастворимый в азотной кислоте).
в) Проведите реакции соляной кислоты, характерные для растворов неорганических кислот. Для этого поместите в несколько пробирок по грануле различных металлов (Mg, Zn, Fe, Pb, Cu). В каждую пробирку прилейте по 1-2 мл раствора кислоты 1:2. Наблюдайте, в каких случаях не идет реакция, а в каких она протекает, и какова ее интенсивность в зависимости от природы металла.
г) Поместите в несколько пробирок небольшие порции (0,5 г) оксидов (ZnO, FeO, CuO и др.) и добавьте в каждую по 1-2 мл раствора кислоты 1:2. Наблюдайте, в каких случаях не идет реакция, а в каких она протекает, и зависит ли ее интенсивность от природы металла.
д) Получите в нескольких пробирках нерастворимые основания и амфотерные гидроксиды (Cu(OH)2, Mg(OH)2, Zn(OH)2 и т.д.); в другие пробирки налейте по 1-2 мл разбавленных растворов щелочей (NaOH, KOH и т.д.), добавив в них по 2-3 капли раствора фенолфталеина. Теперь в каждую пробирку добавляйте небольшими порциями (можно с помощью делительной воронки) раствор соляной кислоты до нейтрализации взятых оснований.
Каков признак окончания реакции в каждом случае?
е) Поместите в несколько пробирок небольшие порции сухих солей или их растворы (K2CO3, Na2SO4, Na2SiO3 и др.), добавьте в них по 2-3 мл раствора соляной кислоты. Наблюдайте различные варианты взаимодействия соляной кислоты с солями.
Составьте перечень солей, с которыми соляная кислота будет реагировать, а с, какими – не будет. Сформулируйте правило, выражающее это свойство соляной кислоты.
Опыты 8-13. Восстановительные свойства соляной кислоты. Поместите в несколько пробирок по крупинке сильных окислителей (MnO2, PbO2, KMnO4, K2Cr2O7, KСlО3, Ca(ClО)2 и др.). В каждую пробирку добавьте (вытяжной шкаф) по несколько капель концентрированной соляной кислоты:
4HCl + MnO2 = MnCl2 + 2H2O + Cl2;
4HCl + PbO2 = PbCl2 + 2H2O + Cl2;
16HCl + 2KMnO4 = 2KCl + 2MnCl2 + 8H2O + 5Cl2;
14HCl + K2Cr2O7 = 2KCl + 2CrCl3 + 7H2O + 3Cl2;
6HCl + KСlО3 = KCl + 3H2O + 3Cl2;
4HCl + Ca(ClО)2 = CaCl2 + 2H2O + 2Cl2;
В каких случаях реакция идет без нагревания, а в каких – потребовалось нагревание? Проверьте факт выделения хлора в каждой пробирке по обесцвечиванию влажной лакмусовой бумажки.
Свойства брома и его соединений
Опыт 1-2. Получение брома и его свойства. а) Поместите в пробирку несколько кристалликов бромида натрия или бромида калия и столько же диоксида марганца. К смеси добавьте несколько капель концентрированной серной кислоты и нагрейте в вытяжном шкафу. Наблюдайте выделение паров брома:
2NaBr + 2H2SO4 + MnO2
 Na2SO4 + MnSO4 + 2H2O + Br2.
Na2SO4 + MnSO4 + 2H2O + Br2.б) К раствору бромида натрия или бромида калия добавьте несколько капель хлорной воды. Раствор окрасится в желто-бурый цвет:
2KBr + Cl2 = 2KCl + Br2.
в) К полученному раствору, разделив его на отдельные порции, добавьте порошки магния, алюминия, цинка и меди. Размешайте смеси и убедитесь, что во всех случаях наблюдается исчезновение окраски:
Br2 + Mg = MgBr2; 3Br2 + 2Al = 2AlBr3;
Br2 + Zn = ZnBr2; Br2 + Cu = CuBr2.
г) К раствору бромида натрия добавьте несколько капель раствора нитрата серебра, выпадает желтоватый творожистый не растворимый в азотной кислоте осадок бромида серебра (качественная реакция на бромиды):
NaBr + AgNO3 = AgBr¯+ NaNO3.
Свойства иода и его соединений
Опыты 1-10. Получение иода, его обнаружение и экстракция.
а) Подобно хлору и брому, иод можно получить взаимодействием иодидов в кислой среде различными окислителями. Поместите в три пробирки по 2-4 кристаллика иодида натрия, добавьте столько же дихромата калия, перманганата калия, диоксида марганца и по 1-2 капли раствора соляной кислоты и слегка нагрейте. Наблюдайте выделение паров иода:
6KI + K2Cr2O7 + 14HCl
 2CrCl3 + 8KCl + 3I2¯+ 7H2O:
2CrCl3 + 8KCl + 3I2¯+ 7H2O:10KI + 2KMnO4 + 16HCl
 12KCl + 2MnCl2 + 8H2O + 5I2¯:
12KCl + 2MnCl2 + 8H2O + 5I2¯:2NaI + 4HCl + MnO2
 2NaCl + MnCl2 + 2H2O + I2¯.
2NaCl + MnCl2 + 2H2O + I2¯.б) Аналогично проведите реакции с другими окислителями (H2O2, KNO2, Fe2(SO4)3, PbO2 и др.) в кислой среде. В отличие от более активных галогенов иодиды восстанавливают даже не сильно разбавленную серную кислоту до серы или сероводорода:
6NaI + 4H2SO4 = 3Na2SO4 + S + 3I¯2 + 4H2O;
8NaI + 5H2SO4 = 4Na2SO4 + H2S +4I2¯ + 4H2O.
в) Реактивом на иод является крахмал. Как приготовить раствор крахмала, описано ниже (см. Раздел 6.1. Растворы). Добавьте в любую из пробирок, где получили иод, немного воды и несколько капель раствора крахмала и запомните окраску характерную для обнаружения иода (или, наоборот, для обнаружения крахмала применяется иод). Если испытуемый раствор содержит только иод, то при нагревании смеси этого раствора с крахмалом окраска исчезает, а при охлаждении вновь появляется.
Почему при нагревании кислых растворов, содержащих иод и крахмал, сине-фиолетовая окраска исчезает, а при охлаждении не восстанавливается?
г) Добавьте в пробирки, где выделился свободный иод, 1-2 мл любого органического растворителя, нерастворимого в воде. Закройте пробирки пробками и несколько раз (осторожно!) встряхните содержимое. Наблюдайте, как водный раствор иода обесцвечивается вследствие перехода галогена в слой органического растворителя. Его окраска становиться более интенсивной.
Какое явление вы наблюдали в этом эксперименте и, где оно применяется на практике?
Опыты 11-17. Свойства иода. а) Поместите в пробирку несколько кристалликов иода и нагрейте их, стараясь не разогреть всю пробирку. Твердый иод переходит в газообразное состояние, минуя жидкое (возгонка, или сублимация), образуя красивые фиолетовые пары. Эти пары вновь, минуя жидкое состояние, осаждаются на холодных стенках пробирки в виде мельчайших черно-фиолетовых кристалликов иода.
б) Взаимодействие иода с алюминием описано выше (см. Раздел 4.5. Бор. Алюминий). Аналогичный опыт проведите с порошком цинка.
в) Взаимодействие иода с металлами можно провести следующим образом. Промойте и отшлифуйте наждачной бумагой металлическую пластинку. Покройте ее с обеих сторон парафином, воском или лаком. После того, как покрытие затвердеет, процарапайте на пластинке рисунок, например, эмблему химического кружка, или надпись. Залейте пластинку водным раствором иода на несколько дней. После этого промойте пластинку, снимите растворителем слой лака и убедитесь, что на поверхности металла получена химическая гравюра.
Почему монетки, иголки или другие металлические предметы, случайно оказавшиеся в аптечке с лекарствами, иногда покрываются темным налетом?
г) Добавьте в пробирку с иодной водой несколько капель раствора щелочи, наблюдайте обесцвечивание раствора:
I2 + 3NaOH = NaIО + NaI + H2O.
д) Если эту реакцию проводить с горячим раствором щелочи, то процесс в основном протекает по другому уравнению:
3I2 + 6NaOH = NaIО3 + 5NaI + 3H2O.
е) Прилейте к иодной воде в пробирке равный объем концентрированной азотной кислоты и нагрейте смесь. Происходит обесцвечивание раствора и выделение газа. В зависимости от концентрации кислоты возможны следующие процессы:
3I2 + 10HNO3
 6HIO3 + 10NO + 2H2O;
6HIO3 + 10NO + 2H2O;I2 + 10HNO3
 2HIO3+ 10NO2 + 4H2O.
2HIO3+ 10NO2 + 4H2O.ж) Прибавьте к иодной воде немного красного фосфора и смесь нагрейте и прокипятите до обесцвечивания:
5I2 + 2Р + 8H2O
 2H3PO4 + 10HI.
2H3PO4 + 10HI.Как доказать, что в результате реакции образовалась смесь иодоводородной и ортофосфорной кислот?
з) К иодной воде добавьте раствор тиосульфата натрия. Иод при этом тоже обесцвечивается:
2Na2SO3S + I2 = Na2S4O6 + 2NaI.
Составьте уравнения электронного баланса реакций с участием иода и определите, какую роль (окислителя или восстановителя) играет в этих процессах галоген.
Опыты 18-22. Свойства соединений иода. а) В две пробирки с раствором иодида натрия в воде добавьте по несколько капель бромной воды и хлорной воды. Наблюдайте выделение иода, которое можно подтвердить раствором крахмала:
2NaI + Br2 = 2NaBr + I2¯;
2NaI + Cl2 = 2NaCl + I2¯.
б) Во второй пробирке, если хлор будет в избытке, произойдет обесцвечивание раствора вследствие обратимой реакции:
I2 + 5Cl2 + 6H2O
 2HIО3 + 10HCl.
2HIО3 + 10HCl.в) Приготовьте насыщенный раствор иода в воде (2-3 мл) с небольшим избытком иода. Прилейте к нему небольшими порциями насыщенный раствор иодида калия. Наблюдайте растворение избытка иода вследствие образования растворимого в воде полииодида калия:
KI + I2
 KI3.
KI3.г) Проверьте, образуется ли полигалогенид, если к насыщенному раствору иода в воде с избытком твердого галогена прилить насыщенные растворы бромида калия или хлорида калия.
д) К раствору иодида калия добавьте несколько капель раствора нитрата серебра, наблюдайте образование характерного желтого творожистого нерастворимого в азотной кислоте осадка иодида серебра:
KI + AgNO3 = AgI¯ + KNO3.
Вопросы и задания
1. Найдите в справочной литературе данные по содержанию элементов VIIА группы в земной коре, даты их открытия и получения в чистом виде. Составьте небольшие рефераты об открытии каждого из этих элементов, отметив трудности в открытии и получении их в чистом виде.
2. Найдите в справочниках происхождение и значение названий элементов VIIА группы и сгруппируйте эти названия по определенным признакам. Химический элемент №9 в одних странах называют фтором, в других - флюором. Как объясняется этот факт? Как бы вы назвали бы этот элемент сегодня? Почему фтор не обладает переменной валентностью?
3. Фтор, хлор, бром и иод – важнейшие химические элементы, необходимые для нормальной жизнедеятельности растений, животных и человека. Недостаток этих элементов, как и их избыток, приводит к серьезным нарушениям в организме. Разработайте модель эксперимента и проведите опыты по определению оптимальной потребности растений в этих элементах в период прорастания и в период роста. Для этого можно использовать любые семена, смачивая их для прорастания растворами с различной концентрацией микроэлементов. Для опытов с растениями подойдут отростки герани или традесканции, помещая их в дистиллированную воду. В качестве сосудов, для предотвращения вымывания элементов из материала сосуда, используйте пластмассовые бутылки из-под минеральной воды. Не забудьте также контролировать значение среды (рН) растворов.
5. Важную роль в производстве спичек играет хлорат калия. Сделайте предположение, для чего необходимо это вещество в обыкновенных спичках.
6. Астат – один из многих элементов, полученных искусственно. Почему он не был открыт и выделен из соединений, как другие галогены? В таблицах, отражающих свойства галогенов, в графах против астата часто стоит прочерк, почему? На основании положения элемента №85 в периодической системе и знаниях о свойствах других галогенов выскажите предположения о его физических и химических свойствах, запишите формулы соединений и уравнения реакций, отражающих свойства астата и его соединений.
7. Напишите в отдельные столбики формулы галогенов и их однотипных соединений и покажите стрелками, как изменяются свойства веществ "сверху вниз" или "снизу вверх".
8. Узнайте, есть ли в вашем населенном пункте (регионе) промышленные или химические производства, производящие или использующие элементы VIIА группы и их соединения. Как называются эти предприятия, и что они производят?
9. Приведите примеры применения элементов VIIА группы и их соединений в быту, сельском хозяйстве, промышленности, медицине, строительстве и других областях деятельности человека. На каких свойствах основано это применение?
