Методические указания к выполнению лабораторной работы по курсу «Основные направления технологии неорганических веществ и электрохимических производств для студентов специальности «Технология неорганических веществ»» Томск 2008
| Вид материала | Методические указания |
- Рабочая программа по дисциплине "Химическая технология неорганических веществ " Направление:, 112.47kb.
- Реферат по курсу технологии неорганических веществ на тему: Технология неконцентрированной, 289.65kb.
- Технология переработки отходов производств, использующих высокочистый кремний 05. 17., 277.13kb.
- Методические указания по выполнению лабораторной работы №12 для студентов специальности, 141.78kb.
- Методические указания по выполнению лабораторной работы №14 для студентов специальности, 187.8kb.
- Рабочая программа дисциплины приборы и методы исследования в технологии неорганических, 249.27kb.
- Программа дисциплины "Технология органических веществ" Контрольная работа 1 по дисциплине, 1073.33kb.
- Методические указания к выполнению лабораторной работы №10 для студентов очной формы, 240.19kb.
- Методические указания по выполнению лабораторной работы №3 для студентов специальности, 177.77kb.
- Гоу впо «Московский государственный открытый университет», 483.26kb.
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение
Высшего профессионального образования
ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
_____________________________________________________________________
«УТВЕРЖДАЮ»
Декан ХТФ
______В.М. Погребенков
«____» __________2008г.
К А Ф Е Д Р А О Б Щ Е Й Х И М И Ч Е С К О Й Т Е Х Н О Л О Г И И
Экстракция цинка
Методические указания к выполнению лабораторной работы по курсу «Основные направления технологии неорганических веществ и электрохимических производств для студентов специальности «Технология неорганических веществ»»
Томск 2008
УДК 66.02.(076.1)
Экстракция цинка
Методические указания к выполнению лабораторной работы по курсу «Основные направления технологии неорганических веществ и электрохимических производств для студентов специальности «Технология неорганических веществ»» Томск: Изд. ТПУ, 2008 - 8 с.
Составитель к.т.н., доц. каф. ОХТ О. И. Налесник
Рецензент к.х.н., доц. каф. ОХТ Ю. Н. Обливанцев

Методические указания рассмотрены и рекомендованы методическим семинаром кафедры общей химической технологии “____”_________ 2007г.
Зав. каф. ОХТ, д.т.н., проф В.В. Коробочкин
1. Введение
Цинк имеет масштабное использование в составе латуней, применяемых в различных отраслях машиностроения и в теплообменной аппаратуре. Цинковые покрытия – основные для защиты стальных деталей и конструкций от коррозии в атмосфере, воде и грунте. Цинк применяется в качестве активного материала отрицательных электродов в различных химических источниках тока.
В природе цинк встречается в составе полиметаллических руд вместе с медью, никелем, кобальтом, кадмием, свинцом и другими цветными металлами. Основной вид химического соединения цинка в природе ZnS (сульфид цинка или цинковая обманка). Реже встречается карбонат цинка ZnСO3. Содержание цинка в полиметаллических рудах не превышает 30 – 40 %, и потому требуется обогащение руды
Значительное количество цинка содержится в вельц-окислах, побочных продуктах производства свинца.
Основной способ производства цинка – гидрометаллургический. Гораздо реже применяется пирометаллургический способ, заключающийся в восстановительной плавке концентрата, отгонке и конденсации паров металлического цинка. Пирометаллургический цинк – порошковый продукт с высокой степенью окисления и существенным содержанием примесей применяется в производстве сплавов.
2. Гидрометаллургическая схема производства
Схема представлена на рисунке 1. Обжиг сульфидного концентрата необходим для перевода в легкорастворимую форму – ZnO по реакции
ZnS + 3/2O2 = ZnO + SO2 (1)
Обжиг осуществляется в печах кипящего слоя при 800 – 900 оС. Одновременно часть сульфида каталитически окисляется до сульфата
ZnS + 2O2 = ZnSO4 (2)
Присутствие примеси из сульфидной формы также превращается в оксидную форму.
Часть оксида цинка сплавляется с оксидами железа, образуя феррит цинка (ZnO·Fe2O3).
Перевод окисленного цинка в раствор происходит легко при малой концентрации серной кислоты.
ZnO + H2SO4 = ZnSO4 +H2O, (3)
а вот растворение феррита цинка требует высокой концентрации кислоты, т. к. оплавленные частицы феррита химически стойки к её действию. Поэтому после выщелачивания основного количества цинка в слабом растворе кислоты (нейтральное выщелачивание), твёрдая фаза подвергается «кислому» выщелачиванию.
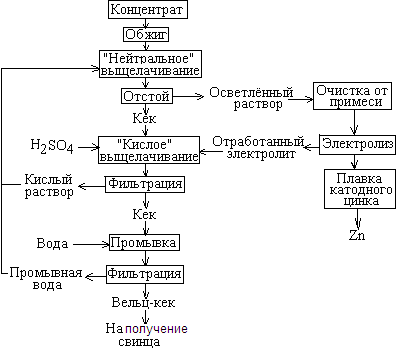
Рис.1 Принципиальная гидрометаллургическая схема производства цинка.
Осветлённый раствор после нейтрального выщелачивания содержит кроме ZnSO4 сульфаты примесей меди, никеля, кадмия и подвергается ступенчатой очистке от них разными методами. Электролизному извлечению цинка из сульфатного раствора может подвергаться только чистый раствор, т. к. все названные примеси имеют более положительный потенциал, чем цинк (см. табл. 1), и будут в первую очередь осаждаться на катоде. Поэтому чистый цинк может электролитически осаждаться только из чистого раствора.
Таблица 1
Потенциалы металлов – примесей и цинка, В.
| Cu | Ni | Co | Fe | Cd | Zn |
| +0,34 | -0,26 | - | -0,44 | - | -0,76 |
Отфильтрованный раствор после «кислого» выщелачивания содержит значительное количество кислоты и используется как реагент для «нейтрального» выщелачивания.
Свинец после обжига при выщелачивании концентрата превращается в нерастворимый сульфат свинца, в результате чего хвостовой кек после промывки и фильтрации используется как сырьё для производства свинца.
3. Теория электроэкстракции цинка
Очищенный раствор сульфата цинка подвергается электролизу после электропроводной добавки серной кислоты. Оптимальный состав электролита: ZnSO4 – 100 г/л, H2SO4 – 50-60 г/л.
На катоде разряжаются не только ионы Zn2+ (см. рис. 2).
Zn2+ + 2е → Zn
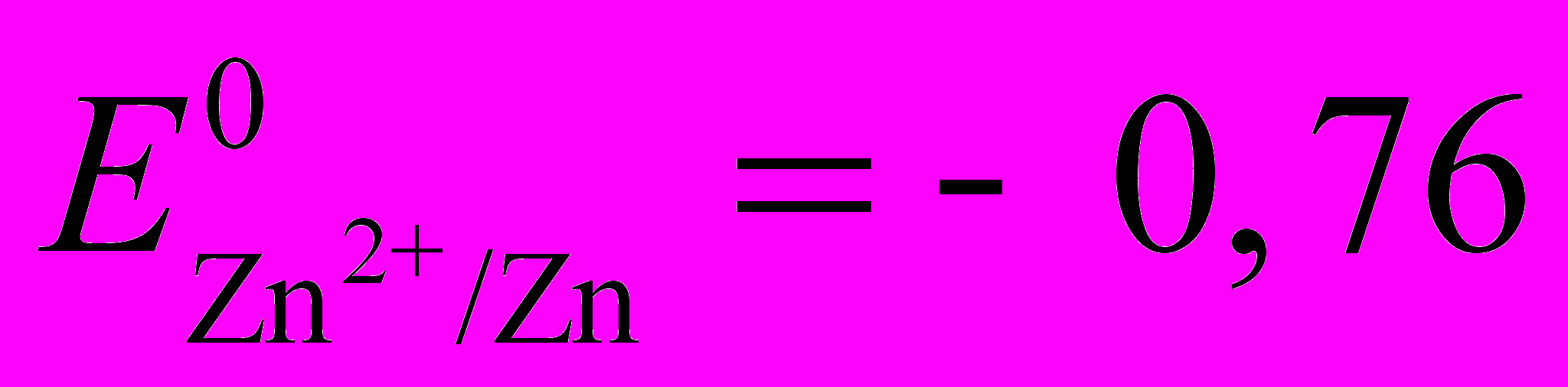 В (4)
В (4)Но и ионы Н+ (Н3О+)
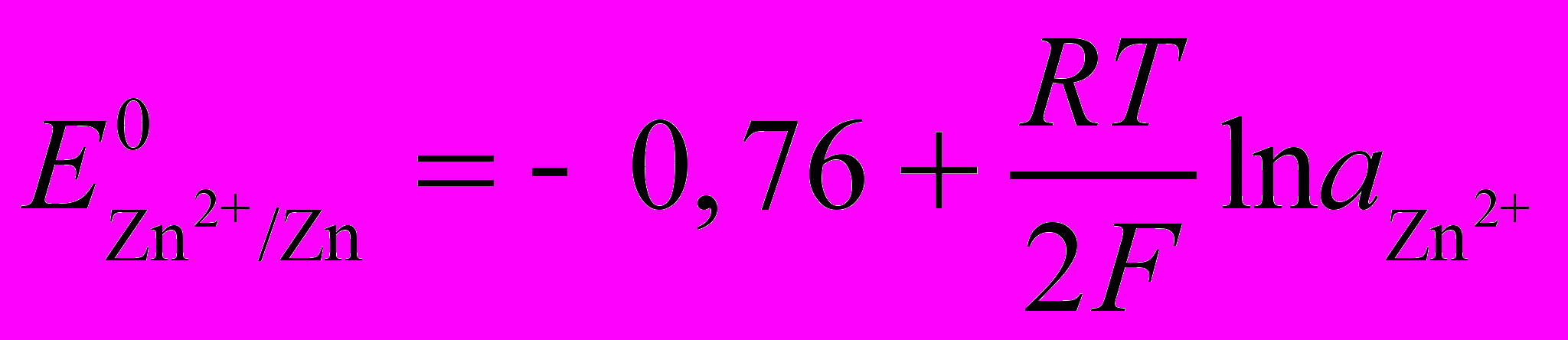 (5)
(5)2Н+ + 2е → Н2
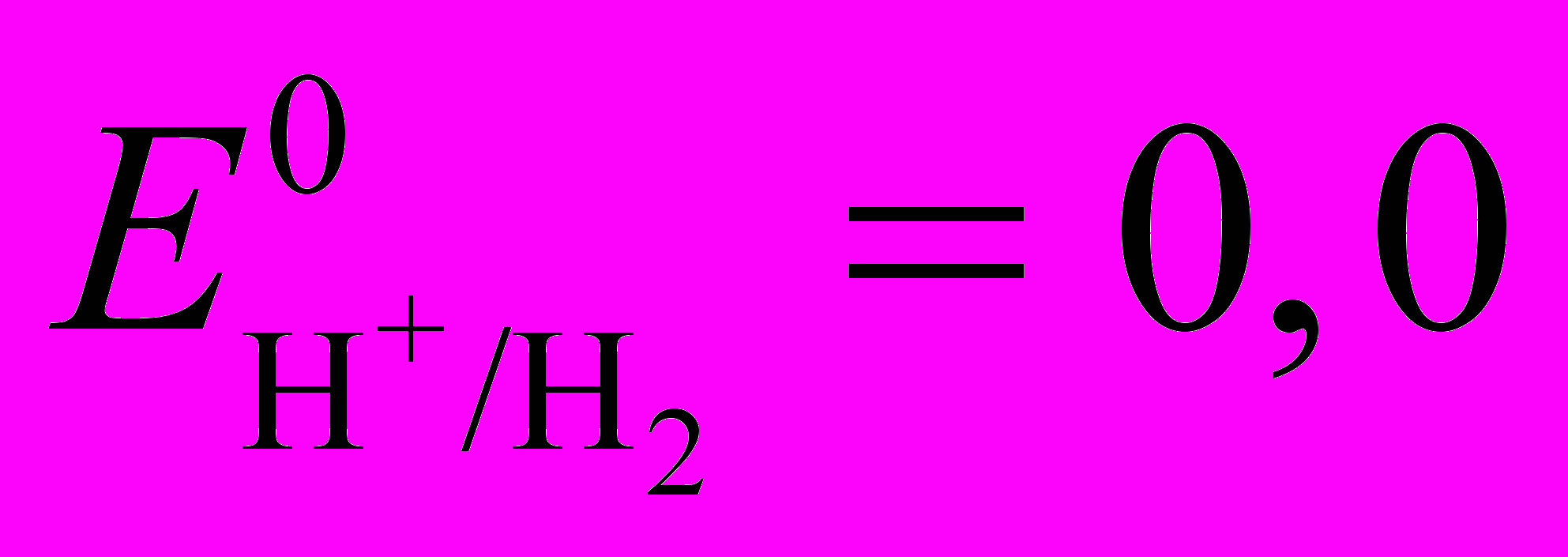 В (6)
В (6)Ход катодных поляризационных кривых показывает, что при разных плотностях тока будет наблюдаться разный выход продукта по току.
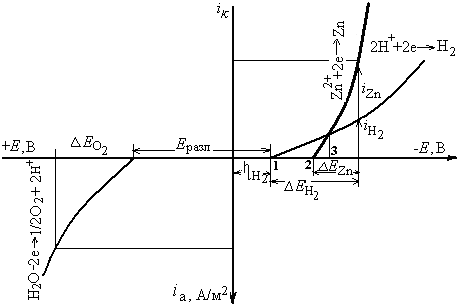
Рис.2. Схема анодной и катодных реакций электроэкстракции цинка.
При потенциалах, лежащих между точками 1 и 2, на катоде происходит только выделение водорода. После точки 2 начинает выделяться цинк, при потенциале точки 3, цинк и водород выделяются в равных количествах. Лишь при наиболее отрицательных потенциалах происходит преимущественное выделение цинка.
Выход цинка по току на производстве составляет 88 – 94 %.
На аноде происходит только выделение кислорода по реакции
Н2О - 2е = 1/2О2 + Н2+
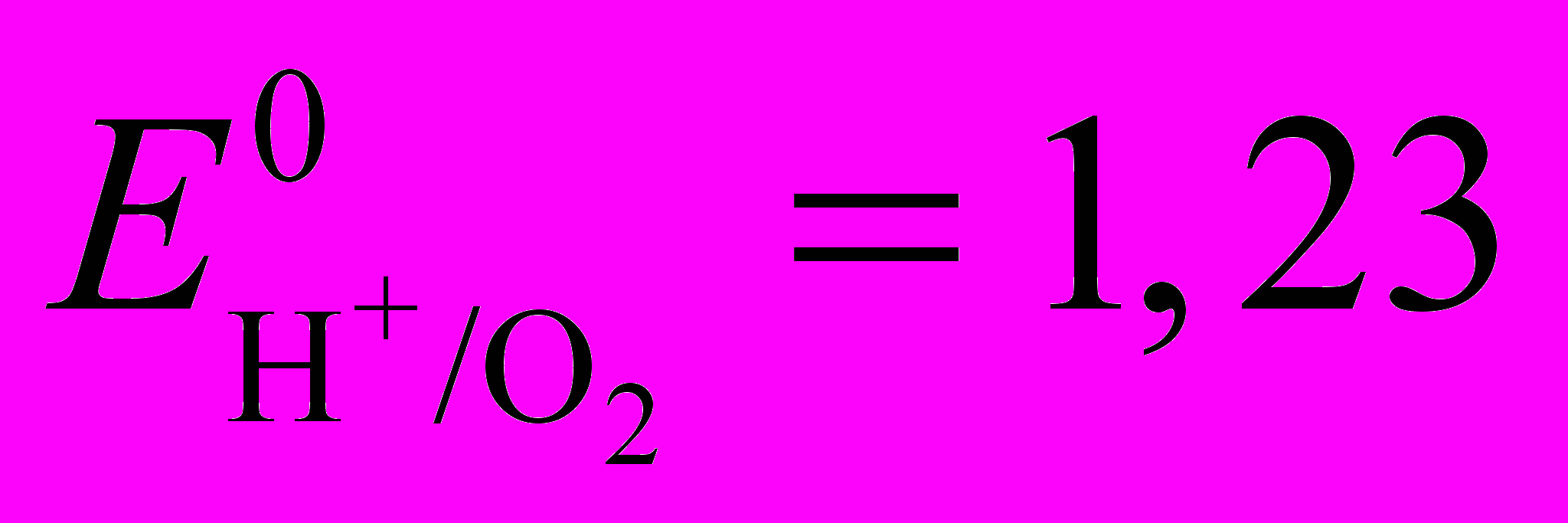 В (7)
В (7)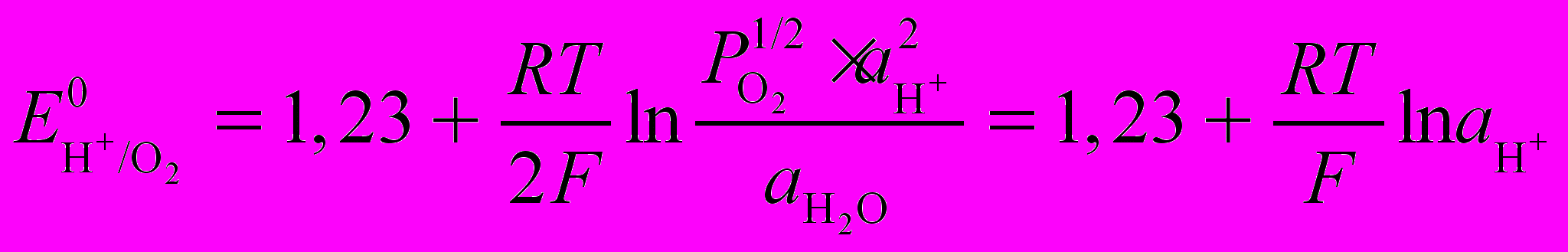 (8)
(8)Суммарная реакция ZnSO4 + H2O =Zn + 1/2 O2 + H2SO4 (9)
Напряжение разложения сульфата цинка
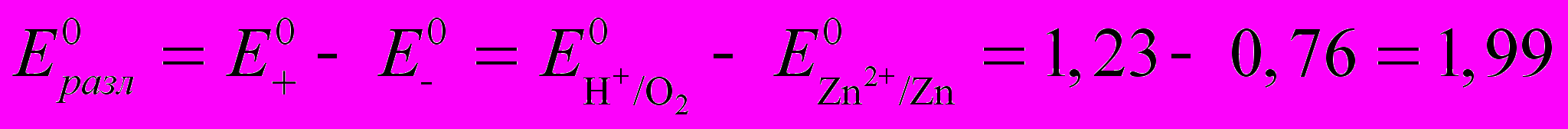 В,
В,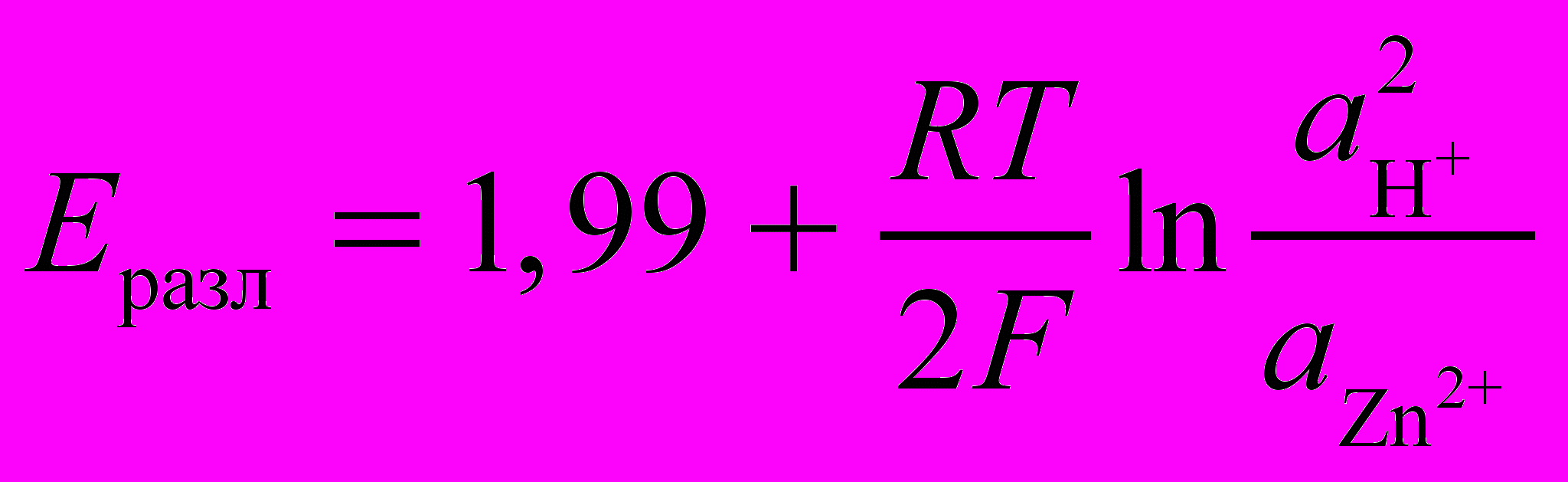 (10)
(10)Практическое напряжение электролиза достигает 3,0 – 3,2 В.
4. Организация электролиза
Наилучшим материалом анода в условиях серной кислоты является свинец с добавкой 1 % серебра. Катодом служит полированный алюминиевый сплав, с которым осаждаемый цинк имеет слабое сцепление. Цинк наращивается до толщины 2 – 3 мм, а затем сдирается с катодной алюминиевой основы и после мойки, сушки поступает на переплавку.
На производстве применяются железобетонные монолитные ванны, футерованные изнутри полимерными материалами.
В цех электролиза поступает нейтральный раствор с концентрацией около 100 г/л цинка. После электролиза отработанный электролит состава 50 г/л цинка и около 100 г/л серной кислоты поступает на охлаждение, а после охлаждения смешивается с исходным нейтральным раствором в соотношении 1:10 и вновь поступает на электролиз (см. схему на рис. 3).
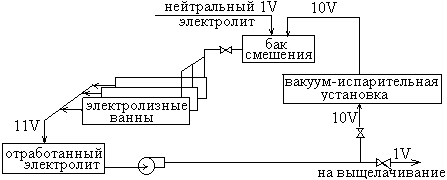
Рис. 3. Схема циркуляции электролита в электролизном цехе.
5. Экспериментальная часть
Цель работы:
Ознакомление в лабораторных условиях с процессом электроэкстракции цинка и изучение влияния плотности тока на напряжение электролиза, выход продукта по току и на удельные затраты электроэнергии.
5.1. Схема установки
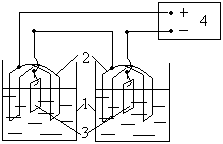
1 – Ячейки с электролитом;
2 – свинцовые аноды;
3 – катоды;
4 – блок питания.
Рис.4. Схема лабораторной установки.
5.2. Порядок выполнения работы
В стаканы 1 наливается раствор, содержащий ZnSO4 и Н2SO4, и устанавливаются, взвешенные катодные основы из нержавеющей стали так, чтобы уровень электролита был ниже точки токоподвода на 8 – 10 мм. Катодные основы различаются шириной в 2 раза. Это позволяет за один опыт провести электролиз при двух плотностях тока.
Расчёт тока электролиза в опытах проводится для интервала плотности тока от 400 до 800 А/м2.
Время электролиза составляет 0,5 или 1 час. После первого опыта завешивается новая пара взвешенных электродов, меняется электролит в ячейках и задаётся другой ток электролиза. Во время обоих опытов с помощью вольтметра регистрируется напряжение электролиза в каждой ячейке.
Перед взвешиванием катоды с осаждённым цинком промываются, обсушиваются фильтровальной бумагой, а затем досушиваются в тепле (в сушильном шкафу при t = 50 оС или на тёплой батарее).
Выход по току металла рассчитывается по формуле
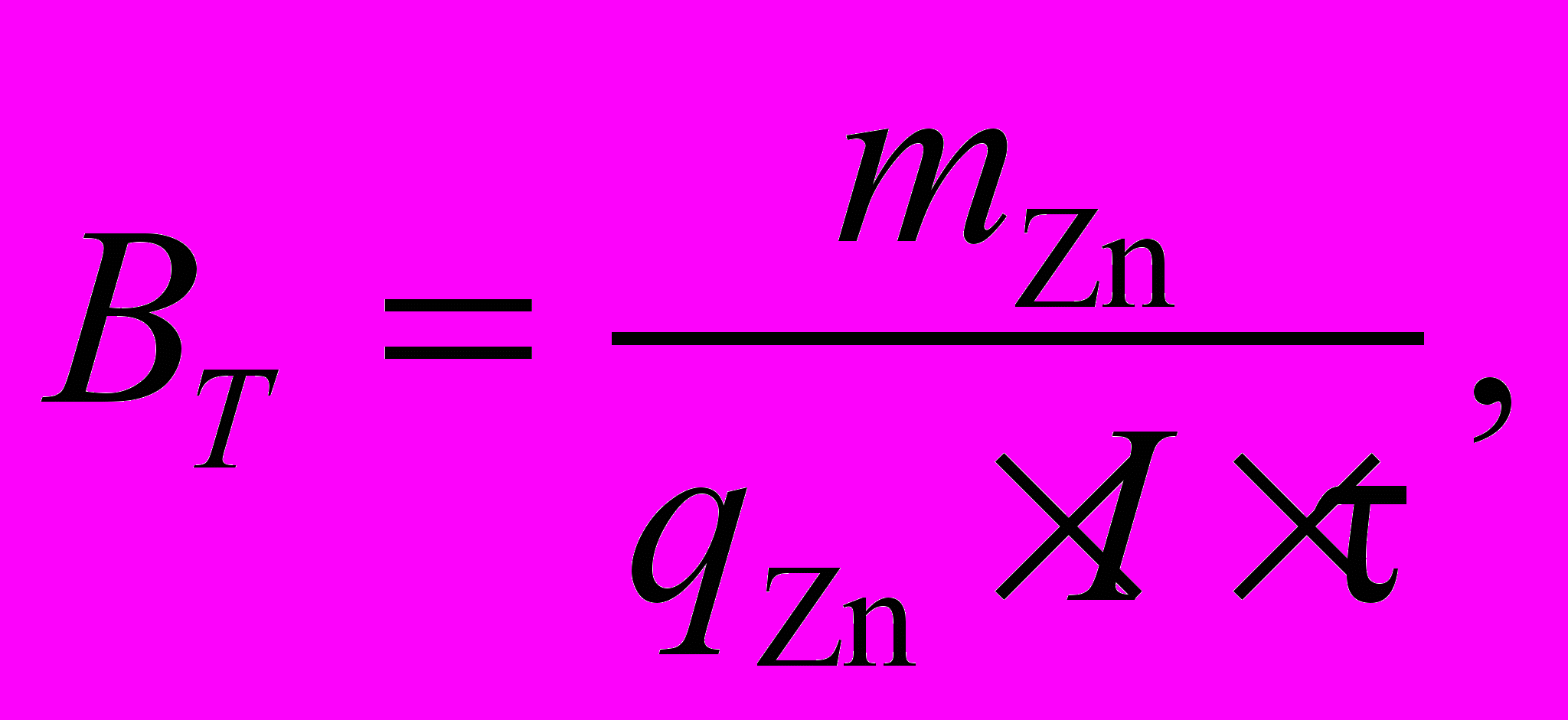 (11)
(11)где mZn – масса осадившегося цинка, г;
mZn = m2 – m1 (12)
m2 – масса катода после опыта, г.;
m1 – масса катода до опыта, г.;
I – сила тока, А;
τ – время электролиза, час;
qZn – электрохимический эквивалент цинка, г/А∙час.
Результаты эксперимента заносят в таблицу
Таблица 2
| № п/п | I, А | ik, А/м2 | Uяч, В | τ, час | Wуд, Вт·ч/г | Вт, % |
| 1 | I1 | i1 i2 | | | | |
| 2 | I2 | i3 i4 | | | | |
6. Оформление отчета
Отчет по экстракции цинка должен содержать:
а) цель работы;
б) схему установки;
в) порядок выполнения работы;
г) электродные и суммарные реакции;
д) поляризационные кривые выделения Zn, H2 и O2
е) таблицу экспериментальных результатов;
ж)результаты эксперимента, представляются таблицей и зависимостям
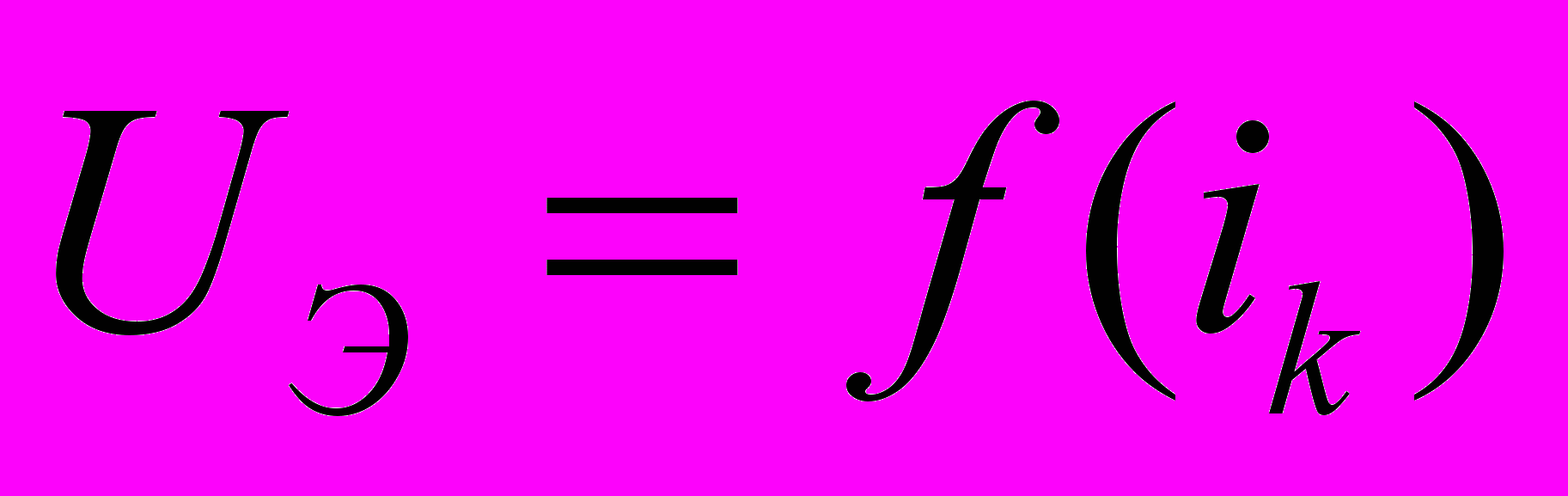 ,
, 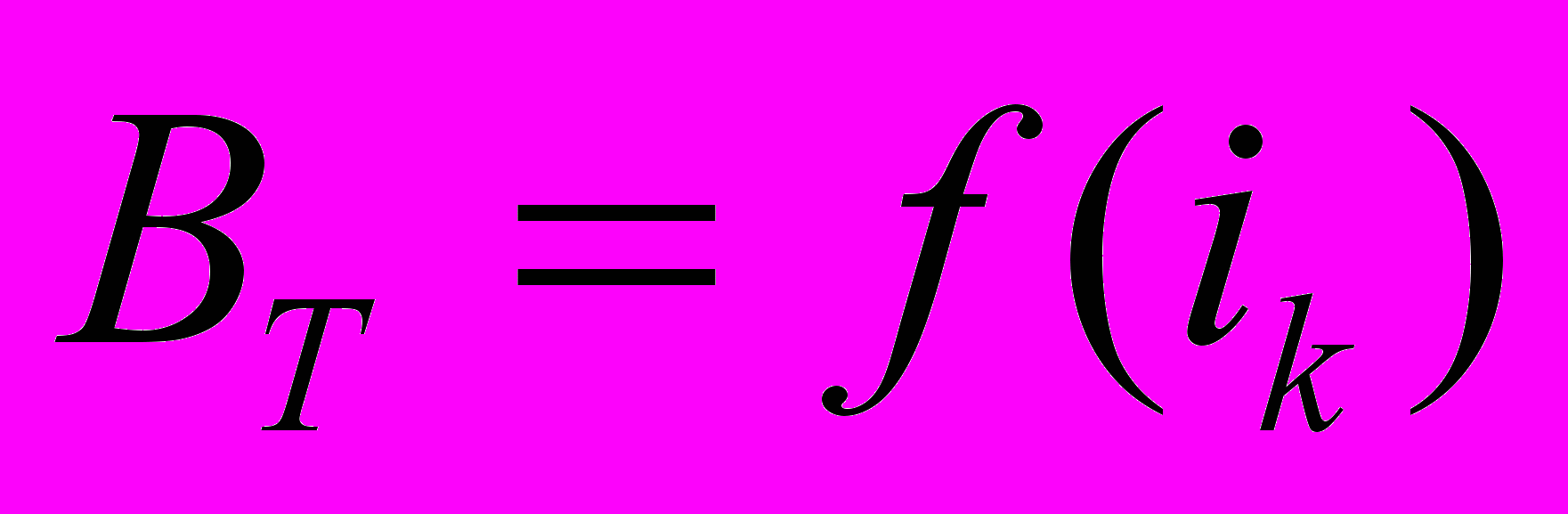 ,
, 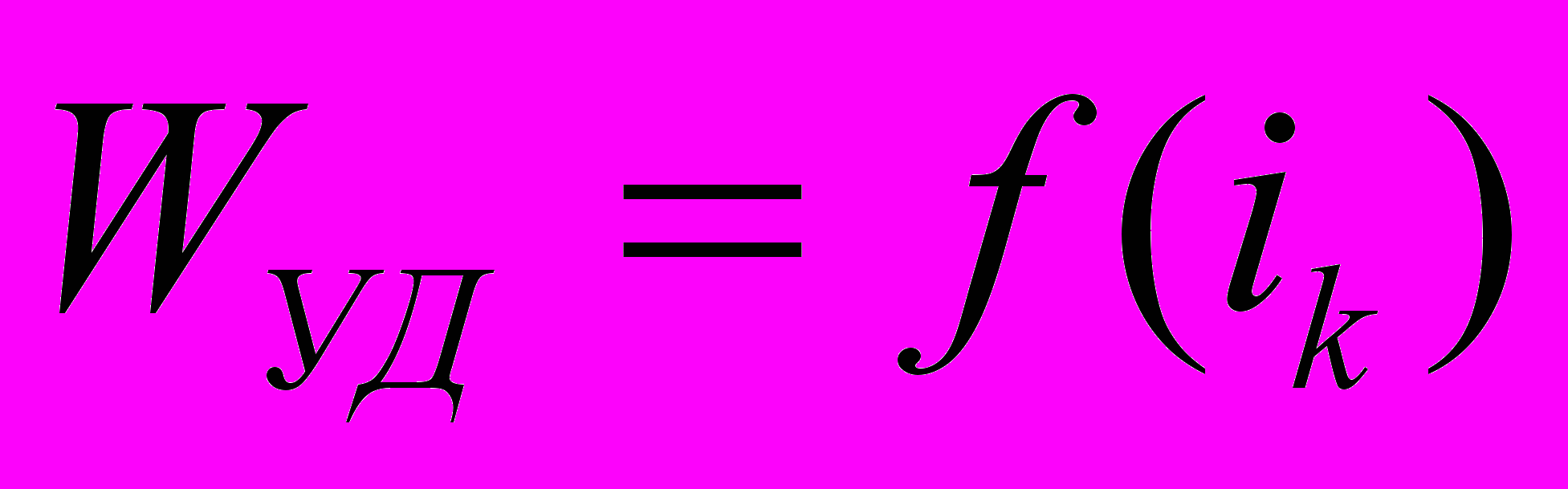 ;
;з) краткий вывод по результатам расчета. Выводы должны объяснять зависимости.
Литература
Прикладная электрохимия. Под ред. Томилова А.П.-М.: Химия, 1984.-520с.
Экстракция цинка
Методические указания к выполнению лабораторной работы по курсу «Основные направления технологии неорганических веществ и электрохимических производств для студентов специальности «Технология неорганических веществ»» – Томск: Изд. ТПУ. 2008 – 8с.
Составитель к.т.н., доц. каф. ОХТ О. И. Налесник
Рецензент к.х.н., доц. каф. ОХТ Ю. Н. Обливанцев
Подписано к печати
Формат 60х84/16. Бумага офсетная.
Печать RISO. Усл. печ. л. . Уч.-изд. л.
Тираж экз. Заказ Цена свободная.
Издательство ТПУ. 634050, Томск, пр. Ленина 30.
