Чупикова наталия Игоревна Получение и биологическая характеристика мультипотентных мезенхимных стромальных клеток костного мозга человека и создание на их основе костных структур
| Вид материала | Документы |
- Возможности физико-химической регуляции пула стволовых клеток, 187.05kb.
- «Использование мезенхимальных стволовых и прогениторных клеток костного мозга для разработки, 353.33kb.
- Перкуссия при болезнях органов кроветворения и крови, 1864.75kb.
- Нейроны и глиальные клетки: общая характеристика, разнообразие, функции. Серое и белое, 2972.29kb.
- О. Л. Литвиненко Ставрополь, 2009г, 227.7kb.
- Рабочая учебная программа по дисциплине Гематология Для специальности, 174.73kb.
- Клеточные технологии и современная медицина, 331.2kb.
- План лекции: Общая характеристика функций спинного мозга Нейронная организация спинного, 696.17kb.
- Чуракова Наталия Игоревна, к п. н., доцент кафедры теории и практики управления организацией, 345.44kb.
- Влияние гипо- и гиперпаратиреоза на особенности организации циркадианных ритмов состава, 234.16kb.
На правах рукописи
ЧУПИКОВА Наталия Игоревна
Получение и биологическая характеристика
мультипотентных мезенхимных стромальных клеток костного мозга человека и создание на их основе
костных структур
03.00.23 - биотехнология
16.00.03 – ветеринарная микробиология, вирусология,
эпизоотология, микология с микотоксикологией и иммунология
А в т о р е ф е р а т
диссертации на соискание ученой степени
кандидата биологических наук
Москва – 2007
Работа выполнена в Федеральном государственном образовательном учреждении высшего профессионального образования «Московская государственная академия ветеринарной медицины и биотехнологии имени К.И. Скрябина» (ФГОУ ВПО МГАВМиБ) и ООО «Институт Стволовой Клетки».
Научные руководители: доктор биологических наук,
профессор, член-корреспондент РАХН
Девришов Давудай Абдулсемедович;
доктор медицинских наук
Тепляшин Александр Сергеевич.
Официальные оппоненты:
доктор биологических наук, профессор Тихонов Игорь Владимирович;
доктор биологических наук, профессор Манько Виктор Михайлович.
Ведущая организация – Государственное научное учреждение «Всероссийский научно-исследовательский и технологический институт биологической промышленности» (ГНУ ВНИТИБП).
Защита состоится ___________ 2007 года в _____ часов на заседании диссертационного совета Д.220.042.01 в Федеральном государственном образовательном учреждении высшего профессионального образования «Московская государственная академия ветеринарной медицины и биотехнологии имени К.И. Скрябина» (109472, Москва, ул. Академика Скрябина, 23. Тел. (495) 377-93-83).
С диссертацией можно ознакомиться в библиотеке ФГОУ ВПО МГАВМиБ.
Автореферат разослан «___» ____________ 2007 г.
Ученый секретарь
диссертационного совета,
профессор Грязнева Т.Н.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Особую актуальность в настоящее время приобрели методы клеточной биотехнологии, которые позволяют получать культуры стволовых клеток, обладающих уникальной свойствами. Изучение физиологических особенностей, функций и локализации в организме различных типов стволовых клеток человека помогают понять механизмы регенерации и поддержания организма (Presnell S.C., 2002; Verfaillie C.M., 2002).
В связи с этим, перспективным подходом является использование мультипотентных мезенхимных стромальных клеток костного мозга (ММСК КМ) человека в качестве источника получения тканей мезодермального происхождения, с целью применения в качестве средства заместительной терапии при лечении заболеваний опорно-двигательного аппарата человека и животных (Bruder S.P., 1998; Kassem M., 2004).
Решение поставленных вопросов зависит от дальнейшего усовершенствования методов выделения, культивирования и дифференцировки in vitro, а также методов получения трехмерных структур на основе ММСК и минеральных или органических матриксов.
Таким образом, изучение ММСК человека является актуальным для применения в ветеринарной и медицинской практике.
Цель и задачи исследований. Цель настоящих исследований – получение и биологическая характеристика ММСК КМ человека, а также разработка на основе этих клеток трехмерных трансплантатов костной ткани (ТТКТ).
Для достижения поставленной цели необходимо было решить следующие задачи:
1. Провести исследования по выделению и разработка оптимальных условий для долгосрочного культивирования ММСК КМ человека.
2. Изучить морфологические и иммуногенетические особенности ММСК КМ человека в культуре.
3. Изучить распределение ММСК КМ при внутривенном введении на модельных животных (мыши).
4. Создать трехмерные структуры костной ткани с использованием ММСК КМ человека и кальций-фосфатного (КФ) матрикса.
5. Провести доклиническое изучение полученных костных трансплантатов на экспериментальных мышах и овцах.
Научная новизна. Впервые проведен сравнительный анализ методов выделения ММСК и предложен усовершенствованный метод. Для выделения популяции ММСК определен параметр центрифугирования Равный 3000 об/мин. Разработаны оптимальные условия для длительного культивирования ММСК КМ человека. Впервые в России проведен широкий анализ антигенов, характеризующих ММСК.
Впервые, с учетом морфологических особенностей клеток представлены данные об оптимальном соотношении количества клеток на объем матрикса с учетом пористости носителя. Впервые показана зависимость плотности заполнения матрикса на дифференцировку клеток. На основе гистологических и иммуногистохимических методов доказано, что в результате культивирования in vitro ММСК КМ в матриксе в дифференцировочной среде получены трехмерные структуры костной ткани. Показано, что при эктопическом введении полученных трансплантатов в организм мышей, они не являются токсичными и не проявляют свойств туморогенности.
Впервые в России проведены предклинические испытания по влиянию полученных костных трансплантатов на организм овцы при смоделированных костных травмах.
Практическая значимость. Разработанный способ выделения ММСК КМ используется для получения и наращивания клеточной массы для последующей криоконсервации и длительного хранения для клинических целей (клиника «Бьюти Плаза»).
Метод получения и наращивания ММСК животных используется на кафедре иммунологии ФГОУ ВПО МГАВМиБ в научно-исследовательской работе и учебном процессе.
В ГУ РОНЦ им. Н.Н.Блохина РАМН используются биотрансплантаты костной ткани для клинического изучения.
Апробация результатов диссертации. Основные результаты диссертационной работы доложены на международном симпозиуме и европейской научно-практической конференции (Германия, 2004); международном симпозиуме по биологии клетки в культуре (Санкт-Петербург, 2004); Российском симпозиуме «Лазерная медицина» (Москва, 2004); II Московском международном конгрессе «Биотехнология: состояние и перспективы развития» (Москва, 2005); на 4-ом ежегодном съезде Европейского общества по тканевой инженерии (Германия, 2005); международной конференции «Surface – Tissue Interaction» (Швейцария, 2005); Всемирной конференции по тканевой инженерии, 8-ом ежегодном съезде международного общества тканевой инженерии (Китай, 2006); 3-ем Московском международном конгрессе «Биотехнология и медицина» (Москва, 2006); VI съезде аллергологов и иммунологов СНГ, Российском Национальном конгрессе аллергологов и иммунологов, III Российской конференции по иммунотерапии (Москва, 2006); на XI съезде международного общества по тканевой инженерии, европейском международном симпозиуме (Нидерланды, 2006).
На защиту выносятся следующие положения и результаты:
1. Усовершенствованный метод выделения, физиологическая характеристика и условия культивирования ММСК.
2. Способ получения трехмерных структур костной ткани.
3. Доклиническое изучение полученных биоимплантов в организме иммунодефицитных животных и мелкого рогатого скота in vivo.
Публикации. По результатам диссертации опубликовано 14 работ, в том числе 4 статьи в научных журналах, 10 статей в сборниках научных трудов.
Объем и структура диссертации. Материалы диссертации изложены на 130 страницах машинописного текста и включают введение, обзор литературы, собственные исследования, обсуждение полученных результатов, выводы, данные о практическом использовании научных результатов, рекомендации по использованию научных выводов, список использованной литературы (167 источников, из которых 10 отечественных и 157 иностранных). Работа содержит 10 таблиц, 19 рисунков, 8 страниц приложений.
СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ
Материалы и методы исследований
Работа выполнена в период с 2003 по 2007 год на кафедре иммунологии ФГОУ ВПО МГАВМиБ и ООО «Институт стволовой клетки».
В экспериментах использовали стандартные питательные среды и растворы отечественного и зарубежного производства. Культивирование клеток проводили в инкубаторе фирмы Sanyo (Япония).
Костный мозг 20 здоровых доноров был получен в клинике «Бьюти Плаза», методом пунктирования гребня подвздошной кости. ММСК КМ получали методом центрифугирования в градиенте плотности фиколла. Полученную популяцию клеток переносили в культуральный матрас из расчета 1 млн. клеток на 1 см2.
Морфологическую оценку ММСК КМ проводили с помощью фазово-контрастной микроскопии.
Изучение клеточных популяций проводили путем анализа клеток, окрашенных иодитом пропидия по пяти клеточным культурам.
Начиная с 1-го пассажа, анализировалось влияние подложек и ростовых факторов на длительность культивирования ММСК КМ.
Подготовку проб для кариологического анализа проводили по стандартной методике с использование раствора колхицина. Хромосомные препараты анализировали методом GTG-окрашивания.
Окрашивание поверхностных маркеров полученной культуры ММСК КМ проводили по методике, описанной Zeille G. (1980) и Collotta F. (1984). Было проанализировано 270 проб клеточной суспензии от 9 доноров.
Анализ локализации ММСК КМ человека в организме животных проводили на 20 самках мышей линии Balb/C nude с помощью ПЦР-анализа по Y-хромосоме на 21-е сутки.
Способность ММСК пяти клеточных линий к дифференцировке в клетки мезодермального ряда и специфическое окрашивание проводилось по Pittenger (1999) и Reyes (2001).
Окраска на специфические антитела проводилась с использованием коммерческого набора DAB-kit (Chemicon, США). Молекулярный анализ дифференцированных клеток проводился методом ОР-ПЦР.
Для создания ТТКТ использовали матриксы BD СаР (BD Biosciences, Германия) и СаР матриксы (Канада) и ММСК КМ человека. После насыщения матрикса клетками, трехмерные структуры культивировали в остеогенной среде в течение 4 недель.
Доклинические испытания проводились на 16 мышах (Balb/C nude). Для оценки токсичности и туморогенности, ТТКТ вшивали подкожно иммунодефицитным мышам в область спины на срок 8 недель.
Клиническое изучение ТТКТ проводили на 9 овцах романовской породы путем моделирования перелома плюсневой кости размером 3,5 см. В эксперименте исследовали 3 группы: 1- контрольный перелом; 2 – в место перелома помещали КФ матрикс без клеток; 3 - в место дефекта помещали ТТКТ. Фиксацию проводили с помощью аппарата Илизарова. У овец в течение срока наблюдения (1 месяц) изучали динамику изменений гематологических и биохимических показателей периферической крови.
Экспериментальные данные обрабатывали методом среднестатистического анализа и с помощью программ CXP v. 2.1 и MultiCycle.
В выполнении отдельных этапов работы принимали участие д.б.н., проф. Савченкова И.П., к.б.н. Коржикова С.В., Шарифуллина С.З. (ООО «Институт стволовой клетки»), сотрудники кафедры иммунологии и кафедры хирургии ФГОУ ВПО МГАВМиБ, ГУ РОНЦ им. Н.И. Блохина РАМН и ИБХ им. Ю.А. Овчинникова и М.М. Шемякина РАН, за что автор им искренне благодарен.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Оптимизация условий выделения и культивирования ММСК КМ
При выделении ММСК КМ сравнивали несколько способов разделения в градиенте фиколла с разными параметрами осаждения клеток, результаты, которых представлены в таблице 1.
Табл. 1. Зависимость количества полученных ММСК от параметров центрифугирования
| Параметры центрифугирования в градиенте фиколла, об/мин | Кол-во клеток в мононукл. фракции, млн. кл. | Кол-во клеток после лизиса, млн. кл. | Кол-во ММСК через 7 дней культивирования, млн.кл. |
| 2000 | 22,7 0,8 | 14,9 0,3 | 2,35 0,18 |
| 2500 | 27,2 1,3 | 14,2 0,9 | 2,55 0,14 |
| 3000 | 21,4 0,6 | 14,3 0,3 | 3,25 0,08 |
| 3500 | 23,8 1,1 | 14,5 0,8 | 2,9 0,17 |
Сравнительный анализ эффективности выделения ММСК при различных параметрах центрифугирования показал, что режим, составляющий 3000 об./мин. является наиболее оптимальным. При таких параметрах в получаемой мононуклеарной фракции содержится наименьшее количество клеток крови, мешающих росту культуры ММСК, а выделенная популяция ММСК к 10 суткам культивирования достигает монослоя.
При анализе влияния различных подложек, а также при добавлении к среде для культивирования ростовых факторов было установлено, что культивирование на подложках на основе коллагена, фибронектина, желатина способствует поддержанию культуры в недифференцированном состоянии. Добавление в среду для культивирования фактора роста фибробластов или его комбинации с фактором роста эндотелия усиливает эффект влияния подложек.
Таким образом, полученные нами данные являются оптимальными для культивирования и позволяют пассировать клетки без спонтанной дифференцировки в культуре более 15 пассажей.
Морфологические особенности ММСК КМ в культуре
ММСК обладали фибробластоподобной морфологией, высокой адгезивностью, клоногенностью, способностью многократно пролиферировать в культуре (более 60 генераций) (рисунок 1).

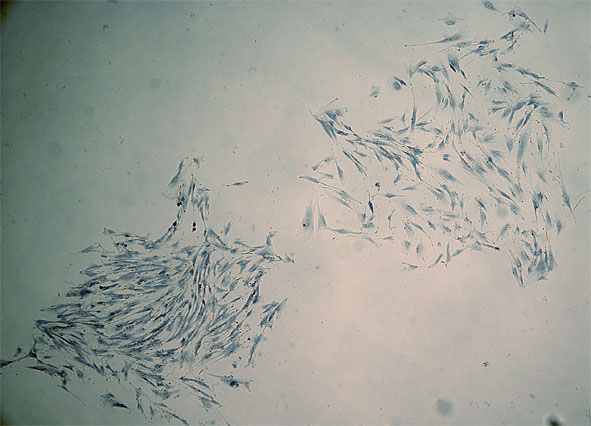
а) б)
Рис.1 Морфология и особенности роста в культуре ММСК КМ
а) популяция ММСК через 7 дней после выделения; х100; б) образование колоний in vitro, х40
Время цитогенерации составило 56-60 часов, а митотический индекс - 31‰. Полученные данные согласуются с данными, полученными в других лабораториях (Zohar et al., 1997; Colter et al., 2000; Hung et al., 2002) и подтверждают, что полученная нами популяция клеток обладает основным характеристиками и особенностями роста ММСК в культуре in vitro.
Анализ ММСК КМ в динамике культивирования in vitro
Анализ клеточной линии на 3 пассаже, при прохождении клетками 32 цитогенераций, показал нормальный, диплоидный кариотип культуры. Также культура клеток была проанализирована на 10 пассаже (клетки прошли 70 цитогенераций). Кариотип данной культуры клеток 46, ХХ, без анеуплоидии и структурных перестроек хромосом.
Таким образом, анализ хромосом позволил сделать заключение, что линия имеет диплоидный кариотип 46, ХХ, не меняющийся во время долгосрочного культивирования.
Культуры клеток были проанализированы по основным параметрам в фазе логарифмического роста. Данные приведены в таблице 2.
Табл. 2. Анализ клеточных культур в фазе log-роста
| № образца | Количество делящихся клеток (S+G2+M) | Индекс ДНК (G2/G1) | Количество живых клеток (%) | Количество клеток в апоптозе (%) |
| 1 | 11,6% | 1,96 | 91,7 | 7,2 |
| 2 | 12,3% | 1,96 | 87,8 | 10,8 |
| 3 | 9,5% | 1,958 | 90,0 | 5,7 |
При длительном культивировании количество генетического материала не менялось. Коэффициент распределения D.I. для культуры клеток ММСК КМ 2 пассажа - 1,3, D.I. 9 пассажа - 1,32. Эти данные соответствуют норме и характеризуют стабильность количества ДНК при длительном пассировании полученной культуры.
Анализ поверхностных маркеров, выделенной популяции ММСК
Среднестатистические данные профиля экспрессии поверхностных антигенов по 9 образцам ММСК приведены в таблице 3.
Табл.3. Иммуннофенотипирование культуры ММСК костного мозга
| CD-маркер | ММСК | CD-маркер | ММСК |
| CD10 | 78,5 ± 3,2 | CD73 | 96,7 ± 1,2 |
| CD13 | 99,0 ± 1,0 | CD90 | 98,1 ± 1,1 |
| CD25 | 1,7 ± 0,5 | CD105 | 97,7 ± 1,5 |
| CD29 | 98,5 ± 1,3 | CD106 | 60,0 ± 2,4 |
| CD31 | 3,2 ± 0,1 | CD117 | 2,9 ± 0,4 |
| CD34 | 3,5 ± 0,3 | CD120a | 34,2 ± 1,3 |
| CD44 | 98,7 ± 0,9 | CD124 | 3,8 ± 0,3 |
| CD45 | 4,5 ± 0,3 | CD133 | 1,7 ± 0,1 |
| CD49a | 97,1 ± 2,7 | CD166 | 99,1 ± 0,5 |
| CD49b | 95,2 ± 3,8 | HLA ABC | 99,5 ± 0,5 |
| CD49d | 20,6 ± 1,4 | HLA DP | 4,8 ± 0,8 |
| CD49f | 78,0 ± 3,2 | HLA DQ | 2,5 ± 0,3 |
| CD54 | 69,0 ± 2,9 | HLA DR | 2,1 ± 0,5 |
| CD71 | 86,4 ± 4,3 | Stro1 | 2,2 ± 0,7 |
Полученные данные иммуннофенотипирования свидетельствуют о наличии разнообразных поверхностных CD-кластеров. Наиболее типичными для ММСК являются СD13, CD29, CD44, CD49a и b, CD73, CD90, СD105, CD166, при этом на поверхности культуры отсутствовали маркеры гемопоэтических и эндотелиальных клеток, что согласуются с ранее полученными данными Minguell et al., (2001), Reyes et al. (2001), De Ugarte et al (2003).
Способность ММСК костного мозга к цитодифференцировке в клетки мезодермального происхождения
Окрашивание клеток после культивирования в адипогенной среде осуществляли с помощью специфического красителя Oil Red. Эффективность адиподифференцировки ММСК КМ составила порядка 20-30%. Возможно, это обусловлено наличием небольшого количества истинно стволовых клеток в полученной культуре клеток.
После 1-й недели культивирования в остеогенной среде в культуре ММСК КМ было выявлено изменение морфологии и накопление кальцифицированного матрикса. Для оценки остеодифференцировки через 14 дней после культивирования в остеогенной среде клетки окрашивали на щелочную фосфатазу (ЩФ) и на 28 день - ализариновым красным и по von Kossa (рис. 2). Эффективность остеодифференцировки составила 85-90%. Такая высокая эффективность может быть объяснена тканеспецифичностью полученной популяции клеток.

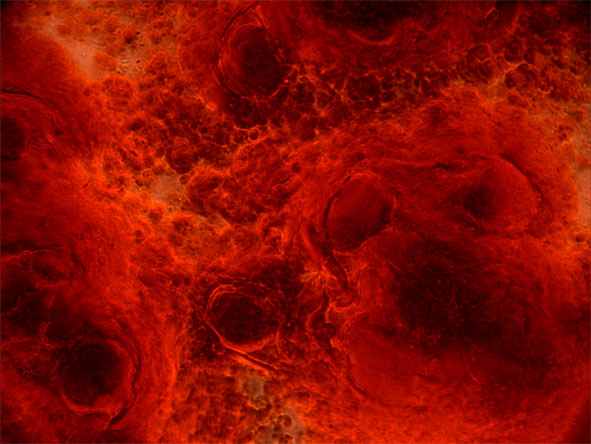
а) б)
Рис. 2. Этапы остеодифференцировки ММСК КМ in vitro
а) через 14 дней после внесения остеогенной среды, окраска на ЩФ, х200; б) через 28 дней после внесения остеогенной среды, окраска ализориновым красным, х200
При моделировании хондроструктур на основе ММСК, так называемые pellet culture, было показано, что через 28 дней в присутствии хондрогенной среды клетки экспрессируют основные маркеры хондрогенеза - коллаген II, аггрекан. Эффективность дифференцировки составила 60-70%.
Таким образом, дифференцировочный потенциал полученных клеток, подтверждает их способность к образованию тканей мезодермального происхождения.
Молекулярный анализ коммитированных ММСК направленных в дифференцировку в клетки костной и хрящевой тканей
Проведенный ОР-ПЦР-анализ остеоиндуцированных образцов ММСК КМ выявил экспрессию основных маркеров остеогенеза. В индуцированных образцах детектировалась экспрессия остеопонтина (ОП), остеокальцина (ОК), костного сиалопротеина II (КСП II) уже на 2-й неделе после внесения индукторов. Результаты молекулярного анализа отражены в таблице 4.
Табл. 4.Результаты ОТ-ПЦР-анализа ММСК КМ после
культивирования в остеогенной среде
| Маркер | Последовательность праймера | Размер продукта | ММСК КМ | |
| опыт | контроль | |||
| 14 21 28 | 14 21 28 | |||
| ОП | 5’acccttccaataagtccaac3’ 5’aggtgatgtcctcgtctgta3’ | 355 н.п. |  |  |
| КСП II | 5’aagggcacctcgaagacaac3’ 5’accatcatagccatcgtagc3’ | 267 н.п. |  |  |
| ОК | 5’atgagagccctcacactcctc3’ 5’ccgtagaagcgccgataggc3’ | 294 н.п. |  |  |
| GAPDH | 5’gggctccttttaactctggt3’ 5’tggcaggtttttctagacgg3’ | 702 н.п. |  |  |
На основе полученных данных было сделано заключение, что ММСК КМ обладают большой потенцией к дифференцировке в клетки костной ткани.
ОТ-ПЦР-анализ образцов клеток после индукции в хондрогенном направлении, подтвердил наличие стойкой экспрессии маркеров специфичных для хрящевой ткани (коллаген II), начиная с 3 недели хондродифференцировки. Ранний маркер хондрогенеза - аггрекан - появляется на 2-й неделе индукции. Экспрессия коллагена X, наличие которого свидетельствует о гипертрофии хондроцитов, практически не детектируется. Таким образом, было сделано заключение о дифференцировочном потенциале ММСК КМ в костную и хрящевую ткани.
Локализация ММСК in vivo в организме мыши
при внутривенном введении
По результатам ПЦР-анализа присутствие донорских клеток было обнаружено в легких, печени, костном мозга и селезенке, что свидетельствует об относительно равномерном распределении ММСК КМ в паренхиматозных, а также кроветворных органах животного. ММСК не элиминируются, не являются токсичными и не обладают туморогенными свойствами.
Получение ТТКТ на основе ММСК КМ и КФ матрикса in vitro
Для насыщения матриксов клетками были использованы рекомендуемые производителями условия. Однако гистологический анализ полученных 3D-структур выявил неравномерность и недостаточность заполнения пор матриксов. После культивирования в остеогенной среде по результатам иммуногистохимического анализа не было выявлено экспрессии специфических маркеров остеодифференцировки (ОП, ОК). Поэтому, был разработан метод эффективного и равномерного насыщения матриксов клетками, а также определено оптимальное количество клеток на 1см3 матрикса. Исследования по наполнению матриксов приведены в таблице 5.
Табл. 5. Определение количества ММСК КМ для эффективного
заполнения матрикса
| Кол-во клеток на матрикс | 2,5x105 | 1,0х106 | 2,0х106 |
| Кол-во клеток вне матрикса через 24 часа, тыс. кл. | 43,8 4,1 | 150,0 6,3 | 740,0 8,0 |
Для получения ТТКТ были определено значение 2х106 клеток на матрикс (Vматрикса = 0,058 см2). Проведенный иммуногистохимический анализ полученных структур после направленной дифференцировки выявил наличие экспрессии специфических маркеров дифференцировки (ОП, ОК).
Таким образом, было показано, что плотность заполнения пор матрикса оказывает влияние на эффективность дифференцировки клеток в остеогенном направлении.
Гистологический и иммунногистохимический анализ ТТКТ,
имплантированных в организм мыши
Полученные ТТКТ эктопически вшивали подкожно иммунодефицитным мышам. Гистологический анализ извлеченных через 8 недель ТТКТ выявил сохранение экспрессии основных маркеров остеодифференцировки, а также сохранение трехмерной структуры трансплантатов. ТТКТ после извлечения из организма животного были покрыты соединительнотканной капсулой, а гистологический анализ выявил наличие сосудистых образований в извлеченной структуре, что говорит о физиологическом соответствии и возможности приживления ТТКТ. Во время эксперимента погибло 3 животных, что составляет 19% от общего количества, и является нормой для данного типа животных.
Влияние полученных трансплантатов костной ткани
на организм овец при остеосинтезе
После операций с имплантацией ТТКТ отмечается достоверное снижение основных параметров красной крови (Эр, Hb) и их функциональной активности. Аналогичные изменения отмечали и у животных контрольной группы, что указывает на реакцию организма, на травму.
При анализе лейкоцитарной фракции во всех экспериментальных группах отмечали относительный нейтрофилез, моноцитоз и лимфопению, что является адаптивной реакцией на травму.
Таким образом, система крови участвует в адаптивных реакциях организма овец, которые мобилизуют клеточные резервы и, следовательно, сопровождаются выбросом клеток из депо, необходимых для активации защитных механизмов организма.
При биохимических исследованиях максимальная активность катаболических реакций была выявлена на 3-4 сутки после операции в контрольных группах и на 4-5-е сутки в опытной, при этом её проявлению предшествовала гиперпротеинемия, однако в общем пуле не изменялась доля альбуминов, глобулинов и Alb/Gl коэффициент; при усилении цитолитической реакции гепатоцитов. На фоне изменения уровня синтетических процессов; достоверно повышался уровень содержания мочевины на фоне уменьшения концентрации креатинина и мочевой кислоты. При этом концентрация мочевой кислоты в группе с ТТКТ была выше, чем в контрольных группах, что говорит о менее интенсивной фазе анаболизма нуклеопротеинов. Анаболическая фаза, характеризующаяся гиперпротеинемией на фоне снижения альбумина, возрастания глобулинов и уменьшения коэффициента Alb/G1 в опытной группе наступала на 8-9 сутки, в отличие от контрольных (10-12 сутки).
Таким образом, ММСК КМ влияют на активации репаративного остеогенеза у овец, а также на состояние белкового обмена.
ВЫВОДЫ
1. Сравнительный анализ эффективности выделения ММСК КМ показал, что режим центрифугирования, составляющий 3000 об./мин. является оптимальным для получения популяции ММСК.
2. ММСК КМ обладали способностью к клонообразованию. Время удвоения составило 56-60 час. Клетки характеризовались низким митотическим индексом (равен 31‰).
3. Культивирование на подложках на основе коллагена, фибронектина, желатина способствует поддержанию культуры в недифференцированном состоянии, добавление в среду для культивирования фактора роста фибробластов или его комбинации с фактором роста эндотелия также способствует сохранению культуры в некоммитированном состоянии.
4. Кариологический анализ клеточных линий на раннем и позднем пассажах показал нормальный, диплоидный кариотип культуры.
5. Показана экспрессия специфичных поверхностных антигенов ММСК КМ и отсутствие маркеров гемопоэтических и эндотелиальных клеток.
6. При культивировании в адипогенной, остеогенной или хондрогенной средах была показана дифференцировка в данных направления с эффективностью 30%, 90% и 70% соответственно.
7. Получены 3D-структуры, подобные костной ткани, на основе ММСК КМ и кальций-фосфатного матрикса, разработан метод эффективного и равномерного насыщения матриксов клетками, а также определена их оптимальная концентрация на 1см3 матрикса, которая составляет 30 млн. клеток.
8. Исследования в условиях in vivo на иммунодефицитных мышах и овцах показали, что полученные ТТКТ не оказывают токсического влияние на организм животных и не туморогенны.
Практическое использование полученных
научных результатов
1. Разработаны и утверждены Федеральной службой по надзору в сфере здравоохранения и социального развития (рег. удостоверение №ФС-2006/266-у) методические рекомендации «Получение мезенхимальных стволовых клеток из костного мозга взрослого человека», в которых изложен метод получения ММСК КМ, приведены показания, противопоказания и материально-техническое обеспечение технологии, позволяющие рационализировать метод получения данных клеток.
2. Данный способ выделения используется для получения и наращивания клеточной массы для последующей криоконсервации и длительного хранения в клинике «Бьюти Плаза» (по лицензии Федеральной службы по надзору в сфере здравоохранения и социального развития на применение новых клеточных технологий в здравоохранении №77-01-000343 от 11.08.2005 г.).
3. Метод получения ТТКТ на основе ММСК КМ человека и животных используется в ГУ РОНЦ им. Н.Н.Блохина РАМН для контроля полученных биоимплантов (договор №12/2005 от 16.09.2005 г.) и в ФГОУ ВПО МГАВМиБ для замещения костных дефектов у животных.
4. Материалы диссертационной работы используются в учебном процессе в ФГОУ ВПО МГАВМиБ для студентов факультета медицинской ветеринарии.
рекомендации по использованию научных выводов
1. Рекомендовать метод выделения ММСК КМ для выделения и наращивания необходимого количества клеток для банкирования медицинским и ветеринарным учреждениям с целью сохранения клеточного материала для дальнейшего использования.
2. Рекомендовать отработанные технологические параметры по получению ТТКТ на основе ММСК КМ для дальнейших экспериментов с целью разработки метода замещения поврежденной костной ткани для ускорения процесса регенерации у человека и животных.
3. Рекомендовать использовать в учебном процессе на базе высших учебных заведений, при изучении дисциплин «Иммунология», «Биотехнология», «Хирургия».
список работ, опубликованных по теме диссертации
1. Teplyashin A.S. Characterization of human MSC-like cells isolated from bone marrow, adipose tissue, skin and placenta /A.S. Teplyashin, N.I. Tchupikova, S.Z. Sharifullina et al. //Herbsttagung der Gesellschaft fur Biochemie und Molekularbiologie. - Munster: GBM. - 2004. - P. 24.
2. Чупикова Н.И. Выделение мезенхимальных стволовых клеток из костного мозга человека и их характеристика /Н.И. Чупикова, М.С. Ростовская, С.З. Шарифуллина, А.С. Тепляшин. //Цитология. - 2004. - Т. 46. - №. 10.- C. 947.
3. Тепляшин А.С. Возможности применения мезенхимальных стволовых клеток при лазерной дермабразии /А.С. Тепляшин, С.А. Петрин, В.С. Еременко, С.З. Шарифуллина, Н.И. Чупикова и др. //Лазерная медицина. - 2004. - Т. 8. - № 3.- С. 48.
4. Тепляшин А.С. Характеристика мезенхимальных стволовых клеток человека, выделенных из костного мозга и жировой ткани /А.С. Тепляшин, С.В. Коржикова, С.З. Шарифуллина, Н.И. Чупикова и др. //Цитология. - 2005. - Т. 47. - № 2. - С. 130-135.
5. Тепляшин А.С. Создание трехмерных трансплантантов хрящевой ткани человека /А.С. Тепляшин, С.В. Коржикова, С.З Шарифуллина., Н.И. Чупикова и др. //Биотехнология: состояние и перспективы развития: сб. науч. трудов. – М: Экспо-биохим-технологии. - 2005. - Ч. 1. - С. 104.
6. Teplyashin A.S. Formation of human three-dimensional transplants of bone tissue /A.S. Teplyashin, N.I. Chupikova, S.V. Korjikova et al. //4th Annual Meeting of the European Tissue Engineering Society. - Munich: Etes. - 2005. - P. XC.
7. Teplyashin A.S. Influence of seeding concentration of сells on efficiency of occupation of Ca-P 3D scaffolds with bone marrow stromal stem cells and differentiation in bone-like tissue /A.S. Teplyashin, N.I. Chupikova, S.V. Korjikova et al. //Eur cell mater. – 2005. – V. 10 (S. 5). – P. STE13.
8. Teplyashin A.S. In vitro cartilage formation by bone marrow-derived mesenchymal stem cells in OPLA scaffolds /A.S. Teplyashin, S.V. Korjikova, N.I. Chupikova et al. //Tissue Engineering. - 2006. - V.12. - N4. - P. 1090.
9. Тепляшин А.С. Мультипотентные мезенхимные стромальные клетки человека – перспективный материал для моделирования остео- и хондрогенеза in vitro /А.С. Тепляшин, Н.И. Чупикова, С.З. Шарифуллина и др. //Биотехнология и медицина: сб. науч. трудов. – М.: Экспо-биохим-технологии. - 2006. - Ч. 1. - С. 294.
10. Тепляшин А.С. Перспективы использования мультипотентных мезенхимных стромальных клеток костного мозга и жировой ткани в регуляции регенерации опорных тканей /А.С. Тепляшин, С.З. Шарифуллина, Н.И. Чупикова, Р.И. Сепиашвили //Аллергология и иммунология. - 2006. - Т. 7. - № 2 - С. 189-198.
11. Чупикова Н.И. Дифференцировка мультипотентных мезенхимных стромальные клеток костного мозга в клетки костной ткани при культивировании их в трехмерном кальций-фосфатном матриксе /Н.И. Чупикова //Аллергология и иммунология.- 2006. - Т.7. - № 3 - С. 248.
12. Тимофеев С.В. О возможностях применения стволовых клеток в ветеринарии (ч.1) /С.В. Тимофеев, Р.Р. Мамашева, А.В. Кузнецов, С.Ю. Концевая, Н.И. Чупикова и др. //Ветеринарная клиника. – 2006. - № 9 (52). – С. 21-23.
13. Тимофеев С.В. О возможностях применения стволовых клеток в ветеринарии (ч.2) /С.В. Тимофеев, Р.Р. Мамашева, А.В. Кузнецов, С.Ю. Концевая, Н.И. Чупикова и др. //Ветеринарная клиника. – 2006. - № 10 (53). – С. 5-8.
14. Teplyashin A.S. A comparison of bone marrow-derived and adipose tissue-derived multipotent mesenchymal stromal cells as perspective material for engineering osteo- and chondrogenesis in vitro /A.S. Teplyashin, N.I. Chupikova, S.Z. Sharifullina et al. //Tissue Engineering and regenerative Medicine. - 2006. - № 95. – P. 80.
