Цервикальной неоплазии
| Вид материала | Автореферат |
- Течение и исходы беременности при консервативной и хирургической коррекции истмико-цервикальной, 92.09kb.
- Опыт применения акушерского разгрузочного пессария у беременных с истмико-цервикальной, 49.95kb.
- Применение постизометрической релаксации мышц головы и шеи и механического вытяжения, 399.92kb.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
1. Клинико-эпидемиологические аспекты генитальных инфекций, ассоциированных с поражением цервикального эпителия. Слизистая оболочка шейки матки как пограничный барьер между верхним отделом генитального тракта и внешней средой постоянно подвергается воздействию повреждающих факторов. Наиболее агрессивным антигенным воздействием на цервикальный эпителий обладают сексуально-трансмиссивные инфекции. Именно на фоне генитальных инфекций развивается большинство поражений шейки матки с нарушением процессов пролиферации, дифференцировки и гибели клеток, а инфекции приобретают хроническое рецидивирующее течение. Среди инфекций, передаваемых половым путем, наибольшее модулирующее влияние на течение патологических процессов шейки матки оказывают вирусы и хламидии, инфицирование которыми связывают с потенциальным риском малигнизации цервикального эпителия.
Результаты проведенного исследования показали, что среди здоровых женщин без патологических изменений цервикального эпителия у 12,0±4,6% выявлялись HPV и у 4,0±2,8% – HSV и CMV, что свидетельствует о достаточно высокой распространенности HPV у здоровых женщин.
При цервикальной интраэпителиальной неоплазии инфицированными оказались 78,1±2,1% пациенток (p<0,001). Наиболее часто встречались HPV, которые в 58,9±6,8% случаев сочетались с другими ИППП: в 18,8±4,0% – с СТ, в 10,6±3,2% – CMV и в 5,3±2,3% – HSV. У больных раком шейки матки в 94,4±3,8% выявлялись HPV (p<0,001). В 52,7±5,4% случаев HPV имели смешанный характер: в 19,8±4,1% – с CMV (p=0,079), в 18,6±4,3% – с HSV (p=0,004) и в 7,3±2,7% – с CТ (p=0,027).
При оценке частоты встречаемости ИППП среди различных возрастных групп максимальная инфицированность была отмечена в возрасте от 20 до 29 лет и от 40 до 49 лет. HPV HR чаще выявлялись у женщин, игнорирующих контрацепцию – 53,1±6,2 (р=0,034), сочетание HPV и CT ассоциировалось с высокой частотой перенесенных доброкачественных заболеваний шейки матки – 62,5±9,9 (р=0,015), HPV и CMV – с отягощенным акушерско-гинекологическим анамнезом – 60,0±8,9 (р=0,021). Большинство инфицированных женщин имели хронические воспалительные заболевания гениталий – 33,3±9,6 (р=0,033) и были курящими – 66,6±9,7 (р<0,001).
Распределение HPV по типам подтвердило общие тенденции преобладания HPV низкого онкогенного риска среди здоровых вирусоносителей (таб. 1).
При прогрессировании цервикальной интраэпителиальной неоплазии и развитии рака шейки матки наиболее часто выявлялись канцерогенные типы HPV. На долю 16 и 18 типов HPV приходилось 12,5-53,1% цервикальной интраэпителиальной неоплазии и 56,7-61,1% рака шейки матки.
При CIN чаще выявлялся 16 тип вируса. Отмечена прямая корреляционная зависимость между выявлением в цервикальном эпителии HPV 16 типа и степенью тяжести цервикальной неоплазии: коэффициент корреляции при CIN I составил r=0,762 (р=0,001), при CIN II – r=0,862 (р=0,047) и при CIN III – r=0,835 (р=0,037). У больных раком шейки матки чаще встречались 16 и 18 типы HPV, при инвазивных опухолях превалировал 18 тип HPV, сочетавшийся в 22,2±6,9% случаев с HSV. Установлено, что HSV-инфицирование связано с инициацией интеграции вирусного генома HPV в клеточную ДНК, что в большинстве случаев может рассматриваться как свидетельство процесса малигнизации инфицированных HPV клеток (J.S. Smith и соавт., 2002).
Таблица 1
Распределение типов HPV
| Тип HPV | Группы обследованных, число обследованных (n), % инфицированных | ||||||
| Здоровые | Цервикальная неоплазия | Рак шейки матки | |||||
| CIN I | CIN II | CIN III | Ia | Ib | II-III | ||
| n=50 | n=62 | n=60 | n=93 | n=40 | n=30 | n=84 | |
| 6 | 6,0±3,4 | 9,4±5,2 | 6,7±4,6 | – | – | – | – |
| 11 | 4,0±2,8 | 6,3±4,3 | 3,3±3,3 | 3,1±3,1 | – | – | – |
| 16 | 2,0±2,0 | 9,4±5,2 | 16,7±6,8 р=0,014 | 37,5±8,6 p<0,001 р1=0,007 | 30,0±8,4 p<0,001 р1=0,039 | 27,7±8,1 р1=0,005 | 38,9±8,1 р1<0,001 р2=0,030 |
| 18 | – | 3,1±3,1 | 6,7±4,6 | 15,6±6,4 | 20,0±7,3 р1=0,033 | 30,0±8,4 p<0,001 р1=0,039 | 22,6±4,6 р=0,002 |
| 31 | – | – | – | 3,1±3,1 | 6,7±4,6 | 10,0±5,5 | 13,9±5,8 |
| 33 | – | – | 3,3±3,3 | 6,3±4, | 3,3±3,3 | 10,0±5,5 | 8,3±4,6 |
| 35 | – | – | – | 6,3±4,3 | 6,7±4,6 | 3,3±3,3 | 8,3±4,6 |
| 45 | – | – | 6,7±4,0 | – | 3,3±3,3 | – | – |
| Микст HPV | – | – | 10,0±5,5 | 6,3±4,3 | 6,7±4,6 | 10,0±5,5 | 2,8±2,7 |
| Итого | 12,0±4,6 | 28,1±7,9 р=0,050 | 53,3±9,1 p<0,001 р1=0,040 р2=0,037 | 78,1±7,3 p<0,001 | 77,7±7,7 | 90,0±5,5 | 94,4±3,8 |
Примечания: типы HPV высокого онкогенного риска выделены жирным шрифтом, типы низкого онкогенного риска – курсивом.
p – статистическая значимость различий с контролем;
р1 – статистическая значимость различий по сравнению с CIN I;
р2 – статистическая значимость различий по сравнению с CIN III.
Исследование показало, что HPV 16 типа превалировал при плоскоклеточном неороговевающем раке (p=0,012), а инфицирование HPV 18 типа и HSV чаще встречалось при мелкоклеточном низкодифференцированном раке и эндоцервикальных аденокарциномах (p=0,041 и p=0,037 соответственно).
Клиническое течение цервикальной интраэпителиальной неоплазии и рака шейки матки не зависело от типа HPV. В 45,5% (9 случаев) рецидивирующего течения цервикальной интраэпителиальной неоплазии выявлялось с хламидийно-папилломавирусное инфицирование (p<0,001). Рак шейки матки, ассоциированный с HPV 18 типа и HSV, составлял 38,8% (19 наблюдений) в группе неблагоприятного прогноза.
Длительная персистенция сексуально-трансмиссивных инфекций, сопровождающаяся существенными изменениями иммунологической реактивности организма, создает условия для прогрессии цервикальной неоплазии и рака шейки матки. Выявленные взаимосвязи между инфекционно обусловленными изменениями шейки матки и особенностями клинического течения цервикальных неоплазий и рака шейки матки могут быть использованы в качестве факторов прогноза.
2. Локальная продукция цитокинов при поражениях шейки матки. В генезе неопластических изменений шейки матки определяющее значение имеют локальные иммунные реакции, механизм регуляции которых связан с продукцией цитокинов. Система цитокинов обеспечивает развитие воспалительных реакций, межклеточные взаимодействия, реализацию эндокринных эффектов и во многом определяет клинические проявления и исход заболевания (Пальцев М.А. и соавт., 1995; Зубова С.Г. и соавт., 2001; Кадагидзе З.Г., 2003).
Проведенная сравнительная оценка локальной продукции цитокинов TNFα, IL-1β и TGFβ в зависимости от варианта инфицирования шейки матки, позволила выявить следующие особенности (рис.1). При моноинфицировании HPV HR и HPV LR отмечено увеличение продукции TGFβ на фоне стабильных по отношению к контролю значений IL-1β и TNFα. Отсутствие адекватной ре-
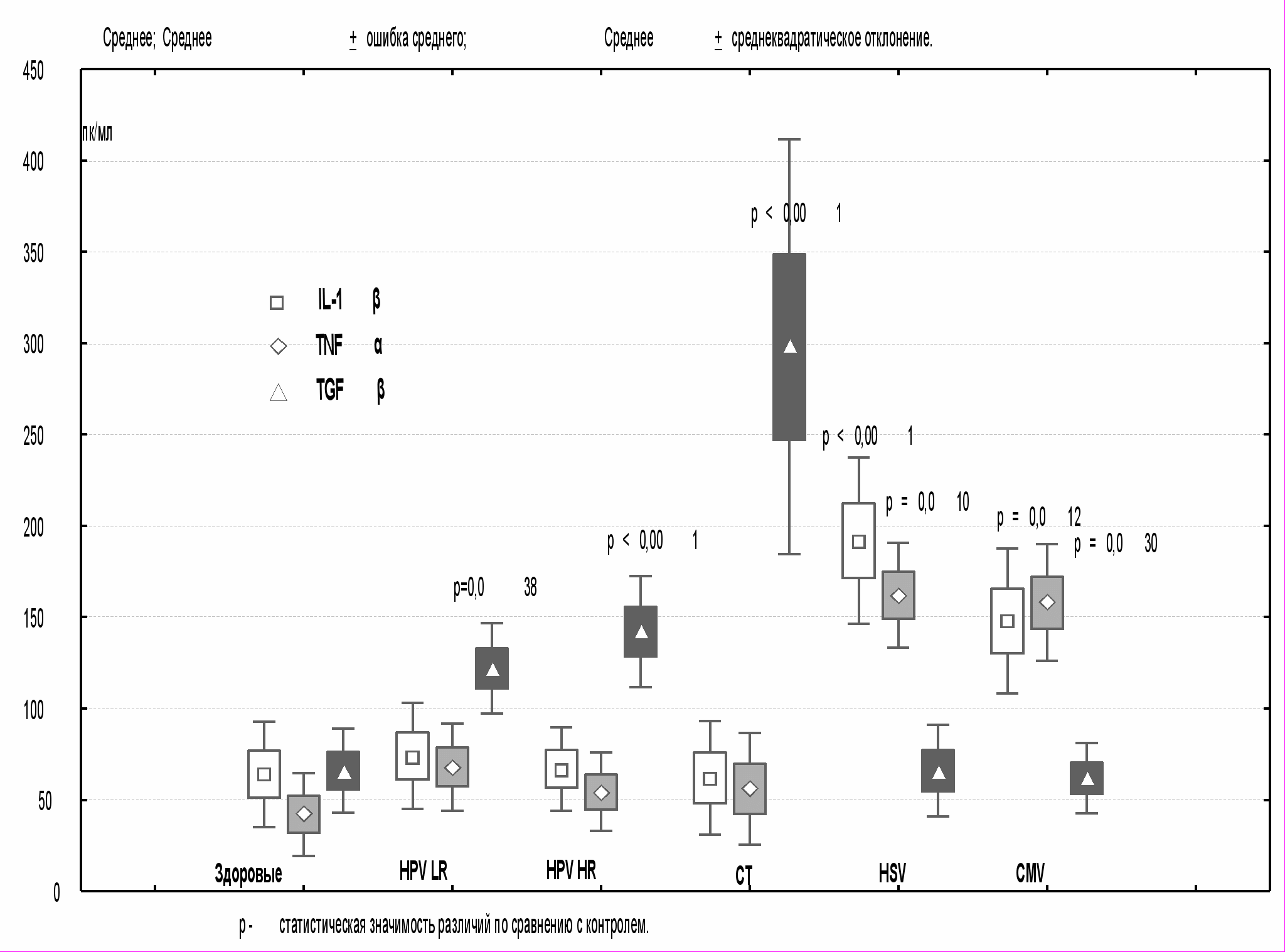
Рис. 1. Содержание IL-1β, TNFα, TGFβ в зависимости
от инфицирования шейки матки.
акции защитных систем при HPV связано с иммуносупрессивными свойствами персистирующего вируса (F.L.Kisseljov, 2000; D. Gaiotti и соавт, 2000). Тем не менее, длительное присутствие вируса приводит к изменению антигенной структуры эпителиоцитов, инициируя активацию иммунокомпетентных клеток и увеличение продукции TGFβ (S.L. Giannini и соавт., 1998; Slier A. и соавт., 1998). Высокие уровни TGFβ при ассоциированной хламидийно-папилломавирусной инфекции связаны с продукцией СТ белков теплового шока (Peeling R.W. и соавт., 1999; Zugel U. И соавт., 1999). Увеличение продукции TGF-β, инактивирующего цитотоксическую активность макрофагов, сопровождается снижением экспрессии TNFα и IL-1β (Зубова С.Г. и соавт., 2001).Известно, что TNFα и IL-1β, продукция которых увеличивалась при инфицировании шейки матки HPV HR в сочетании с HSV и CMV, связаны с локальными защитными реакциями против внутриклеточных вирусов. Несмотря на активацию механизмов противоинфекционной защиты, элиминации вирусов герпеса и цитомегалии не происходит, продолжается их персистенция с повреждением клеток эпителия шейки матки. Несостоятельность систем защиты при инфицировании HPV в сочетании HSV и CMV связана с экспрессией вирусами генов, гомологичных цитокинам и их рецепторам, что позволяет вирусам препятствовать их презентации иммунокомпетентным клеткам, влиять на вирусную репликацию и блокировать противовирусную активность IF и TNFα (Носик Н.Н., 2000; Ramshaw I.A. и соавт., 1998).
Биологические свойства провоспалительных цитокинов связаны не только с противовирусной, но и с противоопухолевой активностью. Нормальная микрофлора слизистой оболочки шейки матки обеспечивает достаточно высокий уровень продукции цитокинов в цервикальном секрете здоровых женщин. При снижении продукции провоспалительных цитокинов, что отмечалось в группе вирусоносителей без патологических изменений шейки матки, вирусы могут персистировать в эпителиальных клетках длительное время и при воздействии определенных факторов способны инициировать неопластическую трансформацию клеток. Прогрессирование цервикальной неоплазии связано с развитием локального иммунодефицита. Инфицированные эпителиоциты, макрофаги, клетки Лангерганса слизистой оболочки шейки матки не способны продуцировать соответствующие уровни цитокинов(Connor J.P. и соавт., 1999; Tay S.K. и соавт., 1997). Деактивирующее влияние на макрофаги со снижением экспрессии провоспалительных цитокинов оказывает TGFβ. Обнаруженный в нашем исследовании возрастающий уровень TGFβ соотносился со степенью тяжести цервикальной неоплазии: повышение уровня TGFβ от 150 пкг/мл до 240 пкг/мл соответствовало CIN I-II, от 240 пкг/мл до 500 пкг/мл CIN III. Повышение экспрессии TGFβ на этапах предракового поражения CIN I-II приводит к торможению роста и переводу пролиферации в дифференцировку клеток. Дальнейшая прогрессия с развитием CIN III и рака, сопровождается снижением восприимчивости трансформированных клеток к рост-ингибирующих эффекту TGFβ с высоким его содержанием в цервикальной слизи и реализацией иммуносупрессивных и ангиогенных потенций этого цитокина. При этом постоянная стимуляция клеток и нечувствительность к антипролиферативному действию TGFβ, который является одновременно индуктором процессов клеточной дифференцировки, приводят к ингибированию или извращению этих процессов.
Способностью продуцировать некоторые цитокины обладают раковые клетки, используя их для нейтрализации противоопухолевого иммунного ответа (Кадагидзе З.Г., 2003). При раке шейки матки значительно возрастало содержание провоспалительных цитокинов IL-1β и TNFα на фоне стабильно высоких значений TGFβ. Значительное увеличение концентрации IL-1β отмечено в случае развития инвазивных опухолей. Изучение взаимосвязи IL-1β и клинико-морфологических особенностей опухолей установило, что высокие уровни IL-1β (>350 пкг/мл) чаще встречались при раке шейки матки с поражением регионарных лимфоузлов по сравнению с карциномами без метастазов. Установлено, что IL-1β способен повышать синтез опухолевыми клетками протеаз, разрушающих базальную мембрану и внеклеточный матрикс, определяя метастатическую и инвазивную активность опухоли (Бережная М.Н. и соавт., 2000). Показатели пятилетней выживаемости больных инвазивным раком шейки матки с высокими значениями IL-1β, превышавшим 300 пкг/мл, значительно хуже по сравнению с пациентками, в цервикальной слизи которых уровни IL-1β соответствовали умеренным значениям.
Полученные данные убедительно свидетельствуют о выраженном дисбалансе цитокиновой регуляции механизмов иммунного контроля клеточного гомеостаза на фоне вирусного инфицирования, что предопределяет формирование и прогрессию неопластических поражений шейки матки.
3. Экспрессия белков-регуляторов апоптоза р53mut и bcl-2. Развитие неопластических состояний связано с неспособностью клеток подвергаться апоптозу. Одним из механизмов нарушения гибели трансформированных клеток являются мутация гена p53, что препятствует функционированию белка-индуктора апоптоза p53, и нарушение экспрессии гена bcl-2, тормозящего апоптоз. При дефектном функционировании этих онкобелков происходит накопление клеток с множественными генетическими изменениями, что может рассматриваться как фактор неблагоприятного прогноза (Лихтенштейн А.В., 1997; Ярилин А.А., 1998; Лушников Е.Ф. и соавт., 2001; Швемберг И.Н. и соавт., 2002; Hale A.J. et al., 1996).
Обнаружено, что онкопротеин р53mut определялся в 21,3±4,2% случаев цервикальной интраэпителиальной неоплазии и превышал 10,0% окрашенных клеток, в контрольных образцах шейки матки р53mut не обнаружено. При раке шейки матки частота определения р53mut составила 54,2±5,1% с уровнем его экспрессии от 10 до 60% (таб. 2).
Таблица 2
Экспрессия р53mut
| Группы обследованных | n | Экспрессия р53mut, % | |
| позитивные случаи | уровень экспрессии | ||
| CIN I | 60 | 6,3±4,3 | 2,3±1,2 |
| CIN II | 62 | 16,7±6,8 | 4,8±1,2 |
| CIN III | 93 | 40,6±8,7 р=0,036 | 13,1±2,9 р=0,018 |
| Рак шейки матки: | |||
| Ia | 40 | 40,0±8,9 | 18,8±3,7 |
| Ib | 30 | 46,7±9,0 | 18,7±4,3 |
| II-III | 54 | 66,9±8,0 р1=0,050 р2=0,049 | 40,0±9,2 р2=0,050 |
р – статистическая значимость различий с CIN II;
р1 – статистическая значимость различий с Ia стадией рака;
р2 – статистическая значимость различий с Ib стадией рака.
Количество р53mut-позитивных случаев и средние значения экспрессии р53mut при CIN I и CIN II не различались, в отличие от CIN III, при которой экспрессия р53mut встречалась более чем в 40% наблюдений и превышала 10,0% окрашенных ядер. В исследованиях P.Beer-Romero и соавт. (1997) установлено, что протеин Е6 HPV HR способен активно инактивировать р53 и предупреждать апоптоз уже на ранних стадиях развития неоплазии.
Изучение возрастных особенностей экспрессии р53mut показало, что наиболее часто р53mut определялся в возрасте от 40 до 59 с высокими значениями экспрессии у женщин 40-49 лет. Отмеченная динамика может быть связано с постепенным накоплением мутантных форм р53 и увеличением вероятности развития цервикального рака (Лукьянова Н.Ю. и соавт., 2000).
По мнению большинства исследователей, р53mut считается прогностическим маркером опухолевого роста и свидетельствует об усиленном инвазивномпотенциале и биологической агрессивности опухоли (Ровенский Ю.А., 1998). Соотнесение р53mut с системой TNM (TNM Classification, 1997) выявило высокую частоту встречаемости этого онкогена при всех стадиях инвазивного поражения. Степень экспрессии р53mut значительно возрастала при опухолях Т1b-Т2-Т3 по сравнению с микроинвазивным раком: 40,0±9,2% (р=0,003); 55,6±16,2% (р=0,025) и 44,7±12,7% (р=0,022) против 18,7±4,3%. При этом р53mut-позитивные опухоли чаще были ассоциированы с местно-регионарным метастазированием, а уровень экспрессии в метастазах рака превышал свои значения по сравнению с первичными опухолями (40,0±9,2% против 66,9±8,6% в метастазах; р=0,42). Считается, что изменения активности р53 приводят к возникновению сразу нескольких компонентов метастатического фенотипа, генетической нестабильности, что облегчает появление дополнительных признаков, необходимых для метастазирования (Копнин Б.П., 2004).
Анализ клинического течения показал, что гиперэкспрессия р53mut ассоциировалась с неблагоприятным течением цервикальной интраэпителиальнойнеоплазии и рака шейки матки. Уровень экспрессии р53mut, превышающий 9,9% позитивных клеток при CIN и 30,6% – при раке шейки матки, превалировал в группе плохого прогноза (p<0,001 и p=0,034 соответственно).
Проявление проапоптозной активности продуктов гена р53 связано с экспрессией другого онкогена bcl-2, проявляющего выраженную антиапоптотическую направленность в случае действия ДНК-повреждающих факторов, именно с этим свойством связывают способность этого гена стимулировать канцерогенез (Швемберг И.Н. и соавт., 2002; X.H. Liang, 1995; Waggoner S.E. и соавт, 1998).
Выявленная экспрессия bcl-2 в базальном слое неизмененного цервикального эпителия связана с протективными функциями bcl-2, который обеспечивает клеткам локальную резистентность к воздействию разнообразных факторов альтерации (Hochebery D.M. и соавт., 1993). При CIN I-II частота и уровень экспрессии bcl-2 не отличались по сравнению с показателями контроля. Отличительной чертой CIN III явилось уменьшение случаев определения bcl-2 и появление образцов с гиперэкспрессией этого онкогена, превышающей 10,0% клеток. Этот уровень экспрессия bcl-2 сохранялся и при раке шейки матки на фоне снижения частоты выявления bcl-2 (рис. 2).
Частота определения bcl-2 коррелировала с возрастом пациенток, снижаясь по мере их старения, что связано с участием гормональной составляющей в регуляции экспрессии bcl-2 (Troche V. и соавт., 1991).
Распределение bcl-2-позитивных случаев и уровень экспрессии этого онкогена в зависимости от размеров первичного поражения таково, что наиболее часто bcl-2 определялся при поражениях шейки матки, соответствующих TIa и T2: 46,7±9,1% и 42,2±10,0% (р=0,014 и р=0,013). При этом опухоли Т2 характеризовались гиперэкспрессией bcl-2 по сравнению с карциномами TIa – 24,1±8,2% против 6,5±2,9% (р=0,048). Гиперэкспрессия bcl-2 была также выявлена и среди поражений T3, при которых доля bcl-2-положительных наблюдений снижалась по сравнению с другими группами (р=0,031).
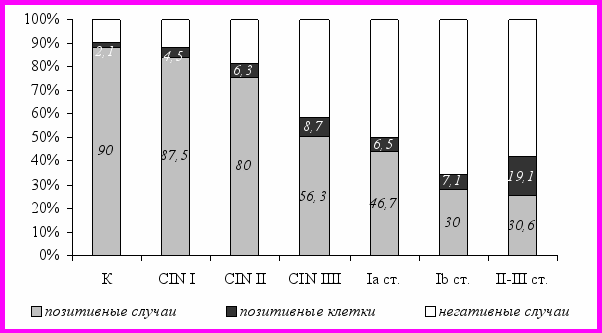
Рис. 2. Экспрессия bcl-2.
В превалирующем числе наблюдений не отмечено одновременной коэкспрессии bcl-2 и p53mut – bcl-2-негативные поражения в большинстве случаев экспрессировали p53mut, и соответственно bcl-2 выявлялся при отсутствии экспрессии p53mut. Т.е. определенный уровень продукции bcl-2 способен нивелировать гипреэкспрессию р53mut, что объясняет благоприятное течение CIN и рака шейки матки, которые ассоциировались с умеренным уровнем экспрессии bcl-2. Выраженная экспрессия bcl-2 обнаруживалась в группе неблагоприятного течения CIN и рака шейки матки – в данном случае антиапоптозная активность bcl-2 инициировала прогрессию неоплазии.
Таким образом, совокупность указанных молекулярно-биологических особенностей течения эпителиальных дисплазий и цервикальных опухолей, обусловленных дисбалансом экспрессии bcl-2 и появлением р53mut, несомненно, имеет определяющее значение в формировании неопластических потенций поражений шейки матки, и оказывает влияние на их клиническое течение.
4. Экспрессия маркеров пролиферации эпителия шейки матки. В основе образования опухоли лежит избыточная пролиферация определенных клеток, поэтому нарушения регуляции клеточного цикла являются одним из основных механизмов возникновения и развития новообразований. (Шацева Т.А., 2004). Одним из важнейших регуляторов клеточной пролиферации и злокачественной трансформации является протоонкоген С-erb-B2 (Копнин Б.Н., 2000; Фрейдлин И.С., 2001).
Выраженность патологических изменений шейки матки коррелировала с уровнем экспрессии c-erb-B2 (рис. 3).
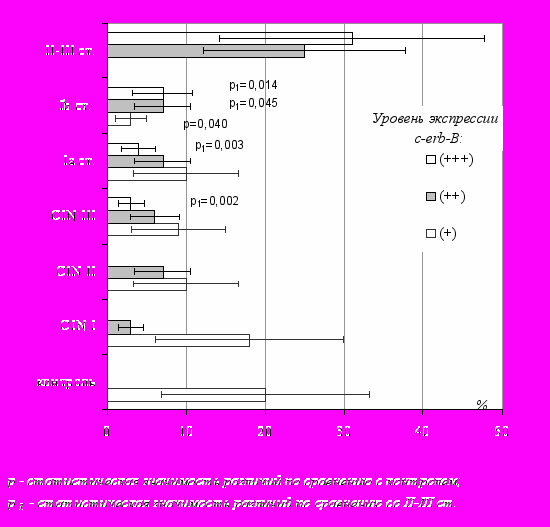
Рис. 3. Экспрессия c-erb-B2.
В неизмененном цервикальном эпителии уровень с-erb-В2 соответствовал низким значениям этого онкогена. Цервикальные неоплазии характеризовались появлением случаев умеренной и выраженной экспрессии c-erb-B2. При раке шейки матки снижалось количество случаев низкой экспрессии c-erb-B2, инвазивные опухоли экспрессировали c-erb-B2 только на умеренном и высоком уровне.
Механизмы, регулирующие экспрессию c-erb-B2 при прогрессии пренеонеоплазии и развитии рака, связаны с изменениями, которые приводят к нарушению передачи рост-ингибирующих сигналов и обеспечивают клеткам самодостаточность в пролиферативных стимулах. C.D. Woodworth и соавт. (1995-2000) обнаружили, что инфицированные HPV HR кератиноциты способны продуцировать в высоких концентрациях IL-1 и TNFα, которые стимулируют пролиферацию посредством гиперэкспрессии c-erb-B2. Таким образом, выявленное нами значительное увеличение концентраций IL-1β и TNFα при злокачественной трансформации клеток, является фактором, инициирующим высокие уровни экспрессии c-erb-B2, что является причиной повышенной пролиферативной активности трансформированных клеток.
Показано, что в регуляции экспрессии c-erb-B2 участвуют стероидные гормоны – Е2 увеличивает экспрессию c-erb-B2, реализуя свой пролиферативный эффект (Ignar-Trowbridge D.B. и соавт., 1992). Результаты проведенного анализа подтвердили наличие обратной связи между частотой определения c-erb-B2 и возрастом обследованных женщин.
Анализ клинического течения CIN и рака шейки матки, ассоциированных с c-erb-B2, p53mut и bcl-2 выявил несколько иммунологических вариантов коэкспрессии этих онкопротеинов (рис. 4). Возможно, функциональная активность экспрессирующихся онкогенов может оказывать суммарное влияние на биологическое поведение CIN и рака шейки матки.
Цервикальная интраэпителиальная неоплазия, в которой c-erb-B2- не обнаруживался или определялся на низком уровне c-erb-B2 в сочетании с умеренной экспрессией bcl-2, не превышающей 10,0% клеток, относилась к группе благоприятного прогноза. Вероятно, что сохранение супрессорного влияния bcl-2 по отношению к p53mut, оказалось стабильным и в сочетании с c-erb-B2.
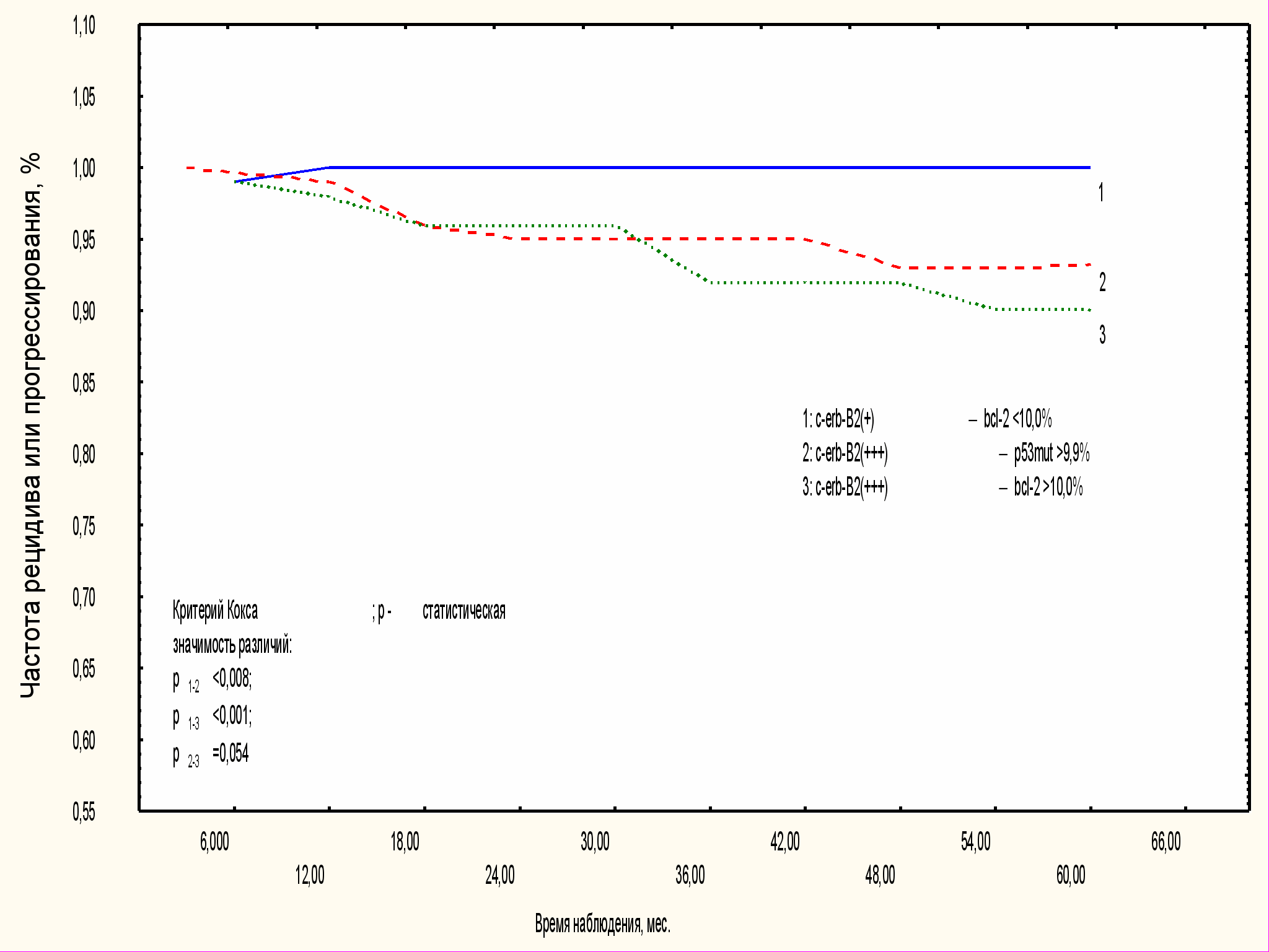
Рис. 4. Течение CIN при различных сочетаниях
c-erb-B2 с другими онкомаркерами.
Благоприятное течение предракf шейки матки было отмечено при c-erb-B2-негативных поражениях или при сочетании низкой экспрессии c-erb-B2 и умеренной экспрессии bcl-2. Сочетанная гиперэкспрессия c-erb-B2 с р53mut или bcl-2 при CIN во всех случаях была связана с рецидивом заболевания или прогрессированием в рак.
Сочетанная гиперэкспрессия c-erb-B2 и p53mut (более 30,6% клеток) определялась в 40,0±11,0% плоскоклеточных карцином, склонных к инвазивному росту и развитию регионарных метастазов, отмеченных в 20,0±8,9% случаев в различные сроки наблюдения. В группу неблагоприятного прогноза относились и опухоли с гиперэкспрессией c-erb-B2 и bcl-2, сочетание которых, вероятно, сопровождалось торможением программы клеточной гибели, и как следствие, неконтролируемым ростом с приобретением клетками метастатических свойств. Опухоли с таким сочетанием онкобелков в 30,0±10,2% наблюдений характеризовались выраженной метастатической активностью, с развитием гематогенных метастазов, глубоким инвазивным ростом.
Одним из важных клинико-морфологических параметров неопластических изменений, определяющих развитие и прогноз заболевания, считается пролиферативная активность клеток, специфичным маркером которой является PCNA (Пожарисский К.М. и соавт., 2000; Петров С.В. и соавт., 2004).
Исследование экспрессии PCNA в образцах здоровых тканей шейки матки показало, что средний уровень определения этого антигена не превышал 5,0% клеток (таб. 3).
Таблица 3
Уровень экспрессии PCNA в группах обследованных
| Группы обследованных | n | PCNA, % | р | р1 | р2 | р3 |
| Контроль | 10 | 3,5±1,5 | | | | |
| CIN I | 62 | 15,5±3,1 | 0,040 | 0,898 | | |
| CIN II | 60 | 16,1±3,5 | 0,048 | | | |
| CIN III | 93 | 27,4±4,4 | 0,005 | 0,051 | 0,846 | |
| Рак шейки матки: | | | | | ||
| Iа стадия | 40 | 28,6±4,3 | 0,002 | | | |
| Ib стадия | 30 | 48,1±8,7 | 0,006 | | 0,049 | |
| II-III стадии | 54 | 77,4±10,6 | <0,001 | | | 0,037 |
p – cтатистическая значимость различий с контролем;
p1 – cтатистическая значимость различий с CIN II;
p2 – cтатистическая значимость различий с микроивазивным раком;
p3 – cтатистическая значимость различий с Ib стадией рака.
При цервикальной интраэпитедиальной неоплазии отмечалась умеренная или выраженная пролиферативная активность – в среднем от 10 до 30% клеток, коррелирующая с нарастанием атипических изменений многослойного плоского эпителия. Систематизация полученных данных показала, что пролиферативная активность при цервикальных неоплазиях, не превышавшая 20,0% клеток, соответствовала CIN I-II, экспрессия PCNA более 20,0% клеток характеризовала CIN III. Цервикальные неоплазии с уровнем пролиферирующих клеток более 29,6%, относились к группе неблагоприятного клинического течения. Таким образом, PCNA при цервикальной интраэпителиальной неоплазии может рассматриваться прогностическим фактором, определяющим вероятную прогрессию CIN.
Определение PCNA в опухолях шейки матки выявило взаимосвязь с клинической характеристикой опухолевого роста – пролиферативная активность раковых клеток в инвазивных опухолях превышала аналогичные параметры по сравнению с микроинвазией. Исследование показало, что наиболее высокие показатели PCNA соответствовали I-III стадиям инвазивного роста, превышая свои значения при внутриэпителиальном раке. Аналогичная направленность отмечена и в отношении показателей пролиферативной активности в зависимости от размеров первичного поражения шейки матки – увеличение числа пролиферирующих клеток отмечалось при поражениях Тis и Т1а и при сравнении последних с опухолями Т1b-T3. Максимально высокие значения PCNA определялись при вовлечении в злокачественный процесс регионарных лимфатических узлов, при этом пролиферирующие раковые клетки пораженных лимфоузлов превышали показатели экспрессии PCNA в первичных опухолях.
Клиническое течение рака шейки матки, связанного с темпами клеточного роста, превышающими 66,8% пролиферирующих клеток, характеризовалось снижением показателей общей пятилетней выживаемости больных по сравнению пациентками, в опухолях которых PCNA не превышал 66,8% клеток: 77,5±6,4% против 94,3±4,1% (р=0,023).
Таким образом, формирование неоплазии и прогрессия рака шейки матки связаны с избыточной пролиферацией клеток в результате нарушения баланса анти- и проапоптозной регуляции поврежденных эпителиоцитов.
5. Экспрессия рецепторов половых гормонов в тканях шейки матки. Доказано, что в инициации цервикальной неоплазии наряду с инфицированием HPV важную роль имеет стероидная регуляция (Auborn K.J. et al.;1991; Woodworth C.D., 1998- 2002; Russo J., 2003).
Исследование обнаружило экспрессию рецепторов эстрогенов и прогестерона во всех образцах здоровых тканей шейки матки (таб. 4).
При цервикальной интраэпителиальной неоплазии отмечено появление рецепторонегативных поражений. Рак шейки матки характеризовался уменьшением частоты сочетанной экспрессии рецепторов эстрогенов и прогестерона. Степень экспрессии PgR при раке шейки матки соответствовала отрицательным и низким значениям, не отличаясь от показателей контроля и при CIN. Снижение уровня экспрессии ER до отрицательных значений выявлялось при микроинвазивных карциномах. Инвазивные опухоли отличались увеличением средних значений H-score ER до умеренных показателей, что определялось присутствием среди инвазивных карцином умеренной и высокой экспрессии ER. Снижение уровня стероидной рецепции при неопластических поражениях шейки матки может свидетельствовать о возникновении автономного «самоподдерживающегося» роста за счет локально продуцирующихся ростовых факторов и цитокинов. Необходимо отметить, что HPV-индуцированные поражения шейки матки тесно взаимосвязаны с гиперэстрогенией, сопровождающейся преимущественной конверсией E2 в агрессивный метаболит 16α-ОНE1, который определяет пролонгированный эффект E2 и активирует экспрессию гена Е7 HPV, инициирующего механизмы патологической пролиферации клеток, блокирующего факторы иммунологической защиты и определяющего опухолевую трансформацию клеток (Киселев В.И. и соавт., 2000-2003). При этом становится понятным доминирующее поражение эстроген-чувствительной зоны трансформации цервикального эпителия, где отмечается наиболее высокий уровень экспрессии стероидных рецепторов.
Таблица 4
Экспрессия рецепторов стероидных гормонов
| Группы, число | Частота экспрессии, % | H-score | ||||
| ER+PgR+ | ER+PgR- | ER-PgR+ | ER-PgR- | ER | PgR | |
| Контр., n=10 | 60,0±15,5 | 30,0±14,5 | 10,0±9,5 | | 76,9±10,1 | 55,6±7,9 |
| CIN I, n=60 | 53,1±8,8 | 34,4±8,4 | 9,4±5,2 | 3,1±3,1 р1=0,042 | 78,0±16,7 | 55,5±6,6 |
| CIN II, n=60 | 56,7±9,0 | 30,7±8,4 | 13,3±6,2 | 3,3±3,3 | 91,0±12,5 | 55,5±10,4 |
| CIN III, n=93 | 31,3±8,2 | 31,3±8,2 | 18,8±6,9 | 18,8±6,9 | 70,4±9,6 | 43,3±6,7 |
| Рак шейки матки, стадия: | ||||||
| Ia, n=40 | 30,0±8,4 | 26,7±8,1 | 23,3±7,7 | 20,0±7,3 р3=0,034 | 72,4±10,0 р2=0,035 | 55,7±12,2 |
| Ib, n=30 | 26,7±8,1 | 30,0±8,4 | 23,3±7,7 | 20,0±7,3 р3=0,034 | 44,6±8,3 р=0,046 р3=0,002 | 71,6±9,1 р3=0,005 |
| II-III, n=84 | 11,1±5,2 р<0,001 | 25,0±7,2 | 19,4±6,6 | 44,4±8,3 | 94,0±12,5 | 37,4±7,5 |
р – статистическая значимость различий по сравнению с контролем;
р1 – статистическая значимость различий с CIN III;
р2 – статистическая значимость различий с Ia стадией рака;
р3 – статистическая значимость различий с II-III стадией рака.
При оценке уровня метаболитов эстрогенов отмечено, что в группах больных цервикальной интраэпителиальной неоплазией и раком шейки матки концентрации пролиферативно-нейтрального 2-ОНЕ1 снижались: соответственно 28,0±4,5 нг/мл и 14,5±2,1 нг/мл (p=0,016) против 30,3±2,8 нг/мл в контроле. Указанная динамика содержания 2-ОНЕ1 коррелировала с увеличением уровня пролиферативно-активного 16α-ОНЕ1: 19,7±0,9 нг/мл при CIN и 19,9±1,1 нг/мл при раке шейки матки против 15,8±0,6 нг/мл в контроле (p=0,04 и p=0,025), что сопровождалось уменьшением соотношения 2-OHЕ1/16α-OHЕ1 метаболитов.
Проведенный анализ выявил наиболее часто встречающиеся варианты коэкспрессии стероидных рецепторов, c-erb-B2, bcl-2, в сочетании с показателями индекса массы тела и метаболитами эстрогенов (таб.6). Учитывая возможность модуляции экспрессии стероидных рецепторов посредством продукции цитокинов и факторов роста, становится понятной частая встречаемость изменений экспрессии стериодных гормонов, bcl-2, c-erb-B2 в самых разных сочетаниях. В процессе неопластической трансформации координированное действие этих регуляторов в большинстве случаев нарушается, что может быть как следствием, так и одной из причин формирования неоплазии.
Взаимодействие ауто/паракринной регуляции при участии ростовых факторов, онкопротеинов и эндокринных механизмов при поражениях шейки матки преобладало в группе с благоприятным течением CIN – сочетание ER и PgR с умеренной экспрессией bcl-2 при низкой экспрессии или отсутствии c-erb-B2 на фоне нормальных показателей индекса массы тела 26,6±1,0 и соотношения 2-ОНЕ1/16α -ОНЕ1, равного 1,66±0,12.
В 8,8±1,9% случаев поражений шейки матки, связанных с умеренной и высокой степенью экспрессии ER, онкогены c-erb-B2, bcl-2, p53mut не выявлялись. В развитии этого варианта неоплазии, вероятно, превалировали эндокринные механизмы, на что указывают высокие средние значения индекса массы 34,4±1,5 тела и увеличение содержания 16α-OHЕ1 с уменьшением соотношения 2-OHЕ1/16α-OHЕ1 метаболитов до 1,10±0,09. Рецидивирующее течение CIN у пациенток этой группы отмечалось в 35,0±10,7% (7 наблюдений), что отличалось от группы благоприятного прогноза.
Таблица 6
Взаимосвязь экспрессии рецепторов эстрогенов и прогестерона,
индекса массы тела и метаболитов эстрогенов
| Сочетание RR, число обследованных | Средние значения ИМТ, кг/м2, М±m | Соотношение 2OHЕ1/16OHЕ1 | ||
| 25,6±1,0 | 34,4±1,5 | 20,5±0,5 | ||
| ER+PgR+, n=58 | 32,5±3,8 | 3,3±1,4 | 1,9±1,1 | 1,60±0,12 |
| ER-PgR+, n=47 | 26,0±3,5 | 1,3±0,9 | 3,3±1,4 | 1,48±0,11 |
| ER+PgR-, n=19 | 2,6±1,3 р,р1<0,001 | 9,1±2,3 р=0,040 р1,р2<0,001 | 0,7±0,6 | 1,10±0,09 р=0,024 р1=0,042 р2=0,010 |
| ER-PgR-, n=30 | 4,5±1,7 р,р1<0,001 | 0,7±0,6 | 14,3±2,8 р,р1,р2<0,001 | 0,36±0,21 р,р1<0,001 |
Примечание: жирным шрифтом выделены значения, имеющие статистически значимые различия.
р – достоверность значимых различий по сравнению с группой ER+PgR+;
р1 – достоверность значимых различий по сравнению с группой ER-PgR+;
р2 – достоверность значимых различий по сравнению с группой ER-PgR-.
Отсутствие экспрессии стероидных рецепторов в сочетании с гиперэкспрессией c-erb-B2 и bcl-2 у больных с дефицитом веса – индекс массы тела 20,5±0,5, и низкими показателями соотношения 2-ОНЕ1/16-ОНЕ1 – 0,36±0,21, доминировало в большинстве случаев 65,0±10,7% (13) неблагоприятного клинического прогноза и сочеталось с традиционно негативными характеристиками. Выявленные в этой группе тенденции связаны с доминирующим влиянием автономной регуляции в биологически агрессивных поражениях шейки матки.
Экспрессия рецепторов половых гормонов при цервикальной неоплазии взаимосвязана с экспрессией онкогенов, клинико-патологическими параметрами, особенностями клинического течения и может быть использована в прогнозе клинического течения заболевания.
6. Многофакторный корреляционный анализ иммунобиологических и клинических параметров эпителиальных дисплазий и рака шейки матки. Проведенный многофакторный корреляционный анализ подтвердил выявленные взаимосвязи между молекулярно-биологическими параметрами и традиционными клинико-морфологическими факторами прогноза, что свидетельствует о наличии патогенетических механизмов формирования цервикальной неоплазии (рис. 5, 6).
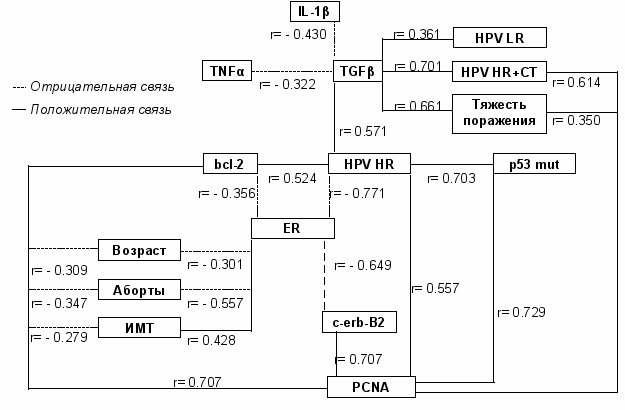
Рис. 5. Корреляционные взаимосвязи при CIN.
Рис. 6. Корреляционные взаимосвязи при раке шейки матки.
