Программа курса по выбору «Фундаментальные и прикладные аспекты медицинской биотехнологии»
| Вид материала | Программа курса |
- Международная научная конференция «Фундаментальные и прикладные аспекты воспаления», 27.32kb.
- Структурно-функциональная организация палеоамигдалы: фундаментальные закономерности, 2391.63kb.
- Доклада, 47.9kb.
- Аналитический обзор по тематике Всероссийской конференции с международным участием, 209.24kb.
- Vii международная научно-техническая конференция «Фундаментальные и прикладные проблемы, 109.18kb.
- Программа курса по выбору ставрополь 2007, 232.67kb.
- Программа дисциплины психология творческой личности автор: д психол н., проф. Семенов, 374.97kb.
- Xi международная научно-практическая конференция "Фундаментальные и прикладные исследования, разработка, 39.29kb.
- Мониторинг биотехнологии 20. 07. 2009, 1201.5kb.
- Программа 15-й международной научно практической конференции «Клинические и фундаментальные, 216.47kb.
ПРОГРАММА КУРСА ПО ВЫБОРУ
«Фундаментальные и прикладные аспекты медицинской биотехнологии»
для студентов медико-биологических факультетов
В проекте программы курса по выбору «Фундаментальные и прикладные аспекты медицинской биотехнологии» представлены важнейшие разделы биомедицинской науки, лежащие в основе современной медицинской биотехнологии. Новые медицинские биотехнологии приобретают все большее значение в самых разных направлениях медицинской науки и практики. Они легли в основу принципиально новых подходов при создании новых лекарственных препаратов, диагностике, прогностике и лечении многих социально значимых заболеваний, а также идентификации личности.
Отдельные лекционные курсы программы посвящены молекулярной организации клетки (с акцентом на роль отдельных белков в макромолекулярной организации клеток и в их функционировании), молекулярным основам наследственной патологии (включая методы анализа генома, стратегию картирования патологических генов и ДНК-диагностику различных наследственных заболеваний), генной инженерии, а также генной терапии (с избранными главами вирусологии). Практические занятия включают два основных раздела: культивирование и методы исследовния эукариотических клеток и методы генной инженерии. Все разделы проекте программы составлены с учетом новейших достижений в области медицинской биотехнологии.
Программа курса по выбору «Фундаментальные и прикладные аспекты медицинской биотехнологии» для студентов медико-биологического факультета Российского государственного медицинского университета (6-ой курс, XI семестр) включает лекционный материал и практические занятия. За время обучения студенты обязаны овладеть рядом основных методов медицинской биотехнологии, широко используемых в современной биомедицине. В конце XI семестра студенты сдают два зачета по практическим занятиям, теоретический зачет по курсам "Генная инженерия", "Молекулярные основы наследственной патологии", "Генная терапия" и экзамен по курсу "Молекулярная организация клетки".
ПРОГРАММА СПЕЦКУРСА
«Фундаментальные и прикладные аспекты медицинской биотехнологии»
Молекулярная организация клетки
Настоящий курс не ставит цель охватить все современные направления молекулярной организации клеток; его главная задача, – опираясь на основополагающие представления клеточной биологии о клеточном цикле, позволяющие описывать жизнь клетки во всей ее полноте, показать студентам прежде всего особенности молекулярного и биологического поведения наиболее важных структурных компонентов клетки таких, как цитоскелет и интегрированные с ним белки, а также показать основные механизмы регуляции цитоскелета в разных состояниях клетки. Продемонстрировать те успехи, которые достигнуты в понимании роли факторов роста и других регуляторных экзо- и эндогенных молекул в их влиянии – на состояние фенотипа клетки, разнообразие форм движения клетки, ее адгезивные свойства, генотипические особенности. При знакомстве с этими фундаментальными явлениями в жизни клетки достаточно подробно рассматриваются особенности молекулярной организации главных компонентов внеклеточного матрикса, всех классов молекул адгезии, важнейших семейств факторов роста. Кроме того, в курсе представлены материалы о протоонкогенах и онкогенах, о регуляторном влиянии их продуктов на жизнь клетки. Значительное внимание уделено обзору структуры и молекулярным особенностям основных классов белков, участвующих в регуляции клеточного цикла, а также другим важнейшим структурам и регуляторным молекулам, которые вовлечены в этот процесс. В каждом разделе курса особое внимание обращается на причины нарушений течения тех или иных регуляторных процессов в нормальной клетке, которые приводят к патологическим изменениям в ее биологическом поведении.
Цитоскелет эукариотических клеток.
Три типа филаментов участвующих в организации цитоскелета и строящих сложную двухмерноорганизованную сеть: микрофиламенты (актиновые филаменты), микротрубочки и промежуточные филаменты. Многообразие структурных и функциональных ролей каждого из типов филаментов в поведении клетки. Проблемы изучения взаимодействия элементов цитоскелета друг с другом и с плазматической мембраной; группы специфических белков, участвующих в организации таких связей. Самосборка микрофиламентов и микротрубочек; роль нуклеотидтрифосфатов. Цитоскелет и эпигенетическая информация.
Актин и актиновые филаменты (микрофиламенты)
Актин - один из наиболее широко представленных белков у эукариотических клеток. Актин – это прототип цитоскелетных белков. Структура молекулы актина; G-актин. Эволюционная консервативность структуры актина. Главные (основные) изоформы актинов млекопитающих. Три класса типов актина: , и . Уникальность одной из изоформ актина для определенного типа ткани. Актиновые филаменты - F-актин. Полимеризация актина in vitro и in vivo. Полярность актинового филамента. Скорость роста актинового филамента с «+» и «-» концов. Актин-АТФ и актин-АДФ, их участие в процессе полимеризации. Роль гидролиза АТФ в росте актинового филамента. Конформационные изменения молекул актина в формах, связанных с АТФ или АДФ. Деление механизма полимеризации актина на три стадии. Вещества, влияющие на поли- и деполимеризацию актинового филамента: цитохалазин A,B,C,D,E, фаллоидин, латринкулин A, B. Краткий обзор функций основных типов белков, связывающих актин и актиновые филаменты: связывающие мономеры актина, кэппируюшие, желатинирующие, связывающие актиновые филаменты в пучки; соучаствующие в поддержании структуры и функции филаментов; белки, ассоциирующие F-актин с плазматической мембраной, миозин. Доменная организация актин-связывающих белков: сходства и отличия. Понятие кортекса клетки, участие сети актиновых филаментов в его организации. Заякоривание актиновых филаментов на плазматической мембране, роль белков – понтикулина, кальпактина и липокортина. Спектрин – высоко специфический белок, участвующий в организации кортекса эритроцитов млекопитающих; его структура. Другие белки кортекса эритроцита: «bandIII» и гликофорин; анкирин, тропомиозин, белок 4.1, аддуцин; их структура и роль в организации кортекса эритроцита. Изоформы спектрина: эритроцитарные и неэритроцитарные формы – фордин и TW260/240.
Роль актиновых филаментов в индукции формирования и сборки сайтов адгезии – фокальных контактов и фокальной адгезии. Зависимость течения фагоцитоза от специфической связи рецепторов фагоцитоза с актиновыми димерами.
Структурная и функциональная роль актиновых филаментов в процессе сокращения эукариотических клеток. Миозиновая и актиновая регуляция сокращения клеток. Миозин II из скелетной мускулатуры. Тонкая организация саркомера. Структура молекулы миозина II. S1 фрагменты головки миозина; «декорирование» S1 фрагментами актиновых филаментов. Эссенциальные и регуляторные легкие цепи головки миозина; их роль в гидролизе АТФ при взаимодействии миозина с актином. Миозин – это АТФаза. Механизм движения головки миозина II вдоль актинового филамента. Структура хвоста миозина II, роль в ассоциации и образовании «толстых филаментов» саркомера. Общая схема миозиновой регуляции поперечно-полосатой мускулатуры. Роль альфа-актинина и десмина в структурной организации саркомера. Структура тропомиозина, его изоформы. Структура тропонинов T, I, С, их взаимодействие с тропомиозином и их роль. Взаимодействие комплекса тропонинов с тропомиозином и с актиновыми филаментами. Механизм регуляции мышечного сокращения, участие Са2+ , тропониновой системы, тропомиозина и F-актина. Изоформы миозина II - возможные функции у эукариотических клеток.
Миозин I – миозин немышечных и гладкомышечных клеток. Структура и изоформы миозина I, сравнение с миозином II. Особенности поведения молекулы миозина I в акте сокращения: активация легких цепей путем фосфорилирования; роль киназы легких цепей миозина; роль Са2+ и кальмодулина; структура и функции кальмодулина. Фосфорилирование легкой цепи изоформ миозина I у немышечных клеток. Молекулярные механизмы миозиновой и актиновой регуляций сокращения немышечных и гладкомышечных клеток. Роль кальдесмона и кальпонина; структура и молекулярные свойства этих белков. Семейство миозинов I неспособных образовывать филаменты: их транспортная роль в клетке.
Кортикальный F-актин и роль миозина I в сокращении сократительного кольца (кольца деления) у ана-телофазных клеток и в организации опоясывающих десмосом у интерфазных клеток, а также в движении и подвижности плазматической мембраны.
Амебоидное движение и подвижность немышечных клеток: сходство и различия, роль субстрата для этих двух типов движения клеток. Амебоидное движение амеб и макрофагов; роль внеклеточных стимулов для образования псевдоподий. Структура псевдоподий; экто- и эндоплазма, переходы золь-гель. Роль актиновых филаментови альфа-актинина в образовании геля; структура альфа-актинина: доменная организация, особенности взаимодействия с актиновыми филаментами. Цитоплазматический золь – двумерноорганизованная структура, где решающая роль принадлежит группе актин-фрагментирующих белков – северину, гельзолину. Структура гельзолина, его изоформы, три актин-связывающих сайта гельзолина, роль ионов кальция в поведении гельзолина. Кэпирование гельзолином «+»концов фрагментов филаментов.
Роль миозинов I и II в потоке цитоплазмы при амебоидном движении. Триггерная роль ионов кальция и инозитолфосфатов в индукции образования и роста псевдоподий. Роль пула G-актина в образовании клеточно-поверхностных выпячиваний. Структура и роль белков, связывающих мономеры актина в регуляции полимеризации кортикальных актиновых филаментов: (1) семейство тимозинов; (2) семейство ADF/кофилин; (3) профилин, локализация в клетке, влияние на конформацию молекулы актина, роль в обмене AДФ на АТФ в молекуле актина.
Акросомная реакция спермиев. Общая организация неактивированного спермия. Копацитация. Молекулярный механизм сборки акросомного выроста. Роль профилина в быстром образовании связки актиновых филаментов акросомного выроста.
Микроворсинки щеточной каемки – прекрасный пример роли актин-связывающих и некоторых структурных белков в упорядоченной сборке актиновых филаментов. Актиновый кор микроворсинки. Фимбрин и виллин – важнейшие актин-связывающие белки, участвующие в морфогенезе кора. Фимбрин: структура, распространение, роль в однонаправленной по полярности параллельной укладке актиновых филаментов. Виллин: структура, зависимое от Са2+ поведение белка; виллин как актин-фрагментирующий белок. Тканеспецифичность виллина. Роль экспрессии виллина в индукции самосборки микроворсинок. 110kDa белок - изоформа миозина I, роль в связывании кора микроворсинки с плазматической мембраной; локализация кальмодулина и АТФ; возможная сократительная функция миозина I в общем механизме противодействия микроворсинки механической деформации. Терминальная пластинка (сеть) микроворсинок; ее молекулярная организация; расположение и участие миозина II, фордина/спектрина (TW260/240), кальдесмона и тропомиозина. Заякоривающая роль пластинки для кора микроворсинки; возможное взаимодействие пластинки с промежуточными филаментами. Возможное участие одного из компонентов вершины ворсинки - эзрина – в заякоривании «+» концов кора на плазматической мембране.
Семейство ЭРМ белков, или семейство эзрин/радиксин/ моезин. Степень гомологии этих белков, распространенность и роль в жизни различных типов клеток. Эзрин: общая структура молекулы, доменная организация, роль отдельных доменов в осуществлении функций молекулы. Роль PIP2 в активации эзрина, роль активной малой ГТФазы – Rho-ГТФ в увеличении содержания PIP2 в клетке, конформационные изменения активированного эзрина; общий механизм активации эзрина. Эзрин – линкер между плазматической мембраной и актиновыми филаментами. Олигомеризация эзрина, возможное участие олигомеров в создании временных «платформ» для полимеризации актина. Роль EGF, HGF, PDGF в активации эзрина и моезина и их влияние на быструю перестройку актинового цитоскелета с участием эзрина и моезина.
Движение немышечных клеток. Три стадии движения клетки по субстрату. Выбор клеточной траектории движения; роль хемоаттрактантов и матрикс-ассоциированных факторов роста; поляризация клетки; роль адгезионных матриксных белков в движении клетки. Лидирующий край клетки, роль филоподий (микрошипов) и ламеллоподий в движении клетки. Структура актинового скелета филоподий и ламеллоподий. Поведение кортекса клетки при движении; роль перестроек актиновой сети в формировании актиновых филаментов структур лидирующего края и раффлинге. Конкурентные и кооперативные взаимоотношения актин-связывающих белков в кортикальном актиновом цитоскелете - филамина, альфа-актинина, тропомиозина и миозина II; роль фимбрина в формировании скелета филоподий, роль филамина /спектрина в ортагональной упаковке филаментов ламеллоподий. Актиновые stress fibers, структура, молекулярный состав; роль stress fibers в прикреплении клетки к субстрату и формировании сайтов фокальной адгезии. Возможная роль миозина I, киназы легких цепей миозина, альфа-актинина, тропомиозина, кальмодулина, входящих в состав stress fibers. Роль альфа-актинина в антиполярной укладке фибрилл stress fibers. Роль винкулина и талина в ассоциации stress fibers к плазматической мембране и формировании сайтов фокальной адгезии.
Фокальная адгезия клеток. Два класса сайтов фокальной адгезии: фокальные контакты и фокальная адгезия. Роль интегринов в организации фокальной адгезии; взаимодействие талина и винкулина с -субъединицей интегринового рецептора и stress fibers. Структура винкулина, паксилина, тензина, особенности их взаимлдействия; расположение сайтов фосфорилирования по остаткам тирозина, серина и треонина у двух последних белков. Регуляторная роль паксилина в сборке и диссоциации фокальной адгезии; кэпирующая роль белков семейства ЭРМ и тензина. Тирозинпротеинкиназы, ассоциированные с фокальной адгезией – FAK-киназа (p125FAK), c-src (p60src), fyn, csk; их роль в фосфорилировании паксилина и тензина; индукция активации p125FAK и p60src интегриновым сигналом; роль тирозинфосфатаз в индукции диссоциации фокальной адгезии.
Регуляция полимеризации актина, сборки stress fibers и фокальной адгезии. Триггерные молекулы этой регуляции – субсемейство малых ГТФаз – “Rho”. Характеристика субсемейства Rho – rhoA, rhoB, rhoC, rac, cdc42; белки GAP, стимулирующие активацию rho, стимулирующие обмен нуклеотидов – smg GDS; ингибирующих диссоциацию ГДФ-rho и ГДФ-rac-rhoGDI1 . Роль интегринового сигнала и сигналов лиганд-связанных рецепторов факторов роста, в активации белков субсемейства Rho. Последовательный каскад активации cdc42, rac, rho и индукция полимеризации актина и сборки филаментов. Зависимость морфологического типа сборки филаментов от активации соответствующей малой ГТФ-азы: активация cdc42 – скелет филоподий и фокальной адгезии; активация rac –скелет ламеллоподий, stress fibers и фокальных контактов на периферии лидирующего края; активация rho – индукция сборки stress fibers и фокальной адгезии. Роль cdc42, rac, rho в координации пространственных и временных изменений кортикального и цитоплазматического цитоскелета. Эффекторные молекулы Rho – два семейства серин-треониновых протеинкиназ, а также PIP-5 киназа. Участие rho-ГТФ в активации FAK-киназы и некоторых актин-связывающих белков, участвующих в фокальной адгезии. Активация винкулина с участием rho-ГТФ и PIP2 – обязательный этап сборки фокальной адгезии. Активация протеинкиназы N, активный Rho и фосфорилирование паксилина – индукция дезагрегации фокальной адгезии. Роль Rho-ГТФ в каскаде фосфорилирования, завершающемся фосфорилированием легкой цепи миозина, и активации миозина I; участие миозина I в инициации упорядоченной сборки актиновых филаментов, их сократимости и формировании stres fibers.
Контроль и механизмы сборки актиновых филаментов внутриклеточными патогенными бактериями. Перемещение бактерий в клетке происходит за счет формирования «актиновых хвостов». Построение актиновых хвостов протекает за счет системы клетки-хозяина. Поверхностный Act-А белок Listeria monocytogenes – индуктор сборки хвоста. Доменная структура Act-A; ABM-1 последовательности и их роль в связывании с VASP-сAMP и cGMP зависимой протеинкиназой. VASP (vasodilator – stimulated phosphoprotein) – доменная организация. Роль VASP в связывании профилина, зиксина. Комплексы из тетрамеров VASP, связанных с ActA и с профилином-G-актином, а также зиксином, стимулируют полимеризацию и рост актиновых филаментов и образование актинового хвоста Listeria.
Использование Shigella flexneri другого механизма для сборки актиновых хвостов. IcxA – белок бактериальной стенки Shigella. Источником ABM-1 последовательности является винкулин клетки-хозяина. Протеолиз винкулина и обнажение ABM-1. Взаимодействие IcxА с р90 полипептидом винкулина, содержащем ABM-1; взаимодействие последнего с комплексом тетрамер VASP-профилин; индукция полимеризации актина и формирование актинового хвоста Shigella.
Микротрубочки
Роль микротрубочек в жизни эукариотических клеток. Их значение для поддержаниия симметрии клетки и в определении ее полярности; участие в движении и морфогенезе клеток. Стабильность микротрубочек - сравненис с F-актиновым.
Структура микротрубочки. Тубулин – глобулярный димерный белок, из которого построены протофиламенты микротрубочек.
 - и
- и 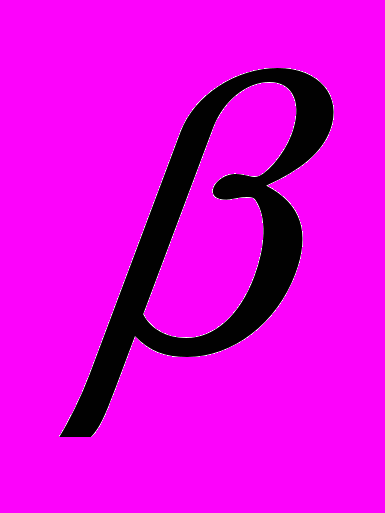 -тубулин, особенности структуры; тип укладки
-тубулин, особенности структуры; тип укладки 
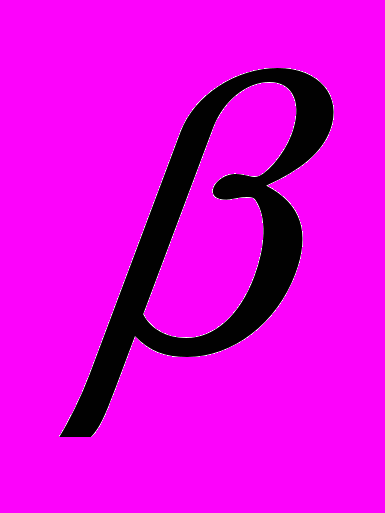 -
- димеров в протофиламенты. Сравнение мономеров актина и тубулина. Полярность микротрубочек. Спонтанная самосборка полимеров тубулина in vitro, роль ГТФ. Индуцирующая роль центра организации микротрубочек в их сборке in vivo; эксперименты, доказывающие эту роль. Структура центра организации; центриоли, их структура и репликация, -тубулин и перицентриолярный материал, его роль в ассоциации «-» концов микротрубочек. Различные варианты полярности микротрубочек у разных типов клеток; полярность микротрубочек митотического веретена. Структурная и кинетическая полярность микротрубочек. Опережающий рост микротрубочек с “+” конца. Сравнение скорости диссоциации микротрубочек с “+” и “-” концов.
димеров в протофиламенты. Сравнение мономеров актина и тубулина. Полярность микротрубочек. Спонтанная самосборка полимеров тубулина in vitro, роль ГТФ. Индуцирующая роль центра организации микротрубочек в их сборке in vivo; эксперименты, доказывающие эту роль. Структура центра организации; центриоли, их структура и репликация, -тубулин и перицентриолярный материал, его роль в ассоциации «-» концов микротрубочек. Различные варианты полярности микротрубочек у разных типов клеток; полярность микротрубочек митотического веретена. Структурная и кинетическая полярность микротрубочек. Опережающий рост микротрубочек с “+” конца. Сравнение скорости диссоциации микротрубочек с “+” и “-” концов. Микротрубочки – ассоциированные белки (МАРs). Разнообразие МАРs; роль в контроле полимеризации микротрубочек; уникальные МАРs, характерные для определеных типов клеток или для различных участков одной клетки. Роль МАРs в определении уникальности тех структур, которые собираются из микротрубочек. “tau”-белок, разнообразие изоформ; роль “tau”-белка в усилении полимеризации тубулина и стабилизации микротрубочек аксонов. Нервные клетки содержат МАР1А и В, МАР2А и В.
Низкая страбильность микротрубочек; эксперименты, демонстрирующие рост и турновер микротрубочек in vivo. Срудняя продолжительность жизни микротрубочек в клетке. Популяции стабильных и нестабильных (динамичных) микротрубочек; возможная их роль в жизни клетки. Гипотеза динамичной нестабильности микротрубочек. ГТФ-кэп и ГДФ-кэп у полимеризующихся микротрубочек. Конформационные изменения
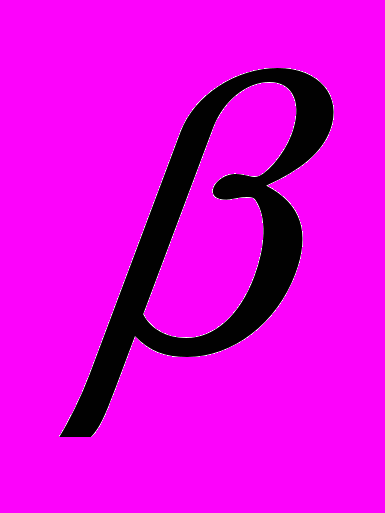 -субъединиц, связавших ГТФ; роль этих изменений в полимеризации тубулина; гидролиз ГТФ в составе полимера.
-субъединиц, связавших ГТФ; роль этих изменений в полимеризации тубулина; гидролиз ГТФ в составе полимера.Гетерогенность
 - и
- и 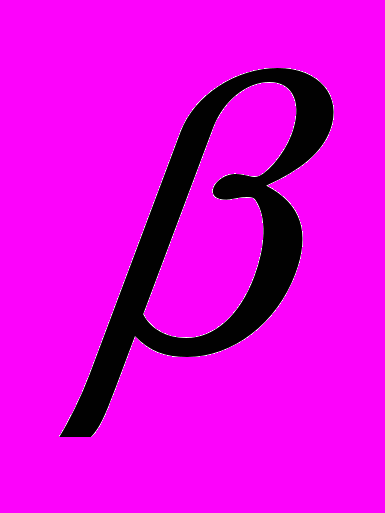 -тубулинов. Доказательства существования различных изотипов
-тубулинов. Доказательства существования различных изотипов  - и
- и 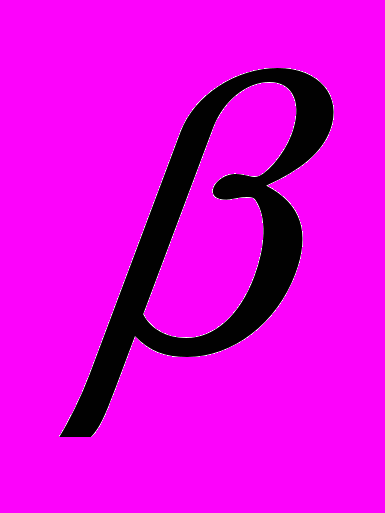 -тубулинов. Число генов
-тубулинов. Число генов  - и
- и 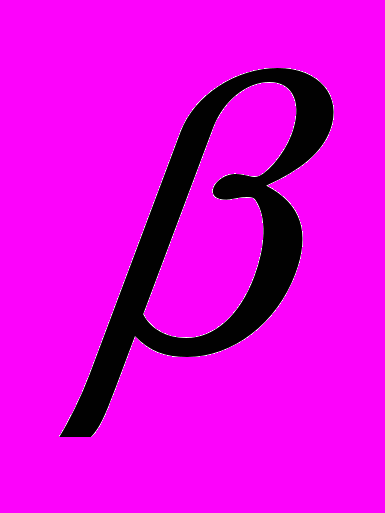 -тубулиновСравнительный анализ кДНК, кодирующих шесть различных типов
-тубулиновСравнительный анализ кДНК, кодирующих шесть различных типов  - и
- и 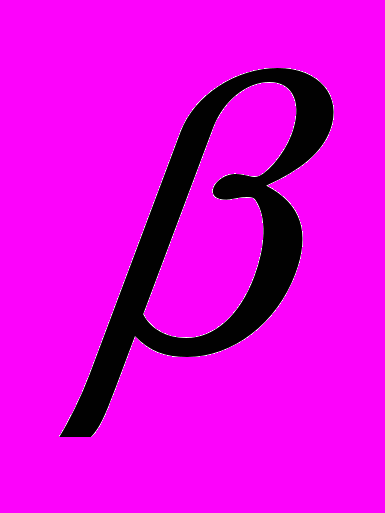 -тубулина. Экспрессия шести классов изотипов
-тубулина. Экспрессия шести классов изотипов 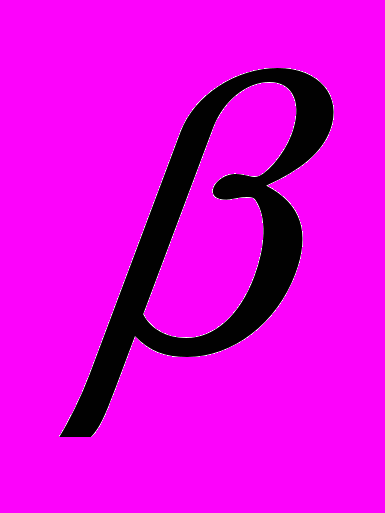 -тубулина в различных тканях птиц и мышей; степень гомологии этих изотипов. Тканеспецифическая экспрессия III, IVa, IVb и VI классов
-тубулина в различных тканях птиц и мышей; степень гомологии этих изотипов. Тканеспецифическая экспрессия III, IVa, IVb и VI классов 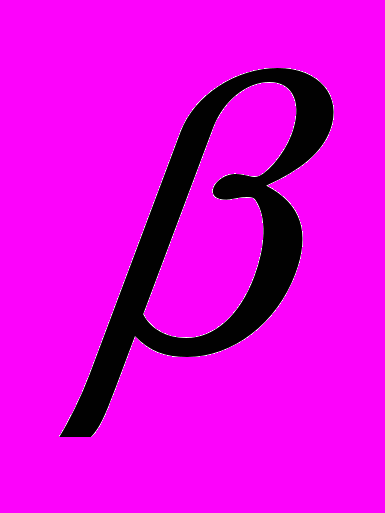 -тубулинов. Различные МАРs связываются с определенными классами
-тубулинов. Различные МАРs связываются с определенными классами 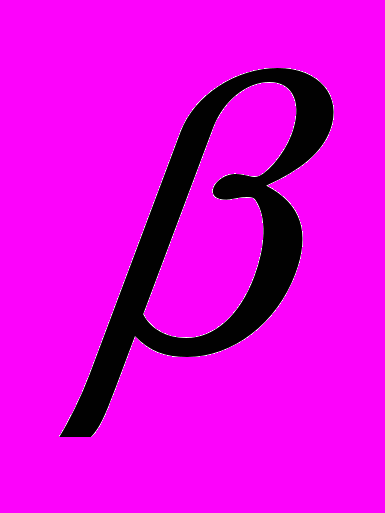 -тубулинов. Особенности экспрессии изотипов
-тубулинов. Особенности экспрессии изотипов 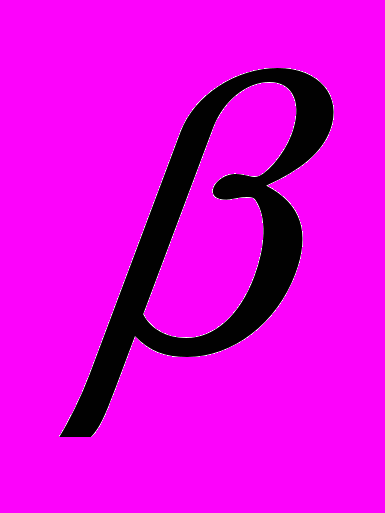 -тубулинов при формировании жгутиков спермиев млекопитающих в норме и патологии.
-тубулинов при формировании жгутиков спермиев млекопитающих в норме и патологии.Посттрансляционная ковалентная модификация
 -тубулинов. Ацетилирование лизинового остатка
-тубулинов. Ацетилирование лизинового остатка  -тубулинов;их участие в морфогенезе ресничек. Деацетилирование
-тубулинов;их участие в морфогенезе ресничек. Деацетилирование  -тубулина. Отщепление тирозинового остатка от COOH-концевого участка
-тубулина. Отщепление тирозинового остатка от COOH-концевого участка  -тубулина. Детирозиназы. Стабильная популяция микротрубочек и детирозинированный
-тубулина. Детирозиназы. Стабильная популяция микротрубочек и детирозинированный  -тубулин. Влияние внешних сигналов (факторов роста и др.) на быструю перестройку и дезагрегацию микротрубочек, связанную с движением клетки, изменением ее полярности; роль стабильной популяции микротрубочек в этих процессах. Стабильные микротрубочки, обогащенные детирозинорованным
-тубулин. Влияние внешних сигналов (факторов роста и др.) на быструю перестройку и дезагрегацию микротрубочек, связанную с движением клетки, изменением ее полярности; роль стабильной популяции микротрубочек в этих процессах. Стабильные микротрубочки, обогащенные детирозинорованным  -тубулином, участники начальных этапов установлении ассиметрии (апикальная-базальная части) эпителия. Посттрансляционные модификации
-тубулином, участники начальных этапов установлении ассиметрии (апикальная-базальная части) эпителия. Посттрансляционные модификации  -тубулинов – маркеры высоко стабильных микротрубочек. Роль кэпирования «+»-концов микротрубочек для достижения их стабильности.
-тубулинов – маркеры высоко стабильных микротрубочек. Роль кэпирования «+»-концов микротрубочек для достижения их стабильности. 