Программа курса по выбору «Фундаментальные и прикладные аспекты медицинской биотехнологии»
| Вид материала | Программа курса |
- Международная научная конференция «Фундаментальные и прикладные аспекты воспаления», 27.32kb.
- Структурно-функциональная организация палеоамигдалы: фундаментальные закономерности, 2391.63kb.
- Доклада, 47.9kb.
- Аналитический обзор по тематике Всероссийской конференции с международным участием, 209.24kb.
- Vii международная научно-техническая конференция «Фундаментальные и прикладные проблемы, 109.18kb.
- Программа курса по выбору ставрополь 2007, 232.67kb.
- Программа дисциплины психология творческой личности автор: д психол н., проф. Семенов, 374.97kb.
- Xi международная научно-практическая конференция "Фундаментальные и прикладные исследования, разработка, 39.29kb.
- Мониторинг биотехнологии 20. 07. 2009, 1201.5kb.
- Программа 15-й международной научно практической конференции «Клинические и фундаментальные, 216.47kb.
Транспортная роль микротрубочек. Движение везикул вдоль микротрубочек; роль цитоплазматического динеина и кинезина. Структура этих белков, АТФ-азная активность. Движение везикул с помощью динеина к «+»-концу микротрубочек, а с помощью кинезина к «-»-концу. Разнонаправленность транспорта везикул в одной клетке, например нервной и фибробласте. Движение гранул меланина в меланофоре. Роль “stop-protein” в стабилизации микротрубочек при их холодовой дестабилизации.
Структура и состав ресничек и жгутиков: периферийные дублеты – А- и В-трубочки; динеиновые ручки; нексиновые связки; радиальные спицы; внутренняя капсула. Структура и функции динеина ресничек. Кинетическая модель движения жгутиков и ресничек; роль динеиновых ручек во взаимном скольжении наружных дублетов микротрубочек и возникновении изгиба реснички.
Специфические агенты, связывающие тубулин: колхицин, колцемид, гризеофульвин, винбластин, винкристин, нокодазол; структура, источники происхождения и особенности действия. Агенты, поддерживающие полимеризацию тубулина и рост микротрубочек: таксол; структура, происхождение, механизм действия.
Промежуточные филаменты
Роль промежуточных филаментов в жизни клетки: формирование высокостабильной скелетной сети в составе цитоскелета. Главное отличие промежуточных филаментов от актиновых филаментов и микротрубочек – высочайшая стабильность. Структура субъединиц белков промежуточных филаментов и сборка цитоплазматических филаментов. Шесть классов белков промежуточных филаментов. Тканеспецифический характер экспрессии белков этих классов. Значение паттерна экспрессии промежуточных филаментов для ранней диагностики патологических изменений тканей. Субъединица белков промежуточных филаментов -
 -спиральный димер; гомо- и гетеродимеры; полимеризация димеров, протофиламенты; их антипараллельность; аполярность протофибрилл; сборка филамента. Доменная организация мономерных белков протофиламентов: голова, хвост,
-спиральный димер; гомо- и гетеродимеры; полимеризация димеров, протофиламенты; их антипараллельность; аполярность протофибрилл; сборка филамента. Доменная организация мономерных белков протофиламентов: голова, хвост,  -спиральный центральный домен; вариабельные и константные части мономера; тандемные повторы аминокислотных остатков; их роль во взаимном скручивании и латеральных взаимодействиях при димеризации мономеров. Сравнение структуры мономеров кератина, виментина, нейрофиламентов и ядерной ламины. Положение потенциальных сайтов фосфорилирования киназой p34cdc2.
-спиральный центральный домен; вариабельные и константные части мономера; тандемные повторы аминокислотных остатков; их роль во взаимном скручивании и латеральных взаимодействиях при димеризации мономеров. Сравнение структуры мономеров кератина, виментина, нейрофиламентов и ядерной ламины. Положение потенциальных сайтов фосфорилирования киназой p34cdc2.Клеточноспецифическая экспрессия белков, входящих в состав промежуточных филаментов: виментина, десмина, трех белков нейрофиламентов – NF-L, NF-M, NF-H, кислого фибриллярного белка, ядерной ламины, кератинов. Особенности молекулярной организации кератинов: гетеродимеры. Примеры тканеспецифической экспрессии белков промежуточных филаментов в процессе развития и ходе дифференцировки: кератинов у эмбриональных тканей и кожного эпителия человека; виментина – при развитии производных мезодермы, дифференцировке мезенхимы и нервной ткани; транзиторный характер экспрессии виментина; десмина – в ходе развития сердечной, поперечнополосатой мускулатуры и гладкомышечных клеток;
 -интернексина – в развитии ЦНС, периферина – в развитии периферической нервной системы; нестина – экспрессия в нейроэпителиальных стволовых клетках зародыша человека и мыши. Белки промежуточных филаментов – как тканеспецифические маркеры in vivo в норме и при патологии. Изменение паттерна экспрессии белков промежуточных филаментов при культивировании клеток. Диагностика типа раковых опухолей и стадий ракового перерождения путем типирования белков- маркеров промежуточных филаментов.
-интернексина – в развитии ЦНС, периферина – в развитии периферической нервной системы; нестина – экспрессия в нейроэпителиальных стволовых клетках зародыша человека и мыши. Белки промежуточных филаментов – как тканеспецифические маркеры in vivo в норме и при патологии. Изменение паттерна экспрессии белков промежуточных филаментов при культивировании клеток. Диагностика типа раковых опухолей и стадий ракового перерождения путем типирования белков- маркеров промежуточных филаментов.Особенности расположения «скелетной» сети промежуточных филаментов в клетке или ее отростках. Механические свойства цитоскелета, построенных промежуточными филаментами. Роль промежуточных филаментов в интеграции клеток в эпителиальные пласты; десмосомы; короткие десмосомы, интеркалярные диски, плотные тельца гладкомышечных клеток, гемидесмосомы, их структура, молекулярный состав, распространение и функции.
Экстрацеллюлярный матрикс
Роль экстрацеллюлярного матрикса (ЭцМ) в поддержании целостности тканей и органов. Разнообразие типов ЭцМ у многоклеточных животных и многообразие выполняемых функций: механическая, фильтрационная, адгезионная. Специализированные формы ЭцМ – базальные мембраны. Основные компоненты ЭцМ: коллагены, фибронектин, ламинины, протеогликаны и гликозамингликаны. Продукция клетками типоспецифического по составу матрикса; примеры: рыхлая и оформленная соединительная ткань. Информационная роль ЭцМ в жизни клетки: влияние на поведение клетки адгезионных молекул ЭцМ – при морфогенезе тканей и органов в ходе развития, при миграции клеток на ранних этапах онтогенеза; при ранозаживлении, влияние на течение воспалительных процессов; роль в онкогенезе. Матрикс - ассоциированные информационные молекулы – факторы роста, их роль в поведении клетки. Обновление ЭцМ, роль различных классов внеклеточных протеиназ: сериновые протеиназы, эластаза, коллагеназа и другие металлопротеиназы, липопротеинлипазы, гиалуронидаза и другие.
Коллагены
Коллагены – обширное семейство одного из главных гликопротеинов ЭцМ. Структурно-механическая роль коллагенов в организации ЭцМ. 12 типов коллагенов высших позвоночных: фибриллярные и нефибриллярные коллагены. Роль коллагенов в контроле адгезии клеток; взаимодействие интегринов с соответствующими типами коллагена.
Структура коллагена I типа. Трехспиральность, размеры субъединицы; особенности организации их первичной структуры, повторяемость триплетов аминокислотных остатков, роль остатков глицина в возникновении
 -спирали субъединицы. Обогащенность субъединицы коллагена I типа остатками пролина и гидроксипролина; роль этих «жестких» аминокислотных остатков в дополнительной стабилизации полипептидной цепи
-спирали субъединицы. Обогащенность субъединицы коллагена I типа остатками пролина и гидроксипролина; роль этих «жестких» аминокислотных остатков в дополнительной стабилизации полипептидной цепи  -спирали субъединицы; стабилизирующая роль лизиловых и гидроксилизиловых остатков в возникновении межцепочечных поперечных сшивок. Формирование коллагеновых фибрилл. Синтез коллагена I типа. Препроколлаген, структура. Проколлаген; ферменты гидроксилирования лизиновых и пролиновых остатков. Роль аскорбиновой кислоты; цинга. Последовательность гликозилирования проколлагена. Образование трехспиральной молекулы проколлагена: N- и С-концевые пропептиды; роль S-S-связей в возникновении глобулярной структуры пропептидов. Особенности гликозилирования и процессов скручивания проколлагенов в тройную спираль в аппарате Гольджи. Экзоцитоз трехспиральных молекул проколлагена в ЭцМ. Роль внеклеточных пептидаз в отщеплении N- и С-концевых пропептидов. Тропоколлаген. Сборка фибрилл коллагена в ЭцМ. Агрегация фибрилл в коллагеновые волокна. Поперечная исчерченность коллагеновых фибрилл и волокон; механизм возникновения.
-спирали субъединицы; стабилизирующая роль лизиловых и гидроксилизиловых остатков в возникновении межцепочечных поперечных сшивок. Формирование коллагеновых фибрилл. Синтез коллагена I типа. Препроколлаген, структура. Проколлаген; ферменты гидроксилирования лизиновых и пролиновых остатков. Роль аскорбиновой кислоты; цинга. Последовательность гликозилирования проколлагена. Образование трехспиральной молекулы проколлагена: N- и С-концевые пропептиды; роль S-S-связей в возникновении глобулярной структуры пропептидов. Особенности гликозилирования и процессов скручивания проколлагенов в тройную спираль в аппарате Гольджи. Экзоцитоз трехспиральных молекул проколлагена в ЭцМ. Роль внеклеточных пептидаз в отщеплении N- и С-концевых пропептидов. Тропоколлаген. Сборка фибрилл коллагена в ЭцМ. Агрегация фибрилл в коллагеновые волокна. Поперечная исчерченность коллагеновых фибрилл и волокон; механизм возникновения. Особенности организации и структуры гена коллагена I типа. Мутации генов коллагена, затрагивающие его структуру или синтез; их многообразие; характерный пример - синдром Марфана. Коллагенозы.
Особенности структуры фибрилл коллагенов III и V типов. Коллаген III типа – эмбриональный коллаген. Ассоциация коллагена I типа с III и V типами. Относительная тканеспецифичность продукции коллагенов I, III и V типов у взрослых млекопитающих. Коллаген II типа – специфический тип для хрящевой ткани. Особенности организации коллагенов IX и XI типов. Ассоциация коллагена II типа с IX и XI типами; значение для структурной организации хрящевого матрикса. Гетеротипические фибриллы, встречаемость и возможная роль. Смена типов коллагена в ходе нормального развития; смена типов - как отражение патологических процессов в ткани, на примерах развития атеросклеротического поражения сосудистой стенки, ранозаживления и регенерации ткани.
Нефибриллярные коллагены: IX, XII и XIV типы – так называемые коллагены с прерывистой тройной спиралью; ассоциация этих типов с фибриллярными коллагенами. Особенности структуры коллагена IX типа, взаимодействие с коллагеном II типа; роль в формировании гиалинового хряща и стекловидного тела глаза. Особенности экспрессии XII и XIV типов в ходе эмбрионального развития человека; близость к структуре IX типа, особенности ассоциации с коллагенами I и III типов.
IV, VIII и X типы коллагенов – способны образовывать структуры типа “сетей”. Структура VIII типа; роль несовершенных последовательностей в сетеобразовании. Десцеметова мембрана ретины глаза. Структура X типа. Паттерн экспрессии. Образование гексагональных решеток при эндохондральном окостенении; устойчивость к коллагеназам. Структура IV тип - молекулярного маркера базальных мембран. VI тип; особенности структуры; способность образовывать филаментоподобные структуры типа «четок»; RGD-последовательности; их возможная роль. Особенности экспрессии; изоформы VI типа коллагена в различных тканях. Возможная роль коллагена VI типа в организации ЭцМ. Изменение уровня экспрессии VI типа коллагена при фиброзных изменениях различной этиологии; остеохондрозах; при синдроме Дауна, при синдроме рыхлой кожи.
Базальная мембрана
Базальная мембрана – высокоспециализированный ЭцМ. Продукция базальных мембран эпителиями, мезенхимой и ее производными, эндотелием, скелетной, гладкой и сердечной мускулатурой. Роль базальных мембран в ходе эмбрионального развития и в поддержании структурной целостности и функциональных особенностей тканей в постнатальный период. Соотношение компонентов в составе базальных мембран; типоспецифичность базальных мембран. Базальная меммбрана – как адгезионная платформа для клетки; роль в движении клеток и их распластывании. Роль базальных мембран в ходе воспаления, ранозаживления, неоваскуляризации. Устойчивость базальных мембран к протеолитической деградации. Роль в предотвращении метастазирования.
Просвечивающая и электронная микроскопия структуры базальных мембран. Особенности организации базальных мембран в различных тканях и органах. Два слоя базальных мембран с различной плотностью – Lamina lucida и Lamina densa. Роль базальных мембран в поддержании цитоархитектоники тканей и их функциональной гетерогенности.
Самосборка базальной мембраны из «протомеров»; состав протомера – коллаген IV типа, ламинин, нидоген/энтактин, протеогликаны. Взаимодействие протомеров и два этапа возникновения супрамолекулярной архитектоники базальной.
Коллаген IV типа. Особенность структурной организации молекулы - неотщепление NH2 -и COOH-терминальных пропептидов. Чередование спирализованных и неспирализованных участков в молекуле - основа структурной “рыхлости” филаментов коллагена IV типа. Самосборка молекул коллагена IV типа, роль цистеиновых остатков COOH-концевых участков; NH2 –концевые домены определяют антипараллельный характер укладки молекул в ди-, три- и тетрамерные структуры, которые способны путем латеральных взаимодействий образовывать сетчатоподобные структуры. Сеть, образованная коллагеном IV типа, - структурная основа базальной мембраны. Доменная структура молекул коллагена IV типа , его способность взаимодействовать с ламинином, протеогликанами, нидогеном и клетками. Гены коллагена IV типа, локализация, особенности структуры и активации генов.
Ламинин - высокоадгезионный гликопротеидный компонент базальных мембран. Присутствие (количественное) ламинина в различных типах базальных мембран определяет их структурные и функциональные особенности. Доменная организация ламинина. Характеристика каждой из трех полипептидных цепей молекулы ламинина: В1, В2 и А. Локализация и роль S-S-связей в образовании крестообразной структуры молекулы ламинина. Домены IV и VI типов - мелкие глобулярные домены, их роль. Домены III и V типов – прутикоподобные, их роль. I и II типы доменов COOH-концов цепей.
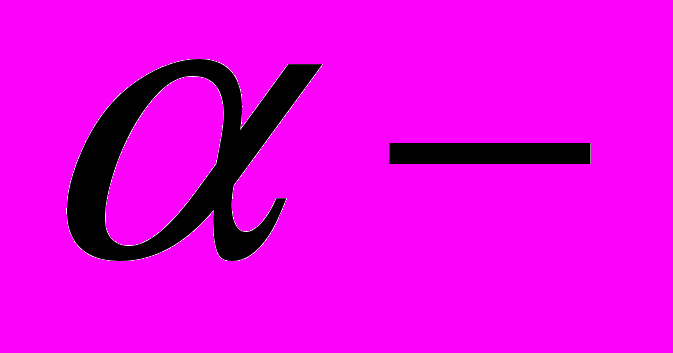 спиральная структура, большой глобулярный домен А-цепи. Гликозилирование ламинина, сайты связывания с олигосахаридными цепями. Транскрипционный контроль продукции каждого типа цепей ламинина в клетке. Способность ламинина к олигомеризации, роль глобулярных доменов коротких плеч в этом процессе. Локализация сайтов связывания в молекуле ламинина с коллагеном IV типа. Роль нидогена в инициации связывания этих двух молекул. Изоформы ламинина in vivo. Отсутствие А-цепи в молекуле ламинина у Шванновских клеток и в матриксе ранних эмбрионов млекопитающих, а также при продукции базальных мембран нефрогенной мезенхимой в морфогенезе почек. Сайты связывания ламинина с клеткой, их локализация. Зависимость авидности связывания интегриновых рецепторов от структуры ламинина.
спиральная структура, большой глобулярный домен А-цепи. Гликозилирование ламинина, сайты связывания с олигосахаридными цепями. Транскрипционный контроль продукции каждого типа цепей ламинина в клетке. Способность ламинина к олигомеризации, роль глобулярных доменов коротких плеч в этом процессе. Локализация сайтов связывания в молекуле ламинина с коллагеном IV типа. Роль нидогена в инициации связывания этих двух молекул. Изоформы ламинина in vivo. Отсутствие А-цепи в молекуле ламинина у Шванновских клеток и в матриксе ранних эмбрионов млекопитающих, а также при продукции базальных мембран нефрогенной мезенхимой в морфогенезе почек. Сайты связывания ламинина с клеткой, их локализация. Зависимость авидности связывания интегриновых рецепторов от структуры ламинина.Нидоген/энтактин – гликопротеин, образующий прочный комплекс с молекулой ламинина. Структура молекулы; доменная организация; локализация сайтов связывания с ламинином и клеткой. Соотношение ламинин-нидоген в базальной мембране. Сайты связывания нидогена с коллагеном III типа; возможный механизм. Инициация связывания молекул ламинина с коллагеном IV типа и нидогеном. Отсутствие сайтов связывания у молекулы нидогена с гепарином и протеогликанами.
Протеогликаны и гликозаминогликаны базальной мембраны. Гепарансульфатпротеогликаны (ГСПГ) – доминирующий из протеогликанов компонент базальной мембраны. ГСПГ высокой и низкой плотности; их распространенность, соотношение и особенности связывания с ламинином, фибронектином и коллагеном IV типа.
Структура кора низкоплотного ГСПГ. Биологические свойства гепарина и гепарансульфата, входящих в состав ГСПГ; их роль в связывании с молекулой ламинина. Гепарансульфат – уникальный накопитель в ЭцМ фибробластного фактора роста (FGF); роль FGF и базальных мембран в ангиогенезе; роль активного гепарина или гепариназы в высвобождении с последующей активацией FGF.
Коллаген VII типа, структура, особенности доменной организации. Димеризация коллагена VII типа и сборка сети «заякоривающих фибрилл»; локализация сайтов связывания с коллагеном IV типа. Роль сети «заякоривающих фибрилл» во взаимодействии с коллагеном I типа и в дополнительном механическом укреплении базальной мембраны.
Современная модель организации и сборки базальной мембраны (Yurchenco P. и Schittny J.C., 1995-1997).
Фибронектин – важнейший класс адгезивных гликопротеинов ЭцМ. Распространенность фибронектина в царстве животных. Три формы фибронектина млекопитающих: растворимая, клеточноповерхностная и матриксная. Краткая история изучения фибронектина – результаты исследований Carl G. Gamberg и Sen-itiroh Hakomori, и происхождение названия “фибронектин”, открытие поверхностного фибронектина Erkki Ruoslahti и Antti Vaheri, и открытие Irwin I. Singer по взаимодействию матриксного фибронектина через специфичные рецепторы - интегрины на плазматической мембране клетки с актиновыми филаментами; открытие D.R.Critchly, M.A.England (Великобритания) и B.W.Mayer, E.D.Hay (США) на модели раннего развития цыпленка, что фибронектин играет ведущую роль в миграции клеток; J.P.Thiery (Франция) – доказательство того, что фибронектин не только «рельсы» для мигрирующих клеток нервного гребня, и что локальные изменения концентрации фибронектина играют роль субстрата позиционных сигналов мезенхимы для остановки мигрирующих клеток и начала формирования периферических ганглиев. Информационная роль матриксного фибронектина; влияние на форму, поведение и дифференцировку клеток; участие в направленной миграции клеток при ранозаживлении; роль в агрегации тромбоцитов и формировании кровяного сгустка. Структура димера фибронектина. Модель образования фибрилл матриксного фибронектина. Шесть глобулярных доменов, из которых построена субъединица; три типа коротких повторов, из различного сочетания которых построены домены. Функциональные различия трех типов повторов по способности связывания с различными лигандами. Многофункциональность молекулы фибронектина: первый домен отвечает за связь с гепарансульфатом и фибрином; второй – с коллагенами, III и IV домены – за взаимодействие с интегринами поверхности клеток, V домен – с гепарансульфатом, VI домен – с фибрином.
Положение сайтов сплайсинга в молекуле фибронектина. Варианты альтернативного сплайсинга большой ядерной мРНК фибронектина – основной механизм возникновения многообразия форм фибронектина на примере плазменного и матриксного фибронектина, варианты возникновения фибронектина, отвечающего за взаимодействие с иммунными лимфоцитами. Особенности экзон-интронной организации гена фибронектона млекопитающих. Возможная роль различных вариантов фибронектина, продуцируемых разными типами клеток. Особенности взаимодействия фибронектина с фибриллярными коллагенами, ассоциированными с различными протеогликанами. Роль рецепторов фибронектина во взаимодействии клеток с различными по составу внеклеточными матриксами, продуцируемыми раличными типами клеток. Формирование сайтов фокальной адгезии и фокальных контактов клетки с внеклеточным матриксом; участие RGD-последовательности IV домена и роль III домена в этом процессе. Сравнение доменной организации двух важнейших адгезионных гликопротеинов – фибронектина и ламинина.
Протеогликаны и гиалуроновая кислота
Протеогликаны и гиалуроновая кислота– важнейшие компоненты ЭцМ. Распространение в царстве животных. Сравнение химического состава, размеров и молекулярных масс олигосахаридов, протеогликанов и гликопротеинов.
Структура протеогликанов: белковый кор и гликозаминогликаны. Структура гликозаминогликанов; дисахаридные компоненты, образованные аминосахарами (D-глюкозамином и D-галактозамином); сульфатированность аминосахаров; второй компонент – уроновые кислоты (L-глюкуроновая и L-идуроновая). Три типа связи полисахаридов с полипептидной цепью (кором) протеогликанов. Роль шероховатой эндоплазматической сети и аппарата Гольджи в синтезе и процессинге протеогликанов. Роль нуклеотидсахаров в процессе элонгации полисахаридных цепей. Химические модификации полисахаридных цепей – включение сульфатных групп, эпимеризация.
Структура семи типов гликозаминогликанов – хондроитин-6-сульфата, кератансульфата, хондроитин-4-сульфата, гепарансульфата, гепарина, двух форм дерматансульфата. Различия гликозаминогликанов по составу мономеров, гликозидным связям и числу сульфатных заместителей. Гликозаминогликаны – это полианионы; функциональные свойства гликозаминогликанов и их роль в создании высокоотрицательной по заряду среды в ЭцМ и поддержании равновесной среды в ЭцМ. Участие протеогликанов в создании в ЭЦМ гелей с различным размером пор и различной плотностью зарядов; роль как биологических фильтров.
Гиалуроновая кислота; уникальность структуры; состав дисахарида:
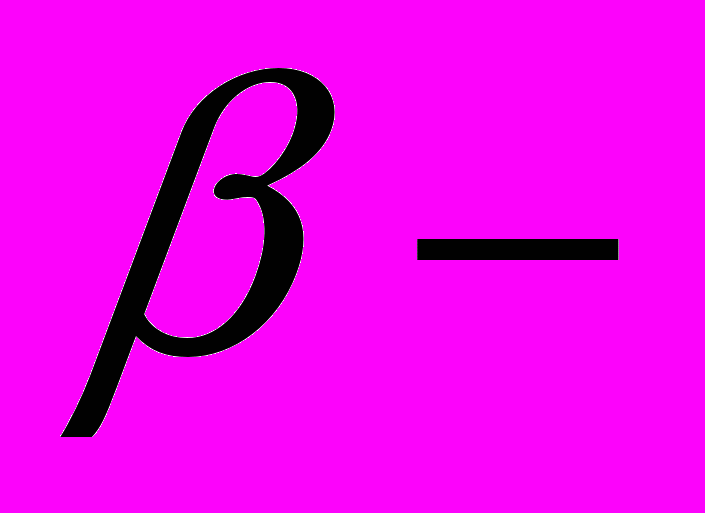 глюкуроновая кислота и N-ацетилглюкозамин. Возникновение конформации «рыхлого клубка»; положение отрицательно заряженных карбоксильных групп. Размеры молекулы. Химическая основа гидрофильности гиалуроновой кислоты; гиалуроновая кислота – обязательный компонент большинства изученных ЭцМ и основа создания гидратированного геля в матриксе. Механическая роль гиалуроновой кислоты в создании давления набухания (тургора), в соединительнотканном матриксе. Регулирующее влияние клеток и коллагена матрикса в регуляции тургора. Участие гиалуроновой кислоты в ингибировании межклеточной адгезии и в инициации миграции клеток на примере морфологичесикх изменений в склеротомах; контролирующая роль гиалуронидазы в этих процессах.
глюкуроновая кислота и N-ацетилглюкозамин. Возникновение конформации «рыхлого клубка»; положение отрицательно заряженных карбоксильных групп. Размеры молекулы. Химическая основа гидрофильности гиалуроновой кислоты; гиалуроновая кислота – обязательный компонент большинства изученных ЭцМ и основа создания гидратированного геля в матриксе. Механическая роль гиалуроновой кислоты в создании давления набухания (тургора), в соединительнотканном матриксе. Регулирующее влияние клеток и коллагена матрикса в регуляции тургора. Участие гиалуроновой кислоты в ингибировании межклеточной адгезии и в инициации миграции клеток на примере морфологичесикх изменений в склеротомах; контролирующая роль гиалуронидазы в этих процессах. Протеогликаны клеточной поверхности; особенности и типы заякоривания в плазматической мембране. Роль различных протеогликанов, представленных на поверхности клетки: механическая, регуляторная, «санитарная», метаболическая, информационная, рецепторная. Представленность на поверхности сходных типов клеток одного типа корового белка, связанного с определнным типом олигосахаридных цепей; исключения из этого правила. Различные типы клеток содержат различные по молекулярной массе и структуре коровые белки, связанные с различными по составу гликозаминогликанами; возможная роль таких различий. Эндоцитоз матриксных и связанных с плазматической мембраной протеогликанов; роль специфической по структуре группы протеогликанов, встроенных в плазматическую мембрану. Вовлеченность клеточно-поверхностных протеогликанов в межклеточные взаимодействия, влияние гепарансульфатпротеогликанов клеточной поверхности на конформационные изменения N-CAM. Самоассоциация гепарансульфатпротеогликанов; роль в кластеризации протеогликанов клеточной поверхности; значение этого явления для распластывания клеток, мигрирующих в очаг воспаления. Роль гепарансульфатпротеогликана в контроле клеточного роста; высокое сродство фибробластного фактора роста к этому типу протеогликанов; роль в морфогенезе капилляров.
Особенности взаимодействия гепарансульфат- и хондроитин-4-сульфат-протеогликанов с липопротеинами плазмы крови. Роль хондроитин-4-сульфата в возникновении пенистых клеток из макрофагов сосудистой стенки в атерогенезе. Роль хондроитин-4-сульфата в оседании в матриксе рыхлой соединительной ткани гранулоцитов, лимфоцитов и NK-клеток; взаимодействие хондроитин-4-сульфат-протеогликана клеточной поверхности с растворимыми коллагенами I и III типов и эластином матрикса.
Протеоглаканы хрящевой ткани; структура и молекулярная организация; роль гиалуроновой кислоты; нековалентное присоединение хондроитинсульфат- и кератинсульфат-протеогликана; участие и роль линкерных белков. Молекулярная организация матрикса хрящевой ткани – основа ее уникальных свойств. Гепарин. Уникальность первичной структуры белкового кора гепарина. Химический состав олигосахаридных цепей; высокий отрицательный заряд гепарина. Особенности взаимодействия гепарина с факторами свертывания крови IX иXI. Антикоагулянтная активность гепарина; взаимодействие с
 2 –гликопротеином плазмы крови, или антитромбином III; влияние образованного комплекса на активность тромбина. Роль взаимодействия гепарина с липопротеинлипазой на капиллярной стенке; роль в поддержании нормального кровотока в сосудах малого диаметра.
2 –гликопротеином плазмы крови, или антитромбином III; влияние образованного комплекса на активность тромбина. Роль взаимодействия гепарина с липопротеинлипазой на капиллярной стенке; роль в поддержании нормального кровотока в сосудах малого диаметра.Клеточная адгезия и ее типы
Исследования J. Holfreter (1935-1955) и A. Moscona (1952) по диссоциации и агрегации клеток зародышей амфибий и птиц; гипотеза о существовании специфических клеточно- поверхностных молекул адгезии, обуславливающих гомо- и гетеротипическое узнавание клеток и их роль в поддержании целостности клеточных пластов или тканей. Открытие двух типов (классов) молекул адгезии - мембранных рецепторов: (1) рецепторов, обуславливающих связь клетки с экстрацеллюлярным матриксом; (2) рецепторов, отвечающих за гомо- и гетеротипическое узнавание между клетками. Четыре основных семейства молекул адгезии: иммуноглобулиноподобное суперсемейство, семейство кадгеринов, суперсемейство интегринов и семейство селектинов.
Иммуноглобулиноподобное суперсемейство
Общая структурная организация трансмембранных белков этого суперсемейства. Сходство экстрацеллюлярного домена с С-доменом молекулы иммуноглобулинов. Одно- и двухсубъединичные рецепторы: из двух - субъединиц - семейство рецепторов Т-клеток: CD3, CD4, CD8, MHC класс I, MHC класс II; из одной - субъединицы - семейство N-CAM, семейство ICAM-VCAM.
Семейство N-CAM (от англ. neural cells adhesion molecule); представитель N-CAM - прототип этого семейства. Исследования C. Edelmann и сотр (1972) - N-CAM вовлечен в межклеточную адгезию при росте и дифференцировке нервной ткани. Первичная структура N-CAM, клонирование гена N-CAM. Структура N-CAM. Изобилие изоформ N-CAM у птиц и млекопитающих; ген N-CAM; "эмбриональные" и "взрослые" N-CAM. Разнообразие цитоплазматических участков N-CAM и особенности их взаимодействия с плазматической мембраной клетки; взаимодействие с кортикальными актиновыми филаментами. Различия в степени гликозилирования экстрацеллюлярных доменов N-CAM; роль полисиаловых цепей в модификации адгезивных свойств N-CAM. N-CAM обуславливает кальций-независимую гомотипическую адгезию клеток; ведущая роль домен-домен взаимодействий внеклеточного участка молекулы, сходство с взаимодействием иммуноглобулинов. Роль гепарансульфатпротеогликанов во взаимодействиях N-CAM. Важнейшие функции N-CAM при формировании синапсов, в морфогенезе эктодермы и части производных мезодермы в развитиии нервной системы. Особенности экспрессии эмбриональных и взрослых N-CAM; эксперименты J.P.Thiery, доказывающие смену экспрессии типов N-CAM в эмбриогенезе цыпленка и участие фибронектина матрикса и N-CAM и Ng-CAM в формировании спинальных ганглиев. Другие представители семейства N-CAM.
