Программа курса по выбору «Фундаментальные и прикладные аспекты медицинской биотехнологии»
| Вид материала | Программа курса |
- Международная научная конференция «Фундаментальные и прикладные аспекты воспаления», 27.32kb.
- Структурно-функциональная организация палеоамигдалы: фундаментальные закономерности, 2391.63kb.
- Доклада, 47.9kb.
- Аналитический обзор по тематике Всероссийской конференции с международным участием, 209.24kb.
- Vii международная научно-техническая конференция «Фундаментальные и прикладные проблемы, 109.18kb.
- Программа курса по выбору ставрополь 2007, 232.67kb.
- Программа дисциплины психология творческой личности автор: д психол н., проф. Семенов, 374.97kb.
- Xi международная научно-практическая конференция "Фундаментальные и прикладные исследования, разработка, 39.29kb.
- Мониторинг биотехнологии 20. 07. 2009, 1201.5kb.
- Программа 15-й международной научно практической конференции «Клинические и фундаментальные, 216.47kb.
MAG (от англ. Myelin-associated glycoprotein); гомотипическая молекула адгезии; структура MAG, экспрессия MAG олигодендроцитами и ее связь с процессом миелинизации. Особенности взаимодействия MAG с элементами экстрацеллюлярного матрикса. Выявление аутоантител к MAG при некоторых видах периферических невропатий.
Ng-CAM, или L1 (от англ. neuralglial cells adhesion molecule), участвует в гомотипическом узнавании нейрон-нейрон и гетеротипическом – нейрон-глия, а также в фасцикуляции нейронов. Особенности доменной структуры: наличие фибронектиновых повторов, присутствие RGD-последовательностей и иммуноглобулиновых повторов. Структура экстрацеллюлярного участка позволяет Ng-CAM участвовать в большом числе разноообразных процессов роста и дифференцировки нервной ткани.
Семейство ICAM-VCAM Семейство включает ICAM-1,-2,-3 (от англ. intercellular adhesion molecule-1,-2,-3) и VCAM-1 (от англ. vascular cells adhesion molecule-1). Близость структуры ICAM-VCAM к молекуле N-CAM. Сравнение доменной организации экстрацеллюлярной части ICAM-1,-2,-3 и VCAM-1: разная степень гликозилирования; участие домена D1 во взаимодействии с лигандом (контррецептором); мутации, возникновение которых в экстрацеллюлярных участках ICAM приводит к отмене адгезивных свойств молекул. Варианты альтернативного сплайсинга мРНК VCAM-1. IL-1, TNF-
 и INF- - индукторы экспрессии ICAM-VCAM. Особенности экспрессии ICAM-1,-2,-3 и VCAM-1 фибробластами, гладкомышечными и эндотелиальными клетками в нормальных тканях в пре- и постнатальном онтогенезе, а также при остром и хроническом воспалении и при иммунном ответе. Молекулы ICAM-VCAM участвуют в гетеротипическом узнавании; различные интегрины – это лиганды, или контррецепторы молекул ICAM-VCAM; особенности экспрессии интегринов клетками гематогенного происхождения. Различия в тканевой экспрессии ICAM-VCAM у млекопитающих обеспечивает согласованный ответ организма на воспаление и иммунный ответ.
и INF- - индукторы экспрессии ICAM-VCAM. Особенности экспрессии ICAM-1,-2,-3 и VCAM-1 фибробластами, гладкомышечными и эндотелиальными клетками в нормальных тканях в пре- и постнатальном онтогенезе, а также при остром и хроническом воспалении и при иммунном ответе. Молекулы ICAM-VCAM участвуют в гетеротипическом узнавании; различные интегрины – это лиганды, или контррецепторы молекул ICAM-VCAM; особенности экспрессии интегринов клетками гематогенного происхождения. Различия в тканевой экспрессии ICAM-VCAM у млекопитающих обеспечивает согласованный ответ организма на воспаление и иммунный ответ.Суперсемейство кадгеринов
Суперсемейство кадгеринов – это гомотипические молекулы адгезии, осуществляющие адгезию только в присутствии ионов Ca2+ . Два семейства этого суперсемейства: первое – кадгерины, второе – кадгерины десмосом. Семейство кадгеринов включает более 14 близкородственных молекул; наиболее изучены – E-, P-, и N-кадгерин; характеристика каждой из молекул адгезии; особенности экспрессии в пре- и постнатальном онтогенезе млекопитающих и птиц. Эксперименты Edelmann (1987), Jacob (1988), Takeihi (1987), показавшие ведущую роль кадгеринов в морфогенезе эпителиев зародыша человека и млекопитающих. Доменная организация трансмемдранного кадгеринового рецептора. Степень гомологии внеклеточного участка E-, P-, и N-кадгеринов. Димеризация кадгериновых рецепторов. Модель “одежной молнии”, объясняющая структуру межклеточных контактов при участии кадгериновых рецепторов. Полная гомология цитоплазматических участков; ассоциация этих участков с актиновым цитоскелетом через специальную группу белков – катенины.
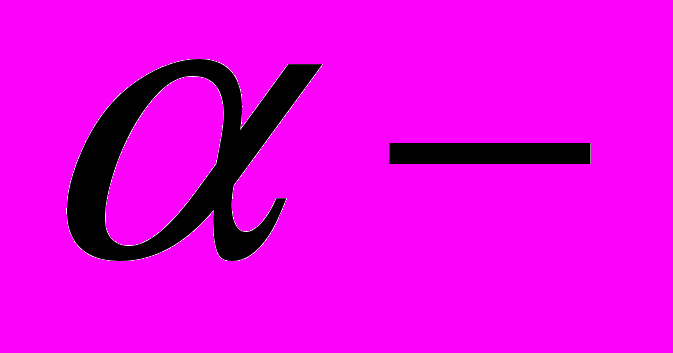 ,
,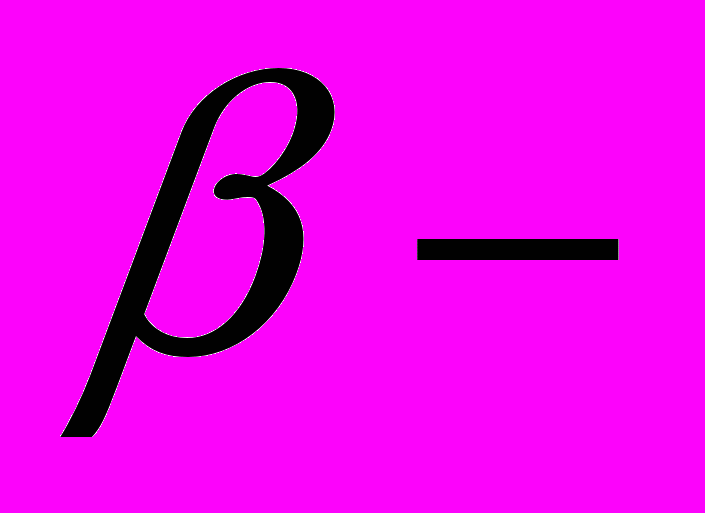 и
и 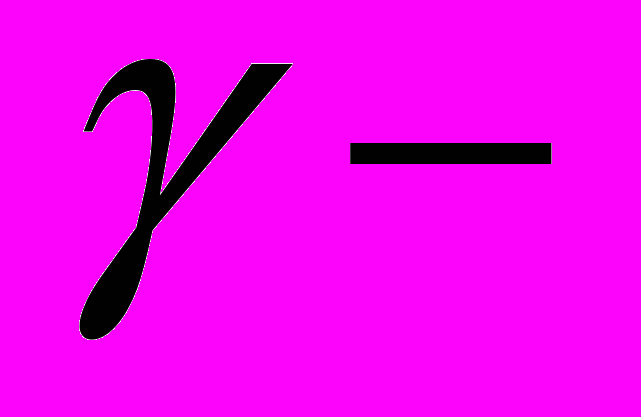 катенины; структура, особенности экспрессии; роль каждого из катенинов в образовании ассоциата цитоплазматического участка кадгеринового рецептора с актиновыми филаментами. Влияние эпидермального фактора роста (EGF) на фосфорилирование
катенины; структура, особенности экспрессии; роль каждого из катенинов в образовании ассоциата цитоплазматического участка кадгеринового рецептора с актиновыми филаментами. Влияние эпидермального фактора роста (EGF) на фосфорилирование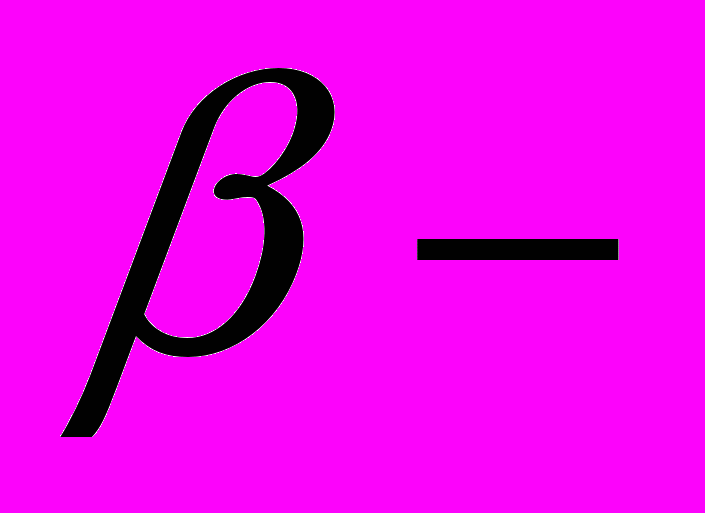 катенина через активацию c-src, c-yes;
катенина через активацию c-src, c-yes; 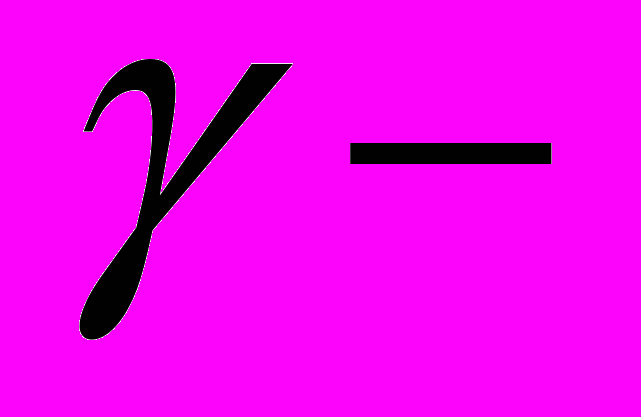 катенин (плакоглобин) – обязательный компонент структурных белков десмосом; взаимодействие плакоглобина с цитокератиновыми филаментами. Современные представления о роли каждого из катенинов в образовании специализированных контактов между эпителиальными клетками: апикального опоясывающего комплекса (zonula adherens и zonula occludens), латеральных контактов и настоящих десмосом (zona macula adherens). Отвечают ли комплексы кадгерин/катенины за развитие полярности эпителиальной клетки? Представление о кадгеринах как о поверхностных рецепторах, вовлеченных в передачу сигнала в клетку. Роль так называемого «X-белка» (предположительно одного из членов семейства АРС-белков) в комплексе кадгерин/катенины – X-белок – актиновые филаменты.
катенин (плакоглобин) – обязательный компонент структурных белков десмосом; взаимодействие плакоглобина с цитокератиновыми филаментами. Современные представления о роли каждого из катенинов в образовании специализированных контактов между эпителиальными клетками: апикального опоясывающего комплекса (zonula adherens и zonula occludens), латеральных контактов и настоящих десмосом (zona macula adherens). Отвечают ли комплексы кадгерин/катенины за развитие полярности эпителиальной клетки? Представление о кадгеринах как о поверхностных рецепторах, вовлеченных в передачу сигнала в клетку. Роль так называемого «X-белка» (предположительно одного из членов семейства АРС-белков) в комплексе кадгерин/катенины – X-белок – актиновые филаменты.Второе семейство – рецепторы адгезии в десмосомах – десмоглеины и десмоколлины; наличие изоформ у обоих белков; паттерны экспрессии изоформ; взаимодействие десмосомных кадгеринов с
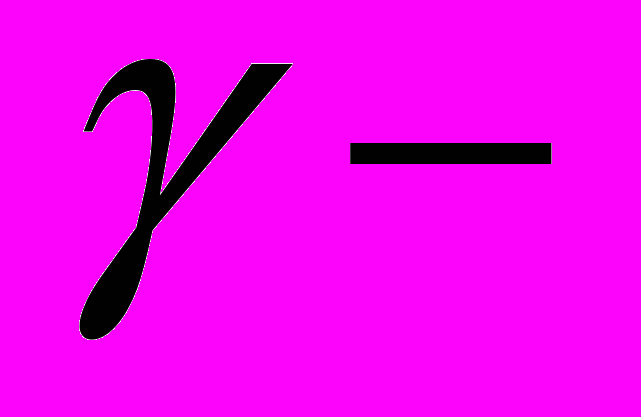 катенином (плакоглобином) или десмоплакином. Фенотипические проявления некоторых генетически-наследуемых аутоиммунных заболеваний, связанных с мутациями генов десмоглеинов и нарушением структуры десмосом. Ведущая роль кадгеринов/катенинов в сохранении целостности и поддержании полярности различных типов эпителиев в постнатальном онтогенезе. Кадгерины и рак.
катенином (плакоглобином) или десмоплакином. Фенотипические проявления некоторых генетически-наследуемых аутоиммунных заболеваний, связанных с мутациями генов десмоглеинов и нарушением структуры десмосом. Ведущая роль кадгеринов/катенинов в сохранении целостности и поддержании полярности различных типов эпителиев в постнатальном онтогенезе. Кадгерины и рак.Суперсемейство интегринов
Интегрины – поверхностные гликопротеины клетки, являющиеся рецепторами белков экстрацеллюлярного матрикса, или же выступающие как контррецепторы при взаимодействии с другими клетками. Интегрины - важнейший структурно-регуляторный компонент в инициации сборки фокальных контактов и фокальной адгезии. Роль интегринов в заякоривании клеток на внеклеточном матриксе; их значение для миграции и распластывании клеток на субстрате; роль в передаче информации от матрикса в клетку, влияние на рост, пролиферацию и дифференцировку клетки. Интегрины – непосредственные участники важнейших биологических процессов –иммунных, воспаления и посттравматического восстановления тканей, тромбообразования, поддержания гомеостатического состояния тканей; участие в процессах онкогенеза.
Структура интегринового рецептора; особенности доменной организации - и -субъединиц; особенности экстрацеллюлярного, трансмембранного и цитоплазматического участков рецептора. Нековалентное взаимодействие - и -субъединиц рецептора; положение лиганд-связывающего сайта; роль цистеиновых остатков в -субъединице; остатки тирозина как потенциальные сайты фосфорилирования у некоторых -субъединиц; Ca2+- и Mg2+-связывающие сайты -субъединиц и роль ионов Ca2+ во взаимодействии с лигандом. Разнообразие -субъединиц (16) и -субъединиц (8 и более). 20 и более различных типов интегринов млекопитающих. Деление суперсемейства на семейства -1, -2, -3, -4, -5, -6 и -7 интегринов. Взаимодействие интегринового рецептора через -субъединицу с актиновым цитоскелетом; участие актин-связывающих белков – талина, винкулина и др., а также некоторых тирозинпротеинкиназ во взаимодействии интегриновых рецепторов с цитоскелетом клетки. Роль RGD-последовательности, представленной в важнейших адгезионных белках матрикса – фибронектине, ламинине, коллагенах, витронектине и некоторых других, в распознавании лиганда -субъединицей рецептора. Модель т.наз. «-пропеллера», образуемого лиганд-связывающим участком. Активация интегринового рецептора; роль процессов ди- и олигомеризации рецепторов; конформационные изменения рецептора, вызванные активацией; интегриновый сигнал в клетку; возможные участники начальных этапов передачи сигнала – FAK-киназа, MAP-киназы, c-src-киназа, рр60-киназа, малые ГТФфзы семейства rho. Влияние интегринового сигнала на перестройку актинового цитоскелета кортекса и цитоплазмы и инициацию сборки сайтов адгезии. Аффинность интегриновых рецепторов. Моно- и полиспецифичность интегриновых рецепторов в распознавании и связывании с лигандом или лигандами ЭцМ. Многообразие типов интегриновых рецепторов, представленных на поверхности клетки; ансамбли интегринов как отражение стерени дифференцированности клеток; различия в аффинности связывания; взаимодействие с различными изоформами лигандов; возможная биологическая роль. Интегрины – как контррецепторы (лиганды) молекул адгезии ICAM-VCAM при гетеротипическом взаимодействии клетка-клетка. Регуляция экспрессии интегриновых молекул в пре- и постнатальном онтогенезе. Характеристика семейств 1-, 2-, 3-, 4- интегринов и их роль в биологических процессах.
Суперсемейство селектинов
Семейство высокогликозилированных адгезионных белков клеточной поверхности, впервые идентифицированных на лимфоцитах, эндотелиальных клетках и активированных тромбоцитах: L-селектин (хоминг-рецептор), E-селектин (ELAM), P-селектин (GMP-140, или PADGEM). Структура доменов трех типов селектинов: присутствие на NH2-конце молекул лектинового домена и следующих за ним различного числа аминокислотных последовательностей, характерных для комплемент-связывающих белов; трансмембранный и цитоплазматический участки; роль каждого из участков в молекуле селектина в осуществлении ее функций. Структура лиганда – сиалил-Lewisx (CD15S) – общего для всех селектинов; экспрессия этого антигена на гранулоцитах, моноцитах и некоторых миелоидных лейкемических клетках. Селектины-типичные представители молекул адгезии, участвующие в гетеротипическом узнавании между некоторыми типами клеток крови и эндотелием; уникальная роль селектинов в адгезии клеток крови на эндотелий, осуществляемая в потоке крови; вовлеченность Е- и Р-селектинов эндотелия в этапы адгезии лейкоцитов на эндотелий и их проникновение в очаг воспаления; Е-селектины и т. наз.. “rolling” лейкоцитов по поверхности эндотелия; Р-селектины и их роль в более прочном связывании лейкоцитов с эндотелием; роль медиаторов воспаления в усилении экспрессии Р-селектина на эндотелии; активация адгезированного нейтрофила хемотактическими агентами. Усиление экспрессии интегриновых рецепторов 1, 2 и 7 семейств на активированных нейтрофилах и их контррецепторов на эндотелии - ICAM-1, -2, -3, VCAM-1. Механизм миграции нейтрофилов, моноцитов и лимфоцитов в очаг воспаления. Высокая эволюционная специализация селектинов. Примеры других возможных функций селектинов.
Факторы роста клеток, или цитокины.
Обмен информацией клеток многоклеточного организма друг с другом необходим для регуляции своего развития, организации в ткани, контроля процессов роста и деления, а также для координации функций. Три способа взаимодействия клеток животных осуществляются: (1) путем выделения клетками химических веществ (сигнальных молекул), действующих на некотором расстоянии или в непосредственной близи от секретирующей клетки; (2) при непосредственном физическом контакте клеток за счет сигнальных молекул, связанных с плазматическими мембранами; (3) через щелевые межклеточные контакты.
Три формы сигнализации с помощью секретирующих молекул: эндокринная, паракринная и синаптическая. Запрограммированность ответа каждой клетки на специфическую комбинацию сигнальных молекул. Селективность ответа клетки на внешние сигналы является продуктом их дифференцировки. Специализированные белки, называемые рецепторы, связывающие определенную внеклеточную сигнальную молекулу, инициируют ответ клетки. Три класса поверхностных рецепторов: рецепторы, образующие ионные каналы, рецепторы, сопряженные с G-белками и каталитические рецепторы. Характеристика механизмов каждого из трех классов этих рецепторов. Важнейшие внутриклеточные посредники или внутриклеточные медиаторы – циклический AMP (cAMP) и Ca2+. Действие внутриклеточных посредников на поведение белков-мишеней в клетке. Разнообразие белков-мишеней. Сравнение различных путей генерирования сигналов с образованием вторичных посредников во всех типах животных клеток при взаимодействии их рецепторов с лигандами; лиганды, влияющие на изменение внутриклеточного содержания c-AMP, сопряжение рецепторов с аденилатциклазой через Gs –белок; путь, наиболее распространенный у эукариот, – сопряжение активированного рецептора через инозитолфосфат с высвобождением Ca2+ из внутриклеточных хранилищ; роль фосфоинозитидов в передаче сигнала; роль активированного рецептора в активации фосфоинозитид-специфической фосфолипазы С; роль этого фермента в образовании из фосфотидилинозитолбифосфата (PIP2 ) двух важнейших продуктов – инозитолтрифосфата (InsP3 или IP3) и диацилглицерола. Роль InsP3 в повышении внутриклеточного содержания ионов Ca2+; диацилглицерол -активатор протеинкиназы С (С-киназа); зависимость активности С-киназы от Ca2+ . Каскад фосфорилирований ряда регуляторных (протеинкиназы) и структурных белков с различными функциями в клетке-мишени. Участие активированной С-киназы в усилении транскрипции определенных генов; предполагаемый механизм участия.
Полипептидные факторы роста, их роль в прямом или опосредованном действии на скорость роста, пролиферацию или дифференцировку эукариотических клеток. Следствие тканевого разнообразия многоклеточных - появление большого разнообразия факторов роста, обеспечивающих коммуникативные взаимодействия как в однородных клеточных популяциях, так и в межтканевых взаимодействиях, что обеспечивает скоординированность процессов роста и пролиферации клеток в ходе формирования тканей и органов; поддержание их стабильности; интегративный контроль работы физиологических систем. Молекулярная природа биологической активности факторов роста. Отличие полипепетидных факторов роста от классических гормонов. Типы факторов роста. Индукция и продукция клеткой фактора(ов) роста. Паракринный и аутокринный механизм действия факторов роста. Относительность деления факторов роста на факторы компетенции и прогрессии. Связывание фактора роста с поверхностными рецепторами клетки.
Рецепторы факторов роста относятся к типу каталитических поверхностноклеточных рецепторов. Пять классов каталитических белков-рецепторов; большинство из них относится к классу гликопротеинов с тирозин-специфической протеинкиназной активностью, однократно пронизывающих мембрану. Структура этого типа рецепторов; особенности структурной организации внеклеточного и цитоплазматического (киназного) доменов. Активация этого типа рецепторов – связь димеризации и аутофосфорилирования тирозиновых остатков в цитоплазматическом домене рецептора. Роль лигандов в разнообразии механизмов димеризации рецепторов различных факторов роста. Активированные каталитические рецепторы связываются в различных комбинациях с сигнальными белками в клетках-мишенях, что обеспечивает различия в клеточном ответе на действие одного и того же лиганда. Роль SH2- и SH3-доменов сигнальных цитозольных белков во взаимодействии с киназным доменом рецептора. Структура SH2- и SH3-доменов. Разнообразие типов сигнальных белков. Короткий путь передачи сигнала при взаимодействии лиганда с рецептором приводит к активации протеинкиназы С. Примеры того, как активация в клетке-мишени сигнальных белков - фосфолипазы С и протеинкиназы А в сопряжении с протеинкиназой С приводит к быстрому и мощному ответу клетки на действие сигнальной молекулы.
Роль факторов роста в регуляции клеточного цикла; участие факторов роста компетенции и прогрессии в выходе клетки из состояния покоя и переходу к фазе G1 клеточного цикла; роль факторов роста в поддержинии фазы G1.
Фактор роста тромбоцитов (ТФР, или PDGF)
Тромбоциты и клетки мезенхимного происхождения – место синтеза, накопления и секреции PDGF. Особенности первичной структуры мономеров цепей PDGF. Три изоформы PDGF человека и млекопитающих - AA, BB, AB. Локализация генов А и В цепей в хромосомах человека, особенности экспрессии этих генов. Протоонкоген c-sis и онкоген v-sis кодируют В-цепь; особенности их экспрессии в нормальных и раковых клетках. Клетки соединительной ткани и крови, способные к синтезу и секреции PDGF, создают условия его локального накопления в тканях и плазме крови. Рецептор PDGF относится к суперсемейству иммуноглобулиноподобных рецепторов факторов роста. Структура рецептора PDGF; особенности организации внеклеточного домена, цитоплазматического тирозинпротеинкиназного домена. и типы рецепторов PDGF; степень их гомологии и особенности структуры; особенностив связывании PDGF-АА и PDGF-ВВ; лигандная специфичность - и -типов рецепторов. Особенности экспрессии - и -типов рецепторов PDGF нормальными и раковыми клетками. Димеризация рецепторов PDGF, их активация. Активация сигнальных белков – PI3-киназы; белка, активирующего ГТФ-азу, и фосфолипазы С-, содержащих SH2- и SH3-домены. Активация протеинкиназы С с последующей активацией ядерного фактора каппа В (NF-kB), активация гена IFN/ при участии NF-kB, аутокринная регуляция поддержания клеткой дифференцированного состояния IFN/.
Примеры механизмов действия PDGF как типичного фактора компетенции, способного удерживать клетки в дифференцированном состоянии. Приобретение клетками компетентности к воздействию факторов прогрессии (т.е. переходу из G0- в G1-фазу клеточного цикла) зависит от концентрации PDGF и продолжительности его действия. Примеры, когда PDGF выступает как митоген клеток мезенхимного происхождения в условиях хронического воспаления, посттравматической регенерации соединительной ткани. PDGF и модификация внеклеточного матрикса. PDGF как стимулятор хемотактической активности клеток. Влияние PDGF на поведение гладкомышечных клеток в нормальной и атеросклеротически измененной сосудистой стенке. Роль PDGF в эмбриональном развитии. PDGF и трансформация клеток. Современная модель ауто- и паракринного влияния PDGF на пролиферативное поведение клетки.
Семейство эпидермального фактора роста (ЭФР, или EGF)
Представители семейства: EGF, трансформирующий фактор роста альфа (TGF-) и некоторые джругие.
EGF – типичный представитель этого семейства. Работы S. Cohen (1960-1975гг.) по выделению и изучению биологического действия EGF. Структура нативной формы EGF. Структура внутриклеточного предшественника EGF. Структура гена EGF и особенности его тканевой экспроссии.
Трансформирующий фактор роста альфа - TGF- – эмбриональная форма EGF (G. Todaro ,1978). Секреция TGF- карциномными и эмбриональными клетками. Рецептор EGF – трансмембранный гликопротеид; особенности организации внеклеточного домена; цитоплазматический домен – типичная тирозинпротеинкиназа.
Протоонкоген c-erbB кодирует рецептор EGF, а онкобелок v-erbB – это «усеченный» вариант рецептора EGF. Особенности экспрессии генов c-erbB и v-erbB. Лигандная специфичность рецепторов EGF. Особенности димеризации рецептора EGF.
EGF – яркий представитель факторов прогрессии. Представление о механизмах внутриклеточной передачи сигнала после взаимодействия EGF с рецептором. Примеры митогенного влияния EGF на различные типы клеток; EGF стимулирует переход клеток из фазы G1 в фазу S клеточного цикла. Роль EGF в ингибировании синтеза коллагена I в костной ткани. Влияние EGF на экспрессию ядерных протоонкогенов c-fos и c-myc; значение для процессов дифференцировки. Раковые клетки не синтезируют EGF, но экспрессируют либо нормальный, либо “усеченный” рецепторы EGF; TGF- является их лигандом.
Секреция проEGF эндокринными железами желудочно-кишечного тракта. Гомеостатическая роль EGF в поддержании целостности эпителиальной выстилки желудочно-кишечного тракта. Механизм действия EGF в поддержании целостности кишечного эпителия и поддержании полярности и целостности эпителия дистальных отделов почечных канальцев.
Семейство фибробластного фактора роста (ФФР, или FGF)
Девять представителей семейства FGF. Исследования D. Gospodarowicz по выделению и изучению структуры кислого и основного FGF. Современая номенклатура представителей семейства FGF. Структура FGF-1 (aFGF) и FGF-2 (bFGF); отсутствие сигнальных последовательностей у FGF-1, -2 и –9, в отличие от FGF-3 – FGF-8. Проблемы понимания механизма секреции FGF-1 и FGF-2. FGF-1 и FGF-2 секретируют эмбриональные и взрослые клетки; FGF-3-8 – эмбриональные, трансформированные и раковые клетки. Локализация генов FGF1-9 в геноме человека; особенности их экспрессии. Множественность изоформ представителей семейства FGF; разнообразие способов возникновения изоформ. Интернализация экзогенного FGF-1 и FGF-2 клеткой. Обнаружение стабильных фрагментов FGF-1 и –2 в ядре; возможная их роль в ядре.
Особенности связывания FGF с рецепторами. «Высокоаффинные» сигнальные рецепторы с тирозинпротеинкиназной активностью и «низкоаффинные» рецепторы – различные по структуре трансмембранные гепарансульфатпротеогликаны. Структура четырех типов «высокоаффинных» рецепторов, наличие изоформ у каждого из типов; значение каждой из иммуноглобулиноподобных петель экстрацеллюлярного домена и межпетлевых участков в «высокоаффинном»связывании лиганда с рецептором; роль степени гликозилирования для функциональной активности связывания рецептора с лигандом. Структура цитоплазматического тирозинпротеинкиназного домена.
Лигандная специфичность сигнальных рецепторов FGF-1-4; представленность определенных сочетаний типов рецепторов на различных типах клеток; современные представления и гипотезы, объясняющие биологическую роль столь большого разнообразия изоформ лигандов и рецепторов.
Структура «низкоаффинного» рецептора FGF, относящегося к семейству синдеканов - трансмембранных гепарансульфатпротеогликанов (ГсПГ); роль корового белка в секреции и закреплении этого типа рецептора в плазматической мембране. Шесть сайтов связывания с гепарансульфатными цепями; роль связывания цитоплазматического домена с кортикальным актином. Роль ГсПГ-рецептора в депонировании FGF, защите от протеолитической деградации; участие ГсПг-рецептора в индукции ди- и олигодимеризации «высокоаффинных» рецепторов. Модель, предложенная Schlessinger, (1996) для объяснения функций «низкоаффинного» рецептора, как презентирующего лиганд «высокоаффинному» рецептору. Активация сигнального рецептора. Важнейшая активируемая сигнальная молекула в клетке – PLC-; ее активация обуславливает множество функции FGFs – в эмбриональной индукции, дифференцировке, хемотаксисе, но не в индукции пролиферации. В стимуляции пролиферации (под действием FGF-2) главным участником является активированная протеинкиназа С. Ее участие в активации генов быстрого, или первичного, ответа (переход из G0 в G1 фазу). Экспрессия второй группы - генов медленного ответа, непосредственно связанная с работой первой группы, приходится на середину – конец G1 фазы и обеспечивает переход к S –фазе – это гены определенных типов циклинов, негистоновых хромосомных белков, синдекана и некоторых других. Особенности влияния FGF на культивируемые клетки. Роль FGF-1 и-2 в ангиогенезе опухолей (J.Folkmann). Роль FGF-2 в миграции и пролиферации эндотелия и гладкомышечных клеток при нарушении целостности сосудистой стенки. Значение FGF-2 в развитии рестенозов сосудистых трансплантатов и протезов; возможные методы и подходы для борьбы с рестенозами. FGF-1 и –2 – как обязательные участники острых и хронических воспалений и посттравмвтического восстановления тканей.
Суперсемейство трансформирующего фактора роста бета
(ТФРбета, или TGFs)
Девятнадцать представителей суперсемейства TGF включает четыре близких семейства: TGF, Vg/DPP/BMP (вегетализирующий фактор роста, определяющий дорзовентральную ось/фактор морфогенеза кости), Inhibin/Activin (ингибин/активин – факторы контроля дифференцировки и индукции мезодермы), MIS (фактор регрессии мюллерова протока). Эволюционная консервативность представителей суперсемейства TGFs. Краткая характеристика биологического действия представителей каждого семейства, многообразие изоформ. TGF - характерный представитель суперсемейства. Структура молекулы TGF, особенности синтеза и секреции. Латентный предшественник TGF. Образование гомо- и гетеродимеров. Особенности депонирования предшественника в экстроцеллюлярном матриксе, поступление и транспорт в плазме крови; молкулы, участвующие в его депонировании и транспорте. Представления об ограниченном протеолизе предшественника. Шесть типов рецепторов TGF. Ser/Thr-протеинкиназа – сигнальный тип рецептора TGF, представленность на различных типах клеток у млекопитающих. Краткая характеристика молекулярной организации основных четырех типов сигнальных рецепторов: Daf-1, TGF-II-R, Act-IIB-R, Act-II-R; структура и гомология киназных доменов; изоформы этого типа рецепторов; спорные вопросы о роли различных участков экстрацеллюлярного домена. Лиганд-препрезентирующий тип рецепторов - бетагликан III типа, а также эндоглин. Структура презентирующих рецепторов, их молекулярное разнообразие. Образование рецепторных комплексов между двумя типами рецепторов, необходимое для связывания лиганда с сигнальным рецептором. Современные представления о механизмах презентации лиганда и связывания с сигнальным рецептором. Экспериментальные данные о механизмах передачи сигнала сигнальным рецептором; возможные кандидаты в субстратные белки, их многообразие; роль эффекторных цитоплазматических молекул - SMAD в передаче информации в ядро; структура SMAD, их разнообразие; трудности интерпретации результатов.
TGFs – как типичные факторы компетенции; сочетание пара- и аутокринных путей регуляции, современные представления. Бифункциональность биологического действия TGF - с одной стороны, временные ингибиторы пролиферации эпителиальных клеток и клеток мезодермального и мезенхимного происхождения, выступающие как мощные факторы дифференцировки и индукторы синтеза компонентов внеклеточного матрикса, а с другой – в сочетании с работой других факторов – как активатора пролиферации, что обеспечивает выход клеток из состояния покоя и переходу в активный клеточный цикл. Различие биологического действия TGF in vitro и in vivo. Современные представления о молекулярных механизмах действия TGF как ингибитора пролиферации. Роль TGF в ингибировании роста и пролиферации раковых клеток эпителиального происхождения, представление о механизме такого ингибирующего действия. Роль представителей семейства TGF в хемотаксисе, в перестройке костной ткани. Роль TGFs в дифференцировке IL-2-зависимых Т-лимфоцитов, влияние на поведение макрофагов – роль TGFs в реализации воспалительных реакций.
Представители суперсемейства TGF - важнейшие регуляторы индукции мезодермы; регуляторы дифференцировки. Роль в определении паттерна симметрии зародышей позвоночных и морфогенеза зародышевых тканей. Возможные последствия нарушения таких механизмом и развитие позвоночных животных.
Семейство фактора некроза опухолей альфа (ФНОальфа, или TNF)
Краткая историческая справка о биологических эффектах, наблюдаемых у экспериментальных животных и человека при действии TNF. Природа эндотоксина и лимфотоксина; TNF - это кахектин; TNF - лимфотоксин, сравнительный анализ их первичной структуры. Секретируемая и трансмембранная формы TNF, особенности секреции. Роль карбонильного и аминоконцевого участков в молекуле TNF для ее биологического действия; генноинженерные экспериментальные данные по этому вопросу. Различия в биологических эффектах трансмембранной и секретируемой форм TNF. Особенности локализации и структуры гена TNF. Индукторы экспрессии гена TNF. Главный источник TNF у млекопитающих – макрофаги, другие типы нормальных и раковых клеток, которые являются продуцентами TNF. Роль IFN- и M-CSF в продукции TNF макрофагами; другие молекулы-мишени для этих индукторов; роль активации транскрипционных факторов NF-kB и AP-1 в активации гена TNF. Два типа рецепторов TNF; особенности их экспрессии на различных типах клеток у млекопитающих. Структура рецепторов TNF гомология с другими представителями суперсемейства рецепторов TNF-R. Особенности первичной структуры цитоплазматических доменов p80 TNF-R и p60 TNF-R, роль в различиях биологических эффектов, вызванных взаимодействием лиганда с определенным типом рецептора. Структура генов рецепторов TNF и особенности регуляции их экспрессии, роль интерферонов. Слабая перекрываемость сигнальных каскадов, вызванных взаимодействием мембранносвязанной и растворимой формами лиганда с каждым из типов рецепторов у нормальных и раковых клеток. TNF - типичный представитель факторов компетенции; TNF - как трофический фактор. Плейотропный эффект действия TNF на нормальную клетку. Роль различных Ser/Thr-протеинкиназ и MBP-киназ в реализации передачи сигнала у разных типов клеток. Роль продуктов активации определенных факторов транскрипции (каскад активаций) в усилении транскрипционной активности клетки. Ассоциация цитоплазматического домена TNF-R с казеинкиназой 1 и некоторыми подмембранными Ser/Thr-протеинкиназами, а также с кислой и нейтральной сфингомиелинидазой. Каскад активаций сфингомиелинидаз и последующая активация церамид-активируемой протеинкиназы, протеинкиназы Сzeta и протеинфосфатаз, активации NF-kB и усиление экспрессии c-myc и c-jun. Продукция клеткой церамида и механизм ингибирования ее роста, вызванная действием TNF. Возможные механизмы активации клеточной пролиферации при действии TNF. “Домен смерти” в составе цитоплазматического домена двух типов рецепторов TNF и его роль. Возможный молекулярный механизм участия TNF в супрессии генов, вовлеченных в рост раковых клеток; ингибирование гена Rb, усиление экспрессии генов р53 и TNF.
Биологические эффекты TNF: TNF как аутокринный фактор дифференцировки макрофагов и гранулоцитов и активации макрофагов в усилении продукции иммунорегуляторов и медиаторов воспаления. Роль TNF в активации гранулоцитов при остром воспалении; ее молекулярный механизм. Роль TNF в кахексии, анорексии и ожирении. Использование TNF для клинических целей – современное состояние вопроса.
Протоонкогены и онкогены
Определение терминов “протоонкоген” и “онкоген”. Основные процессы в жизни клетки куда вовлечены продукты протоонкогенов –регуляция контроля нормального роста и пролиферации, течения клеточного цикла, а также дифференцировки. Мутации и другие нарушения в структуре или работе протоонкогенов – главные причины появления признаков онкотрансформации клетки. Экспериментальные данные, позволяющие разделить онкогены на несколько групп: иммортализующие клетку, снижающие потребность клетки к экзогенным факторам роста; изменяющие характер взаимодействия клетки с субстратом, влияющие прямо или опосредованно на контроль пролиферации. Трансгенные мыши – прекрасная модель для изучения роли онкогенов в онкогенезе. Модели, используемые в экспериментах in vitro для идентификации новых онкогенов.
Открытие онкогенов; вирусные онкогены. Структура генома ретровирусов; особенности интеграции вирусного генома в геном клетки-хозяина. Деление ретровирусов на два класса. Современные представления об активации онкогенов через ретровирусную трансдукцию; активация онкогенов путем инсерции вируса. Выявление онкогенов в раковых клетках человека. Хромосомные транслокации (характерные примеры) и места выявления онкогенов в раковых клетках; использование различных технологий по трансфекции ДНК, выделенных из трансформированных или раковых клеток в слаботрансформированные клетки линии NIH 3T3; химический канцерогенез и выявление онкогенов. Примеры химерных генов, механизмы их возникновения. Амплификация протоонкогенов и онкогенез; их выявление и прогностическое значение при диагностике и лечении некоторых типов рака человека.
Эволюционная консервативность протоонкогенов и их продуктов у эукариот. Группы вирусных онкогенов и их продуктов гомологичные таковым протоонкогенам: факторов роста; рецепторов, лишенных протеинкиназной активности; тирозинпротеинкиназ, интегрированных в плазматическую мембрану, т.е. рецепторов факторов роста; цитоплазматических и подмембранных тирозинпротеинкиназ; семейство мембранносвязанных G-белков; семейство белков GFF (guanine nucleotide exchange proteins); цитоплазматических Ser/Thr-протеинкиназ; семейство ядерных белков.
Краткая характеристика молекулярных и фенотипических изменений в клетке, происходящих вследствие гиперактивации или гиперпродукции продуктов тех онкогенов, которые гомологичны основным группам протоонкогенов: факторам роста, на примере v-sis; рецеторам факторов роста с тирозинпротеинкиназным (ТПК) доменом на примерах v-erbB, v-fms, met, trk, ras, v-kit, bck; рецепторам факторов роста без ТПК домена, на примере mas нерецепторных ТПК – на примере v-scr, v-fes, v-fos, v-yes и lck; белков с активностью ГТФаз –ras-онкогенов;нарушение основных молекулярных механизмов, наблюдаемых при передаче сигнала в клетке с участием ras p21; ядерных онкобелков, участвующих в контроле экспрессии важнейших групп генов регулирующих клеточный цикл, пролиферацию, дифференцировку и адгезию. Структура протоонкогенов и протоонкобелков fos, jun, myc; гомо- и гетеродимерные белки; «лейциновые застежки» и “basic domain’ы”, их роль во взаимодействии протоонкобелков с соответствующими участками геномной ДНК. Особенности изменений структуры онкогенов v-fos, v-jun и других и влияние таких мутаций на их экспрессию и поведение у онкотрансформированных клеток in vitro и in vivo.
Онкогены и онкобелки – как диагностические и прогностические маркеры различных типов рака у человека; их значение для ранней дианостики рака и химиотерапии.
Клеточный цикл
Определение “клеточный цикл”, “митотический (пролиферативный) цикл”. Создание метода авторадиографии, разделение интерфазы на G1-, S- и G2-периоды. М-период. Параметры клеточного цикла - по модели цикла, разработанной Pardee A. и соавт. (1975, 1978). Относительная стабильность и варьирование продолжительности периодов (фаз) клеточного цикла клеток млекопитающих. Примеры, когда не выявляются G1, G2+G2, S+G1+G2. Эксперименты, показывающие, что самостоятельность механизма контроля определенной фазы цикла относительна и является составной частью общего механизма контроля цикла, жестко контролирующего нормальную последовательность прохождения фаз клеточного цикла. Регуляция интенсивности клеточной пролиферации зависит от G1- и G2-фазы. Рост и дифференцировка клеток связаны с изменением интенсивности их пролиферации. Разделение тканей млекопитающих на три группы (по Leblond C.P., 1964,1982) в зависимости от темпа их пролиферации: неразмножающиеся (static) популяции; популяции с очень низким темпом пролиферации (expanding); обновляющиеся (renewing) популяции. Общая характеристика обновляющихся тканей, определение понятий «стволовые клетки» (stem cells), “коммитированные клетки”, “клетки-предшественники”, “зрелые клетки” – сходства и различия. Понятия “пролиферативный пул”, “пролиферативный потенциал”, “лаг-период клеточного цикла”, “ пролиферативный период”. Наблюдения и эксперименты, свидетельствующие о периоде покоя (G0, или R) в клеточных системах многоклеточных. Выход клеток в покой по завершении М-фазы, либо - S-фазы; сходство и различия клеток вышедших в покой и составляющих т.наз. R1- и R2- популяции; примерв таких популяций. Понятие «углубление в покой»; эксперименты, показывающие, что клетки по разному углублены в покой. Выход клеток из состояния покоя; экспериментальные модели in vitro и in vivo; современные представления о механизмах выхода клеток из покоя; роль факторов роста. Разнообразие механизмов умножения генома в митотическом цикле, примеры таких клеточных популяций у человека и млекопитающих. Современная модель клеточного цикла эукариот; понятие “точек перехода” (рестрикции, R) в G1- и G2-фазе; теоретические предпосылки и экспериментальные модели поиска молекул-регуляторов, координирующих вступление и прохождение каждой из фаз клеточного цикла; общие теоретические представления о механизме контроля клеточного цикла эукариот.
Механизм молекулярного контроля клеточного цикла
Краткий анализ результатов исследований по генетическому контролю клеточного цикла дрожжей и поиску молекул, контролирующих прохождение клеточного цикла в овогенезе и раннем развитии амфибий. Консервативность механизмов контроля клеточного цикла эукариот. Работа L. Hartwell и P. Nurse (1990-1991) на дрожжах Saccharomyces cerevisiae и Schizosaccharomyces pombe – открытие гомологичных генов (cdc2 и CDC28) и их продуктов, участвующих в реализации программы контроля прохождения клеткой фаз клеточного цикла у этих двух видов с различным ядерным (жизненным) циклом. Предложенная этими авторами фундаментальная идея клеточной биологии об организации молекулярного контроля клеточного цикла. Точки “Start” в клеточном цикле у S.cerevisiae и S.pombe и “Checkpoint control”. Совпадение точки “Start” и точки перехода (R) в клетках дрожжей и млекопитающих.Открытие фактора промотирующего переход к М-фазе (MPF) в овогенезе и раннем развитии амфибий (Masul H.,et al., 1971). Очистка MPF и изучение его димерной структуры; в состав MPF входит циклин-зависимая киназа (cdk) - каталитическая субъединица, и активирующая киназу субъединицу – циклин; cdks – Ser/Thr-потеинкиназы; циклины – уникальная группа белков, контролирующая способность cdk, связываться и фосфорилировать определенные белки-мишени.Особенности экспрессии этих субъединиц в ходе клеточного цикла. Основа контрольного механизма клеточного цикла – периодическое объединение, активация и распад коемплексов циклин-cdk. Парадигма Murray A. (1989) о контроле клеточного цикла у эукариот как цикле cdk1 (в частности p34cdc2 дрожжей), активация соответствующей киназной субъединицы необходима как для прохождения определенной фазы цикла, так и для осуществления точек перехода из G1- в S-фазу и из G2- в М-фазу. У дрожжей S.cerevisiae и S.pombe киназная субъединица р34 – CDC28 и cdc2 – единственный и главный «контролер» в клеточном цикле. Уникальность сочетаний паттерна экспрессии и активаций cdks , характерных для каждой фазы клеточного цикла у млекопитающих. Семейство циклинов; первичная структура циклинов D, E, B, A, H, “cyclin box” и роль “destruction box” в молекуле циклина. Конформационные изменения молекул циклина и cdk в ходе их взаимодействия с (образование MPF). Разнообразие циклинов млекопитающих и дрожжей; особенности паттерна их экспрессии в зависимости от фазы клеточного цикла. Молекулярная модель активации cdk; G1-, S-, G2-циклины и их партнеры – соответствующие cdk в клеточном цикле млекопитающих. Регуляция циклин-зависимой протеинкиназы осуществляется путем ее фосфорилирования и дефосфорилирования; участники этих процессов. Гены, участвующие в контроле клеточного цикла гаплоидных дрожжей S.pombe: cdc2 (Ser/Thr-протеинкиназа, p34cdc2), cdc13 (циклин М-киназы, р60), cdc25 (специфическая фосфатаза), suc1 (p13), wec1 (Ser/Thr-протеинкиназа), nim1 (протеинкиназа, негативный регулятор wec1), Mo15 (активирующая киназа), cdc10; особенности экспрессии этих генов; структура и функция продуктов этих генов в контроле цикла S.pombe. Отличительные особенности течения и регуляции клеточного цикла у диплоидный дрожжей S. сerevisiae - p34cdc28 остается главным и единственным регулятором клеточного цикла диплоидных дрожжей, но увеличивается число типов циклинов, участвующих в регуляции более сложного по течению клеточного цикла S. сerevisiae.
Ингибиторы циклин-зависимых киназ; семейство INK4 белков и семейство CIP/KIP белков; их структура, особенности экспрессии в ходе клеточного цикла. Субстраты-мишени для активированных cdk – т.наз. «М-киназы» (MPF): H1-гистон, MAP-киназы, MAP-белки, белки ядерной ламины; особенности структуры этих белков и их фосфорилирования для осуществления перехода из G2- в M-фазу. Субстраты-мишени “Start kinase” (определенные комплексы циклин-cdk) необходимые для перехода из G1- в S-фазу: Rb-белок, s6 и некоторые факторы, участвующие в репликации ДНК.Особенности этапов фосфорилирования Rb-белка; высвобождение фактора транскрипции E2F; его роль в усилении транскрипции генов необходимых для осуществления S-фазы, а также экспрессии гена циклина Е, последующего образования активного комплекса циклин Е-cdk2, необходимого для преодоления точки перехода (R1) из G1- в S-фазу; роль комплекса циклин А-cdk2 в инактивации фактора E2F.
Протеолиз и регуляция клеточного цикла. Деградация циклина В обеспечивает необратимый переход от метафазы к анафазе. Структура протеосом (26S комплексы); убиквитин, его структура, селективно-сигнальная роль убиквитина при его связывании с белком, впоследствии подвергающемся деградации в протеосоме. Убиквитин-активирующие ферменты. “Destruction box” – особый мотив в молекуле циклина В, распознаваемый убиквитином. АРС-комплексы, их структура и состав, роль АРС-комплексов в убиквитинилировании циклинов В в мета- анафазе и циклинов в G1-фазе.
Общая схема молекулярных механизмов, участвующих в регуляции клеточного цикла млекопитающих.
Генная инженерия
Основные понятия генной инженерии: клонирование, трансформация, вектор. Основные свойства векторов, используемых в генной инженерии. Векторы замещения. Инсерционные векторы.
Векторы на основе плазмид. Участок ori, селективные маркеры, полилинкер. Система селекции с использованием альфа цепи бетта-галактозидазы. Компетентные клетки. Сравнительная характеристика различных штаммов. Бактериофаг М13. Эффективность трансформации, ее зависимость от длины плазмиды. Векторы на основе фага лямбда. Векторы ВАС, РАС, YAC. Области применения рассматриваемых векторов.
Система модификации-рестрикции бактерий. Рестриктазы второго типа. Изошизомеры. Другие ферменты, используемые в генной инженерии: ДНК-лигазы, ДНК-полимеразы, полинуклеотидкиназа фага Т4, фосфатазы. Способы встраивания чужеродной ДНК в вектор. Геномные клонотеки. Представительность клонотеки, минимальное число анализируемых клонов.
Анализ нуклеиновых кислот с помощью электрофореза. Разрешающая способность геля. Агарозные и акриламидные гели. Методы визуализации нуклеиновых кислот в геле. Конформация молекул нуклеиновой кислоты при электрофорезе. Денатурирующий электрофорез. Капиллярный электрофорез. Импульс-электрофорез.
Плавление ДНК. Температура плавления, интервал плавления. Гибридизация. Примеры «+» и «-»-гибридизации. Мембраны для иммобилизации нуклеиновых кислот. Получение ДНК- и РНК- зондов для гибридизации, Саузерн- и Нозерн-гибридизация. Использование изотопов и флюоресцентных красителей. Создание геномных клонотек, покрывающих геном. Скрининг геномных клонотек.
Картирование. Физические карты, генетические карты. Масштаб физической и генетической карты. Рекомбинационные единицы. Клонотеки, представляющие отдельные хромосомы. "Шаги" и "прыжки" по хромосоме. Энциклопедии генов.
Определение последовательности нуклеотидов. Метод полимеразной достройки ДНК с использованием модифицированных нуклеотидов-терминаторов (метод Сэнгера), метод специфической химической модификации оснований с последующим расщеплением ДНК (метод Максама-Гильберта). Автоматическое секвенирование. Определение последовательностей нуклеотидов длинных фрагментов ДНК.
Полимеразная цепная реакция. Области применения. Основные параметры реакции. Термостабильные ДНК-полимеразы.
Подходы к картированию геномов высших эукариот. Полиморфизм длины рестрикционных фрагментов (RFLP), ДНК-маркирующие сайты (STS). Различные нуклеотидные повторы и их использование для картирования. Микросателлитные маркеры. Геномная дактилоскопия. Определение полной последовательности нуклеотидов организмов. Программа «Геном человека».
Создание клонотек кДНК. Методы скрининга клонотек кДНК: гибридизация нуклеиновых кислот, иммунологическая детекция специфических антигенов, гомологичная рекомбинация, отбор по продуцированию биологически активных молекул. Определение точки начала транскрипции. Метод «футпринтинга».
Основы биоинформатики: сравнение последовательностей нуклеотидов, сравнение последовательностей аминокислотных остатков. Гомология. Идентификация функциональных областей генома на основе нуклеотидного состава. Базы данных. Знание полной последовательности нуклеотидов генома: что это дает?
Клонирование новых генов. Открытые рамки считывания. Переход к последовательности аминокислотных остатков. Анализ экзон - интронной структуры. Определение хромосомной локализации. Поиск регуляторных элементов. Предсказание функции клонированного гена по первичной структуре.
Позиционное клонирование. Ген-кандидат. Анализ сцепления. Генетические маркеры. Прямая и непрямая генная диагностика.
Генная инженерия высших эукариот. Модельные организмы. Генная терапия: задачи, подходы, векторные системы. Дополнительная и заместительная генная терапия. Гомологичная рекомбинация. Регуляция экспрессии внесенных генов. Морально-этические проблемы генной терапии. Оценка и возможное уменьшение биологического риска, связанного с созданием и распространением рекомбинантной ДНК.
Получение продуцентов интересующих белков. Векторные системы. Способы оптимизации продуцентов. Выделение и очистка слитных белков. Получение белков в активной форме. Посттрансляционная модификация.
Взаимосвязь генов в клетке. Генные сети. Методы изучения экспрессии генов. Подходы к изучению экспресси генов на уровне целой клетки. Array, EST. Проблемы интерпретации полученных результатов.
Протеом.
Молекулярные основы наследственной патологии
Анализ генома
Геном человека. Различные уровни анализа генома: цитогенетический, молекулярно-цитогенетический, молекулярно-биологический. Хромосомный набор, морфология хромосом. Дифференциальная окраска хромосом (G-, C-, R-, Q-, T-, Ag-). Анализ хромосом на разных стадиях митоза: метафазные хромосомы, раннеметафазные хромосомы, прометафазные хромосомы, профазные хромосомы. Гетерогенность G-окраски гомологичных хромосом на разных стадиях митоза. Молекулярная организация хромосомы: нуклеосомная упаковка ДНК, хроматиновое волокно и его упаковка, петли хроматина, сестринские хроматиды. Взаимосвязь упаковки хроматина и дифференциального окрашивания хромосомы: R-петли, Q-петли, районы прикрепления петель хроматина к каркасу, эухроматин, факультативный гетерохроматин, структурный гетерохроматин
Временные параметры репликации хромосом Хромосомные аномалии - классификация, механизмы и примеры. Численные аномалии хромосом: три- и тетраплоидии, анеусомии: трисомии хромосом 21 (синдром Дауна), 18 (синдром Эдвардса), 13 (синдром Патау), Х (синдромы ХХХ и Клайнфельтера), Y, моносомия Х (синдром Шерешевского-Тернера). Структурные аномалии хромосом: реципрокные и нереципрокные транслокации, робертсоновские транслокации, тандемные транслокации, инсерции прямые и инвертированные, делеции терминальные и интерстициальные, дупликации прямые и инвертированные, кольцевые хромосомы, изохромосомы моно- и дицентрические. Ломкость хромосом - фрагильные участки. Биодозиметрия
Операционные уровни в цитогенетике: светооптический, молекулярный. Молекулярная цитогенетика - методы: флуоресцентная гибридизация in situ, ПЦР на хромосомах, сравнительная геномная гибридизация, спектроскопический анализ хромосом. Операционные уровни в молекулярной биологии: крупные фрагменты ДНК, гены, мРНК, экзоны, нуклеотиды.
Методы анализа ДНК: анализ сцепления, электрофорез в пульсирующем поле, молекулярное клонирование, электрофорез в агарозном геле, ПЦР, методы поиска мутаций, секвенирование. Композиция генома человека: ядерный и митохондриальный геномы. Ядерный геном: гены и генные последовательности, кодирующие и некодирующие ДНК, псевдогены, фрагменты генов, нетранслируемые последовательности, повторяющиеся последовательности. Клиническая цитогенетика и онкоцитогенетика - база картирования генов наследственных заболеваний человека
.
Стратегии картирования генома
Стратегия «Функциональное клонирование»: геноспецифические олигонуклеотиды, специфические антитела, скрининг антител, экспрессионные библиотеки кДНК, функциональная комплементация. Список наследственных заболеваний человека, картированных с использованием этой стратегии.
Стратегия «Позиционное клонирование». Алгоритм исследования. Генетическое картирование, анализ сцепления: генетические маркеры, генетические карты, анализ гаплотипов, генетическое расстояние (сантиморган), кроссинговер, позитивный и негативный лод-балл, мультилокусное сцепление.
Делеционное картирование и клонирование точек разрыва. Микродиссекция и клонирование фрагментов ДНК. Анализ потери гетерозиготности и сравнительная геномная гибридизация. Физическое картирование определенного района, физические маркеры: искусственные дрожжевые хромосомы, клоны на основе вирусной и бактериальной ДНК, радиационные гибриды, хромосомоспецифические ДНК-библиотеки, контиги клонов, флуоресцентная гибридизация на нити ДНК, секвенированные маркерные участки (STS).
Тонкое генетическое картирование: анализ рекомбинаций, неравновесие по сцеплению. Идентификация гена в определенном районе: скрининг кДНК-библиотек с использованием геномных клонов, кДНК селекция, нозерн-блоттинг на панели тканей, зоо-блоттинг, идентификация CpG-островков, экзон-треппинг, компьютерный анализ последовательности: поиск гомологии, предсказание экзонов, поиск мотивов и сигнальных последовательностей, выявление мутаций.
Стратегия «Ген-кандидат»: «позиционно-независимый ген-кандидат», «позиционный ген-кандидат». Усредненные характеристики гена: размеры генов, экзонов, интронов, организация промоторных районов, гены внутри генов, антисмысловые генные последовательности.
ДНК-диагностика - практический подход
Основные типы мутаций: нуклеотидные замены, инсерции, делеции, хромосомные аномалии. Полиморфизмы ДНК (SNP). Методы косвенной ДНК-диагностики: анализ полиморфизма длин рестрикционных фрагментов, анализ полиморфизма микросателлитных последовательностей. Методы прямой ДНК-диагностики: множественная ПЦР, анализ однонитевого конформационного полиморфизма (SSCP), анализ гетеродуплексов (HA), денатурирующий градиентный гель-электрофорез (DGGE), градиентный по температуре гель-электрофорез (TGGE), химическое расщепление неспаренных участков (CCM), энзиматическое расщепление неспаренных участков, белок-усеченный тест (PTT), секвенирование. Анализ функционального состояния ДНК: метилчувствительная ПЦР, метилспецифическая ПЦР, метилспецифический фингерпринтинг. Анализ однородительской изодисомии. Анализ крупных структурных перестроек ДНК: электрофоретический анализ в пульсирующем поле, дозовый блот-гибридизационный анализ. Анализ экспансии тринуклеотидных повторов.
Классификация мутаций по функции: потеря функции, приобретение новой функции, изменение дозы гена. Классификация мутаций по структуре: миссенс-мутации, нонсенс-мутации, мутации сдвига рамки считывания. Мутации сайтов сплайсинга: механизмы возникновения мутаций сплайсинга, донорные и акцепторные сайты сплайсинга, сайты ветвления, криптические сайты сплайсинга. Номенклатура и правила записи мутаций. Характерные мутации при распространенных наследственных заболеваниях.
Молекулярные основы наследственной патологии
Картирование и клонирование генов EXT1 и EXT2 при множественной экзостозной хондродисплазии: синдром Лангера-Гидиона, трихо-рино-фаланговый синдром, множественная экзостозная хондродисплазия, делеция хромосомы 8q24.1, делеция хромосомы 11р12, анализ сцепления, критические рекомбинации, клонирование точек разрыва, делеционное картирование, дозовый блот-гибридизационный анализ, анализ длин рестрикционных фрагментов, контиги космидных клонов, микросателлитные ДНК-маркеры, уникальные ДНК-маркеры, скрининг кДНК-библиотек, 5’- и 3’- RACE, нозерн блоттинг-гибридизация, зоо-блоттинг, анализ ДНК-последовательности по базам данных, определение экзон-интронной организации генов, скрининг и секвенирование мутаций. потеря гетерозиготности и мутации во вторичных хондросаркомах.
Картирование и клонирование генов PAX6 и WT1 при синдроме WAGR. Синдром аниридии, нефробластомы, аномалий мочеполового тракта, умственной и физической задержки развития, изолированная аниридия, изолированная нефробластома, делеция хромосомы 11р13, клонирование точек разрыва, делеционное картирование, контиг космидных клонов. радиационные гибриды, флуоресцентная гибридизация на хромосомах, дозовый блот-гибридизационный анализ, дозовая ПЦР, экзон-интронная организация генов, скрининг и секвенирование мутаций.
Мышечные дистрофии Дюшенна и Беккера: история картирования и клонирования гена, экзон-интронная организация гена, варианты дистрофина в результате альтернативного сплайсинга в различных тканях, делеции гена дистрофина, молекулярная диагностика аномалий гена дистрофина.
Муковисцидоз: история картирования и клонирования гена. экзон-интронная организация гена, частота и спектр мутаций, методы детекции мутаций, гены-модификаторы, влияющие на течение заболевани.
Ретинобластома: история картирования и клонирования гена, экзон-интронная организация гена. белковый продукт гена и его функция. взаимодействие pRB с другими генами в цепи регуляции клеточного цикла, частота и спектр герминальных мутаций, потеря гетерозиготности и мутации в опухоли, функциональная инактивация гена в опухоли, методы детекции мутаций.
Множественная эндокринная неоплазия, типы 2А и 2В, семейный медуллярный рак щитовидной железы и синдром Гиршпрунга: история картирования и клонирования гена RET, экзон-интронная организация гена, белковый продукт гена и его функция, частота и спектр герминальных мутаций при МЭН2А и 2В и медуллярном раке, частота и спектр герминальных мутаций при синдроме Гиршпрунга, структурные перестройки гена RET при папиллярной карциноме щитовидной железы, типы химерных генов на основе RET, приобретение новой функции, методы детекции химерных генов. Создание диагностических протоколов.
Болезни экспансии
Повторяющиеся последовательности генома. Классификация.
Мультигенные семейства: классические генные семейства (рРНК), генные семейства, кодирующие большие консервативные домены (PAX-гены, гомеобоксные гены), генные семейства, кодирующие короткие консервативные мотивы (DEAD-мотив), генные суперсемейства (гены иммуноглобулинов, комплекса гистосовместимости), кластерированные генные семейства (различные формы псевдогенов, глобиновый кластер), РНК-кодирующее генное семейство.
Внегенные повторяющиеся последовательности и мобильные элементы: тандемные повторы: сателлитная ДНК и центромерный гетерохроматин, минисателлитная ДНК (теломерное семейство, гипервариабельное семейство), микросателлитная ДНК, рассеянные повторы: SINE (Alu-повторы), LINE (Kpn-повторы), ME, THE-1, RTLV.
Механизмы возникновения структурной патологии и мутаций в повторяющихся районах генома: проскальзывание неспаренной нити ДНК (репликационное проскальзывание), неравный кроссинговер, неравный обмен сестринских хроматид, генная конверсия.
Примеры генетических заболеваний, связанных с районами повторяющихся последовательностей: вело-кардио-фациальный синдром, синдром Вильямса, синдром Смита-Магениса, азооспермия (DAZ), синдром Шарко-Мари-Тус. Синдром Мартина-Белл, как пример структурной и функциональной патологии: ломкость хромосомы Xq27.3, экспансия CGG-повтора, механизмы, методы ДНК-диагностики, метилирование повтора и промоторной области, область отсроченной репликации и нестабильность микросателлитов, ремоделирование хроматина. Другие болезни, связанные с динамическими мутациями: хорея Гентингтона, болезнь Кеннеди, спино-церебральные атаксии (SCA1-7), миотоническая дистрофия, миоклональная эпилепсия.
Днк-диагностика в онкологии
Двухударная теория канцерогенеза Кнудсона. Онкогены и гены-супрессоры опухолевого роста.
ДНК-диагностика моногенных и дигенных наследственных онкологических заболеваний: р53 и синдром Ли-Фраумени, АРС и семейный полипоз, АТМ и атаксия-телангиоэктазия, BRCA1, BRCA2 и наследственный рак молочной железы, NF1, NF2 и нейрофиброматоз, р16 и наследственная меланома, VHL и синдром фон Хиппель-Ландау.
ДНК-диагностика маркеров неблагоприятного прогноза: гиперэкспрессия/инактивация определенных генов в различных типах опухолей, клинико-биологические типы нейробластомы, молекулярная эволюция рака толстого кишечника и опухолей мозга.
ДНК-диагностика микрометастазов, РТ-ПЦР - как основной метод, определение экспрессии опухолеспецифических маркеров в периферической крови, тирозиназа при меланоме, тирозинкиназа при нейробластоме, цитокератин 19 при раке молочной железы.
Диагностика полиморфизмов ДНК, определяющих риск развития злокачественных новообразований: полиморфизмы гена ароматазы и риск развития рака молочной железы, полиморфизмы андрогенового рецептора и риск развития рака предстательной железы, полиморфизмы генов NAT1, PADPRP и риск развития рака легкого.
Эпигенетическая регуляция экспрессии генов в опухоли: инактивация гена hMLH при карциноме желудка, инактивация генов GSTP1, BRCA1, ER при раке молочной железы, инактивация MGMT, DAP, р16 при раке легкого.
Определение маркеров, свидетельствующих о злокачественном процессе на ранних стадиях, в плазме крови, метилирование р16, Е-кадгерина, BRCA1, мутации р53, потеря гетерозиготности по маркерам хромосом 3р, 9р, 17р, 18q. Исследование генных регуляторных цепей в опухоли. Разработка диагностических протоколов. Эпигенетические механизмы регуляции генной экспрессии и наследственная патология.
Структура хроматина и механизмы ее определяющие, нуклеотидные «сторожевые» районы, метилирование цитозинов, ацетилирование/деацетилирование гистонов, белковые комплексы, осуществляющие модификацию хроматина.
Эффект положения. Классические примеры: мозаичный эффект положения у дрозофилы, аниридия и ген PAX6, цефалополисиндактилия Грейга и ген GLI3, акроцефалосиндактилия и ген TWIST, синдром Ригера и ген PITX2, кампомелическая дисплазия и ген SOX9, Х-сцепленная глухота и ген POU3F4, голопрозэнцефалия и ген sonic hedgehog, XY-реверсия пола ген SRY, эктродактилия и ген DSS1, лице-плече-лопаточная мышечная дистрофия и ген FRG1, азооспермия и ген DAZ, механизмы ЭП, конформация ДНК, деацетилирование гистонов, эухроматиновый домен, гетерохроматиновый домен, время-зависимая экспрессия генов, энхансеры, сайленсеры, инсуляторы, конкуренция за регуляторный элемент, инактивирующий белковый комплекс.
Импринтинг. Определение. Примеры импринтинга: трансплантация пронуклеусов, андрогенетические зиготы, гиногенетические зиготы, пузырный занос, тератома, андроид, гиноид, синдром Шерешевского тернера, делеция хромосомы 15q11.2, синдром Прадера-Вилли, синдром Ангельмана, синдром Миллера-Дикера, синдром ДиДжорджи, синдром «кошачьего крика», болезни экспансии, синдром Видеманна-Беквита, дупликация хромосомы 11р15.5. Моноаллельная экспрессия, метилирование, однородительская изодисомия, импринтированный ген, ген-импринтор, центр импринтинга, потеря импринтинга, глобальное деметилирование, кластеризация импринтированных генов, асинхронность репликации, онтогенетическая регуляция импринтинга, тканевая регуляция импринтинга, повторяющиеся последовательности, нетранслируемая РНК, антисмысловая РНК, метилспецифическая ПЦР, метилчувствительная ПЦР, микросателлитный анализ, инактивирующее влияние структурного гетерохроматина, метилспецифические белки, консервативность импринтинга.
Генная терапия и избранные главы по вирусологии
Генная терапия (ГТ) – новое направление современной биомедицины. Природа заболеваний, являющихся объектом ГТ. Наследственные болезни, обусловленные мутациями или отсутствием существенных генов. Онкологические заболевания, вызванные перестройкой и другими модификациями генома. Молекулярно-биологические и медицинские предпосылки создания и развития ГТ. Геномика. Реализация международного проекта «Геном человека». Достижения в структурно-функциональном анализе нормальных и дефектных генов. Локализация генов. Современные методы выделения и поддержания in vitro клеток человека различной специфичности. Методы создания функционирующих клеток с измененными свойствами. Генетически модифицированные организмы – трансгенные животные. Основные подходы и приемы генной терапии. Перенос и экспрессия целевых генов в тканях больных. Дополнительная и заместительная генная терапия. Гомологичная рекомбинация. Регулируемая экспрессия внесенных генов. Подавление экспрессии активированных онкогенов. Подавление развития инфекционных заболеваний методами ГТ за счет переноса и экспрессии неприродной рекомбинантной ДНК и РНК.
