Курсовая работа по теме: «Биотрансформация органических соединений, как одно из направлений биотехнологии»
| Вид материала | Курсовая |
- Лекция Классификация и изомерия органических соединений, 296.86kb.
- Курс общие вопросы введение. Биотехнология как наука и сфера производства. Краткая, 98.5kb.
- Учебно-тематический план современные методы исследования в органическом синтезе, 20.49kb.
- Тематический план лекций модуля 1 с органической химии для студентов 2 курса фармацевтического, 25.24kb.
- Факультет биотехнологии и биотехники кафедра промышленной биотехнологии Реферат, 1153.97kb.
- Календарно-тематический план лекций по биоорганической химии 1 курс (2 семестр) специальность, 65.41kb.
- Тематический план лекций и самостоятельной работы по органической химии (осенний семестр), 91.46kb.
- 10 класс. Тема урока: «Причины многообразия органических соединений» Тип урока, 145.21kb.
- Самостоятельная работа студентов методические рекомендации по дисциплине сд., 302.18kb.
- Дробот Светлана Сергеевна конспект, 69.15kb.
Федеральное агентство по образованию
Государственное образовательное учреждение
Высшего профессионального образования
Пермский государственный технический университет
Кафедра Химии и Биотехнологии
Курсовая работа по теме:
«Биотрансформация органических соединений, как одно из направлений биотехнологии»
Выполнил:
студент гр.ХТБмЭ-05
Нечаев А.И.
Преподаватель:
Виноградова А.В.
Пермь, 2010
Оглавление
Введение 4
1 Микробиологическая трансформация стероидов 5
1.1 Основные микробиологические превращения стероидов 7
1.1.1 Введение гидроксильной группы. 7
1.1.2 Дегидрогенизация стероидов. 8
1.1.3 Микробиологическое восстановление. 9
1.1.4 Окисление гидроксильной группы в кетогруппу 9
1.1.5 Гидролиз эфиров стероидов. 9
1.1.6 Отщепление боковых цепей стероидов. 10
1.2 Методы проведения процессов микробиологических трансформаций 11
1.3 Пример промышленного использования микробиологических трансформаций 12
1.4 Пути интенсификации микробиологических трансформаций 13
2 Микробиологические трансформации углеводов 14
2.1 Примеры трансформации углеводов 15
3 Микробиологические трансформации гетероциклических соединений 16
3.1 Микробиологическая трансформация производных индола 17
3.2 Микробиологические трансформации производных пиридина 18
Заключение 19
Список используемой литературы 20
Введение
Область синтетического применения микроорганизмов можно условно разделить на два направления:
- Полный биосинтез микроорганизмами важных биологически активных веществ и продуктов (антибиотиков, ферментов, витаминов, стеринов, аминокислот и др.), осуществляемый клетками с помощью компонентов питательной среды;
- Микробиологические трансформации, т.е. совместное использование отдельных химических и микробиологических стадий в многостадийном целенаправленном синтезе лекарственных препаратов и других ценных для народного хозяйства продуктов.
Применение микроорганизмов в качестве носителей активных полиферментных систем, способных переводить экзогенные органические соединения в разнообразные полезные продукты и физиологически активные вещества, основано на том, что они могут осуществлять в одну стадию важнейшие превращения, требующие при синтезе 20 химических стадий. Кроме того, удается легко проводить реакции, трудно или пока совсем неосуществимые методами чисто химического синтеза.
В последние десятилетия ярко продемонстрированы преимущества метода микробиологических превращений перед химическими реакциями: возможность тонких перестроек сложных молекул, удобство и экономичность технологических процессов. Преимущества этих методов особенно ярко проявились в области химии стероидов. Дело в том, что сложность и громоздкость молекул стероидов затрудняет даже незначительные модификации их химическим путем. Микроорганизмы могут осуществлять уникальные реакции в синтезе лекарственных препаратов стероидной природы, а именно 1,2-дегидрирование, 11β-гидроксилирование. Промышленный синтез таких важнейших лекарств, как гидрокортизон, преднизон, преднизолон, дексаметазон стал возможет только после разработки микробиологических способов их получения. Эти препараты широко применяются при лечении тяжелых ревматических заболеваний, бронхиальной астмы, воспалительных процессов и хронических кожных заболеваний.
В последние годы рядом исследований показано, что микробиологические превращения более простых по строению органических веществ, чем стероиды, также представляют практический интерес. Описаны типовые ферментативные и микробные превращения для основных классов органических соединений.
Большинство процессов микробиологической трансформации приводит к незначительной перестройке молекулы субстрата, осуществляемой одним или несколькими ферментами. Однако имеются микробиологические процессы, существенно изменяющие структуру трансформируемого соединения. Общей чертой всех процессов микробиологической трансформации является то, что их результат – изменение молекулярной структуры трансформируемого вещества, а не синтез молекулы de novo.
К микробиологическим трансформациям относится также синтез метаболитов из предшественников, если при этом структура продукта реакции определяется, в основном, структурой молекул предшественников (например, синтез некоторых нуклеотидов из гетероциклических оснований, пентоз и фосфатов).
В настоящее время принята классификация метаболических трансформаций по типу возникновения и отщепления функциональных групп. Основные процессы микробиологической трансформации: окисление, восстановление, декарбоксилирование, дезаминирование, образование гликозидов, гидролиз, метилирование, этерификация, дегедрирование, диспропорционирование, конденсация, аминирование, ацетилирование, амидирование, деметоксилирование, нуклеотидация, галогенирование, деметилирование, асимметризация, рацемизация, изомеризация. [1,2]
1Микробиологическая трансформация стероидов
В области превращений стероидных соединений достоинства биологических катализаторов проявляются наиболее ярко. Долгое время микробиологическая трансформация считалась специфическим методом химии стероидов.
Первые сообщения о трансформации стероидов микроорганизмами появились задолго до того, как было установлено строение основных представителей стероидов. Еще в конце XIX в. было известно, что бактериальная флора кишечника млекопитающих превращает холестерин в копростерин, а холевую кислоту – в дезоксихолевую. К 1913 г. относится открытие полного расщепления холестерина микобактериями. И лишь в 30-х годах, когда была установлена структура основных стероидных гормонов, известных к тому времени, начались попытки применять трансформирующую способность микроорганизмов для препаративного получения этих соединений. В 1948 г. впервые осуществлено введение гидроксильной группы в молекулу стероида микробиологическим путем. Но только после получения 11α-гидроксипрогестерона из прогестерона при ферментации последнего с культурой Rhizopus nigricans микробиологические трансформации стероидов привлекли широкое внимание:
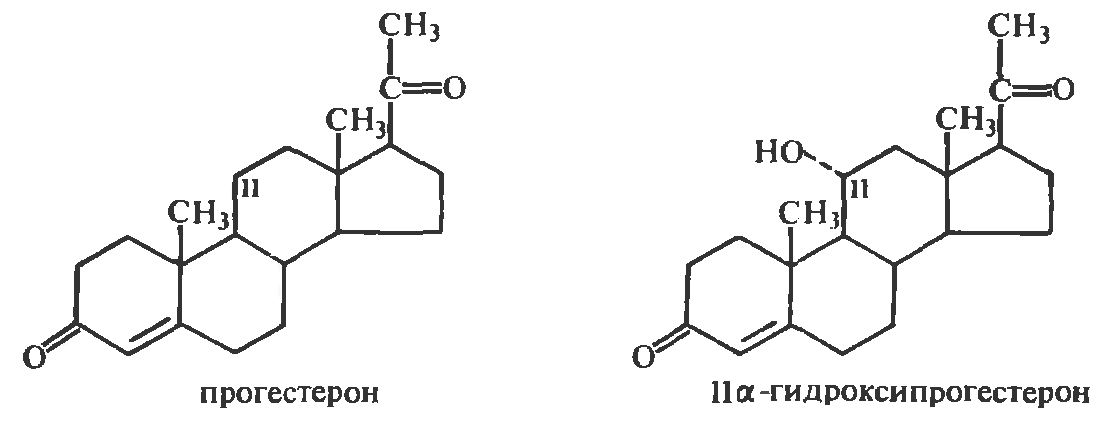
Данная трансформация ярко продемонстрировала преимущества микробиологических методов перед химическими: ведение кислородной функции в определенное положение молекулы стероида (С-11) в случае химического синтеза представляло необычайно трудную задачу и требовало многочисленных химических операций, здесь же оно заменялось единственной стадией ферментативного гидроксилирования. Открытие в эти же годы терапевтической ценности кортизона наряду с указанными успехами микробиологического процесса гидроксилирования привлекло огромное внимание микробиологов, химиков и врачей к данной области. Внедрение микробиологического синтеза в процессы получения стероидных гормональных препаратов вызвало переворот в фармацевтической промышленности, позволив сразу во много раз удешевить ценные препараты.
Природные стерины – сырье для получения ценных лекарственных препаратов.
Большой класс стероидов характеризуется наличием в молекуле специфического циклического скелета – циклопентанпергидрофенфнтрена, построенного из 4х колец, три из которых шестичленные (А, В, и С) и одно – пятичленное (D). Для обозначения различных положений этого кольца принята следующая нумерация. К стеринам (стеролам) относятся стероиды, несущие в положение С-3 гидроксильную группу:
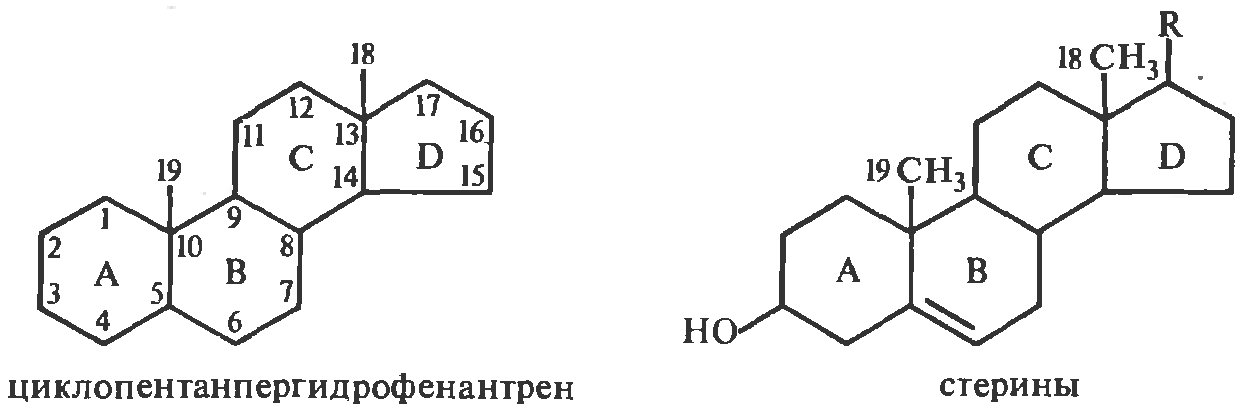
Стерины необходимы для осуществления физиологических и биохимических функций живого организма. Предполагается, что стерины требуются для образования мембранных систем, клеточных оболочек и других структурных образований клетки. Есть данные о том, что стерины являются защитным фактором против токсического действия многих природных соединений.
Основные пути биосинтеза стероидных гормонов из холестерина. В организме животных и человека из холестерина образуются три важные группы гормонов: прогестины, половые гормоны и гормоны коры надпочечников (кортикостероиды). Основные пути биосинтеза этих гормонов показаны на схеме:
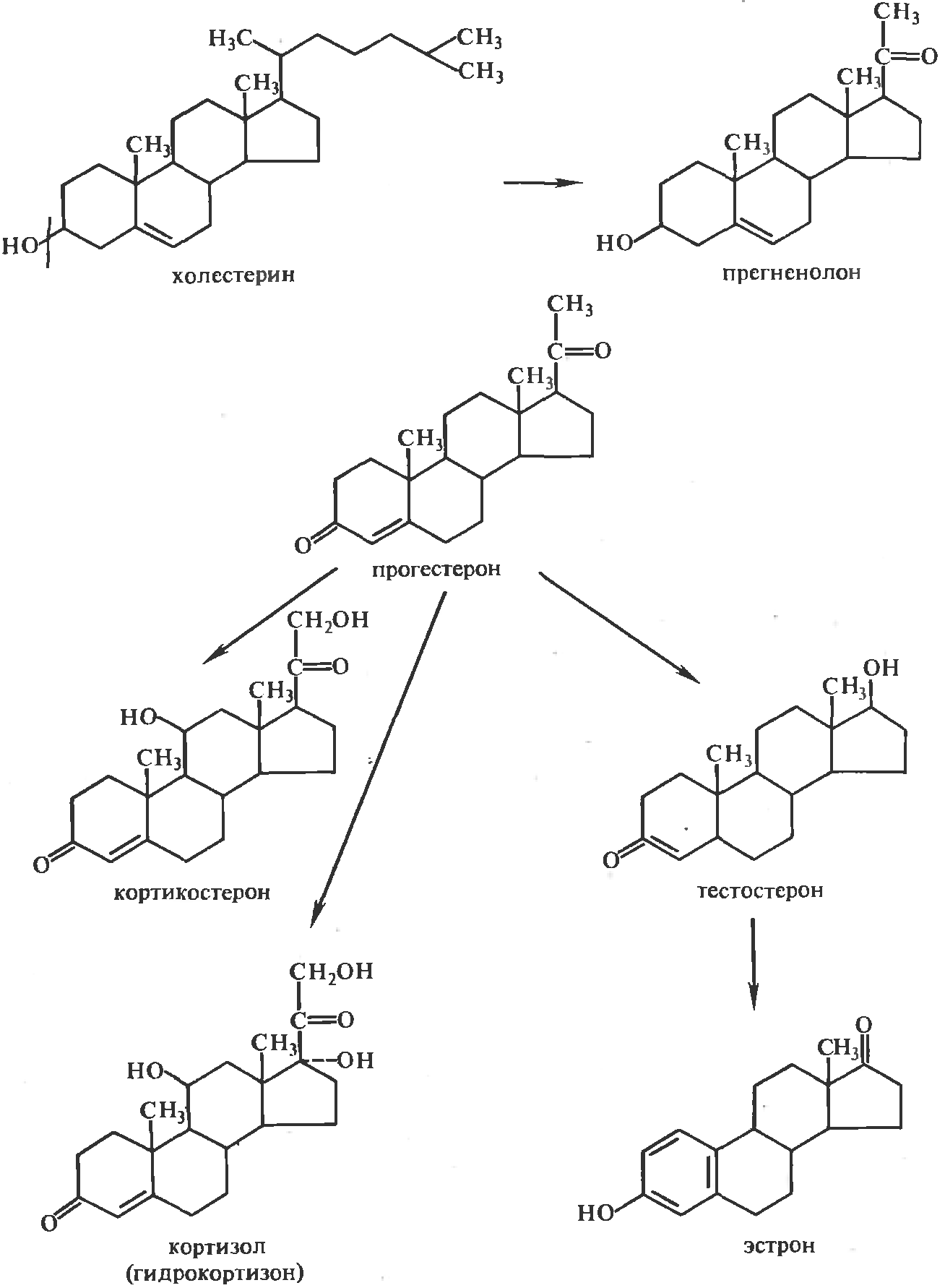
При образовании стероидных гормонов из холестерина сначала образуется прегненолон – основной промежуточный продукт биосинтеза стероидов и кортикостероидов. Окисление 3ОН-группы прегненолона в С=О сопровождается перемещением двойной свяхи; продуктом этой кетостероидизомеразной реакции является прогестерон – гормон плаценты и желтого тела.[3,4]
1.1Основные микробиологические превращения стероидов
Промышленный синтез названных выше ценных лекарственных препаратов стал возможен только с развитием методов микробиологической химии и, в частности, метода микробиологической трансформации. В качестве сырья для получения указанных лекарственных средств используют диосгенин (из растения диоскореи), стигмастерин из соевых бобов, а последние годы интенсивно изучается β-ситостерин ак потенциально дешевый и доступный источник. В таблице приведены некоторые трансформации стероидов, имеющие промышленное значение:
| Реакция | Субстрат | Продукт | Микроорганизм-трансформатор |
| 11α-гидроксилирование | Прогестерон | 11α-гидроксипрогестерон | Rhizopus nigricans |
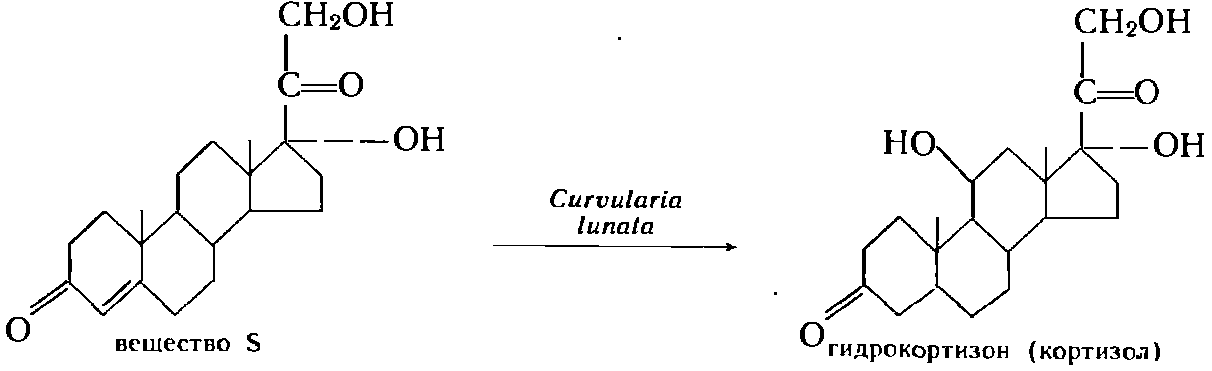
| 11β-гидроксилирование | Вещество S | Гидрокортизон | Carvularia lunata |
| 16α-гидроксилирование | 9α-фторкортизол | 9α-фтор-16α-гидроксикортизол | Streptomyces roseochromogenus |
| 1,2-дегидрирование | Гидрокортизон | Преднизолон | Arthrobacter simplex |
| Расщепление боковой цепи | Β-ситостерин | Андростендион | Mycobacterium spp. |
Модифицированные тем или иным способом стероиды сами могут служить субстратами для проведения соответствующих целенаправленных трансформаций. Так, например, ключевым веществом в синтезе гидрокортизона, кортизона и преднизолона служит вещество S Рейхштейна (4-прегнен-17α, 21-диол-3,20-диом), которое для краткости принято называть «вещество S». Она в свою очередь, является модифицированным продуктом биотрансформации моноацетата «вещества R» (21-ацетат-5-прегнен-3β, 17α, 21-триол-20-он) с помощью культуры Corynebacterium mediolanum:
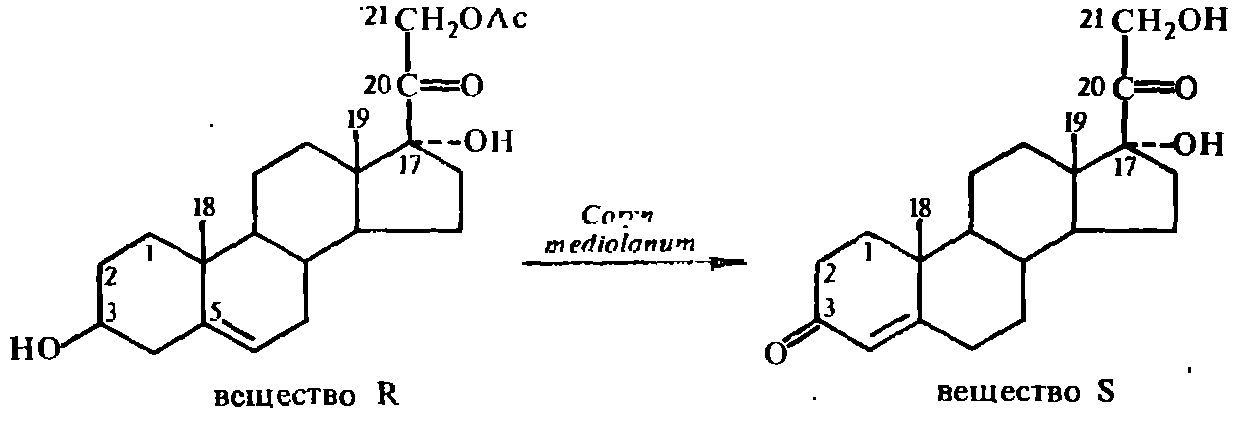
Процесс ферментативного превращения моноацетата вещества R в вещество S Рейхштейна с помощью культуры Соrуп. mediolanum состоит из гидролиза 21-ацетогруппы и окисления 3β-гидроксигруппы в 3-кетогруппу с одновременной миграцией двойной связи из А5 в А4. Трансформация заканчивается практически количественным выходом вещества S Рейхштейна, поскольку для культуры Соrуп. mediolanum нехарактерны реакции расщепления стероидной молекулы. Это имеет принципиальное значение в производстве кортикостероидных препаратов, поскольку стадия получения вещества S Рейхштейна является ключевой и в значительной степени определяет конечный выход готовых продуктов следующих трансформаций.
1.1.1Введение гидроксильной группы.
Микробиологическое гидроксилирование — это наиболее важный и часто применяемый метод. Наличие гидроксильных групп в 3, 11, 16, 17 положениях молекулы стероида, как правило, обусловливает физиологическую активность большинства гормональных стероидных препаратов.
Гидроксилирование стероидов осуществляется очень многими микроорганизмами, чаще всего грибами, даже конидии некоторых грибов обладают гидроксилирующей активностью. Гидроксилирование стероидов при помощи гриба Rh. nigricans — яркий пример сочетания, специфичности и разнообразия действия микроорганизмов.
11α-Гидроксилирование как один из важнейших путей получения кортизона изучено наиболее детально и давно применяется в промышленности, выходы продуктов трансформации очень высоки. Многие микроорганизмы образуют смесь 11α- и l1β-эпимеров, соотношение которых существенно зависит от фазы развития культуры, как было показано в случае гидроксилирования вещества S Рейхштейна грибом Tieghemella orchidis.
Разработан метод получения гидрокортизона культурой Т. orchidis из вещества S Рейхштейна в условиях глубинного культивирования. Наибольшей трансформирующей способностью обладает 17-часовая культура, за 10 ч она трансформирует до 70% вещества S Рейхштейна, выход гидрокортизона при этом составляет 52%.
Наличие в молекуле стероидов 11β-гидроксильной группы обусловливает физиологическую активность гидрокортизона (кортизола) и преднизолона. Гидроксилированию подвергаются субстраты самого различного строения — от производных эстрана до сложных молекул стеринов, сапогенинов и т. п. Причина этого — очень широкая субстратная специфичность гидроксилаз, которую демонстрируют многие микроорганизмы. Так описан штамм Cunninghamella blakesleeana, который вводит оксигруппу в 11β-положение обширного набора стероидов — различных производных эстрана, тестостерона, кортексолона, прогестерона и т. д.
Получение 14α-гидроксипрогестерона при помощи Bacillus cereus является одним из немногих примеров гидроксилирования при помощи бактерий. 15α-Гидроксилирование осуществляется также многими микроорганизмами, основное место среди которых занимают Fusarium и Penicillium.
Главным препятствием, стоящим на пути дальнейшего развития промышленного микробиологического гидроксилирования стероидов, так же как и вообще микробиологических трансформаций этих соединений, является низкая производительность ферментаций, несмотря на высокий процентный выход по субстрату. Это обусловлено, с одной стороны, нерастворимостью стероидных субстратов в воде, с другой — токсичностью растворителей, применяемых при внесении стероида и невозможностью использования высоких концентраций субстрата.
1.1.2Дегидрогенизация стероидов.
Наличие двойных связей коренным образом влияет на физиологическую активность препаратов. Используя эту реакцию, получают такие эффективные препараты, как преднизолон. Чаще всего микроорганизмы дегидрируют положения 1,2 и 4,5, но описано и введение двойной связи в положения 7,8; 8,9; 9,11; 16,17; 17,20. Реакции дегидрогенизации осуществляют бактерии и актиномицеты, особенно часто это микоформы Arthrobacter, Corynebacterium, Nocardia. Широкая субстратная специфичность дегидрогеназ показана на большом экспериментальном материале; она позволяет использовать в качестве субстратов ацетаты стероидов, которые являются полупродуктами во многих технологических схемах получения стероидов. Например, Mycobacterium globiforme 193, дегидрирующая 1,2-связь в кортизоне, так же эффективно превращает и кортизонацетат в преднизонацетат с выходом 86%. Исследование показало, что для этой культуры характерна максимальная удельная трансформирующая активность в период снижения удельной скорости роста.
Реакция дегидрогенизации позволяет получать преднизолон из кортизона, дианабол из метилтестостерона, преднизолон из гидрокортизона. Продукты 1,2-дегидрирования образуются с высокими выходами—до 86%. Распространенность этой реакции объясняется не только наличием соответствующих дегидрогеназ у большого числа микроорганизмов, но и химическими свойствами данного участка стероидной молекулы, ее нестабильностью, особенно при наличии кетогруппы в 3-м положении и (или) двойной связи 4,5. Этими свойствами стероидной молекулы объясняется и доступность связи 1,2 для микробных оксидоредуктаз. Во многих случаях показана обратимость реакций дегидрогенизации и восстановления.
1.1.3Микробиологическое восстановление.
Этот процесс используется в меньшей степени, чем дегидрирование. Он осуществляется главным образом дрожжами и анаэробными бактериями, представителями микрофлоры кишечника млекопитающих, осуществляющими превращение холестерина в копростерин:
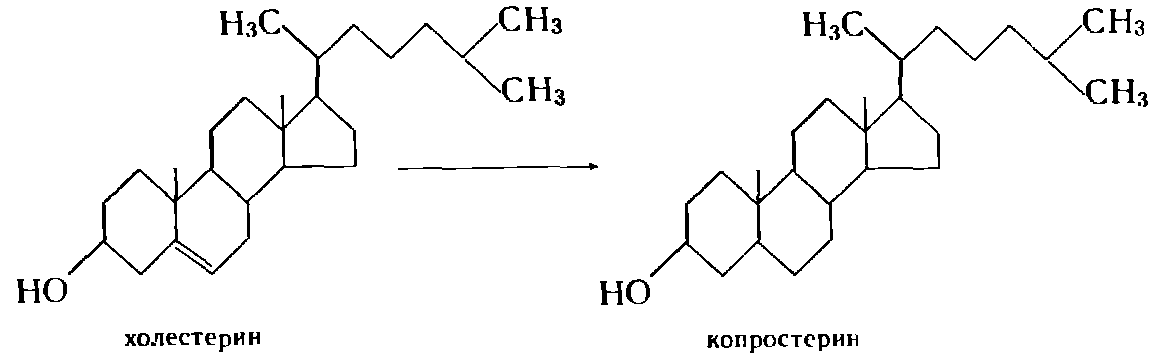
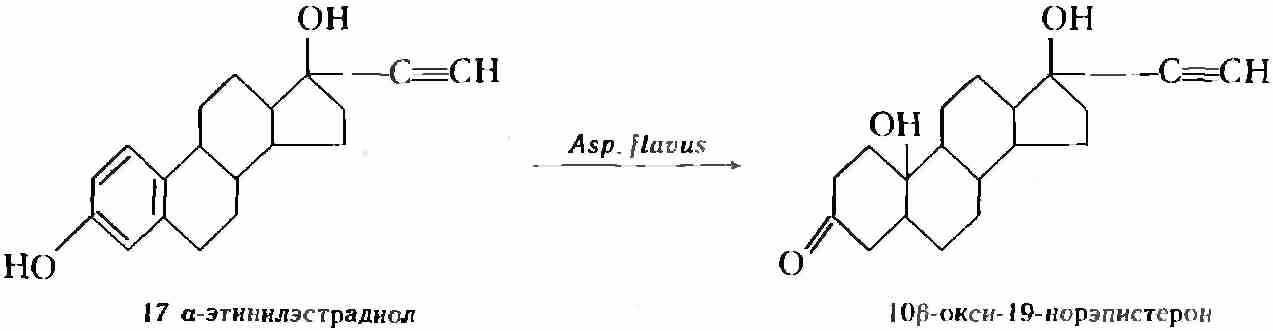
Описаны процессы насыщения двойных связей также и аэробными культурами, широко известными как окислители — актиномицетами, микоформами и даже грибами. Например, культура Aspergillus flavus восстанавливает ароматическое кольцо некоторых стероидов:
1.1.4Окисление гидроксильной группы в кетогруппу
Это одна из наиболее частых реакций, осуществляемых микроорганизмами (бактериями, актиномицетами, грибами). Наибольший практический интерес представляют окислительные превращения гидроксильных групп у 3,17 и 20-го атомов стероидной молекулы. Окисление гидроксила в 3-м положении легко осуществляется у соединений с ненасыщенным кольцом А, а также при наличии двойной связи в положении 4. К этому же типу окислительных превращений относят введение кетогруппы в молекулу стероида.
1.1.5Гидролиз эфиров стероидов.
Проводится с помощью микроорганизмов. Имеет практическую значимость. Ацилированные стероиды являются обычными промежуточными продуктами химического синтеза, в котором используется ацильная защита функциональных групп. Хотя гидролиз ацильной группы легко осуществим химическим путем, он часто приводит к побочным нежелательным продуктам. Микробиологическое расщепление эфирной связи осуществляется представителями различных таксономических групп, в частности флавобактериями. Культура Вас. megaterium обладает специфической активностью по отношению к 1-ацетатам стероидов с диоксиацетоновой цепочкой:
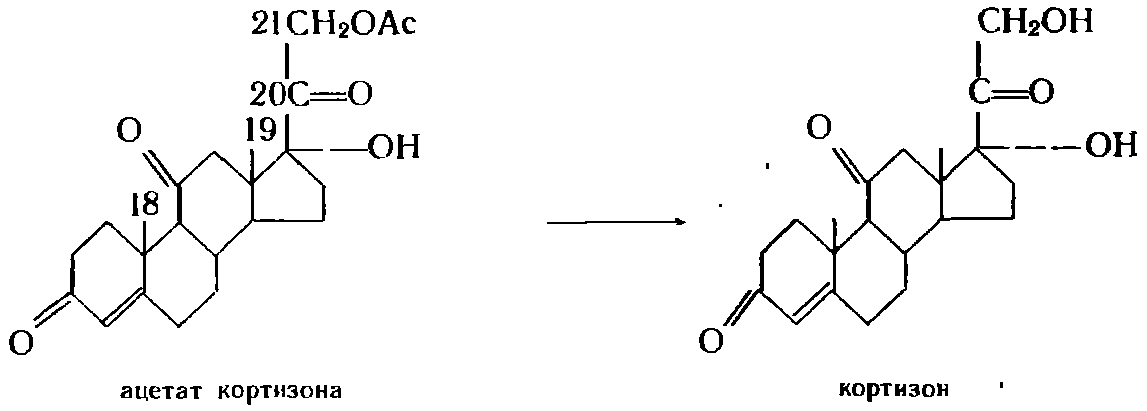
Дезацилирующая способность часто встречается среди микоформ, мукоровых и несовершенных грибов, актиномицетов. Особенность приведенной реакции состоит в том, что она проводится обычно одновременно с другими процессами — гидроксилированием, дегидрогенизацией. Ценность представляют как культуры, избирательно отщепляющие ацильную группу, так и микроорганизмы, способные наряду с гидролизом эфирной связи осуществлять еще какую-либо практически важную реакцию.
1.1.6Отщепление боковых цепей стероидов.
Представляет огромный интерес как путь получения ценных продуктов из относительно дешевых природных стероидов животного и растительного происхождения — стеринов, желчных кислот, сапогенинов.
Возрастающая потребность в производстве стероидных препаратов, а также истощение сырьевой базы делает все более актуальным поиск новых источников сырья. Стоимость диосгенина, получаемого из различных видов диоскореи, за последние годы возросла более чем в 10 раз в результате истощения запасов этих растений. В связи с этим возрос интерес к более доступным природным стеринам.
Основная трудность при использовании фитостерииов заключается в необходимости селективного удаления насыщенной алифатической боковой цепи с сохранением целостности стероидного скелета. Удовлетворительных методов химического расщепления до сих пор не удалось разработать, перспективными считаются лишь микробиологические способы. Однако промышленный интерес представляют только процессы расщепления боковой цепи, не затрагивающие стероидного ядра.
Проблема расщепления боковой цепи стеринов с сохранением стероидного скелета может быть решена следующими способами: 1) синтезом модифицированных стеринов, заместители в кольце А или В которых не позволяют микроорганизмам осуществлять 1,2-дегидрирование или 9α-гидроксилирование; 2) инкубацией стеринов в присутствии соединений, ингибирующих действие ферментов 9α-гидроксилазы или 1,2-дегидрогеназы, 3) получением мутантных штаммов, не способных осуществлять определенные стадии расщепления самого стероидного ядра. Эти три способа, а иногда и их комбинации в сочетании с оптимальными условиями режима ферментации позволили получить из ряда стеринов большой спектр промежуточных соединений, применяемых для химического синтеза высокоактивных стероидных препаратов.[3,4]
1.2Методы проведения процессов микробиологических трансформаций
Несмотря на разнообразие биотрансформаций стероидов, методы проведения микробиологических реакций довольно единообразны. При поисковых работах, где не требуется или нет возможности применять большие количества вещества, ограничиваются проведением реакции в колбах на качалках, загрузка стероида в колбу составляет 100—200 мг. Для загрузок порядка 1—2 г стероида применяют стеклянные ферментеры. В промышленности и на опытных установках применяют стальные аппараты, оборудованные аэрирующими и перемешивающими устройствами.
Собранный стеклянный ферментер стерилизуют и загружают стерильной питательной средой с заранее внесенной в нее в асептических условиях трансформирующей культурой. Особое внимание уделяют соблюдению асептики во всех операциях. Стерилизацию в зависимости от объекта осуществляют автоклавированием питательной среды при 110—120°С в боксах, освещаемых бактерицидными лампами. Операции по загрузке, отбору проб проводят в пламени газовой горелки. Загрузка питательной среды в ферментер, как правило, осуществляется передавливанием стерильным сжатым воздухом. Время роста культуры микроорганизма-трансформатора определяется появлением максимальной трансформирующей активности и может колебаться от нескольких часов для одних культур до нескольких суток для других. Для многих культур-трансформаторов характерна максимальная трансформирующая активность в период снижения удельной скорости роста культуры.
Растворимость стеринов в воде очень низка. В настоящее время стерины, предназначенные для окисления, в небольшой концентрации (порядка 1 г/л) вносят растворенными в малотоксичном, смешивающемся с водой растворителе (ацетоне, спирте, диметилформамиде). При более высоких концентрациях стеринов (выше 1 г/л) их вносят в среду в виде мелкоизмельченной пудры; для этого кристаллы стерина растирают в специальной аппаратуре или разрушают ультразвуком.
Другой способ внесения стеринов для биотрансформации состоит в том, что стерин, например β-ситостерин, растворяют в смеси гептан/этиленхлорид, добавляют при перемешивании воду и отгоняют растворитель нагреванием смеси до 95°С. При таком методе концентрация ситостерина в водной суспензии может достигать 140 г/л.
Трансформация стеринов микроорганизмами основана на их использовании в качестве источника углерода, поэтому стимуляция роста трансформирующих штаммов должна приводить к увеличению выхода продуктов расщепления стеринов. Процесс стимулируется насыщением среды кислородом. Добавление в питательную среду некоторых масел в количестве 1—3 мас.% (соевого, арахисового, рапсового, оливкового) повышает выход продукта трансформации. Аналогичные результаты получены с применением глицеридов животного и растительного происхождения (тристеарин, триолеин, трипальмитин). Механизм стимуляции роста глицеридами, вероятно, состоит в устранении гидрофобности стеринов, т. е. глицериды действуют так же, как неионные ПАВ (твин), обычно применяемые для микробиологических процессов трансформации. Температурный режим микробиологических трансформаций стероидов не отличается от принятых для других микробиологических процессов и составляет 24—33°С. Условия рН определяются при отборе штамма культуры-трансформатора и колеблются в широком интервале.
Микробиологический контроль осуществляется только на стадии выращивания трансформирующей культуры. Аналитический контроль реакции трансформации ведется путем отбора проб через определенные временные интервалы и анализа их методом тонкослойной хроматографии на силуфоле в присутствии «свидетелей» — исходного стероида, целевого продукта трансформации и некоторых промежуточных и побочных продуктов, если они участвуют в данном процессе.
После завершения трансформации культуральная жидкость, отделенная от мицелия (или другой биомассы), экстрагируется несмешивающимся с водой органическим растворителем, пригодным для растворения соответствующего стероида (этилацетат, метиленхлорид или хлороформ). Экстракт, отделенный от водной фазы, проходит требуемую очистку (окрашенные примеси обычно отделяют обработкой с активированным углем, затем уголь отфильтровывают); далее его концентрируют в вакууме и полученный осадок стероида перекристаллизовывают из подходящего растворителя. В препаративных целях при работе с небольшими количествами стероидов очистку продукта трансформации можно проводить методом колоночной хроматографии.
Специфической особенностью процесса микробиологических трансформаций является использование чистых культур микроорганизмов-трансформаторов. Поэтому необходимым условием технологического режима является соблюдение мер для предотвращения развития посторонней микрофлоры. Последняя постоянно присутствует в воздушных потоках, циркулирующих в производственных помещениях, и представлена в основном мезофильными микроорганизмами, оптимальная температура развития которых находится в пределах 24—30°С. Такой же температурный оптимум характерен, как правило, и для микроорганизмов-трансформаторов.
Все операции по подготовке и выращиванию трансформирующих культур проводят в стерильных условиях с соблюдением правил и норм, разработанных и утвержденных для производств микробного синтеза. Однако внесение стероидного субстрата на трансформацию (в растущую на полноценной питательной среде культур при использовании бактерий или в водную суспензию неразмножающихся клеток — в случае применения грибного мицелия) и сам процесс трансформации, как правило, проводят не стерильно. Для уменьшения вероятности загрязнения используют стерильную воду при приготовлении суспензии стероидных субстратов, поскольку сами стероиды обычно неустойчивы в условиях автоклавирования. Одним из вариантов решения этой проблемы может служить способ внесения стероидного субстрата в питательную среду до засева ее трансформирующей культурой в момент, когда температура среды после автоклавирования снизится до 80°С и безопасна для субстрата. После выдержки в течение 30 мин среду со стероидом охлаждают до 33°С и в нее стерильно вносят трансформирующую культуру.
Используют культуру-трансформатор в стадии замедления роста, когда питательные компоненты среды в значительной степени израсходованы, а сильно разросшаяся культура подавляет рост других микроорганизмов. Однако и эти меры не полностью предохраняют трансформационную среду от загрязнения посторонней микрофлорой. В последней могут оказаться виды, способные отрицательно влиять на ход трансформации.[3,5]
1.3Пример промышленного использования микробиологических трансформаций
Получение гидрокортизона (кортизола) из вещества S осуществляется с помощью С. linata. Процесс включает следующие стадии:
1 Выращивание трансформирующей культуры (I стадия) производят путем трех последовательных генераций на питательной среде, содержащей сахарозу, дрожжевой автолизат и сложный набор неорганических солей:

Крышку инокулятора перед засевом обрабатывают водным раствором формалина, аппарат и все помещение облучают бактерицидной лампой и весь процесс выращивания трансформирующей культуры проводят в стерильных условиях. Далее полученная трансформирующая культура поступает в сепаратор, откуда отделенный мицелий в виде водной суспензии передается в ферментер для проведения основной реакции трансформации вещества S.
2 Трансформация вещества S (II стадия) также начинается со стерилизации ферментера и воздушного фильтра водным раствором формалина. Особое внимание уделяется размолу стероида на микромельнице и получению суспензии его в стерильной воде с содержанием стероида 1 г/л. Для предотвращения развития посторонней микрофлоры используется добавка антибиотика. Перемешивание и аэрация осуществляются, как и на предыдущей стадии, так же используются и пеногасители.
3 Выделение продукта трансформации — гидрокортизона (III стадия). Культуральная жидкость вместе с мицелием после II-й стадии поступает на сепарацию. Отделенный мицелий промывается, промывные воды присоединяются к основной культуральной жидкости. Далее производится экстракция-сепарация продукта трансформации из водной среды органическим растворителем. Осветленный активированным углем экстракт подвергается многократному упариванию с различными растворителями, осветлению, снова упариванию досуха и промывке подходящим растворителем. Последние приемы обработки готового технического продукта обычны для технологии получения многих органических веществ и лекарственных препаратов. Получение чистых лекарственных форм гидрокортизона проводится традиционными методами.[3]
1.4Пути интенсификации микробиологических трансформаций
Одним из путей интенсификации процессов трансформации является предварительное индуцирование растущей культуры — трансформатора, соответствующим субстратом или его аналогом. Этот прием связан с индуцированием биосинтеза соответствующих ферментных систем культуры и особенно широко применяется в процессах микробиологической дегидрогенизации.
Наиболее перспективным считается применение закрепленных (иммобилизованных) живых клеток микроорганизмов. Преимущества использования иммобилизованных клеток в технологии очевидно:
отсутствие затрат на выделение и очистку ферментов; более высокая активность и стабильность по сравнению с иммобилизованными ферментами и свободными клетками; уменьшение затрат на выделение и очистку продуктов реакции, так как они изолированы от биомассы и некоторых продуктов обмена; появление возможности создания непрерывных автоматизированных процессов; способность к длительному функционированию полиферментных систем и регенерации кофакторов.[3]
Методы иммобилизации клеток: адсорбция, ковалентное и поперечное связывание, метод включения в различные полимеры, микрокапсулирование. Метод включения, в частности, в целлюлозные волокна или мембраны весьма технологичен и является перспективным для проведения одностадийных процессов. Одним из наиболее экономичных носителей для иммобилизации клеток является каппакаррагинан, полисахарид из морских красных водорослей Rhodophyceae, Ginartinaceae, применяемых как пищевая добавка. Интактные клетки, введенные в гель, интенсивно размножаются на питательной среде и могут многократно использоваться как полиферментные системы.
Включение в альгинатные гели относится к мягким методам иммобилизации, т. е. клетки после иммобилизации остаются жизнеспособными и могут осуществлять полиферментные процессы. Положительным качеством геля является возможность размножения в нем клеток, а также его способность к растворению при изменении рН и температуры, что позволяет выделять жизнеспособные клетки и облегчает изучение их физиологии и морфологии. Во многих случаях включение клеток в альгинат приводит к лучшим результатам по сравнению с каррагинаном.
Преимущества иммобилизованных клеток делают их весьма перспективными, в частности, для трансформации стероидных соединений. Именно стероиды были одними из первых субстратов, которые удалось трансформировать с помощью иммобилизованных клеток. В настоящее время достаточно досконально изучены закономерности процесса трансформации стероидных соединений живыми иммобилизованными клетками, исследованы пути направленного изменения ферментативной активности и ее стабилизации. В нашей стране впервые осуществлены следующие процессы трансформации стероидных соединений с помощью живых иммобилизованных клеток микроорганизмов: 1,2-дегидрирование, 1,2-восстановление, 20-восстановление (Arthobacter glo-biforme), стереоспецифическое 17β-восстановление (Sacch. cere-visiae), 20α- и 20β-восстановление (В. megaterium), 11α- и 11β-гидроксилирование (Tieghemella orchidis).[2]
2Микробиологические трансформации углеводов
Углеводы являются естественными и основными, почти универсальными субстратами для большинства микроорганизмов. Ферментативное превращение углеводов дает преобладающему большинству микроорганизмов энергию и материал для построения внутриклеточных структур.
Микроорганизмы при контакте с углеводами могут осуществлять необычайно широкий набор реакций. Ферментативное воздействие на углеводы характеризуется особенной интенсивностью, что обусловливает и обеспечивает рентабельность многих микробиологических трансформаций углеводов. Наконец, для многих микроорганизмов характерно накопление больших количеств продуктов частичного превращения углеводов в обычных условиях культивирования. Уксуснокислые бактерии, некоторые грибы и псевдомонады очень хорошо служат практическим целям трансформации углеводов. Все это обусловило использование ферментативной активности микроорганизмов для препаративного получения многих производных углеводов.
Превращения углеводов, осуществляемые микроорганизмами, можно разделить на несколько основных типов: окислительные трансформации углеводов (окисление полиолов, получение альдоновых кислот), восстановление углеводов и изомеризация углеводов.
Окислительные трансформации углеводов распространены очень широко и детально изучены, особенно подробно изучен и имеет промышленное применение процесс окисления полиспиртов (полиолов).
Окисление полиолов впервые описано в классических работах Брауна (1886) и Бертрана (1896); было проведено окисление маннита в фруктозу и сорбита в сорбозу в помощью микроорганизмов Acetobacter aceti и Acetobacter xyltnum. Позднее были обнаружены культуры, которые ведут этот процесс намного
интенсивнее (Acetobacter suboxydans). Окислению подвергаются все полиолы, обладающие двумя вторичными гидроксилами в цис-положении, прилежащими к терминальной первичной спиртовой группировке, причем окисляется атом углерода, смежный с терминальным. Это явление получило название правила Бертрана—Хадсона по имени первых его исследователей: было установлено, что Ac. suboxydans окисляет лишь структуры, где упомянутые два гидроксила имеют D-конфигурацию. Долгое время считалось, что это свойство Ac. suboxydans, однако позже было установлено, что эта закономерность сохраняется для других микроорганизмов.
Окисление полиспиртов в кетозы получило название процесса кетогенной ферментации. В основе всех этих процессов лежит следующая реакция:
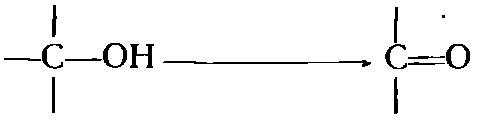
Продукт реакции определяется исходным субстратом и специфической ферментной системой используемых культур микроорганизмов.[3,6]
2.1Примеры трансформации углеводов
В промышленном масштабе применяются два процесса окисления полиолов: 1) превращение глицерина в диоксиацетон и 2) превращение D-сорбита в L-сорбозу. Особый интерес представляет окисление D-сорбита в L-сорбозу, как одна из стадии синтеза аскорбиновой кислоты.
Превращение глицерина в диоксиацетон происходит в соответствии со следующей схемой:
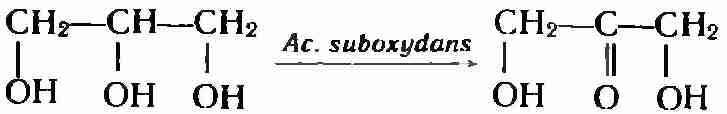
Диоксиацетон — ценное органическое соединение, широко применяемое в медицине, парфюмерной и фармацевтической промышленности. В последние годы его получают из глицерина методом микробиологического окисления с помощью клеток Ac. suboxydans. Разработан метод с многократным использованием неразмножающихся клеток (в том числе иммобилизованных в гелях) в среде, содержащей глицерин, монокалийфосфат и 10% по объему дрожжевой воды (концентрация дрожжей 10%), процесс идет при 28°С в течение 36 ч.
Главное требование этих ферментации — высокое содержание кислорода в растворе, питательная среда должна содержать витамины В комплекса, водный экстракт пекарских дрожжей, дрожжевой автолизат, кукурузный экстракт и СаСОз для нейтрализации.
Превращение D-сорбита в L-сорбозу происходит в соответствии со следующей схемой:

В производстве применяется метод глубинного культивирования. Инокулят — суспензия клеток Ac. suboxydans — выращивается на среде, включающей сорбит, глюкозу, дрожжевой экстрат и СаС03. В 15—20%-ные растворы D-сорбита, содержащие трансформирующую культуру и необходимые для ее роста витамины, пропускают воздух через распылительные системы. При t = 30°С через 24 ч L-сорбоза получается с 93%-ным выходом в растворе.
В конце процесса ферментации раствор, содержащий сорбозу (культуральную жидкость), обесцвечивается активированным углем, фильтруется, затем еще раз фильтруется на фильтр-прессе; фильтрат концентрируют в вакууме до сиропообразной массы, которая кристаллизуется при 15°С. Кристаллы отделяют центрифугированием, промывают ледяной водой и сушат. Вторая порция L-сорбозы получается из маточника и промывается.
Весьма успешной была попытка применить для непрерывной трансформации сорбита двухстадийную систему; получен 96%-ный выход L-сорбозы при 20% сорбита в исходной среде.
Дальнейшее совершенствование этих процессов связано с сокращением времени инкубации и повышением эффективности самого процесса.
Сейчас значительное внимание уделяется исследованиям возможности проведения окислительных трансформаций клетками уксуснокислых бактерий, иммобилизованными в геле. Показана способность иммобилизованных клеток Gluconobacter oxydans окислять глицерин в диоксиацетон. Кроме того, эти иммобилизованные клетки окисляют многие углеводы, например маннозу, арабинозу, и такие спирты, как рибит, маннит, сорбит. Однако отмечается значительное снижение скорости окислительных процессов при использовании иммобилизованных в гелях клеток.[3,4]
3Микробиологические трансформации гетероциклических соединений
Биохимическая активность микроорганизмов широко используется и для превращения некоторых гетероциклических соединений, в частности соединений индольного ряда. Среди индольных соединений особый интерес представляют продукты метаболизма триптофана: триптамин, серотонин, их замещенные аналоги, а также триптофол и индолил-3-уксусная кислота. Эти соединения играют важную роль в процессах обмена веществ и интенсивно исследуются с биохимической и медицинской точек зрения.
Пути метаболизма триптофана и его производных микроорганизмами изучены довольно полно, работы же по трансформации соединений индольного ряда немногочисленны.
3.1Микробиологическая трансформация производных индола
Эти трансформации представлены в основном гидроксилированием. Так, главным продуктом окисления индолил-3-уксусной кислоты (ИУК) грибами Claviceps purpurea является 5-оксиин-долил-3-уксусная кислота:

ИУК гидроксилируется грибом Asp. niger в положении 5. Однако при проведении трансформации этим грибом всего ряда индолилжирных кислот — индолил-3-пропионовой, индолил-3-ва-лериановой, индолил-3-капроновой, индолил-3-энантовой — не были обнаружены соответствующие 5-оксипроизводные, что свидетельствует о специфичности его гидроксилирующей системы.
Была изучена и схема превращения триптамина грибами Asp. niger.

Как видно из схемы, начальным этапом превращения Триптамина является реакция дезаминирования. Продукт этой реакции — индолил-3-уксусный альдегид выделить не удалось. Одновременное образование ИУК и триптофола дает возможность предположить, что индолил-3-ацетальдегид подвергается реакции дисмутации, окисляясь до кислоты и восстанавливаясь до спирта. Следующий этап — окисление ИУК с образованием 5-оксииндолилуксусной кислоты и неидентифици-рованного индола. Эти соединения были получены и при трансформации кристаллической ИУК. Дальнейшее превращение не обнаружено. Видимо, таким путем микроорганизмы проводядетоксикацию гетероауксина. 5-Гидроксилирование индольной молекулы большим числом культур Asp. niger и Asp. awamori говорит о широком распространении этой реакции среди грибов. Процесс легко осуществляется на обычных питательных средах в сравнительно короткий срок. Это дает возможнось использовать гидроксилазную активность грибов для синтеза труднодоступных 5-оксииндолов. Asp. niger осуществляет также окислительное дезаминирование N-замещенных аналогов триптамина. Процессу предшествует отщепление замещенных групп, что увеличивает время ферментации. Продуктами превращения являются 5-оксииндолилуксусная кислота и неидентифицированная индольная оксикислота.
3.2Микробиологические трансформации производных пиридина
Никотиновая кислота и ее амид (витамин РР или В5) обычно получают химическим синтезом, однако уже разработаны пути микробных трансформаций соответствующих субстратов:
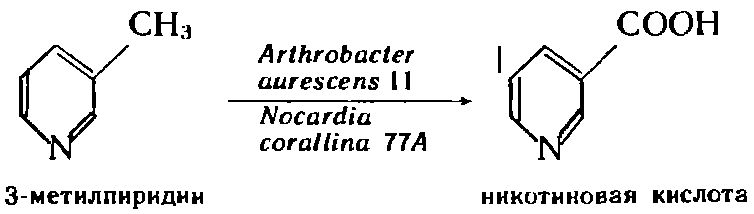


Методом последовательной индукции было установлено, что происходит окисление субстратов. Так, превращение 3-метил-пиридина культурой Nocardia происходит через стадию образования соответствующего спирта (3-оксиметилпиридина):
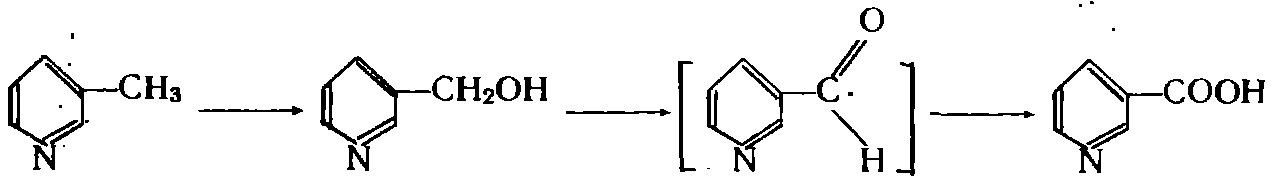
З-Оксиметнлпиридин окислялся клетками и бесклеточными экстрактами культуры N. corallina, выращенной на любых источниках роста. Видимо, окисление спирта осуществляется обычными дегидрогеназными системами.
Хотя эти процессы еще не нашли промышленного применения, можно утверждать, что и в этом случае разработка соответствующей технологии приведет к замене, хотя бы частичной, химической трансформации на микробиологическую.[3,4,5]
Заключение
Микроорганизмы способны осуществлять реакции трансформации (изменение отдельных участков в молекулах органических веществ), превращая те или другие соединения в новые продукты. Условия протекания этих реакций мягкие, и во многих случаях микробиологические трансформации предпочтительнее химических.
Пример существующих крупномасштабных промышленных биоконверсий - производство уксуса из этанола, глюконовой кислоты из глюкозы. Широко используется микробная модификация стероидов, которые являются сложными полициклическими липидами. Теперь с использованием биоконверсии получают кортизон, гидрокортизон, преднизолон и целый ряд других стероидов. Применение и совершенствование микробной технологии в сотни раз снижает себестоимость производства стероидов.
В отличие от процессов биосинтеза и брожения, в которых участвует большое количество ферментов, в микробиологической трансформации обычно работает один определенный фермент, катализирующий окисление, декарбоксилирование, метилирование или какую-либо другую реакцию. Чтобы провести трансформацию какого-либо вещества, вначале размножают культуру соответствующего микроорганизма до количества, равного 5-10% объема трансформируемого раствора. Раствор для трансформации вещества готовят, учитывая, что в нем надо растворить максимально возможное количество трансформируемого вещества (обычно 10-25%) и надо использовать минимальное количество необходимых для развития культуры питательных солей, в таком виде, чтобы не было затруднено химическое выделение вещества. Если трансформируемое вещество не растворяется в воде, его предварительно растворяют в нейтральном органическом растворителе и затем, при интенсивном перемешивании, смешивают с основной средой. Трансформацию ведут в стерильных условиях при оптимуме рН, температуры и других условий. Длительность процесса обычно 1-2 суток. После микробиологической трансформации следует химическое выделение вещества из раствора.
Список используемой литературы
- chnolog.ru/prombt/prombt2_4.htm
- Бирюков В.В. Основы промышленной биотехнологии – М.: КолосС, 2004. – 296 с.
- Микробиологическое производство биологически активных веществ и препаратов/ Быков В.А., Крылов И.А., Манаков М.Н. – М.: Высш. шк., 1987. – 143 с.
- Комов В.П. Биохимия/ В.П. Комов, В.Н. Шведова. – М. Дрофа, 2004. – 638 с.
- Гусев М.В. Микробиология/ М.В. Гусев, Л.А. Минеева. М.: Изд-во Моск. ун-та. 1992. 376с.
- Шлегель Г. Общая микробиология/ Г. Шлегель. М.: Мир. 1987. 303с.
