Закон и Периодическая система химических элементов Д. И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки
| Вид материала | Закон |
- Закон Д. И. Менделеева и периодическая система элементов, 563.34kb.
- Д. И. Менделеева и периодическая система элементов Периодический закон, 366.84kb.
- Закон и периодическая система химических элементов Д. И. Менделеева" Значение и место, 131.75kb.
- Закон и периодическая система Д. И. Менделеева, 30.82kb.
- Тема урока: «Периодический закон и периодическая система химических элементов, 266.68kb.
- Урок а «Периодический закон и периодическая система химических элементов Д. И. Менделеева.», 106.31kb.
- Урока «периодический закон и периодическая система химических элементов д. И. Менделеева», 105.86kb.
- Химических элементов д. И. Менделеева. 8 Класс, 47.65kb.
- Химическая конференция (к 176-летию со дня рождения Д. И. Менделеева), 204.32kb.
- Лекция 3-2009 Электронная структура атомов и периодическая система элементов, 217.47kb.
Периодический закон и Периодическая система химических элементов Д.И.Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
К 60-м годам XIX века химическая наука накопила огромный опыт, как в области практики, так и теории. Однако общего закона, связывающего свойства простых и сложных веществ с какой-либо понятной и доступной характеристикой атома еще не существовало.
Первым среди многих ученых, пытавшихся подвести единую базу под классификацию известных химических элементов, был Д.И. Менделеев. Взяв за основу атомную массу элемента, он выявил закономерности в изменении свойств веществ. Современная формулировка этого закона, учитывающая то, чего еще не мог знать Д.И. Менделеев, а именно, строения атома, звучит так: свойства элементов, а также формы и свойства, образуемых ими простых веществ и соединений, находятся в периодической зависимости от величины заряда их атомных ядер.
Вспомним, что именно ядро состоит из наиболее тяжелых элементарных частиц (протонов и нейтронов), и значит практически вся масса атома сосредоточена в ядре. При переходе от предыдущего атома к последующему в ядре атома увеличивается на единицу число положительно заряженных протонов. Вместе с этим возрастает и масса атома. Заряду ядра соответствует порядковый номер элемента в таблице, который указывает на число протонов в ядре и число электронов вокруг него.
Важно, что Д.И. Менделеев открыл периодическую повторяемость химических свойств элементов и включил их в соответствующие группы. Эта периодическая повторяемость обусловлена повторяемостью в строении внешнего электронного уровня. Например, все металлы IA - группы имеют один s-электрон, а неметаллы VIIA - группы два s- и пять р-электронов на внешнем уровне.
Современная система химических элементов (периодическая таблица) состоит из семи периодов (трех малых, трех больших и одного большого незаконченного). Они располагаются по горизонтали и разложены на ряды. По вертикали в таблице расположены восемь групп, каждая из которых делиться на две подгруппы: главную (А) и побочную (В).
Тем самым каждый химический элемент имеет в этой таблице свои конкретные координаты. Например, сера S находится в VIA - группе 3 периода.
Закономерности в изменении свойств элементов выглядят следующим образом.
Слева направо в каждом периоде ослабевают металлические и усиливаются неметаллические свойства. Последним элементом в каждом периоде стоит атом благородного (инертного) газа (s2р6-элемент).
Напомним, что под неметаллическими свойствами атома химического элемента мы понимаем его стремление к приобретению электронов (т.е. способность выступать окислителем), а под металлическими - способность отдавать электроны, т.е. окисляться и выступать в роли восстановителя.
В группах сверху вниз возрастают именно металлические свойства. Таким образом, самым активным металлом является франций, а самым активным неметаллом - фтор.
В группах находятся химические элементы со сходными свойствами, т.е. со сходным строением атома (одинаковое количество валентных электронов). Их максимальная валентность в соединениях равна числу этих валентных электронов. В периодах валентность атомов возрастает слева направо на единицу при переходе от предыдущего атома к последующему.
Благородные газы образуют самостоятельную VIIIA - группу, которая позже других появилась в таблице (после открытия этих газов в начале ХХ века).
Важно знать, что изменение свойств элементов по периоду происходит постепенно, и определяющим является заряд ядра.
Умелое пользование таблицей химических элементов позволяет правильно составлять формулы сложных соединений, сравнивать и оценивать свойства элементов, рассчитывать молекулярные массы веществ, устанавливать состав атомов и ядер.
Значение периодического закона для развития науки:
Этот закон:
- дает целостное представление о взаимосвязи строения атомов и их свойств;
-объясняет причины схожести и индивидуальности в химическом поведении простых и сложных веществ;
-показывает периодическую зависимость свойств простых и сложных соединений от строения атомов.
В прошлом этот закон позволил предвидеть открытие многих новых элементов и предсказать их основные физические и химические свойства.
Строение атомов и закономерности в изменении свойств
химических элементов на примере: а) элементов одного периода;
б) элементов одной А – подгруппы.
Порядковый номер химического элемента показывает численное значение заряда его ядра (т.е. число протонов в ядре), а также общее число электронов, движущихся около ядра.
Каждый следующий по порядку атом имеет на один протон больше в своем ядре и на один электрон больше в своей электронной оболочке. При движении по периоду слева направо с ростом заряда ядра атома уменьшается его размер и возрастает энергия связи электронов с ядром. Это проявляется в том, что металличность элемента (способность отдавать свои валентные электроны) снижается, и одновременно возрастает стремление атома к присоединению электронов (т.е. его неметалличность).
В 4-м периоде эта закономерность наблюдается от калия до брома. Электронные формулы некоторых элементов из этого периода:
+19 К 1s22s22р63s2Зр6Зd04s1(самый активный металл 4-го периода)
+32 Ge 1s22s22р63s2Зр6Зd104s24p2 (амфотерный элемент)
+35 ,Вг 1s22s22р63s2Зр6Зdl04s24р5 (самый активный неметалл 4-го периода)
+36 Кr 1s22s22р63s2Зр6Зdl04s24р6 (благородный газ) "
(подчеркнуты валентные электроны)
Постепенное заполнение электронами внешнего энергетического уровня закономерно меняет свойства атома от металлических к неметаллическим. Снижается восстановительная и возрастает окислительная способность атомов.
В группах сверху вниз с ростом размера атома осла6евает энергия связи его электронов с ядром, т.е. растет восстановительная способность атома (металличность), а снизу вверх усиливается окислительная способность.
Например, такая закономерность видна в IV А - группе:
от металла свинца (РЬ) к неметаллу углероду (С).
В группах объединены элементы, имеющие сходное строение атома "на уровне внешнего электронного слоя. Так, и у атома углерода, и у атома свинца внешняя электронная оболочка содержит четыре электрона (два s- и два р-электрона).
+6 C 1s22s22p2
+82 Pb …6s26p2
В периоде характер оксидов элементов меняется от основного (К2О, СаО) к кислотному (SеОз), а в группах сверху вниз ослабевает кислотный характер оксидов.
Виды химической связи: ионная, ковалентная (полярная, неполярная); простые и кратные связи в органических соединениях.
Образование и существование в природе простых и сложных веществ было бы невозможным, если бы между образующими их химическими частицами (атомами или ионами) не было бы сил, связывающих эти частицы (химических связей).
Объяснение механизма возникновения химических связей стало возможным только после открытия строения атома. Основными элементарными частицами, участвующими в образовании химических связей, являются электроны, а точнее, валентные электроны, находящиеся на внешнем энергетическом уровне. Именно они в определенных условиях могут покидать свои атомные орбитали. Характером перемещения этих электронов в околоядерном пространстве определяется тот или иной тип химической связи.
Ковалентная неполярная и полярная связь
Так при сближении атомов (без этого связь не может возникнуть) их валентные электроны, объединяясь, как правило, в пары, переходят в иную область околоядерного пространства, т.е. на общую молекулярную орбиталь, где сосредотачивается отрицательный заряд данной пары электронов. Положение этой орбитали относительно положительных ядер взаимодействующих атомов либо усиливает притяжение ядер (связь возникает), либо ослабляет это притяжение
(связь слабеет или вообще не возникает). В первом случае общая молекулярная (орбиталь располагается в пространстве между ядрами атомов. Когда такое расположение симметрично относительно ядер атомов (например, если взаимодействуют одинаковые атомы), то возникает неполярная ковалентная связь. Чаще всего соединяются разные атомы, и тогда молекулярная орбиталь (общая электронная пара) смещается в сторону, ядра того атома, чье стремление притягивать электроны сильнее. Принято говорить, что у этого атома больщая электроотрицательность. В этом случае образуется ковалентная полярная связь.
Схематично образование ковалентных связей можно представить следующим образом:
Н· + ·Н ~ Н: Н
атом атом молекула
водорода водорода водорода ковалентная неполярная связь
•• ••
Н• + •Cl: → H:Cl:
•• ••
атом атом молекула
водорода хлора хлороводорода ковалентная полярная связь
В той части молекулы HCl, где находится атом хлора, наблюдается, как принято говорить, повышенная электронная плотность.
Ионная связь.
Если взаимодействуют атомы, которые сильно отличаются по своей электроотрицательности (например, активный металл и активный неметалл), то объединяющая их молекулярная орбиталь (общая электронная пара) практически полностью перемещается в сторону атома неметалла. Принято считать, что электроны от атома металла переходят к атому неметалла. В результате такого перераспределения электронов происходит образование положительно заряженных ионов металла и отрицательно заряженных ионов неметалла.

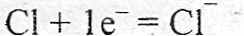
Образовавшиеся ионы притягиваются друг к другу, и образуется другой гип связи – ионная.
K+ + Cl- = KCl
Сходство ковалентной и ионной видов связи заключается в том, что они образуются благодаря валентным электронам атомов, которые под влияние ядер взаимодействующих атомов перемещаются в околоядерном пространстве, формируя результирующие молекулярные орбитали. Различие между этими типами связей определяется тем, какое место в пространстве будут занимать в итоге эти результирующие молекулярные орбитали, иначе говоря, где по отношению к ядрам атомов будут находиться общие электронные пары.
Эти типы связей существуют в неорганических (н2, Н2О, H2S04 и др.) и органических (метан, метанол и др.) веществах.
Водородная связь.
Если вещество имеет молекулярное строение, то между этими частицами действуют межмолекулярные связи (значительно более слабые, чем ковалентные и ионные связи). Одним из видов межмолекулярного взаимодействия являются водородные связи. Эти связи возникают между атомами водорода одной молекулы и сильно электроотрицательными атомами другой молекулы (О, N, F). Эти последние атомы, как правило, имеют частичный отрицательный заряд (к ним смещена электроотрицательная плотность), а атомы водорода - частичный положительный заряд. Их взаимное притяжение ведет к появлению водородной связи, например, между молекулами воды, спиртов, нуклеиновых кислот и др.
Металлическая связь.
Этот тип связи существует в кристаллах металлов. Валентные электроны металлических элементов обладают высокой подвижностью. Они достаточно легко покидают свои атомные орбитали, перемещаясь на орбитали молекулярные. Число этих свободных орбиталей велико и охватывает всю структуру металла. В результате эти подвижные электроны обеспечивают объединение всех атомов в целостную кристаллическую структуру.
Простые и кратные связи.
Если два атома соединены между собой одной обшей электронной парой, находящейся на молекулярной орбитали, то такая связь называется простой одинарной связью. Но когда в связывании атомов участвуют две или три электронные пары, то возникают кратные связи: соответственно двойная и тройная связь. Одинарная связь называется Õ-связью, двойная связь включает Õ- и π-связь, а тройная - Õ- и две π-связи, причем π-связь слабее Õ-связи. Вместе с тем суммарная энергия связи возрастает от одинарной к тройной.
Н

 апример, двойная существует в этилене CН2=CH2, а тройная - в молекулах азота N=N и ацетилена НС=СН.
апример, двойная существует в этилене CН2=CH2, а тройная - в молекулах азота N=N и ацетилена НС=СН.Классификация химических реакций
в неорганической и органической химии.
Все химические реакции могут быть классифицированы, исходя из тех или иных признаков.
1) По характеру теплового эффекта реакции делятся на экзотермические, протекающие с выделением тепловой энергии, и эндотермические, идущие с поглощением теплоты. Для начала реакций первого типа необходим, как правило, первоначальный подвод тепла извне, а в последующем реакция протекает самопроизвольно за счет выделяющегося тепла. Для протекания эндотермических реакций требуется постоянно подводить внешнее тепло
К экзотермическим реакциям относятся в большинстве случаев реакции соединения.
2Mg + О2 = 2MgO + Q
СН4 + 2О2 = СО2 + 2Н2O + Q
Эндотермические реакции наиболее характерны для реакций разложения сложных веществ, требующих затрат энергии
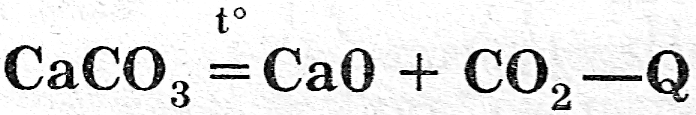
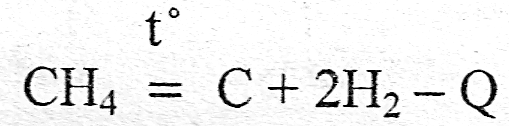
Q - тепловой эффект данной химической реакции.
2) По характеру и полноте протекания все реакции делятся на необратимые, идущие до конца в одном направлении, например:
СНзСООН + NaOH = СНзСООNа + Н2О
4NНз + 3О2 = 2N2 + 6Н2О
И обратимые, в ходе которых в данных условиях устанавливается химическое равновесие, когда скорости прямой и обратной реакций становятся равными, а при изменении внешних условий происходит сдвиг этого равновесия в ту или иную сторону
N2 + 3Н2 ↔ 2NH; СН2=СН2 + НОН ↔С2Н5ОН
Для обозначения обратимых реакций используется знак↔.
3) Если в ходе реакции происходит перераспределение электронов между взаимодействующими атомами веществ, то такие реакции называют окислительно - восстановительными
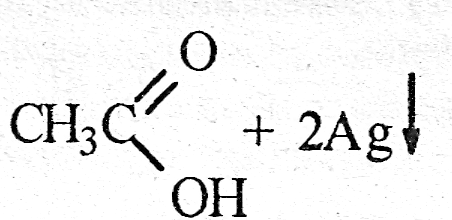
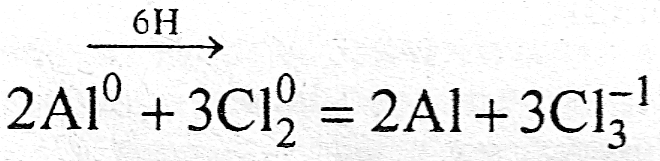
Если во время реакции не происходит перераспределения электронов между атомами взаимодействующих веществ, то такие реакции не относятся к окислительно - восстановительным, например, реакции обмена:
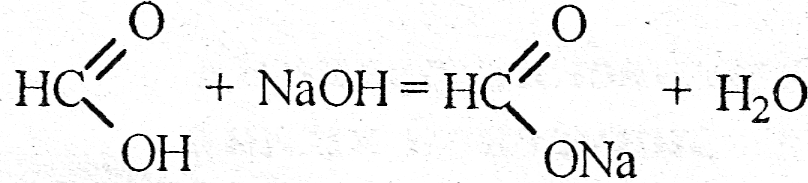
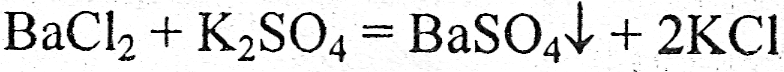
4) По виду и количеству исходных и конечных веществ реакции подразделяют на:
а) реакции соединения
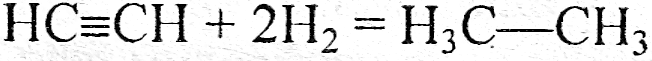
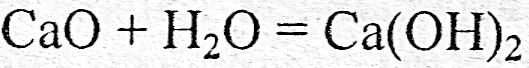
б) реакции разложения

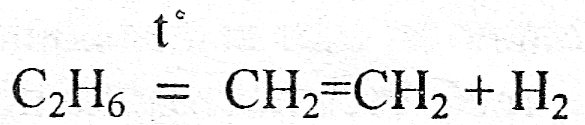
в) реакции замещения (атомы одного химического элемента замещают атомы другого элемента)
СН4 + Cl2 = СНзСl + НСl Fe + CuS04 = FeS04 + Cu
г) реакции обмена (взаимодействующие вещества обмениваются своими составными частями):
2СН3СООН + Mg(OH)2 = (СНЗСОО)2Мg + 2Н20
АgNО3 + NaCl = AgCl + NaNO3
В итоге любая химическая реакция мажет быть охарактеризована всесторонне, например реакция получения аммиака имеет следующую характеристику:
N2 + 3Н2 ↔ 2 NН3 + Q
Это экзотермическая обратимая окислительно - восстановительная реакция соединения.
Обратимость реакций. Химическое равновесие и способы его смещения.
Как известно, все химические реакции делятся на необратимые (идут до конца) и обратимые.
Обратимые химические реакции - это реакции, протекающие одновременно в двух направлениях (прямая и обратная реакции).
В ходе обратимых реакций, когда скорости прямой и обратимой становятся равными, устанавливается химическое равновесие. Оно может сохраняться сколь угодно долго, если внешние условия (давление, температура и др.) остаются постоянными. На практике, когда является важным получить как можно быстрее конечный продукт реакции, существует необходимость научно обоснованного воздействия на химическое равновесие путем изменении ряда внешних параметров.
Основной принцип такого воздействия (принцип Ле-Шателье) заключается в том, что если на систему, находящуюся в равновесии, оказывает влияние какой-либо внешний фактор, то система отвечает на это воздействие так, чтобы снизить влияние этого воздействия.
Это становится более понятным на конкретных примерах.
1. Изменение концентрации реагирующих веществ.
Если в ходе обратимой реакции мы увеличиваем концентрацию какого-либо вещества, то равновесие смещается в сторону ускорения той реакции (прямой или обратной), в ходе которой концентрация этого вещества уменьшается.
Например, если увеличивать концентрацию кислорода О2 в реакции 2S02
+ 02 ↔ 2S0з + Q, то равновесие смещается в сторону прямой реакции, которая ведет к снижению концентрации кислорода.
2. Изменение температуры.
Если мы увеличиваем температуру, то ускоряется та реакция, где подводимое тепло поглощается (т.е. эндотермическая). И наоборот, снижение температуры увеличивает скорость экзотермической реакции.
Например, в реакции СО2 + С ↔ 2СО - Q повышение температуры смещает равновесие вправо, в сторону образования газа СО.
3. Изменение давления.
В тех случаях, когда в реакциях участвуют газообразные вещества и объекты исходных и конечных веществ различаются, изменение давления влияет на равновесие: увеличение давления ускоряет ту реакцию, которая ведет в сторону уменьшения общего объема реакционной смеси. И наоборот, если мы уменьшаем давление, ускоряется реакция, ведущая к увеличению общего объема системы.
Так, в реакции 3Н2 + N2 ↔ 2NНз увеличение давления ведет к росту концентрации аммиака NН3 (соотношение объемов -исходных и конечных веществ составляет 4:2).
4. Катализаторы в равной степени ускоряют прямую и обратную реакции, т.е. равновесие наступает быстрее, но смещения этого равновесия в пользу одной из реакций не происходит.
