С. В. Борзенко Институт природных ресурсов, экологии и криологии со ран, Чита, Россия
| Вид материала | Документы |
- Положение о региональном молодёжном конкурсе проектов развития «приграничное сотрудничество:, 101.04kb.
- Министерство Природных Ресурсов и Экологии РФ федеральное государственное унитарное, 53.3kb.
- Российская Академия Наук Уральское Отделение Институт экологии растений и животных, 102.2kb.
- Доклад на Всероссийской научной конференции «От СССР к рф: 20 лет итоги и уроки», 140.15kb.
- Использование современных информационно-коммуникационных технологий при проведении, 62.15kb.
- Для участия в конференции зарегистрировалось 107 человек. Среди них 26 докторов, 30.63kb.
- Постановлением Правительства Российской Федерации от 29 мая 2008 г. N 404 "о министерстве, 211.75kb.
- Земельный фонд юга европейской части России под воздействием опасных природных процессов, 864.85kb.
- Классификация природных ресурсов, 88.14kb.
- Российская академия наук отделение биологических наук Самарский научный центр Институт, 541.01kb.
4. ГОДИЧНОЕ СОБРАНИЕ ЧИТИНСКОГО ОТДЕЛЕНИЯ РОССИЙСКОГО
МИНЕРАЛОГИЧЕСКОГО ОБЩЕСТВА.
VIII ЧТЕНИЯ ПАМЯТИ АКАДЕМИКА А.Е. ФЕРСМАНА.
СОВРЕМЕННОЕ ГИПЕРГЕННОЕ МИНЕРАЛООБРАЗОВАНИЕ.
ГЕОХИМИЧЕСКИЕ БАРЬЕРЫ. КРИОМИНЕРАЛОГЕНЕЗ
ВТОРИЧНОЕ МИНЕРАЛООБРАЗОВАНИЕ КАК ОДИН ИЗ МЕХАНИЗМОВ
ФОРМИРОВАНИЯ СОДОВЫХ ВОД ОЗЕРА ДОРОНИНСКОЕ
С.В. Борзенко
Институт природных ресурсов, экологии и криологии СО РАН, Чита, Россия, svb_64@mail.ru
SECONDARY MINERAL FORMATION AS ONE OF LAKE DORONINSKOE SODA
FORMATION MECHANISMS
S.V. Borzenko
Institute of Natural Resources, Ecology and Criology SB RAS, Chita, Russia, svb_64@mail.ru
The resulted material testifies to the significant contribution of hydrolysis aluminosilicate minerals in formation of lake Doroninskoe soda waters.
Недостаточная изученность проблемы формирования содовых вод зоны гипергенеза вызывает большие разногласия среди исследователей и формирует разнообразные подходы к механизму содообразования [4, 5 и др.]. Считается, что содообразование - это естественный этап развития системы вода-порода, связанный с осаждением кальцита, монтмориллонитов и других глин, которые выводят из раствора катионы: Са2+, Mg2+, К+ и частично Na+, однако большая часть последнего сохраняется в растворе, способствуя формированию содовых вод [5]. Для установления основных причин образования поверхностных вод содового состава мы рассмотрели влияние процессов вторичного минералообразования в рапе озера Доронинское.
Озеро Доронинское один из крупнейших содовых соляных водоемов Восточной Сибири. За вековую практику наблюдения за гидрохимическим состоянием озера установлен переход от рассольного типа вод к соленому. Колебания солености воды сказываются на ее химическом составе и являются следствием изменения термодинамических равновесий в системе «вода-порода». Так равновесие воды с содой в озере Доронинское наблюдалось в начале прошлого столетия, когда минерализация рапы достигала 94 г/л, а содержания гидрокарбонатов и карбонатов натрия – 72 г/л [3]. Со второй половины прошлого века, по эпизодическим наблюдениям, новосадка соды не происходит [1]. В настоящее время минерализация рапы не превышает 35.5 г/л, по химическому составу вода относится к хлоридно-карбонатному натриевому типу. Отмечается устойчивая химическая стратификация водной толщи в наиболее глубоководной зоне (табл. 1). Осадок пелитовых фракций донных отложений озера имеет смектит-каолинит-гидрослюдистый состав и содержит гидросульфиды железа и примесь карбонатов доломит-анкеритовой и содовой групп [2].
Таблица 1
Химический состав воды (мг/л) оз. Доронинское (октябрь 2004 г.)
| Глубина, м | pH | CO32- | HCO3- | SO42- | Cl- | F- | Ca2+ | Mg2+ | Na+ | K+ | 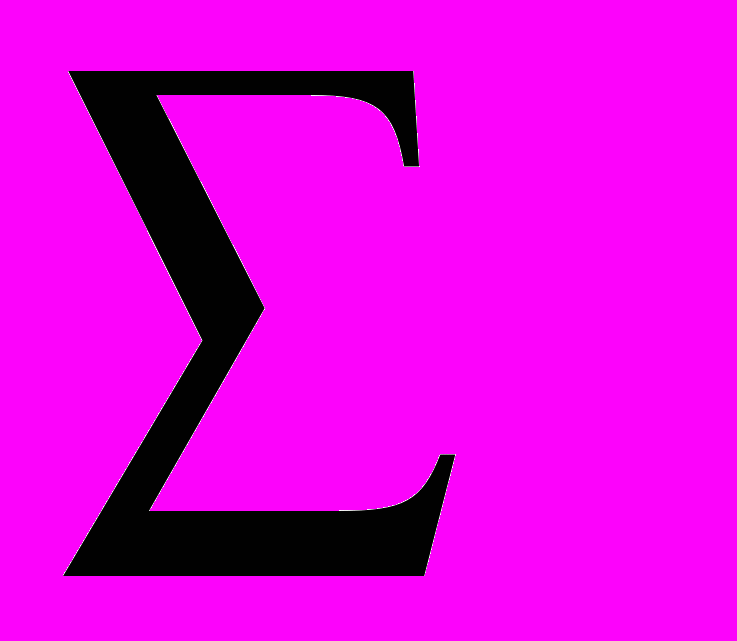 | Н2S |
| 0 | 9.79 | 5820 | 5917 | 125 | 4258 | 12.1 | 2.0 | 58.8 | 9600 | 162 | 25955 | <0.32 |
| 6 | 9.69 | 5730 | 8480 | 58 | 5003 | 13.5 | 2.2 | 63.0 | 10860 | 262 | 30472 | 13.37 |
Выполненная нами оценка минеральных равновесий, показала, что рапа в высокой степени перенасыщена по кальциту (СаСО3) (рис. 1) и доломиту (СаМg(СО3)2) [2]. Достигается насыщение по каолиниту и Са-содержащим алюмосиликатным минералам (рис. 2). Взаимодействие воды с Mg-алюмосиликатами приводит к равновесию с Мg-хлоритом (рис. 3). Равновесия вод с Na-алюмосиликатами указывает на то, что в поле устойчивости Na-монтмориллонита оказывается большее количество водных проб, чем каолинита, что характерно для высокощелочных вод, имеется насыщение и по анальциму (рис .4). Расчет равновесий относительно Na-содержащих галогенных минералов (нахколит, сода, мирабилит, гидрогалит и др.), за исключением гейлюсита [6], показал отсутствие термодинамических равновесий, в виду недостаточных содержаний основных ионов. Наконец, равновесия с К-алюмосиликатами свидетельствует о насыщении воды по мусковиту (рис. 5).

Рис. 1. Равновесие рапы озера Доронинское с кальцитом.
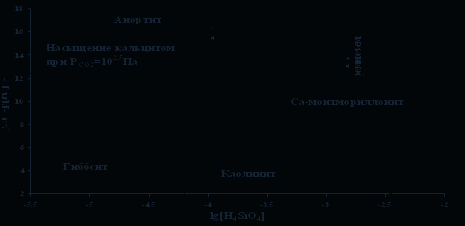
Рис. 2. Диаграмма равновесия анортит-гиббсит-каолинит-монтмориллонит
(Шварцев, 1998 г.) с нанесением данных по составу рапы озера Доронинское.
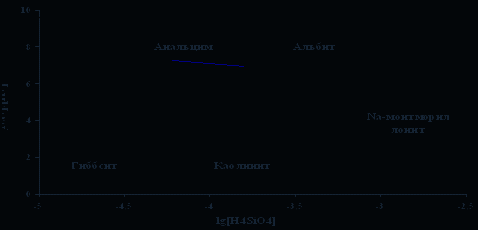
Рис. 3. Диаграмма равновесия анальцим-альбит-монтмориллонит-каолинит-гиббсит
(Шварцев, 1998 г.) с нанесением данных по составу рапы озера Доронинское.
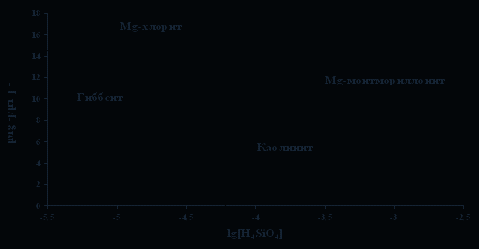
Рис. 4. Диаграмма равновесия хлорит-монтмориллонит-гиббсит-каолинит
(Шварцев, 1998) с нанесением данных по составу рапы озера Доронинское.
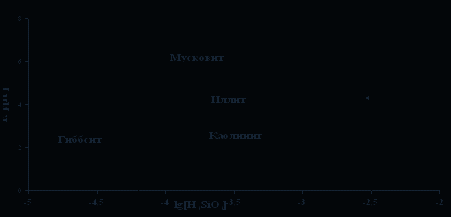
Рис. 5. Диаграмма равновесия мусковит-иллит-монтмориллонит-каолинит-гиббсит
(Шварцев, 1998 г.) с нанесением данных по составу рапы озера Доронинское.
Представленные графики как и термодинамические расчеты отражают не полную картину возможного образования новых минеральных фаз, контактирующих с озерной рапой, поскольку невозможно учесть все их разнообразие, но очевидно, что рапа насыщена по некоторым из первичных минералов, в частности по мусковиту, анальциму, кварцу, а также по вторичным минералам (каолиниту, монтмориллониту, Мg-хлориту, кальциту и др.). Все же большинство первичных алюмосиликатов (анортит, К-полевой шпат и др.) неравновесны с озерной рапой [2] и способны инконгруентно растворяться [5, с. 96] в этих условиях, при этом значительная часть химических элементов связывается вторичными продуктами, а другая часть концентрируется в растворе.
Процесс растворения и осаждения минералов отчетливо заметен на катионах озерной рапы. Так, с момента насыщения рапы кальцитом и доломитом концентрации Са2+ и Мg2+ не превышают 20.3 и 71 мг/л соответственно. Концентрации К+ достигают 270 мг/л, поскольку он высаживается из раствора в меньших количествах, чем щелочноземельные. Иная картина характерна для Na, степень участия которого в минералообразовании несоизмеримо мала по сравнению с остальными катионами (табл. 2), поэтому ему более свойственно накопление.
Анализ анионного состава рапы озера Доронинское показал, что природа HCO3- в озерной рапе многообразна, помимо гидролиза алюмосиликатных минералов установлена также возможность его биохимического продуцирования, обусловленного бактериальными процессами, которые надежно фиксируются как максимальными содержаниями сероводорода, так и наибольшим приростом гидрокарбонатной щелочности [1]. Для высокощелочной озерной среды не менее устойчивой формой является CO32- как результат диссоциации Н2СО3. По мере накопления этого аниона (после осаждения кальцита и доломита) ему также свойственен рост содержаний. Высокие концентрации Cl- являются результатом испарительного концентрирования, т.к. не существует в данном случае источников, которые в значительной степени изменили его содержания в рапе. Этот анион не имеет геохимических барьеров в таких типах вод, его содержания увеличиваются с ростом карбонатности и рН воды.
Таблица 2
Равновесные минералы рапы озера Доронинское
| Минералы | Высажено из раствора, мг/л |
| кальцит CaCO3 | 1.2923 |
| доломит CaMg(CO3)2 | 39.1100 |
| хлорит(Mg) Mg2.25Al1.5Si1.25O5(OH)4 | 0.0160 |
| мусковит KAl3Si3O10(OH)2 | 1.20554E-14 |
| анальцим NaAlSi2O5(OH)2 | 6.66727E-16 |
| каолинит Al2Si2O5(OH)4 | 0.0007 |
| монтмориллонит Ca.15Al1.9Si4O10(OH)2 | 0.0034 |
| гиббсит Al(OH)3; | 0.0008 |
Примечание E-14 – 10-14 и т.д.
Состав алюмосиликатов разнообразен, отсюда следует большое количество реакций гидролиза, которые все протекают с образованием гидрослюд, глин того или иного состава, кальцита, доломита с последующим концентрированием в растворе Na+ и НСО3-, т.е. соды. Рассмотренные термодинамические равновесия с позиции взаимодействия в системе «вода-порода» подтверждают значительный вклад вторичного минералообразования в процессы формирования содовых вод озера Доронинское.
Литература
1. Борзенко С.В., Замана Л.В. Сульфатредукция как фактор формирования содовых вод озера Доронинское (Восточное Забайкалье) // Вестник ТГУ, № 312. 2008. – С. 188.
2. Замана Л.В., Борзенко С.В. Гидрохимическая и термодиномическая оценка минеральных равновесий водной толщи содового озера Доронинское / Мат. конф. – Улан-Удэ: Изд-во БНЦ СО РАН, 2007. – С. 68-71.
3. Иванов А.В., Трофимова Л.Н.. Гидрохимия озер Центрального Забайкалья. Владивосток: Дальневосточное кн. изд-во. – 1982. – С. 140.
4. Посохов Е.В. Происхождение содовых вод в природе. Л.: Гидрометеоиздат, 1969. – С. 153.
5. Шварцев С.Л.. Гидрогеохимия зоны гипергенеза. ОАО. Изд-во «Недра», 1998. – 365 с.
6. Юргенсон Г.А.., Серебренникова Н.В., Борзенко С.В., Матафонов Д.В. О гейлюссите озера Доронинское / Труды I Всероссийского симпозиума с межд. участием и VII-х Всероссийских чтений памяти акад. А.Е. Ферсмана 7 – 10 ноября 2006 г. Чита, Россия.Чита: 2006. – С. 167-162.
БИОГЕННОЕ МИНЕРАЛООБРАЗОВАНИЕ В МИНЕРАЛЬНЫХ ИСТОЧНИКАХ
ВОСТОЧНЫХ САЯН
Э.В. Данилова, Д.Д. Бархутова, Б.Б. Намсараев
Институт общей и экспериментальной биологии СО РАН, Улан-Удэ, Россия erzhena_danilova@mail.ru
BIOGENIC MINERAL FORMATION IN MINERAL SPRINGS OF EAST SAYAN
A.V. Danilova, D.D. Barhutova, B.B. Namsaraev
Institute of General and Experimental Biology SB RAS, Ulan-Ude, Russia,
erzhena_danilova@mail.ru
Микробное сообщество играет важную роль в процессе минералообразования в гидротермальных системах, участвуя в создании геохимических барьеров [1]. При выходе гидротермальных вод на поверхность и протоке по руслу источника создаются градиенты по концентрациям, растворимости компонентов, температуре, рН и давлению [2].
Образование геохимических барьеров в мате ведет к осаждению ряда минералов. Образование травертинов - карбонатных пород происходит в ходе декомпрессии углекислого газа при выходе вод на поверхность. Давление падает, углекислый газ вскипает и улетучивается из гидротермальных вод. В результате вода становится пересыщенной по кальциту и происходит его выпадение из раствора [3]. Нашими исследованиями установлено, что отложение травертинов из термальных углекислых сульфатно-гидрокарбонатных кальциевых вод также происходит с участием микроорганизмов [5]. Образующиеся тела травертинов могут достигать 85 метров мощности и занимать огромные площади [4]. Это хорошо видно на углекислых источниках Восточных Саян: Жойгон и Хойто-Гол.
В осаждение карбоната кальция наибольший вклад вносят цианобактерии: в ходе оксигенного фотосинтеза удаляют СО2 из раствора и нарушают карбонатное равновесие. Считается, что большинство травертинов образовано в результате совместного воздействия биогенных и абиогенных факторов, зависящих от множества переменных: содержания растворенного СО2, температуры воды, интенсивности света и т.д. В травертине слои биогенно осажденного кальцита могут перемежаться со слоями абиогенного кальцита. Биогенно осаждаемый кальцит может составлять до 90% от всего осаждаемого кальцита.
Наибольшая активность процесса минералообразования, на примере минеральных источников Жойгон, обнаруживается в зонах с постоянным доступом воды источника и превышением продукции (0,20 гС/м2сут) над деструкцией (0,03 гС/м2сут). Здесь происходит формирование щелочного геохимического барьера в зоне оксигенного фотосинтеза в связи с удалением СО2 в цианобактериальном мате, на котором и происходит осаждение карбоната кальция. Если же доступ воды из источника уменьшается, то деструкция в мате значительно превышает продукцию. При этом мат высыхает, образуя тонкие постепенно разрушающиеся корки, и литификации микробного мата не происходит.
Наилучшие условия для осаждения карбонатов создаются под слоем активно растущих цианобактерий в связи с появлением локальных зон с высоким рН и подтоком раствора, несущего ионов кальция и карбоната снизу. Таких прослоев может быть несколько, что зависит от периода активного роста цианобактерий [4].
Характерной особенностью среды обитания микроорганизмов источников Хойто-Гол являются наличие большого количества сероводорода, который обеспечивает интенсивный круговорот серы. Геохимическая деятельность бесцветных серобактерий и тионовых бактерий связана с окислением соединений серы. Выделенные культуры тионовых бактерий из источников Хойто-Гол были близки по своим свойствам к Thiobacillus thioparus, характерной особенностью которых является снижение рН среды в процессе роста до 3,5 от исходной рН 7. Развитие данной бактерии сопровождается появлением на поверхности среды пленки серы. Конечным продуктом окисления является сульфат.
На конечном этапе деструкции часть органического вещества в минеральных источниках активно используется сульфатредукторами за счет использования сульфатов.
Литература
1. Герасименко Л.М., Крапов Г.А., Орлеанский В.К. Заварзин Г.А. Роль цианобактериального фильтра в трансформации газовых компонентов гидротерм на примере кальдеры Узон на Камчатке // Журн. Общ. Биологии – 1983. – №6. – С. 842-851.
2. Крайнов С.Р., Швец В.М. Основы геохимии подземных вод. – М.: Недра, 1980. – 285 с.
3. Аверкин Ю.А. Динамика отложения компонентов из гидротермального раствора при выкипании СО2 // Геохимия. – 1987. - №11. – С. 1580-1585.
4. Намсараев З.Б., Горленко В.М., Намсараев Б.Б., Бархутова Д.Д. Микробные сообщества щелочных гидротерм. – Новосибирск: изд-во СО РАН, 2006. – 111 с.
5. Татаринов А.В., Яловик Л.И., Данилова Э.В., Намсараев З.Б. Участие микроорганизмов в образовании травертинов и сапропелитового керогена в отложениях термальных углекислых вод Байкальской рифтовой зоны // Докл. РАН, 2006. Т. 411. № 4. – С. 1435-1438.
РАСЧЁТ СТАНДАРТНЫХ ПОТЕНЦИАЛОВ ГИББСА ДЛЯ КОМПЛЕКСНЫХ
СУЛЬФАТОВ
О.В. Ерёмин
Институт природных ресурсов, экологии и криологии СО РАН, Чита, Россия, yeroleg@yandex.ru
THE CALCULATION OF GIBBS STANDARD POTENTIALS FOR COMPLEX
SULFATES
O.V. Eryomin
Institute of Natural Resources, Ecology and Criology SB RAS, Chita, Russia, yeroleg@yandex.ru
The linear programming problems for the set of chemical compounds and minerals of Cu-Zn-Pb-Al-S-O-H system have been formulated and solved. The calculations from the dual solutions have been carried out for estimations of Gibbs standard potentials for minerals and compounds with unknown thermodynamic properties - complex sulfates of copper, lead, aluminium and zinc.
Зададим множество минералов и химических соединений системы Cu-Zn-Pb-Al-S-O-H, таким образом, чтобы стехиометрическая матрица имела полный ранг по химическим элементам, и для каждого компонента множества были известны значения стандартных потенциалов Гиббса: Al2O3 (корунд), Al2(SO4)3, PbO (массикот), PbSO4 (англезит), ZnS (сфалерит), ZnSO4 (цинкозит), Cu2S (халькозин), CuSO4 (халькоцианит), Cu3SO4(OH)4 (антлерит), H2O (кристаллизационная), O2 (газ). Для построенного таким образом множества, можно сформулировать невырожденные задачи линейного программирования, из двойственных решений которых представляется возможным оценить потенциалы соединений и минералов с неизвестной термодинамикой по формуле [1,2]:
fG0 = Ay, (1)
где fG0 –стандартные потенциалы Гиббса образования веществ из элементов, A- стехиометрическая матрица химических соединений системы, y - двойственные решения задач линейного программирования.
При оценке fG0 сульфатов с одним видом катионов в расчётах использовались значения потенциалов кристаллизационной воды для соответствующих рядов простых гидратов [3]. В случаях разных видов катионов в составе соединения – среднего арифметического соответствующих рядов простых сульфатных гидратов.
Результаты расчётов приведены в таблице.
Отметим, что расчёты по (1) для сульфатов, образующих базовое множество компонентов (сульфат алюминия, англезит, цинкозит, халькоцианит, антлерит) выполняются с точность до равенств. Оценки для гидроксосульфатов меди: Cu4(OH)6SO4 (брошантит) и Cu4(OH)6SO4∙H2O (познякит), не превышают 1% по сравнению с опубликованными данными.
Таблица
Значения стандартных потенциалов Гиббса -fG0 (Дж/моль) для сульфатов меди, цинка,
свинца и алюминия рассчитанные по двойственным решениям (1)
| Химическая формула (минерал) | Исходные данные | -fG0, Дж/моль |
| 1 | 2 | 3 |
| CuSO4 (халькоцианит) | 661900 | 661900 |
| Cu3(OH)4SO4 (антлерит) | 1446000 | 1446000 |
| ZnSO4 (цинкозит) | 871598 | 871598 |
| PbSO4 (англезит) | 814383 | 814383 |
| Al2(SO4)3 | 3102946 | 3102946 |
| Cu8(OH)10(SO4)3∙H2O (удоканит) | | 4188882 |
| Cu4(OH)6SO4∙2H2O (лангит, роуволфит) | | 2323914 |
| Cu3(OH)4SO4∙2H2O (ктенасит) | | 1931864 |
| Cu3(OH)4SO4∙6H2O (камарецит) | | 2903592 |
| | | |
| Окончание таблицы | ||
| 1 | 2 | 3 |
| Cu4(OH)2(SO4)3∙4H2O (вернадскит) | | 3349478 |
| Cu5(OH)6(SO4)2∙3H2O (арнимит) | | 3228746 |
| Zn4(OH)6SO4∙5H2O (новый минерал) | | 3878642 |
| Zn2Cu2(OH)6SO4∙4H2O (намууит) | | 2982384 |
| ZnCu4(OH)6(SO4)2∙3H2O (серпиерит) | | 3434586 |
| Zn2Cu5(OH)10(SO4)2∙5H2O (рамсбекит) | | 4911676 |
| Zn3Cu4(OH)10(SO4)2∙3H2O (шуленбергит) | | 4638082 |
| Zn3Cu2(OH)6(SO4)2∙4H2O (кристелит) | | 4095628 |
| PbCuSO4(OH)2 (линарит) | | 1206433 |
| Pb4Cu(SO4)2(OH)6 (ченит) | | 3109882 |
| Pb4CuSO4 (OH)8 (элиит) | | 2840032 |
| PbCu4(SO4)2(OH)6∙3H2O (лаутенталит) | | 3363976 |
| Al2(SO4)3∙18H2O (алуноген) | | 7673146 |
| Al2(SO4)3∙13.5H2O (метаалуноген) | | 6530596 |
| (H3O)Al3(SO4)2(OH)6 (оксониоалунит) | | 4530623 |
| Al2SO4(OH)4∙7H2O (алюминит) | | 4374969 |
| Al2(SO4)2(OH)2∙10H2O (джурбанит) | | 5389308 |
| Al4SO4(OH)10∙10H2O (паралюминит) | | 7481700 |
| AlSO4(OH)∙5H2O (ростит) | | 2694654 |
| Al4SO4(OH)10∙5H2O (базалюминит) | | 6212200 |
| Al2SO4(OH)4∙5H2O (метаалюминит) | | 3867169 |
| Al4SO4(OH)10∙36H2O (гидробазалюминит) | | 14083100 |
| Al4SO4(OH)10∙5H2O (фельшобаниит) | | 6212200 |
| Al12(SO4)5(OH)26∙20H2O (захерит) | | 20411378 |
| Cu4Al2SO4(OH)12∙3H2O (вудвардит) | | 4947060 |
| Cu4Al2SO4(OH)12∙6H2O (кужелит) | | 5692308 |
| Cu4Al2SO4(OH)12∙2H2O (цианотрихит) | | 4698644 |
| CuAl4SO4(OH)12∙3H2O (халькоалюмит) | | 6064306 |
| Zn6Al6(SO4)2(OH)26∙5H2O (цинкалюминит) | | 12986057 |
| ZnAl2(SO4)4 · 22H2O (дитрихит) | | 9411404 |
| Zn5Al3(SO4)1,5(OH)16∙9H2O (глаукокеринит) | | 9161312 |
| ZnAlSO4(OH)3∙H2O (цинквудвардит) | | 2281088 |
| PbCuAl2(SO4)2(OH)6 (озаризаваит) | | 3793630 |
Жирным шрифтом выделены исходные данные и равные им из двойственных оценок.
Литература
1. Ерёмин О.В. Расчёт стандартных потенциалов Гиббса для сульфатов меди и цинка / Актуальные проблемы геологии и геофизики. Материалы республиканской научной конференции, т. II. Ташкент: Изд-во института геологии и геофизики, 2007. – С. 23-26.
2. Ерёмин О.В., Винниченко С.В., Юргенсон Г.А. Оценка стандартных потенциалов Гиббса гидроксосульфатов меди с кристаллизационной водой из решений двойственных задач линейного программирования // ДАН, 2006, т. 409, № 3. – С. 386-388.
3. Mercury, L., Vieillard, Ph., Tardy, Y. Thermodynamics of ice polymorphs and «ice-like» water in hydrates and hydroxides // Appl. Geochem., 2001, 16. – P.161-181.
Аутигенный минерагенез в урбофациях (культурном слое)
А.А. Каздым
ФГУП ВИМС им. Н.М Федоровского, Москва, Россия, kazdym@mail.ru
