Использование четвертичных аммониевых солей для защиты стали от коррозии в сернокислых растворах
| Вид материала | Документы |
- Методические указания для курсового и дипломного проектирования Москва 2009, 305.78kb.
- Vi методы защиты от коррозии металлов и сплавов, 783.92kb.
- Защиты от коррозии и старения, 844.02kb.
- Защиты от коррозии и старения, 1104.68kb.
- Методическая разработка урока химии по теме: «понятие о коррозии металлов, способы, 159.91kb.
- Реверсивное потенциометрическое титрование в анализе щелочных растворов солей карбоновых, 81.35kb.
- «Электрохимические методы защиты металлов от коррозии», 282.48kb.
- «Вызов», 86.73kb.
- Эффект электроиндуцированного селективного дрейфа катионных аквакомплексов в водных, 268.92kb.
- Эффект электроиндуцированного селективного дрейфа катионных аквакомплексов в водных, 268.96kb.
ИСПОЛЬЗОВАНИЕ ЧЕТВЕРТИЧНЫХ АММОНИЕВЫХ СОЛЕЙ
ДЛЯ ЗАЩИТЫ СТАЛИ ОТ КОРРОЗИИ В СЕРНОКИСЛЫХ РАСТВОРАХ
Авдеев Я.Г.*, Белинский П.А.*, Кузнецов Ю.И.**
*Калужский государственный педагогический университет
им. К.Э. Циолковского, г. Калуга,
248023, г. Калуга, ул. Степана Разина, д. 26, avdeev@kspu.kaluga.ru.
**Институт физической химии и электрохимии им. А.Н. Фрумкина РАН, г. Москва, 119991, г. Москва, Ленинский просп., д. 31, kuznetsov@ipc.rssi.ru.
В настоящее время отечественная промышленность испытывает потребность в эффективных и экономически доступных ингибиторах коррозии железа и сталей в серной кислоте. В связи с этим заслуживает внимания хорошо известный класс ингибиторов коррозии углеродистых сталей в растворах минеральных кислот – четвертичные аммониевые соли (ЧАС), синтез которых достаточно прост. Такие ингибиторы часто обладают рядом полезных технологических свойств, среди которых следует выделить их хорошую растворимость в воде, отсутствие летучести, умеренную пенообразующую способность, что позволяет снизить испарение кислоты из травильной ванны, возможность использования ЧАС в растворах различных кислот и усиление их защитного действия в смеси с другими ингибиторами коррозии.
В качестве ингибиторов коррозии стали в серной кислоте нами исследованы следующие ЧАС: ИФХАН-92, ЧАС-К1, трибензилэтаноламмоний хлорид (ТБЭАХ) и бензилтриэтаноламмоний хлорид (БТЭАХ). В индивидуальном состоянии 5-10 мМ ИФХАН-92 и ЧАС-К1 (25-80C) обеспечивают Z = 90-99% и превосходят по эффективности промышленный ингибитор катамин АБ, что является следствием более эффективного торможения этими ингибиторами электродных реакций. С повышением температуры наблюдается усиление торможения коррозии ингибиторами ИФХАН-92 и ЧАС-К1. Напротив, ТБЭАХ и БТЭАХ слабо тормозят коррозию стали. Применение анионактивных (KI, KBr, KCNS, диэтилдитиокарбомат натрия) и гидрофобных молекулярных (дифенилтиомочевина и каптакс) добавок существенно повышает значения коэффициентов торможения исследованных нами ЧАС. Разработаны смеси (ТБЭАХ с KI, KCNS, дифенилтиомочевиной и каптаксом; БТЭАХ с KI, дифенилтиомочевиной) для которых Z 90%. Смеси на основе ИФХАН-92 и ЧАС К1 проявляют преимущественно антагонизм действия компонентов, а ТБЭАХ – преимущественно синергизм действия компонентов. Несмотря на антогонизм в композициях на базе ИФХАН-92, эти смеси наиболее эффективны.
Присутствие в растворе H2SO4 катионов Fe (III) снижает эффективность ЧАС и смесей на их основе. Причиной низкой эффективности исследованных ингибиторов в присутствии Fe (III) является слабое торможение ими катодной деполяризации катионов Fe (III), а также растормаживание восстановления катионов водорода, вследствие снижения катионами Fe (III) степени заполнения поверхности металла адсорбированным водородом. В горячих растворах H2SO4 (60C) ИФХАН-92 и ЧАС-К1 устойчивы к воздействию 0,2M Fe(II) и 0,05М Fe(III), при этом Z 90%. Несколько уступают им смеси ТБЭАХ с KI, KCNS и каптаксом, сохраняющие высокое защитное действие до 0,02М Fe(III).
Ингибиторы ИФХАН-92, ЧАС-К1, а также смеси ТБЭАХ с гидрофобными анионными и молекулярными добавками рекомендованы к промышленному использованию для защиты стали в сернокислых растворах.
Отрицательная адсорбция атомов хрома на межфазовой границе сплав/оксидная плёнка в процессах окисления на воздухе и
анодной пассивации сплавов Fe – Cr и Ni – Cr1.
Ю.Я. Андреев*, И.А. Сафонов.
Московский Государственный институт стали и сплавов
119991 Москва, Ленинский просп., 4
*E-mail: yuandr@rambler.ru
Образование Cr2O3 в оксидной плёнке (ОП) на поверхности сплава Fe – Cr или Ni – Cr в процессе термического окисления и анодной пассивации рассматривается как результат твёрдофазной химической реакции на границе сплав/оксидная плёнка
| 3FeO (или NiO) + 2Cr = Cr2O3 + 3Fe (или Ni) | (1), |
в которой общее изменение энергии Гиббса есть [1]
| ΔGS,T = ΔGT + ΔGS. | (2) |
где ΔGT < 0 – вклад энергии термохимической реакции окисления атомов Fe (или Ni) и Cr, а ΔGS > 0 – вклад энергии поверхностного слоя (ПС) сплава, обновляемого в процессе его окисления.
При расчёте величины ΔGS использовались литературные данные о поверхностной энергии чистых металлов
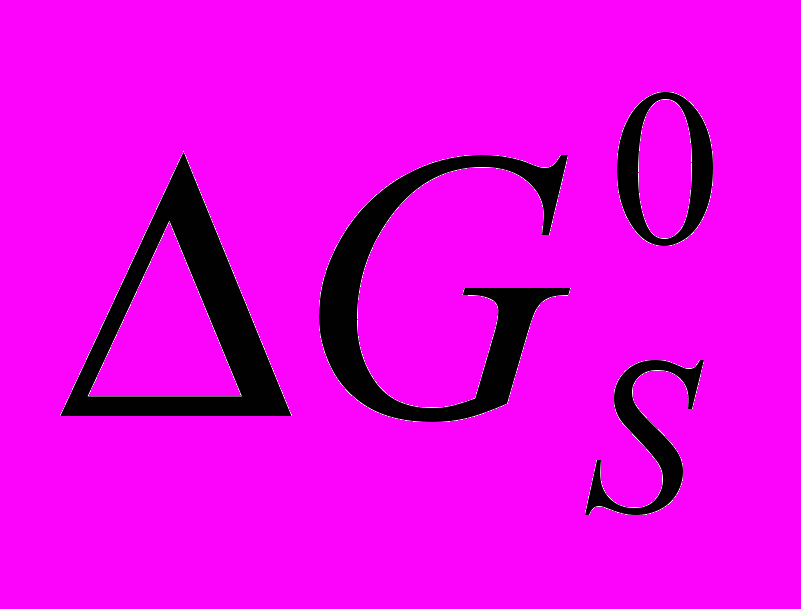 и энтальпии образования сплавов. Расчёт показал существование отрицательной адсорбции XCr << 1 в ПС сплавов, связанной, в основном, с большой разницей поверхностных энергий Cr и Fe (или Ni). В частности, для сплавов 10 – 25% Cr снижение их температуры окисления от Т > 1000 К (окисление на воздухе) до Т ≈ 298 К (анодная пассивация) понижает величину XCr в Fe – Cr сплавах соответственно с 10-2 до 10-4, а в Ni – Cr сплавах с 10-4 до 10-12. Очень малую величину XCr в ПС пассивных сплавов практически нельзя измерить. Этим можно объяснить, почему авторы [2], изучавшие пассивность Fe – Cr сплавов методом РФЭС, констатируют, что состав поверхности сплава непосредственно под пассивной плёнкой точно такой же как в объёме сплава. Однако можно рассчитать константу равновесия реакции (1) с учётом, что замена объёмной концентрации Cr на поверхностную XCr смещает это равновесие в сторону обогащения ОП оксидом Fe (или Ni). По новой методике [1], используя (2), рассчитан состав пассивной плёнки на сплаве Fe – 20Cr, который оказался близок к результату анализа РФЭС плёнки (≈20% FeO, ост. Cr2O3), полученному в [3]. Кроме того, излагаются собственные результаты анализа РФЭС тонких плёнок на сплавах Ni – Cr, полученных окислением на воздухе при 773 К (≈ 100 нм) и анодной пассивацией в H2SO4 (≈ 2 нм), и результаты термодинамического расчёта их состава.
и энтальпии образования сплавов. Расчёт показал существование отрицательной адсорбции XCr << 1 в ПС сплавов, связанной, в основном, с большой разницей поверхностных энергий Cr и Fe (или Ni). В частности, для сплавов 10 – 25% Cr снижение их температуры окисления от Т > 1000 К (окисление на воздухе) до Т ≈ 298 К (анодная пассивация) понижает величину XCr в Fe – Cr сплавах соответственно с 10-2 до 10-4, а в Ni – Cr сплавах с 10-4 до 10-12. Очень малую величину XCr в ПС пассивных сплавов практически нельзя измерить. Этим можно объяснить, почему авторы [2], изучавшие пассивность Fe – Cr сплавов методом РФЭС, констатируют, что состав поверхности сплава непосредственно под пассивной плёнкой точно такой же как в объёме сплава. Однако можно рассчитать константу равновесия реакции (1) с учётом, что замена объёмной концентрации Cr на поверхностную XCr смещает это равновесие в сторону обогащения ОП оксидом Fe (или Ni). По новой методике [1], используя (2), рассчитан состав пассивной плёнки на сплаве Fe – 20Cr, который оказался близок к результату анализа РФЭС плёнки (≈20% FeO, ост. Cr2O3), полученному в [3]. Кроме того, излагаются собственные результаты анализа РФЭС тонких плёнок на сплавах Ni – Cr, полученных окислением на воздухе при 773 К (≈ 100 нм) и анодной пассивацией в H2SO4 (≈ 2 нм), и результаты термодинамического расчёта их состава.- Андреев Ю.Я. // Журн. физ. химии. 2007. Т. 81. № 6. С. 1106
- Asami K., Hashimoto K., Shimodaira S.//Corr. Sci. 1978. V.18. P.151
- Keller P., Strehblow H.–H.//Corr. Sci. 2004. V.46. P. 1939.
ИССЛЕДОВАНИЕ ИНГИБИТОРОВ ВНУТРЕННЕЙ КОРРОЗИИ ТРУБОПРОВОДОВ СИСТЕМ ТЕПЛОСНАБЖЕНИЯ ПРИ ВЫСОКОМ СОДЕРЖАНИИ КИСЛОРОДА В СЕТЕВОЙ ВОДЕ
Балабан-Ирменин Ю.В., Фокина Н.Г.
ОАО «Всероссийский теплотехнический институт» (ВТИ)
115280, г. Москва, ул. Автозаводская, д.14/23, ОАО «ВТИ»
e-mail: nat-fokina1@yandex.ru
Надежность систем теплоснабжения во многом определяется процессами внутренней коррозии трубопроводов. Большое влияние на коррозию оказывает концентрация кислорода в воде, которая в соответствии с ПТЭ в подпиточной воде должна быть не более 50 мкг/дм3, в сетевой воде – 20 мкг/дм3. Проведенные ВТИ стендовые и промышленные исследования показали, что в системах с нормативным содержанием кислорода высокоэффективным ингибитором коррозии является ОЭДФЦ (цинковый комплекс оксиэтилидендифосфоновой кислоты) при концентрации менее 5 мг/дм3 (г.Ростов-наДону) или едкий натр при высоких рН (г.Москва). Но существует много систем, в которых деаэрация отсутствует и концентрация кислорода значительно выше нормируемой. Для оценки ситуации в таких системах был произведен расчет концентрации кислорода, устанавливающейся в закрытой системе теплоснабжения, заполняющейся и подпитывающейся холодной недеаэрированной водой. Усредненная концентрация кислорода в сетевой воде должна зависеть от концентрации кислорода в подпиточной воде, расхода подпиточной воды, водяного объема системы, поверхности и скорости коррозии стали, с которой контактирует кислород. Исходя из этого была получена формула для расчета концентрации кислорода в любой момент времени. Показано, что при использовании недеаэрированной воды за несколько суток в системе устанавливается стабильная концентрация кислорода в сетевой воде. Значение стабильной концентрации кислорода определяется температурой сетевой воды, концентрацией кислорода в подпиточной воде, отношением расхода подпиточной воды к объему системы (относительной подпиткой), соотношением поверхности и объема системы. Были проведены расчеты стабильной концентрации кислорода для разных величин относительной подпитки – 0,001÷0,1. Результаты расчетов показали, что системы, подпитывающиеся недеаэрированной водой, будут работать с достаточно высокими концентрациями кислорода при низких значениях рН воды. Как способ защиты от коррозии в системах с высокими концентрациями кислорода режим высокого рН не может быть применен, т.к. в этих условиях может интенсифицироваться язвенная коррозия стали, поэтому была проведена проверка различных реагентов в качестве ингибиторов коррозии в воде с высокой концентрацией кислорода (600 мкг/дм3). Эксперименты проводились на установке для поляризационных измерений при рН=7,0, t = 90oC на вращающемся цилиндрическом электроде из стали Ст3сп. Было показано, что при повышенном содержании кислорода в воде для снижения скорости коррозии стали могут быть рекомендованы фосфонаты ИОМС-1 и ПАФ-13А с концентрацией 4-5 мг/л. Для применения ОЭДФЦ необходима его концентрация 25 мг/л, что соответствует данным ИФХАН. Одним из факторов, определяющих ингибирующее действие ОЭДФЦ, является адсорбция реагента или его соединений с железом на поверхности стали. Для проверки возможности адсорбции других фосфонатов на поверхности стали были проведены отдельные испытания. После длительной выдержки образцов в растворах реагентов ОЭДФЦ, ИОМС-1 и ПАФ-13А при 90 оС методом растровой электронной микроскопии и локального рентгеноспектрального анализа приповерхностных пленок продуктов коррозии на стали было показано, что ИОМС-1 и ПАФ-13А также как ОЭДФЦ адсорбируются на поверхности стали.
Математическое моделирование электрических полей КАТОДНОЙ ЗАЩИТЫ ТРУБОПРОВОДОВ
Болотнов А.М., Глазов Н.Н., Глазов Н.П., Шамшетдинов К.Л., Башаев М.А.*
ГОУ ВПО Башкирский государственный университет, Уфа, Фрунзе, 32. BolotnovAM@mail.ru.
*Всероссийский научно-исследовательский институт по строительству и эксплуатации
трубопроводов, объектов ТЭК (ВНИИСТ), Москва, Окружной проезд, 19. Glazov@vniist.ru,
Эффективным методом снижения скорости коррозии подземных трубопроводов является катодная защита, основанная на смещении электрического потенциала защищаемого металла в отрицательную область относительно грунта. Защитный потенциал трубы должен находиться в определенном интервале: при выходе потенциала из данного интервала в положительную сторону эффективность защиты снижается; при сдвиге в отрицательную сторону возникает так называемый "эффект перезащиты", следствием чего является преждевременный износ изоляции трубы.
Постоянное электрическое поле в системе "анод – грунт – труба" создается катодной станцией с помощью анодных заземлителей, проложенные в грунте вдоль трубы. Из экономических соображений целесообразно применять аноды минимальных размеров, располагая их как можно дальше друг от друга. При этом с увеличением расстояния между анодами растет неравномерность распределения потенциала трубы и выход его из заданного интервала; с уменьшением поверхности анода плотность тока на контактной границе "анод – грунт" возрастает, следствием чего является увеличение скорости растворения поверхностного анодного слоя и сокращение срока службы анода. Таким образом, возникает проблема оптимизации электрического поля катодной защиты при заданных ограничениях на потенциал трубопровода и на плотность тока, стекающего с поверхности анода в грунт.
Распределение электрического поля определяется режимом работы катодной станции, геометрическими параметрами трубопровода и анодов их взаимным расположением, сопротивлениями изоляции трубы и поверхностного слоя анода, которые изменяются в процессе эксплуатации, а также сопротивлением грунта, зависящим от множества факторов, включая погодные условия.
Проектирование и оптимизация параметров катодной защиты магистральных трубопроводов требуют как экспериментальных исследований, так и разработки математических моделей, алгоритмов и комплексов программ для проведения вычислительных экспериментов с целью повышения экономической эффективности при обеспечении надежности защиты в заданные сроки эксплуатации.
Целью данной работы является создание математической модели, алгоритма и программы расчета электрического поля катодной защиты магистральных трубопроводов протяженными анодами постоянного и переменного диаметра с последующим поиском оптимальной длины анода, с учетом ограничений, накладываемых на плотность анодного тока и защитный потенциал трубы. Для решения краевой задачи распределения потенциала электрического поля в трехмерном полуограниченном пространстве предложен метод фиктивных источников. Программа реализована в средах визуального программирования Delphi и Lazarus.
Противокоррозионная защита магистральных трубопроводов
Глазов Н.П.
ООО Научно-исследовательский институт по строительству и эксплуатации объектов ТЭК «Институт ВНИИСТ», 105187 Москва, Окружной проезд, 19 E-mail: Glazov@vniist.ru
Надежность магистрального транспорта газа, нефти и нефтепродуктов является не только важнейшей народно-хозяйственной задачей, но имеет большое стратегическое значение. Перерыв в работе магистрального транспорта ведет не только большим прямым затратам на ликвидацию разрыва трубопровода, но и к многократно большим косвенным потерями из-за перерыва в подачи транспортируемого продукта.
В начальный период развития нефтегазовой отрасли в стране в качестве изоляционного материала был только битум. Применение этого материала не обеспечивало ни требуемого качества изоляции, ни высокой производительности при требуемых правительством темпах строительства новых трубопроводов. Переход на новые изоляционные материалы – пленочные полимерные ленты позволил резко увеличить скорость возведения новых нефтегазопроводов.
Однако скоро стало ясно, что эти покрытия обладают многими существенными недостатками, особенно при применении их на трубопроводах большого диаметра. Следует отметить также, что строительство и ввод в эксплуатацию средств электрохимической защиты (ЭХЗ) производились со значительными задержками, не редко спустя 3 – 5 лет после окончания строительства. Уровень эксплуатации ЭХЗ, как правило, не отвечал техническим требованиям.
Огромное количество коррозионных отказов (более 30 %) вызвало необходимость поиска мер для повышения надежности трубопроводного транспорта. Одним из ярких примеров опасности коррозии в то время был краснотуринский узел, в котором пересекались два коридора газопроводов диаметром до 1420 мм с давлением до 75 атм. (один коридор – 4 трубопровода, другой – 5 трубопроводов). Ситуация осложнялась пересечением электрифицированной железной дорогой, и близостью линий электропередачи высокого напряжения. Если в других местах основной причиной коррозионного разрушения трубопроводов были коррозия блуждающими токами и почвенная коррозия, скорость которой достигала 5 мм/год, то на краснотуринском узле основной ущерб определялся коррозионным растрескиванием под напряжением.
Правительством была создана представительная комиссия под председательством академика Я.М. Колотыркина, которой было поручено провести анализ состояния и разработать предложения по совершенствованию противокоррозионной защиты.
Предложения комиссии Я.М. Колотыркина стали основой многих постановлений ЦК КПСС и Совета Министров СССР. Эти предложения включали переход на заводскую изоляцию труб, внедрение новых технология этой изоляции, разработку и производство средств ЭХЗ и приборов контроля противокоррозионной защиты. Для обеспечения выполнения этих постановлений была сформирована научно-техническая программа, объединявшая усилия многих научных и производственных организаций.
Современное состояние противокоррозионной защиты трубопроводов – в значительной степени результат работы этой комиссии: новые трубопроводы стоят преимущественно из труб с заводской изоляцией, контроль ЭХЗ осуществляют только по поляризационному потенциалу, используют высоконадежные катодные преобразователи и анодные заземления, применяют внутритрубную диагностику трубопроводов и коррозионную электрометрию, что вместе с выполнением требований ГОСТа Р 51164 позволило резко сократить количество коррозионных отказов.
структурное строение и кинетика восстановления комплексов хрома в хлоридных расплавах
Елизарова И.Р.
Институт химии и технологии редких элементов и минерального сырья КНЦ РАН, г. Апатиты, ул. Ферсмана, 26 а, Академгородок, elizarir@chemy.kolasc.net.ru
Вольтамперометрические методы достаточно успешно могут быть применены и для исследования электрохимической кинетики, и как аналитические методы, чувствительные к структурному строению электроактивных комплексов в солевых расплавах.
На основании исследования процессов восстановления Cr(III) и Cr(II) в составе хлоридных комплексных ионов изучен механизм и кинетика восстановления ионов хрома при введении в расплавы NaCl – KCl, KCl и CsCl трихлорида хрома в широком диапазоне концентраций и температур. Совместное применение критериев линейной вольтамперометрии и квантово-механических расчетов позволило предположить наличие химической реакции образования полиядерного комплекса двухвалентного хрома Cr2Cl73- с калием или цезием во внешней координационной сфере, в расплаве NaCl – KCl комплексные ионы с натрием во внешней координационной сфере образуются с одним центральным двухвалентным ионом хрома. Процесс образования полиядерного комплекса хрома становится возможным при изменении состава внешней координационной сферы с заменой Na+ на K+.
На зависимостях изменения потенциала пика волны восстановления от логарифма скорости поляризации индикаторного электрода в расплаве NaCl – KCl наблюдается изменение углового коэффициента линейной функции. Отношение угловых коэффициентов линейных участков до и после V = 0.8 В с-1 при температурах до 1023 К приблизительно равно 1 : 2. что свидетельствует о восстановлении комплексов с переносом двух электронов в одном случае и четырех – в другом случае. Это может быть вызвано протеканием электродной реакции восстановления ионов хрома, содержащих в качестве центрального не только одного, но и двух атомов двухвалентного хрома.
Предложены модели образующихся комплексных ионов хрома, рассчитаны длины связей и стерические энергии комплексных ионов хрома по программе GAMESS (ссылка скрыта), таблица.
Таблица. Длина связи и стерическая энергия комплексных ионов хрома.
| Комплексный ион | Связь | Ucт, ккал моль-1 | Длина связи, Å |
| CrCl63- | Cr-Cl | -612.096 | 2.63 |
| CrCl42- | Cr-Cl | -331,911 | 2.57 |
| CrCl3- | Cr-Cl | -339.830 | 2.44 |
| Cr2Cl73- | Cr-Cl | -601.389 | 2.56 |
| Cr-Clмост. | 2.66 | ||
| CrCl4- | Cr-Cl | -696.692 | 2.31 |
| Cr2Cl62-(объемная конфигурация) | Cr-Cl | -679.650 | 2.48 |
| Cr-Clмост. | 2.69 | ||
| Cr2Cl62-(плоская конфигурация) | Cr-Cl | -654.440 | 2.53 |
| Cr-Clмост. | 2.77 |
Определены кинетические параметры восстановления исследуемых комплексов и их зависимости от концентрации, температуры и состава, подтверждающие вывод о наличии в расплаве полиядерного комплексного иона хрома.
Электрохимические и коррозионные исследования
в НИФХИ им. Л.Я. Карпова за 90 лет.
