Механизмы микроэволюции вируса клещевого энцефалита 03. 00. 06 вирусология
| Вид материала | Автореферат диссертации |
| Поведение популяции ВКЭ при смене хозяина |
- Международная научная конференция «клещевой энцефалит и другие инфекции, переносимые, 24.37kb.
- Приказ Федеральной службы по надзору в сфере защиты прав потребителей и благополучия, 89.3kb.
- Приказ №85 г. Петрозаводск от 15 марта 2007 года Об утверждении стандартов оказания, 153.88kb.
- Инструкция для участника запроса котировок, 513.56kb.
- Лекции по профилактике туберкулеза и клещевого энцефалита для проведения на уроках, 213.83kb.
- Конспект урока Тема: «Видообразование как результат микроэволюции», 92.92kb.
- Примерная программа наименование дисциплины «Вирусология и биотехнология» Рекомендуется, 844.41kb.
- План урока Понятие компьютерного вируса и троянской программы. Признаки заражения компьютера., 79.39kb.
- Область данных вирусной программы Завершаем запускающую программу Текст нерезидентного, 1055.5kb.
- Примерная программа дисциплины микробиология, вирусология, микробиология полости рта, 447.35kb.
Поведение популяции ВКЭ при смене хозяина
Как было показано в табл. 1, адаптированный к клещам вариант М образовывал мелкие (<1 мм) бляшки в культуре клеток СПЭВ, при чем на 100 мелких бляшек практически всегда можно было обнаружить 1-2 крупные бляшки. Из популяции варианта М были клонированы крупная и мелкие бляшки (табл. 8) в культуру клеток СПЭВ. После первого же пассажа клоны, которые были взяты при клонировании как мелкая бляшка, приобретали крупнобляшечный или смешанный фенотип. При следующем пассаже в культуре клеток вирус, образующий крупные бляшки, вытеснял мелкобляшечный вариант. Для устранения примеси мелкобляшечного вируса были сделаны дополнительные клонирования. При клонировании отбирали крупные бляшки. Только после 3 клонирований точечные бляшки при титровании перестали появляться. Новые клоны 160/57, 118/58, и 103/84 образовывали в культуре клеток СПЭВ бляшки, похожие на бляшки родительского штамма ЭК-328, которые к 8 дню достигали размера 6-8 мм и продолжали расти в течение всeго периода наблюдения. Клон 116/59 образовывал бляшки диаметром 4-5 мм. В параллельных экспериментах было предпринято клонирование для получения мелкобляшечного вируса. Только в результате четырех клонирований мелких бляшек были получены клоны 424 и 298, которые практически не содержали в популяции крупнобляшечных вариантов.
Оценка свойств вирионов клонов, полученных из популяции варианта М клонированием методом бляшек, показала, что крупнобляшечные клоны
Таблица 8. Характеристика клонов, выделенных из популяции варианта М в культуре клеток СПЭВ
-
вирус
Диаметр бляшки до выделения
Диаметр бляшки, мм
на 8 сутки*
клон 57
1 мм
тчк:4:7=(1:1:7)
клон 58
1 мм
7
клон 59
1 мм
4
клон 83
1 мм
7:3:тчк=(2:2:1)
клон 84
5 мм
тчк:7 = (2:1)
клон 86
5 мм
7
ЭК-328
7
вариант М
тчк:7 = (100:1)
* - в скобках указано соотношение бляшек разного размера; тчк - точечного размера, т.е. <1мм.
восстановили свойства родительского штамма ЭК-328, а мелкобляшечные клоны сохранили характеристики варианта М. Вирионы клонов 160/57, 118/58, 103/84 и 116/59 обладали ГА, а также образовывали преципитат с АТ в РИЭФ, направленный к катоду (рис. 7). Клоны 424 и 298, подобно варианту М, не обладали ГА и в РИЭФ не образовывали подобной ракеты.
Рисунок 8. Анализ с помощью РИЭФ антигенных структур ВКЭ, накапливающихся в КЖ клеток СПЭВ, инфицированных клонами из популяции варианта М. 1 – клон 118/58, 2 – клон 116/59, 3 – клон 103/84, 4 – клон 160/57, 5 – клон 298.
анод
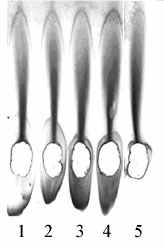 катод
катодДля клонов, полученных из популяции варианта М и прошедших 3-4 пассажа в культуре клеток СПЭВ, была определена нуклеотидная последовательность генов белка Е, а также фрагментов РНК, включающих позиции, где были выявлены различия между штаммом ЭК-328 и вариантом М. Мелкобляшечный клон 298 сохранил аминокислотные остатки в белке Е, характерные для варианта М (табл.9). Все крупнобляшечные клоны имели треонин в позиции 426, как у штамма Эк-328. Следовательно, эта позиция имеет прямое отношение к реверсии свойств полученных нами клонов.
Таблица 9. Фенотипические и генетические свойства клонов, выделенных из популяции варианта М.
| вирус | фено тип | кол-во клонирований | 19нт 5’НТО | 42нт 5’НТО | 1 prM | 64 E | 122 E | 124 E | 2190 нт E | 426 E | 2362нт E | 52 NS2A | 22 NS4A | 41 NS4A |
| ЭК-328 | Э | | a | c | A | K | E | K | c | T | t | K | S | R |
| Вариант M | M | | g/а | a | V | K | G | K | t | I | c | N | G | K |
| 160/57 | Э | 3 | а | а | V | K | G | E | t | T | c | N | G | K |
| 118/58 | Э | 3 | а | а | V | K | E | K | t | T | с | N | G | K |
| 116/59 | Э | 3 | g | a | V | K | G | Q | t | T | с | N | G | K |
| 103/84 | Э | 1 | a | a | V | Q | G | K | t | T | c | N | G | K |
| клон 298 | M | 4 | g | a | V | K | G | K | t | I | c | N | G | K |
| клон 424 | M | 4 | н/о | н/о | н/о | K | G | K | t | I | c | н/о | н/о | н/о |
н/о – не оценивали; прописные буквы – аминокислоты, строчные – нуклеотиды.
Фенотип: Э - размер бляшек, свойства вирионов, как у штамма ЭК-328; М - размер бляшек, свойства вирионов, как у варианта М.
Как говорилось выше, замена в позиции 122 у варианта М приводит к повышению положительного заряда белка Е. У клона 118/58, который, как и штамм Эк-328, образовывал крупные бляшки в культуре клеток СПЭВ и давал преципитат с АТ в РИЭФ, мы наблюдали обратную замену глицина на глютаминовую кислоту. У трех клонов 160/57, 116/59 и 103/84, также обладающих фенотипом штамма ЭК-328, в позиции 122 сохранялся глицин, как у варианта М. Тем не менее, у клона 160/57 появлялась замена лизина на глутаминовую кислоту в позиции 124. У клона 116/59 в той же позиции лизин заменялся на глутамин, а у клона 103/84 аналогичная замена лизина на глутамин появлялась в позиции 64. Эти замены приводят к снижению положительного заряда. Как видно на рис. 3, у крупнобляшечных клонов способность связываться с ГС была даже несколько ниже, чем у штамма ЭК-328. Это свидетельствует о том, что замены в позициях 124 и 64 являются компенсирующими. У всех клонов нуклеотиды в позициях 2190 и 2362 совпадали с таковыми у варианта М, т.е. эти клоны являются истинными ревертантами. Вне зависимости от фенотипа все клоны, полученные из варианта М, имели те же аминокислотные остатки в сигнальной последовательности PrM и в белках NS2a и NS4a, что и вариант М, т.е. эти замены, по-видимому, не имеют прямого отношения к описанному фенотипу. Представленные данные не позволяют сделать однозначного заключения о роли замены в позиции 19 в 5'-НTO в изменении характеристик варианта М, но очевидно, что эта замены не могут определять свойства вирионов этого вируса.
Таким образом, при репродукции варианта М в культуре клеток СПЭВ образуется большой спектр ревертантов с различными компенсирующими заменами. Анализ ревертантов, полученных при выделении клонов из популяции варианта М, показал, что характерный для адаптированного к клещам варианта М фенотип определяется двумя заменами в белке Е в позициях 122 и 426, а также определенную роль может играть замена в позиции 19 5'-НТО.
Для клонов 160/57, 118/58, 116/59, и 103/84 провели оценку нейровирулентности и НИ для мышей линии BALB/c разного возраста (табл. 10). Клоны 118/58 и 116/59 восстановили НИ, однако у клонов 160/57 и 103/84 НИ осталась низкой. Клоны 160/57 и 116/59 имеют разные компенсирующие замены в позиции 124, клон 118/58 является обратным ревертантом, а клон 103/84 имеет компенсирующую замену, как клон 116/59, но в позиции 64. При этом, а.к. замены в других позициях у всех этих клонов одинаковы. Таким образом, отличия в НИ клонов варианта М, обладающих всеми другими фенотипическими признаками, свойственными родительскому штамму ЭК-328, могут быть связаны с конкретной аминокислотной заменой и ее позицией в белке Е, хотя также нельзя полностью исключить связь с заменами в других не изученных нами областях генома. Представленные данные позволяют предположить, что вирулентность вируса может определяться аффинностью связывания вирионов с рецепторами на каких-то определенных клетках, и компенсирующие замены модулируют взаимодействие с этими рецептороми.
Способность высоковирулентных вирусов персистировать в ЦНС была проверена на одном из клонов из популяции варианта М, восстановившим свою НИ. При и/п заражении мышей сублетальной дозой клона 116/59 3 мыши не заболели, а у 2 мышей развились параличи. На 6 неделе они полностью выздоровели. У всех животных, не заболевших и выздоровевших, на фоне иммунодепрессии, вызванной введением ЦФ, развития заболевания не наблюдалось, и инфекционный вирус в мозге не выявлялся. При проверке методом ОТ-ПЦР оказалось, что у всех мышей в мозге присутствует вирусная РНК. Таким образом, учитывая отсутствие клинических признаков заболевания и отдаленные сроки после начала инфекции, можно утверждать, что клон 116/59 в сублетальной дозе вызвал у них персистентную инфекцию.
Таблица 10. Вирулентность клонов варианта М для мышей линии BALB/c разного возраста.
-
Вирус
Вирулентность для мышей
Мыши 6 г
БОЕ /ЛД50
Мыши 12 г
БОЕ /ЛД50
и/ц
и/ц
и/п
ЭК-328
2
0,5
16
Вариант M
0,4
2,5
250000
клон 160/57
8
0,3
>500
клон 118/58
1,6
1,6
2,5
клон 116/59
1
0,3
1
клон 103/84
6,3
2
>500
Таким образом, мы показали, что варианты ВКЭ, обладающие повышенной аффинностью связывания с ГАГ, а также варианты, ревертировавшие по этому свойству как за счет обратной, так и за счет различных компенсирующих замен, могут вызывать все типы инфекций: инаппарантную, острую и персистентную.
Было изучено поведение популяции варианта М в пассажах in vitro и in vivo. Для оценки стабильности популяции варианта М при пассажах в культуре клеток СПЭВ была выбрана схема, предусматривающая пассирование вируса в двух режимах: три независимых линии вели таким образом, что КЖ инфицированных клеток брали для следующего пассажа до наступления ЦПД (24-36 ч после начала инфекции), а 3 линии – после наступления ЦПД (48-72 ч). Для всех линий пассажей 2 раза материал был заморожен между пассированием. Таким образом, было сделано 12 пассажей линий с ЦПД и 20 пассажей для линий без ЦПД. Полученные вирусы были оттитрованы методов бляшек.
Во всех линиях количество крупных бляшек увеличилось уже на первых пассажах до 7-10% и при дальнейшем пассировании колебалось от пассажа к пассажу, но оставалось на данном уровне. Во всех 6 линиях вирус не приобрел способности формировать направленный к катоду преципитат вирионов с АТ в РИЭФ. Для одной из линий, пассированной без выраженного ЦПД, была определена нуклеотидная последовательность в областях генома, где были найдены замены между штаммом ЭК-328 и вариантом М. Только в позиции в 5’НТО у пассированного в культуре клеток СПЭВ вируса наблюдали реверсию к штамму ЭК-328. НИ этого вируса повысилась до 600 БОЕ/ЛД50, однако не достигла уровня, свойственного штамму ЭК-328.
Полученные данные показывают, что в отличие от заражении с низкой множественностью, когда вирус клонировали из бляшки, при пассажах адаптированного к клещам варианта М в культуре клеток СПЭВ без выраженного эффекта "бутылочного горлышка" формируется стабильная гетерогенная популяция с содержанием 7-10% крупнобляшечного варианта.
При пассировании варианта М через мозг юных мышей наблюдали постепенное нарастание количества крупных бляшек. К 12 пассажу соотношение крупных и мелких бляшек было 1:1. Полученный вирус был назван RNm. Вирионы этого вируса нерегулярно образовывали катодный преципитат с АТ в РИЭФ. Секвенирование фрагмента РНК варианта RNm, кодирующего белок Е, показало, что он сохранил нуклеотидную последовательность варианта М (табл.10). Тогда из популяции варианта RNm были выделены 2 крупнобляшечных клона 46 и 48. Вирионы всех клонов вели себя в РИЭФ, как вирионы штамма ЭК-328. При секвенировании генов Е этих клонов было установлено, что все они имели нуклеотидную последовательность, аналогичную таковой родительского штамма ЭК-328, включая нуклеотиды в позициях 2190 и 2362, по которым вариант М отличается от родительского штамма Эк-328. У этих клонов и в позиции 9888 был уридин, как у штамма Эк-328. Аминокислотные замены могут иметь адаптивный характер и ревертировать при изменении селективного воздействия, однако, реверсия трех н.т. замен в разных частях генома крайне маловероятна, и их можно использовать в качестве маркера, позволяющего различить вариант М и штамм ЭК-328. Таким образом, крупнобляшечные клоны, выделенные из популяции варианта М, переадаптированного к мозгу белых мышей, оказались примесью родительского штамма ЭК-328, сохранившейся в популяции варианта М в процессе 17 пассажей через клещей. Это показывает, что ВКЭ может существовать в виде гетерогенной популяции не только при репродукции в клетках млекопитающих, но и в клещах.
В одном из экспериментов взрослые мыши линии BALB/c были и/п инфицированы 10000 БОЕ варианта М. Несколько мышей заболело. На пике болезни у них были взяты кровь и мозг. При титровании сгустка крови и мозговой суспензии методом бляшек была выявлена гетерогенность вирусной популяции. Соотношение крупных и мелких бляшек было примерно 1:1. Их этих популяций были изолированы крупнобляшечные клоны 51, 53 и 56. Вирионы всех клонов вели себя в РИЭФ как вирионы штамма ЭК-328. Секвенирование гена Е показало, что все эти клоны являются истинными ревертантами. Аминокислотные остатки в позициях 122 и 426, были как у штамма ЭК-328, но они сохранили н.т. замены, по которым вариант М отличается от штамма ЭК-328. Это свидетельствует о том, что при репродукции адаптированного к клещам варианта М in vivo изменение структуры популяции может идти за счет появления ревертантов.
Таблица 10. Характеристика ревертантов, появляющихся в популяции варианта М при пассажах in vivo.
-
вирус
Характеристика вируса и источник выделения клонов
Размер бляшек
РИЭФ*
замены в гене белка Е
несиноним.
синоним.
122
426
2190
2362
Эк-328
-
5-6
+
Glu
Thr
C
T
вариант M
-
<1mm
-
Gly
Ile
T
C
RNm
11 пассажей вариантаМ через мозг мышей
5mm:<1mm=1:1
+/-
Gly
Ile
T
C
Клон 46
RNm
5
+
Glu
Thr
C
T
Клон 48
RNm
5
+
Glu
Thr
C
T
Клон 51
Кровь от заболевшей мыши после и/п введения варианта М
5
+
Glu
Thr
T
C
Клон 53
мозг от заболевшей мыши после и/п введения варианта М
5
+
Glu
Thr
T
C
Клон 56
мозг от заболевшей мыши после и/п введения варианта М
5
+
Glu
Thr
T
C
*- + - наличие катодного преципитата вирионов с АТ, - отсутствие катодного преципитата вирионов.
Далее мы попытались оценить влияние данных вирусов друг на друга при одновременной репродукции. Для этого клетки СПЭВ были инфицированы раздельно и смесью вирусов, взятых в разных соотношениях. Полученное потомство оценивали по соотношению крупных и мелких бляшек при титровании в культуре клеток СПЭВ, а также по его поведению в РИЭФ. Очевидно, что такой эксперимент может дать только приблизительные данные о соотношении вирусов с разными фенотипами в популяции. Тем не менее, было поставлено 3 подобных эксперимента, и во всех были получены сходные результаты. Данные одного из этих экспериментах приведены в табл. 11. При равном количестве штамма Эк-328 и варианта М в инокуляте при средней множественности заражения вирусы с разным фенотипом не мешают репродукции друг друга, а при низкой множественности титры варианта М даже увеличиваются. При этом при определенных соотношениях вирусов в инокуляте вариант М может снижать титры штамма Эк-328 и наоборот.
Необходимы тщательные исследования по изучению взаимодействия описанных вирусов при смешанной инфекции на генетическом уровне, а также изучение механизмов описанной интерференции и комплементации. Тем не менее, этот эксперимент и результаты обратных пассажей адаптированного к клещам варианта М показывают, что в клетках млекопитающих ВКЭ может длительно существовать в виде стабильной гетерогенной популяции, в которой присутствует как варианты, обладающие селективным преимуществом при репродукции в клетках млекопитающих, так и варианты, имеющие преимущества при репродукции в членистоногих.
При выделении мелкобляшечных клонов из популяции варианта М, т.е. при создании эффекта «бутылочного горлышка», в результате 1 пассажа в культуре клеток мы получили целый набор ревертантов с обратными и различными компенсирующими мутациями. Это свидетельствует о том, что образование мутантов является при определенных условиях частым событием при репродукции ВКЭ. Нельзя исключить, что подобные мутанты в следовых количествах могут возникать и длительно существовать в любой популяции, тем не менее, за счет интерференции основной популяции они так и остаются в следовых количествах. При клонировании селективное давление основной популяции снижается, и это приводит к резкому изменению структуры популяции с преобладанием более приспособленного к данным условиям варианта вируса.
Очевидным является вопрос. Если адаптация ВКЭ к клещам приводит к появлению таких мутантов с ГАГ-связывающим фенотипом, то подобные вирусы должны постоянно выявляться в клещах. Естественно нельзя ожидать, что все изоляты ВКЭ, выделенные из клещей, должны обладать таким фенотипом, поскольку неизвестно, на какой стадии адаптации в клещам находится этот вирус и как быстро такой вариант может отбираться в клещах в природных условиях, поскольку ВКЭ может длительное время циркулировать в популяции клещей без попадания в млекопитающих на счет трансфазовой или трансовариальной
Таблица 11. Характеристика вирусного потомства при смешанной инфекции клеток СПЭВ вариантом М и штаммом Эк-328 , взятых в разных соотношениях.
| Инокулят-множественность заражения (БОЕ/клетку) | Вирусное потомство | |||||
| Общая | Эк-328 | М вариант | Титр вируса lgБОЕ/мл | РИЭФ*** | ||
| общий | Эк-328* | вариантМ** | ||||
| 1,000 | 1,000 | - | 7,6 | 7,6 | - | + |
| 0,100 | 0,100 | - | 7,3 | 7,3 | - | + |
| 1,000 | - | 1,000 | 6,7 | -**** | 6,7 | - |
| 0,100 | - | 0,100 | 6,7 | -**** | 6,7 | - |
| 0,010 | - | 0,010 | 6,7 | -**** | 6,7 | - |
| 1,000 | 0,500 | 0,500 | 7,1 | 7,1 | 6,7 | + |
| 0,550 | 0,500 | 0,050 | 7,1 | 7,1 | 5,5 | + |
| 0,550 | 0,505 | 0,005 | 6,3 | 6,3 | - | + |
| 0,550 | 0,050 | 0,500 | 6,7 | 6,0 | 6,7 | - |
| 0,100 | 0,050 | 0,050 | 7,1 | 7,1 | 8,5 | - |
* - оценивали по количеству крупных бляшек; ** - оценивали по количеству точечных бляшек; *** - + - наличие катодного преципитата вирионов, - отсутствие катодного преципитата вирионов. В предварительных экспериментах было показано, что вирионы штамма ЭК-328, полученные при концентрировании КЖ, содержащей 6lgPFU, образуют катодный преципитат с АТ в РИЭФ. **** - как отмечалось ранее, так и данном эксперименте, при титровании варианта М иногда на фоне большого количества точечных бляшек можно было выявить 1-2 крупные бляшки.
передачи. Из клещей, собранных в разных регионах России, часто выделяют вирусы с мелкобляшечным фенотипом. Нами были просмотрено более 100 вируссодержащих клещевых суспензий, выделенных в разных регионах РФ. Более половины имели мелкобляшечный фенотип или представляли собой смешанную популяцию, которая в процессе лабораторных пассажей через мозг белых мышей или в культуре клеток СПЭВ превращались в вирусы с крупными бляшками (Карганова, 1991; Погодина и др., 1991; Карганова и др., 1992, 1994; неопубликованные данные). Часть из них были изучены подробнее, и было показано, что их свойства близки свойствам варианта М, в том числе у этих вирусов отсутствует ГА, вирионы не образуют преципитаты с АТ в РИЭФ. Естественно, нужны специальные исследования, чтобы установить, что представляют собой изоляты ВКЭ из клещей с мелкобляшечным фенотипом, связана ли мелкая бляшка с особенностями связывания вирионов в ГАГ клетками, и какую роль в их возникновении играет длительность пребывания в клещах. Тем не менее, очевидно, что в природной популяции в клещах циркулируют вирусы, обладающие фенотипом, близким адаптированному в лабораторных условиях к клещам варианту М, который представлен в данной работе.
Полученные данные относятся к лабораторной модели, которая не может быть просто экстраполирована на природную популяцию вируса КЭ. Тем не менее, описанный нами полиморфизм популяции вируса КЭ позволяет объяснить его способность к быстрой адаптации к новому хозяину. Схематично это можно объяснить следующим образом. Быстрое размножение вируса в новом хозяине осуществляется за счет активной репродукции либо уже присутствующих в популяции, либо вновь возникших мутантов, приспособленных к репродукции именно в этом виде хозяина. При этом основная популяция не может подавлять репродукцию этих мутантов, т.к. новый хозяин является для нее непермиссивной системой. При этом, по-видимому, наиболее неожиданные мутанты могут быть получены при репродукции вируса в совершенно новом хозяине, с которым этот вирус еще не встречался. Представленные нами данные показывают, что важную роль в этом играют мутации, определяющие начальные этапы взаимодействия вируса КЭ с клетками. Вероятно, определенное значение могут иметь и мутации, определяющие наиболее эффективное взаимодействие вирусной РНК и белков и клеточных факторов, формирующих репликативный комплекс, или участвующих в подавлении защитных средств клетки, в первую очередь, индукцию ИФН или ИФН сигнальные пути.
