Механизмы микроэволюции вируса клещевого энцефалита 03. 00. 06 вирусология
| Вид материала | Автореферат диссертации |
| Характеристика моноклонАТ Взаимодействие вирионов ВКЭ с рецепторами на поверхности клеток Изменение патогенетических характеристик ВКЭ при адаптации к клещам и переадаптации к млекопитающим |
- Международная научная конференция «клещевой энцефалит и другие инфекции, переносимые, 24.37kb.
- Приказ Федеральной службы по надзору в сфере защиты прав потребителей и благополучия, 89.3kb.
- Приказ №85 г. Петрозаводск от 15 марта 2007 года Об утверждении стандартов оказания, 153.88kb.
- Инструкция для участника запроса котировок, 513.56kb.
- Лекции по профилактике туберкулеза и клещевого энцефалита для проведения на уроках, 213.83kb.
- Конспект урока Тема: «Видообразование как результат микроэволюции», 92.92kb.
- Примерная программа наименование дисциплины «Вирусология и биотехнология» Рекомендуется, 844.41kb.
- План урока Понятие компьютерного вируса и троянской программы. Признаки заражения компьютера., 79.39kb.
- Область данных вирусной программы Завершаем запускающую программу Текст нерезидентного, 1055.5kb.
- Примерная программа дисциплины микробиология, вирусология, микробиология полости рта, 447.35kb.
a Аминокислотная позиция в соответствующем белке, нумерация с начала соответствующего белка
сорбированы на ГС, инкубированы в течение 1 часа при комнатной температуре при периодическом перемешивании. В отдельных пробирках готовили контрольные вирусы, которые выдерживали в тех же условиях. После адсорбции сефарозу осаждали, супернатант собирали. Полученные пробы несорбированного на сефарозе и контрольного вируса титровали методом бляшек в культуре клеток СПЭВ (Romanova et al., 2007). Сорбция вирионов адаптированного к клещам варианта М на ГС оказалась выше, чем у вирионов штамма Эк-328 (рис.3), т.е. М вариант обладает ГАГ-связывающим фенотипом.
Варианты с подобным ГАГ-связывающим фенотипом описаны для многих вирусов (Byrnes and Griffin, 2000; Hulst et al., 2000; Lin et al., 2000), в том числе и флавивирусов японского энцефалита (ЯЭ), лихорадки Западного Нила (ЛЗН) и энцефалита Долины Муррей (ЭДМ) (Lee and Lobigs, 2002; Lee et al., 2004), в частности ВКЭ (Mandl et al., 2001; Goto et al., 2003). Для всех подобных вариантов характерна низкая виремия и низкая НИ для лабораторных мышей.
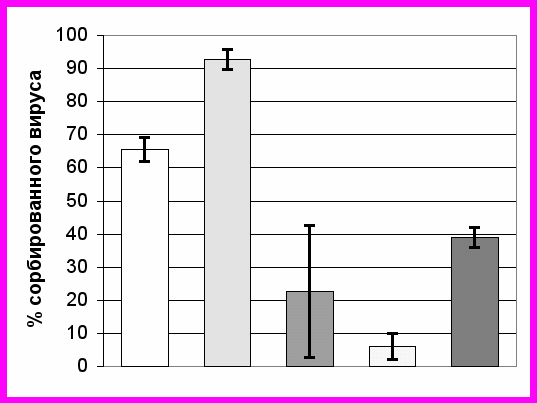
Рисунок 3. Процент вируса, сорбированного на ГС, для штамма ЭК-328, варианта М и клонов 160/57, 116/59 и 103/84.
ЭК-328 вар.М Клон клон клон
160/57 116/59 103/84
В наших экспериментах появление вируса с ГАГ-связывающим фенотипом наблюдали при адаптации штамма ВКЭ сибирского генотипа к клещам H. m. marginatum. Доктор Чунихин с соавт. (1986) адаптировали к клещам H. anatolicum 4 штамма ВКЭ, выделенных в Сибири и на дальнем Востоке. Во всех случаях в результате пассажей на клещах были получены мелкобляшечные варианты с низкой НИ для мышей. Вирионы всех полученных вариантов, подобно нашему варианту М, не образовывали преципитата с АТ в РИЭФ. Таким образом, разные штаммы ВКЭ имели сходную изменчивость при адаптации к клещам, относящимся к роду Hyalomma, которые не являются переносчиками этого вируса в природных очагах. Доктор Labuda с соавт. (1994) получили сходное изменение свойств ВКЭ при пассировании штамма европейского генотипа к клещам I.ricinus, которые являются основным переносчикам этого вируса. При этом авторы наблюдали снижение НИ вируса и выявили а.к. замену в позиции 84 белка Е, которая приводит к повышению положительного заряда вирионов и может обеспечивать ГАГ-связывающий фенотип полученного мутанта. Все перечисленные факты позволяют предположить, что появление вариантов ВКЭ с ГАГ-связывающим фенотипом является закономерностью при адаптации ВКЭ к клещам.
Для оценки влияния выявленных в белке Е замен на антигенные свойства вирусов были изучены вирионы штамма ЭК-328 и варианта М с помощью моноклональных АТ (моноклонАТ) в иммуноферментном анализе (ИФА) и с использованием преципитации меченых вирусных белков (РИП) из лизатов инфицированных клеток СПЭВ. Для сравнения брали штамм Софьин (дальневосточный генотип) и штамм Рс (европейский генотип) так, чтобы в реакции были представлены все 3 генотипа ВКЭ. ИФА проводили по непрямому методу (Романова и др., 2006). С помощью ИФА определили, что моноклонАТ E6B значительно слабее взаимодействуют с вариантом М, по сравнению со штаммами ЭК-328, Рс и Софьин (табл. 3). E6B является нейтрализующим и обладающим антиГА активностью моноклоном к эпитопу, принадлежащему к антигенному домену е2 белка Е, согласно эпитопной карте Цехановской с соавт. (1993). МоноклонАТ Е4А, не обладающие нейтрализующими и антиГА свойствами, также различили штамм ЭК-328 и вариант М.
Таблица 3. Сравнение антигенной структуры вирионов штамма Эк-328 и варианта М с помощью набора моноклональных АТ к белку Е.
| Сыворотка и моноклональные АТ | Характеристика моноклонАТ* | Антигены | |||||
| РНБ | РНБ | РНБ | Эк-328 | Вариант М | Софьин | Рс | |
| ИФА | |||||||
| Контр.сыворотка к ВКЭ | | | | 1600 | 800 | 1600 | 800 |
| Е4А | - | - | н.о. | >25600 | 64 | >25600 | >25600 |
| EB1 | - | - | е2 | >25600 | 12500 | >25600 | >25600 |
| E6B | + | + | е2 | >25600 | 640 | 25600 | 25600 |
| Иммунопреципитация радиоактивно меченных белков | |||||||
| 6B9 | - | - | е1-е2 | 0,9±0,2 | 0,5±0,1 | 0,2±0,1 | 0,5±0,1 |
| 7F10 | - | - | е1 | 1,4±0,3 | 0,7±0,2 | 0,2±0,3 | 0,2±0,2 |
| 4C7 | - | + | е1 | 0,7±0,2 | 0,6±0,3 | 0,0±0,1 | 0,3±0,1 |
| 10H10 | - | + | е2 | 1,7±0,3 | 1,9±0,3 | 2,7±0,4 | 1,3±0,2 |
| 13F2 | - | - | е2 | 0,1±0,1 | 0,2±0,1 | 0,1±0,2 | 0,4±0,2 |
* по опубликованным данным (Гайдамович и др., 1990; Протопопова и др., 1996, 1997).
В РИП оценивали количество белка, которое преципитируют моноклонАТ из лизатов клеток СПЭВ, инфицированных вышеперечисленными штаммами, по отношению к количеству белка, преципитированного из этого лизата g-глобулином против ВКЭ (Романова и др., 2006). МоноклонАТ 7F10 к эпитопу в домене е1 статистически достоверно более активно преципитировали белок Е штамма ЭК-328, по сравнению с вариантом М.
МоноклонАТ, различившие в данной работе белок Е варианта М и исходного штамма ЭК-328, связываются с эпитопами в разных антигенных доменах белка Е. Следовательно, изменение антигенной структуры у варианта М затрагивает удаленные эпитопы этого белка.
- Взаимодействие вирионов ВКЭ с рецепторами на поверхности клеток
Представленные выше данные показывают, что адаптация к клещам приводит к селекции вариантов ВКЭ с ГАГ-связывающим фенотипом. В связи с этим мы попытались более подробно изучить адсорбцию вирионов ВКЭ на клетках с целью лучше понять, какую роль в процессе проникновения вирионов в клетку могут играть ГАГ. К началу данного исследования сведения о природе рецепторов на поверхности клеток для флавивирусов и, в частности, для ВКЭ отсутствовали.
Для анализа связывания вирионов ВКЭ использовали штамм Софьин. Вирионы метили по РНК при выращивании в клетках почек зеленых мартышек 46-47 в присутствии [Н3]-уридина (Timofeev et al., 1991). Меченые вирионы концентрировали с помощью ультрацентрифугирования и использовали для экспериментов по адсорбции на клетках СПЭВ. Клетки выращивали в 96-лучночных пластинах. К монослоям добавляли возрастающие концентрации меченого вируса. Проводили адсорбцию в течение 2 часов при +40С. После адсорбции собирали не связавшийся с клетками вирус, промывали клеточный монослой средой и собирали клетки. Определяли количество связавшегося и свободного вируса. Полученные результаты представляли в координатах Скэтчарда (Scatchard, 1949). Взаимодействие лиганда с одним рецептором в этих координатах описывается прямой линией, которая отсекает на оси ординат константу связывания, а на оси абсцисс – количество рецепторов данного типа. Если лиганд связывается с двумя или большим количеством типов рецепторов, то в данной системе процесс описывается гиперболой или линией более высокого порядка. Асимптоты к плечам гиперболы характеризуют соответствующие типы рецепторов, которые различаются аффинностью связывания с лигандом. Под одним типом рецепторов могут выступать химически разные молекулы.
Как видно на рис. 4, в координатах Скэтчарда взаимодействие вирионов ВКЭ с клетками описывается гиперболой. Один из рецепторов характеризуется высокой константой связывания и представлен небольшим количеством на поверхности клеток. Второй, низкоаффинный рецептор, связывает практически все вирионы ВКЭ. Таким образом, адсорбция вирионов ВКЭ на клетках обусловлено взаимодействием с двумя типами рецептором: высокоаффинными и низкоаффинными.
+ - экспериментальные данные;
— -аппроксимированная кривая;
— асимптоты к аппроксимированной кривой. Аппроксимированная кривая рассчитана методом наименьших квадратов. Асимптоты рассчитаны, согласно работе Варфаламеева и др. (1980).
Рис.4. Результаты связывания меченных [3H]-уридином вирионов ВКЭ на монослое клеток СПЭВ, выраженные в координатах Скэтчарда.
Для выяснения природы клеточных рецепторов, обуславливающих вышеописанные взаимодействия вирионов ВКЭ с клетками, клетки СПЭВ обрабатывали раствором ТРСК-трипсина в течение 15 минут при комнатной температуре и проводили адсорбцию меченого вируса. Обработка клеток трипсином полностью блокировала высокоаффинное связывание вирионов с клетками. Эти данные позволили сделать предположение о белковой природе высокоаффинного рецептора.
Для более детального изучения предполагаемого клеточного белкового рецептора была получена антиидиотипическая сыворотка к поверхностному гликопротеину Е ВКЭ. Для этого мыши были однократно иммунизированы 50мкг
очищенного белка Е (Timofeev et al., 1991). Для получения сыворотки у мышей была взята кровь из супраорбитальной вены на 9 (нормальный иммунный ответ на введение антигена) и 35 сутки после иммунизации (время максимального накопления антиидиотипических антител). Сыворотка мышей, взятая на 9 сутки после иммунизации, преципитировала из лизата клеток СПЭВ, инфицированных ВКЭ, белок Е. Сыворотка, взятая у тех же мышей на 35 сутки после иммунизации белком Е, содержала антиидиотипические антитела к этому белку, поскольку в ИФА при взаимодействии с иммуноглобулином против ВКЭ вела себя, как антиген.
Обработка клеток сывороткой с антиидиотипическими антителами перед адсорбцией вируса практически полностью блокировала связывание вирионов ВКЭ на высокоаффинном рецепторе. Данная сыворотка в РИП белков, меченных смесью [C14]-аминокислот или [C14]-глюкозамином, из лизатов незараженных клеток СПЭВ преципитировала только гликопротеин с мол. массой около 110 кДа.
В последствие появился ряд работ, в которых с помощью антиидиотипических поликлональных и моноклонАТ был выявлен целый набор претендентов в рецепторы для вирионов ВКЭ (Протопопова и др, 1996, 1997; Kopecky et al., 2005). С помощью моноклонАТ к нейтрализующим моноклонАТ к белку Е (в том числе к использованным в данной работе Е6В) из нескольких культур клеток были выделены белки с мол. массами 43, 67, 110, 210 кДа (Протопопова и др., 1996, 1997). Было показано, что белок 110 кДа является β1-цепью, а белок 210 кДа –α3-цепью интегрина. Для вирусов ЛЗН и ЯЭ так же показано, что αvβ3-интегрин является общим для этих вирусов рецептором на поверхности клеток Vero, HeLa, N2A (клетки мышиной нейробластомы) (Chu and Ng, 2004), и этот рецептор опосредует проникновение вирионов в клетку.
Выявленный белок с мол. массой 67 кДа оказался - ламининсвязывающим белком (ЛСБ) и был предложен авторами в качестве рецептора для ВКЭ с константой связывания 2,5х107 М-1, т.е. низкоаффинного рецептора (Protopopova et al., 1997; Локтев и др., 2002). Представленные данные позволяют высказать предположение, что на поверхности белка Е ВКЭ есть участок, структурно близкий рецепторной области ламинина, который может взаимодействовать с разными типами рецепторов для ламинина. Таким образом, взаимодействие ЛСБ и ГАГ с белком Е ВКЭ может иметь сходный механизм, поскольку ГАГ могут выполнять функции ко-рецепторов для ламинина.. Выявленная нами замена в 122 позиции белка Е глутаминовой кислоты на глицин, повышает положительный заряд белка Е и приводит к повышению связывания с ГАГ клетки. В наших экспериментах, в отличие от родительского штамма ЭК-328 вариант М, имеющий такую замену, слабо взаимодействует с моноклонАТ Е6В к эпитопу белка Е ВКЭ, отвечающему за связывание с ЛСБ на поверхности клетки. Это позволяет предположить, что ГАГ и ЛСБ могут служить в качестве одного из ко-рецепторов для разных вариантов ВКЭ, при этом адаптация к новому хозяину может сопровождаться изменением связывания с этими рецепторами.
Таким образом, нами впервые было показано, что ВКЭ имеет два типа рецепторов на поверхности клетки: высокоаффинный, по-видимому, белковой природы, с которым связывается менее 1% сорбированных вирионов, и низкоаффинный, с которым связывается основная масса вирионов ВКЭ.
- Изменение патогенетических характеристик ВКЭ при адаптации к клещам и переадаптации к млекопитающим
Сравнение вирулентности штамма Эк-328 и варианта М проводили на мышах линии Balb/c разного возраста, которые были инокулированы и/ц и интраперитонеально (и/п). Для сравнения использовали штамм Абсеттаров ВКЭ, обладающий высокой нейроинвазивностью для мышей этой линии.
Как видно из табл. 4, все изученные вирусы обладали близкой нейровирулентностью для мышей 6 и 12 г. В экспериментах на взрослых мышах штамм Эк-328 продемонстрировал несколько меньшую НИ, чем штамм Абсеттаров, исходя из данных о количестве БОЕ, необходимых для того, чтобы вызвать 50% гибель животных. НИ варианта М была в 10000 раз ниже, чем у штамма ЭК-328.
Таблица 4. Вирулентность штамма Эк-328, варианта М и штамма Абсеттаров ВКЭ для мышей BALB/c разного возраста
| вирусы | и/ц заражение | и/п заражение | |||
| Мыши 5-7г | Мыши 12 г | Мыши 5-7г | |||
| ЛД50(БОЕ) | СПЖ(сутки)* | ЛД50(БОЕ) | ЛД50(БОЕ) | СПЖ(сутки)** | |
| Абсеттаров | 0,1 | 4,2±0,2 | 0,1 | 3 | 9,90,5 |
| ЭК-328 | 0,5 | 5,0±0,0 | 0,5 | 18 | 121,2 |
| Вариант М | 0,4 | 5,1±0,3 | 2,5 | 250 000 | 5 месяцев *** |
* доза заражения 5,5 lg ЛД50; ** доза заражения 10 ЛД50; *** - период наблюдения.
Для характеристики инфекции мыши линии Balb/c 12г были инокулированы и/п 1000 БОЕ данными вирусами. Ежедневно у 3-х мышей брали кровь и органы, содержание инфекционного вируса в которых определяли методом бляшек. На 7-8 день по три мыши для каждого вируса были использованы для патоморфологического исследования.
У мышей, инфицированных штаммом Абсеттаров, после и/п введения 1000 БОЕ инфекция протекала остро. Все животные заболели на 6-7 сутки и к 9 дню погибли. Гистологическое исследование выявило характерную для ВКЭ картину менингоэнцефалита. У животных наблюдали двухволновую виремию с более выраженным вторым пиком (табл. 5). В мозгу вирус появлялся, начиная с 5 суток.
Таблица 5. Динамика появления инфекционного вируса (lgБОЕ/мл 10% суспензии) в крови органах и противовирусных АТ (ИФА) в сыворотках мышей после и/п введения 1000 БОЕ штаммов Абсеттаров, Эк-328 и варианта М
| штамм Абсеттаров | ||||||||
| | дни после начала инфекции | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| Кровь* | 2 | 2,7 | 2,7 | 0 | 2 | 4 | 2,7 | 4,1 |
| мозг | 0 | 0 | 0 | 0 | 4,8 | 6,6 | 7,8 | 7,6 |
| л/у | 0 | 0 | 2 | 0 | 0 | 3 | 0 | 0 |
| селезенка | 0 | 4,7 | 2,4 | 3,9 | 4,9 | 4 | 0 | 5,8 |
| AT | 0 | 0 | 0 | 160 | 160 | 320 | 320 | 320 |
| штамм ЭК-328 | ||||||||
| | дни после начала инфекции | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| Кровь | 2,3 | 4,3 | 4,1 | 0 | 2,3 | 2 | 0 | 0 |
| мозг | 0 | 0 | 0 | 3,2 | 4,3 | 4,7 | 6,8 | 7,2 |
| л/у | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 0 |
| селезенка | 2 | 3 | 3,2 | 3,7 | 3,4 | 2,7 | 0 | 4,7 |
| AT | 0 | 0 | 0 | 160 | 160 | 160 | 320 | 320 |
| вариант М | ||||||||
| | дни после начала инфекции | |||||||
| | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Кровь | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| мозг | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| л/у | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 3 |
| селезенка | 0 | 0 | 0 | 0 | 3** | 2,7** | 0 | 0 |
| АТ | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
При инфицировании мышей 1000 БОЕ штамма Эк-328 наблюдали также острую инфекцию с двухволновой виремией с более выраженным первым пиком. В мозге мышей вирус появлялся на сутки раньше, чем при инфекции вызванной штаммом Абсеттаров, однако животные заболевали только на 8-9 сутки, погибая к 11 дню. При гистологическом исследовании был обнаружен менингоэнцефалит.
Введение 1000 БОЕ варианта М и/п не вызвало никаких признаков заболевания у 49 из 50 зараженных животных. Гистологический анализ не обнаружил каких-либо специфических повреждений в ЦНС инфицированных животных. Нам не удалось выявить инфекционный вирус в крови мышей, инфицированных вариантом М, в лимфоузлах и селезенках был найден вирус в невысоких титрах. У одной мыши из 50 на 7 сутки после начала инфекции наблюдали типичную для КЭ картину заболевания.
Сыворотки мышей, инфицированных штаммами Абсеттаров, Эк-328 и вариантом М были проверены на наличие противовирусных антител с помощью ИФА. При острой инфекции в сыворотках мышей, инфицированных шт. Абсеттаров и Эк-328, противовирусные АТ появлялись на 4 сутки после начала инфекции (табл. 5). При инаппарантной инфекции, вызванной вариантом М, нам не удалось с помощью ИФА выявить противовирусные АТ.
Сыворотки мышей, инфицированных штаммом Абсеттаров и вариантом М, полученные на 6 сутки после заражения, были проанализированы с помощью РИП вирусных белков из лизатов инфицированных клеток. Сыворотка мышей, зараженных штаммом Абсеттаров, преципитировала белок Е и высокомолекулярные неструктурные белки NS1, NS3 и NS5 из лизатов клеток СПЭВ, инфицированных как штаммом Абсеттаров, так и вариантом М. С помощью сыворотки мышей, зараженных вариантом М, никакие вирусные белки выявлены не были. С помощью лизата клеток СПЭВ, инфицированных дефектным аденовирусом Rad51, несущим ген белка NS1 вируса КЭ (Timofeev et al., 1998), мы выявили в небольших количествах АТ к белку NS1 в сыворотках мышей, инфицированных вариантом М, взятых на 7 и 28 дни инфекции.
Через 3 недели и 5 месяцев после и/п введения 1000 БОЕ варианта М мыши были умерщвлены, у них были взяты головной мозг, селезенки, лимфоузлы, а также были получены сгустки крови. Ни в исходных гомогенатах органов, ни в материалах после двух слепых пассажей этих гомогенатов в культуре клеток СПЭВ инфекционный вирус не был обнаружен. На эти сроки в мозге и селезенках мышей, инфицированных вариантом М, на фоне введения циклофосфана не удалось выявить вирусную РНК с помощью предложенного нами варианта ОТ-ПЦР с внутренним контролем (Романова и др., 2006).
В те же сроки через 3 недели и через 5 месяцев после и/п введения 1000 БОЕ варианта М мыши были разрешены 100 ЛД50 штамма Абсеттаров. Все мыши, предварительно инфицированные вариантом М, были защищены от последующего введения вирулентного вируса КЭ. Формирование длительного протективного иммунитета после и/п введения варианта М было показано в трех независимых экспериментах.
Отсутствие клинических признаков заболевания и повреждений в ЦНС показывают, что вариант М при и/п введении мышам вызывает инаппарантную форму инфекции, характеризующуюся отсутствием вируса в крови и ЦНС, хотя чувствительность использованного метода (45 БОЕ в пробе) не позволяет полностью исключить попадание небольшого количества вируса и его персистенции в ЦНС.
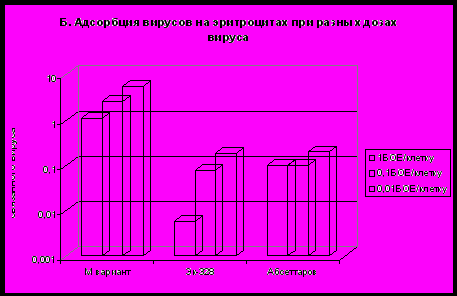
Для ГАГ-связывающих мутантов переносимых комарами флавивирусов ЯЭ и ЭДМ было показано, что после внутривенного введения вируса они быстро попадают в печень, где, по-видимому, элиминируются макрофагами печени (Lee and Lobigs, 2003). Вирионы могут попадать в печень в свободном состоянии или связанными с клетками крови. Мы проверили сорбцию вирионов изучаемых вирусов на эритроцитах мыши. Для этого у здоровых мышей были взяты эритроциты, к эритроцитам были добавлены вирусы. После инкубации несвязавшийся с клетками вирус был собран, и были определены титры свободного и связанного с эритроцитами вируса. На рис. 5А представлена динамика сорбции вирионов родительского штаммов Абсеттаров, ЭК-328, и варианта М на эритроцитах мыши. Насыщение эритроцитов вирионами происходит в первые 10 мин после добавления вируса. На рис. 5Б показана доля связанного вируса при разных соотношениях эритроцитов и вирионов. В любых условиях доля вирионов варианта М, связанных с эритроцитами, в 50-100 раз больше, чем этот показатель для штаммов Эк-328 и Абсеттаров.
Для оценки активации раннего неспецифического противовирусного иммунного ответа проводили определение содержания /-ИФН, ФНО-, ИЛ-10 и ИЛ-12 в крови мышей на начальных этапах инфекции после и/п введения 1000 БОЕ вирусов в виде вируссодержащей мозговой суспензии или КЖ инфицирпованных клеток СПЭВ.
Содержание /-ИФН в сыворотках крови, взятых от трех мышей через разные сроки после начала инфекции, определяли по подавлению цитопатического действия (ЦПД) вируса энцефаломиокардита мышей (ЭММ) (Бабаянц и др., 1985). В качестве контроля использовали сыворотку от трех мышей, которым вместо вируса вводили мозговую суспензию (МС) от здоровых мышей в соответствующем разведении. В сыворотке крови контрольных мышей через 5 часов после введения МС от здоровых мышей обнаружили /-ИФН в титрах 1:8, который отсутствовал в пробе, взятой через следующие 5 часов. Как представлено на рис. 6, штамм ЭК-328 оказался слабым индуктором ИФН 1 типа.
Рис. 5. Характеристика адсорбции штаммов Абсеттаров,
Эк-328 и
варианта М на эритроцитах мыши.

Штамм Абсеттаров и вариант М индуцировали /-ИФН в сопоставимых титрах, но при инфекции, вызванной вариантом М, ИФН появлялся в крови животных уже через 5 часов, а у мышей, зараженных штаммом Абсеттаров, только через 10 часов после введения вируса.
Уровень остальных ключевых цитокинов в сыворотках крови животных, зараженных и/п 1000 БОЕ штаммов Абсеттаров, ЭК-328 и варианта М в виде КЖ инфицированных клеток СПЭВ, устанавливали с помощью коммерческих наборов для определения соответствующих цитокинов методом ИФА. Количество цитокинов в сыворотках крови инфицированных мышей сравнивали с уровнем цитокинов в контрольных сыворотках, полученных от животных, которым и/п была введена питательная среда 199.
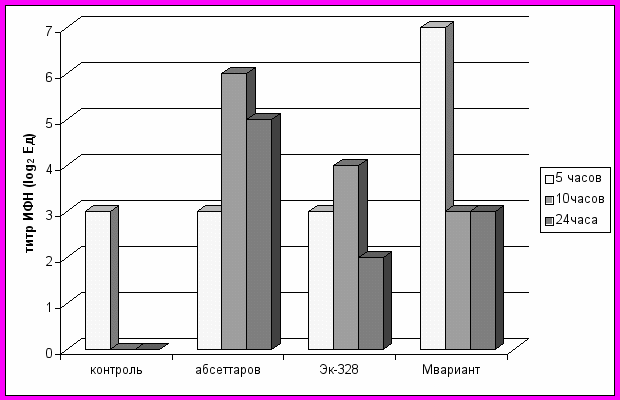
Рис. 6. Динамика появления ИФН-1типа в сыворотках мышей, и/п инфицирован-ных штаммами Абсеттаров, Эк-328 и вариантом М в дозе 1000БОЕ.
В первые часы после заражения животных изучаемыми штаммами ВКЭ мы наблюдали повышение в крови уровня ФНО- и ИЛ-10. ФНО- является провоспалительным цитокином (табл. 6). Его появление в крови свидетельствует об активации макрофагов и нейтрофилов. ФНО- индуцирует синтез ИЛ-10, а ИЛ-10 в свою очередь, подавляет синтез ФНО- (van der Pool et al., 1994). В нашем эксперименте ИЛ-10 выявляли одновременно с ФНО-, после чего концентрация ФНО- в крови животных понижалась до уровня контроля. Известно, что ИЛ-10, являясь регулятором иммунных реакций, подавляет продукцию таких основных провоспалительных цитокинов, как ИЛ-6, ФНО-, экспрессию на клеточной мембране МНС-II и антигенпрезентирующую способность моноцитов/макрофагов, продукцию цитокинов Тh-1 лимфоцитами (-ИФН, ИЛ-2), продукцию цитокинов натуральными киллерами (НК), пролиферацию Т-лимфоцитов (Кашкин, 1998). Таким образом, ВКЭ, попадая в организм мыши, индуцирует состояние иммунодепрессии у инфицированных животных в первые часы после заражения, при этом штаммы ВКЭ могут различаться по выраженности и длительности вызываемой ими иммунодепресии.
В отличие от штамма Абсеттаров через 10 часов после заражения штаммом ЭК-328 и вариантом М в крови мышей в высоких концентрациях выявляли ИЛ-12, который на ранних стадиях инфекции свидетельствует об активации антигенпрезентирующих и фагоцитирующих клеток (Хаитов и Пинегин, 2000; Biron & Sen, 2002). Появление в крови этого интерлейкина и /-ИФН может приводить к активации НК.
Таблица 6. Концентрация цитокинов в сыворотках крови мышей на ранних этапах инфекции после и/п введения 1000 БОЕ шт. Абсеттаров, ЭК-328 и варианта М (пкг/мл)
| вирус | ФНО- | ИЛ-10 | ИЛ-12 | |||
| 5 ч | 10 ч | 18 ч | 10 ч | 18 ч | 10 ч | |
| Абсеттаров | К | 107±19 | К | 301±30 | 20±0 | К |
| ЭК-328 | К | К | 75±10 | К | 75±10 | 352±42 |
| ВариантМ | К | 116±32 | К | 151±20 | 1 118±21 | 348±21 |
Примечание: концентрация ИЛ в контрольных сыворотках крови (К), полученных от животных после введения среды 199 на растворе Эрла (пкг/мл): ФНО- - 23±3; ИЛ-10 – 8±4; ИЛ-12 - 131±56.
На 4-е сутки у животных, зараженных штаммом Абсеттаров, в сыворотках крови обнаруживали ИЛ-6 и незначительное количество -ИФН (табл. 7). У животных, зараженных шт. ЭК-328, ИЛ-6 и -ИФН появились на сутки раньше. Повышение концентрации ИЛ-6 свидетельствует об активации Th2-лимфоцитов, которые обеспечивают формирование гуморального иммунного ответа. Об этом свидетельствует и появление в это время противовирусных антител в сыворотках крови мышей, инфицированных штаммами Абсеттаров и Эк-328. Продукция -ИФН связана с активностью ИЛ-12. При инфекции штаммом Абсеттаров мы наблюдали однократный подъем уровня ИЛ-12 на 2 сутки, а при инфекции шт. ЭК-328 – двукратный подъем через 10 часов и на 4 сутки после заражения животных. При этом второе повышение количества ИЛ-12 в крови мышей, инфицированных штаммом ЭК-328, не сопровождалось последующей продукцией -ИФН.
При инфекции вариантом М на 3 сутки в крови животных повысился уровень ИЛ-2 и -ИФН. Это говорит об активации Th1-лимфоцитов, которые обеспечивают развитие клеточного иммунитета. -ИФН в крови животных далее выявлялся на протяжении всего срока наблюдения.
На 7 сутки после заражения в крови мышей, инфицированных штаммом Абсеттаров, обнаружили в высоких титрах ИЛ-10, -ИФН, ИЛ-6 и ФНО-. В эти же сроки отмечали выраженные симптомы заболевания, высокий титр инфекционного вируса в крови и мозге, развитие менингоэнцефалита. Уровень ИЛ-6 в сыворотке крови животных, заболевших на 7-е сутки после и/п введения 1000 БОЕ штамма ЭК-328, также был высоким. Появление провоспалительных цитокинов в крови инфицированных животных в высоких титрах на этой стадии острого заболевания КЭ свидетельствует о выраженном патологическом процессе в ЦНС и нарушении гематоэнцефалического барьера.
Таблица 7. Концентрация цитокинов в сыворотках крови мышей после и/п введения 1000 БОЕ штаммов Абсеттаров, Эк-328 и варианта М (пкг/мл)
| штамм Абсеттаров | |||||||
| Цитокины | Срок после заражения животных | ||||||
| | 1 сут | 2 сут | 3 сут | 4 сут | 5 сут | 6 сут | 7 сут |
| ФНО- | К | К | К | К | К | К | 31543 |
| ИЛ-10 | 10134 | К | К | К | К | К | 4514 1 |
| -ИФН | К | К | К | 275 | 39 | К | 28436 |
| ИЛ-12 | К | 32817 | К | К | н/и | н/и | н/и |
| ИЛ-6 | К | К | К | 699 | К | К | 64085 |
| ИЛ-2 | К | К | К | К | К | К | К |
штамм ЭК-328
| Цитокины | Срок после заражения животных | ||||||
| 1 сут | 2 сут | 3 сут | 4 сут | 5 сут | 6 сут | 7 сут | |
| ФНО- | К | К | К | К | 1074 | К | н/и |
| ИЛ-10 | К | К | К | К | К | К | 331 1 |
| -ИФН | К | К | 302 | 494 | К | К | н/и |
| ИЛ-12 | К | К | К | 29298 | н/и | н/и | н/и |
| ИЛ-6 | К | К | 746 | К | К | К | 1139 |
| ИЛ-2 | К | К | К | К | К | К | н/и |
вариант М
| Цитокины | Срок после заражения животных | ||||||
| 1 сут | 2 сут | 3 сут | 4 сут | 5 сут | 6 сут | 7 сут | |
| ФНО- | К | К | К | К | К | К | К |
| ИЛ-10 | 78 | К | К | 121 | 315 | К | К |
| -ИФН | К | К | 965 | 428 | 11667 | 10114 | 16770 |
| ИЛ-12 | К | 41442 | К | К | н/и | н/и | н/и |
| ИЛ-6 | К | К | К | К | К | К | 576 |
| ИЛ-2 | К | К | 253 | К | 416 | К | 396 |
Примечание: концентрация ИЛ в контрольных сыворотках крови (К), полученных от животных после введения среды 199 на растворе Эрла (пкг/мл): ФНО- - 233; ИЛ-10 – 84; -ИФН - 25±2; ИЛ-12 - 131±56; ИЛ-6 - 16±1; ИЛ-2 – 103. 1 – указаны данные для заболевших животных; у мышей без клинических проявлений болезни содержание ИЛ в указанный срок было К.
При инаппарантной инфекции, вызванной вариантом М, на 7 сутки после заражения мы наблюдали присутствие в крови в небольших концентрациях ИЛ-2, ИЛ-6 и -ИФН. При этом все животные были клинически здоровы, вирус из головного мозга не выделялся, и патоморфологическое исследование ЦНС не выявило каких-либо изменений. Наличие в крови ИЛ-2, ИЛ-6 и -ИФН свидетельствует о развитии к 7-м суткам после заражения сбалансированного (Th1 и Th2) иммунного ответа при данном типе инфекции.
Таким образом, инаппарантная форма КЭ, вызванная вариантом М, характеризуется развитием более раннего неспецифического иммунного ответа и развитием сбалансированного специфического иммунного ответа. Острая форма КЭ, вызванная штаммами Абсеттаров и ЭК-328, характеризуется более поздней активацией неспецифического иммунитета и преобладанием выраженного гуморального ответа, которого оказывается недостаточно для предотвращения развития заболевания.
