Механизмы микроэволюции вируса клещевого энцефалита 03. 00. 06 вирусология
| Вид материала | Автореферат диссертации |
- Международная научная конференция «клещевой энцефалит и другие инфекции, переносимые, 24.37kb.
- Приказ Федеральной службы по надзору в сфере защиты прав потребителей и благополучия, 89.3kb.
- Приказ №85 г. Петрозаводск от 15 марта 2007 года Об утверждении стандартов оказания, 153.88kb.
- Инструкция для участника запроса котировок, 513.56kb.
- Лекции по профилактике туберкулеза и клещевого энцефалита для проведения на уроках, 213.83kb.
- Конспект урока Тема: «Видообразование как результат микроэволюции», 92.92kb.
- Примерная программа наименование дисциплины «Вирусология и биотехнология» Рекомендуется, 844.41kb.
- План урока Понятие компьютерного вируса и троянской программы. Признаки заражения компьютера., 79.39kb.
- Область данных вирусной программы Завершаем запускающую программу Текст нерезидентного, 1055.5kb.
- Примерная программа дисциплины микробиология, вирусология, микробиология полости рта, 447.35kb.
Особенности эволюции переносимых клещами флавивирусов
К началу данного исследования были известны полные геномы только для двух штаммов ВКЭ (Плетнев и др., 1989; Pletnev et al., 1990; Mandl et al., 1990, 1991). В настоящее время в Генбанке представлено 28 полных геномов для 25 штаммов этого вируса.
Был проведен филогенетический анализ с использованием известных полных геномов штаммов ВКЭ и переносимых клещом I. ricinus флавивирусов, вызывающих энцефаломиелиты у домашних животных (рис. 1). Вирусы разделились на две группы. В первую группу вошли 5 европейских штаммов ВКЭ в виде одной группы и вирусы шотландского энцефаломиелита овец (ШЭО), испанского энцефаломиелита овец (ИЭО), турецкого энцефаломиелита овец (ТЭО) и греческого энцефаломиелита коз (ГЭК). Для каждого из этих вирусов известен геном только для одного штамма. Вторая группа достоверно разделилась на несколько ветвей. Отдельную ветвь представляют штаммы, относящиеся к сибирскому генотипу, две отдельные ветви - иркутские штаммы 178-79 и 886-84, выделенные в 1979 и 1984 годах, соответственно, и отдельную ветвь формирует дальневосточный генотип вируса.
Дивергенция геномов штаммов внутри европейского генотипа до 3%, внутри дальневосточного - до 6,5%, и до 7,8% - у сибирского генотипа. Обращает на себя внимание, что штаммы, относящиеся к одному генотипу, очень близки между собой, несмотря на большую разницу во времени выделения.
Штаммы, относящиеся в сибирскому генотипу, почти равно удалены от европейского и дальневосточного на 17,1-18,2% и 16,3-17,29%, соответственно. Штамм ЭК-328, для которого нами была определена последовательность полного генома, принадлежит сибирскому подтипу и образует отдельную ветвь внутри него.
Штаммы 178-79 и 886-84 отличаются друг от друга на 13,2%, и на 12,2-14,3% от представителей ближайшего к ним дальневосточного генотипа. Эти отличия значительно больше, чем между штаммами внутри генотипов ВКЭ, и близки к уровню дивергенции европейского генотипа ВКЭ и вирусов ШЭО и ИЭО. Эти значения и данные филогенетического анализа свидетельствуют о том, что иркутские штаммы представляют собой два новых генотипа. Различия между дальневосточными и сибирскими штаммами превышают или на уровне различий между европейскими штаммами и вирусами ШЭО, ТЭО, ИЭО, ГЭК.
Одним из актуальных в вирусологии вопросов является определение понятия вида. Критериями объединения в один вид считаются следующие факторы: возможность рекомбинации геномов, наличие общего хозяина, данные филогенетического анализа и молекулярной дистанции и др. У флавивирусов, переносимых комарами, была зарегистрирована внутритиповая рекомбинация (Holmes et al., 1999; Baillie et al., 2008). Проведенный нами анализ 26 геномов штаммов ВКЭ с помощью программы “Simplot” не выявил признаков рекомбинации.
Grard с соавт. (2007) предложили, чтобы все флавивирусы, переносимые клещами I.ricinus и I. persulcatus, были отнесены к одному виду – вирус клещевого энцефалита. По предложению Kuno с соавт. (1998) у флавивирусов в

Рис.1. Филогенетическое дерево для полных геномов (без концевых 16 нуклеотидов (нт)) штаммов ВКЭ и вирусов, переносимых клещом I. ricinus: SSEV – вирус ИЭО, LIV – ШЭО, TSEV – вирус ТЭО, GGEV - вирус ГЭК. Алгоритм neighbour joining.
вид объединяются вирусы, имеющие общего переносчика, с процентом гомологии более 84%. Если все вирусы объединить в один вид ВКЭ, уровень дивергенции геномов внутри вида будет достигать 21,5%. С другой стороны, все
вирусы можно разделить на два вида: вирусы, переносимые клещом I.persulcatus,
и вирусы, переносимые клещом I. ricinus. Уровни дивергенции геномов внутри вида будут достигать 16,4% и 17,1%, соответственно. В это случае, встает вопрос о вариантах ВКЭ, относящихся к дальневосточному и европейскому генотипам и циркулирующих в Юго-Восточной Азии без участия этих видов клещей (Takashima et al., 1997; Kim et al., 2008).
В любом случае, очевидно, что основным фактором эволюции на уровне вида для переносимых клещами флавивирусов млекопитающих является вид основного переносчика вируса. Независимо от того, как будут названы группы вирусов с разными переносчиками (видом или подвидом), рицинусная группа вирусов, очевидно, состоит из 4 субтипов: европейский генотип ВКЭ, вирус ШЭО, вирус ИЭО и подгруппа, включающая вирусы ГЭК и ТЭО. Персулькатусная группа также включает 4 субтипа: дальнейвосточный, сибирский и субтипы, представленные штаммами 178-79 и 886-84.
Для многих вирусов основным фактором, определяющими эволюцию внутри вида, является иммунный ответ хозяина. Анализ представленных в Ген-банке данных для фрагментов РНК, длиной 1020 нуклеотидов, кодирующих большую часть поверхностного белка Е, который отвечает за формирование гуморального иммунитета при флавивирусной инфекции, показал высокую гомология генов этого белка у штаммов, относящихся к одному генотипу и значительно отличающихся по времени выделения. Например, ген белка Е штамма Эк-328 отличается от эстонского штамма, выделенного через 30 лет, всего 3 нуклеотидными заменами.
При анализе известных 27 полных геномов 25 штаммов ВКЭ мы выявили 40 аминокислотных остатков, различающих рицинусные и персулькатусные вирусы, и всего 4 сайта, которые различаются у вирусов КЭ и вирусов энцефаломиелита домашних животных. Мы не нашли сайты, которые различали бы все рицинусные и персулькатусные субтипы, но выявили 15 сайтов, различающих все три генотипа ВКЭ. Только один из них находится в белке Е. Это означает, что разделение на генотипы не связано с уходом вируса от гуморального иммунного ответа прокормителей.
Таким образом, для ВКЭ характерно существование стабильных в течение большого периода времени локальных популяций, привязанных к географическому месту, циркуляция нескольких генотипов в одном и том же очаге и незначительное селективное воздействие иммунной системы хозяина на уровне гуморального иммунитета. Об этом говорят следующие данные: идентичность белков Е вирусов, выделенных на определенной территории с интервалом более 30 лет; наличие всего 1 позиции в гене белка Е, различающей генотипы ВКЭ; антигенная близость в серологических реакциях штаммов ВКЭ, принадлежащих к разным генотипам (Clarke, 1960, 1964; Calisher et al., 1989); случаи несовпадения принадлежности штаммов ВКЭ к определенному генотипу и серотипу (Злобин и др., 2003; Погодина и др., 2004); эффективность инактивированных вакцин на основе дальневосточных и европейских штаммов на всей территории РФ, где в основном представлены другие генотипы вируса (Леонова и др., 2004; Романенко и др., 2007).
- Изменение свойств вируса КЭ при адаптации к клещам и млекопитающим и выявление хозяин-специфических генетических детерминант
Ранее рядом авторов, в том числе и нами, для разных штаммов ВКЭ и вируса Повассан было показано, что репродукция в клещах и млекопитающих оказывает разное селективное воздействие на вирусы (Дживанян и др. 1975; Чунихин и др., 1975; Чунихин и Дживанян, 1977; Khozinskaya et al., 1985; Дживанян и др., 1986, 1988, 1991; Чунихин и др., 1986; Kaluzova et al., 1994; Labuda et al., 1994). Адаптация ВКЭ к клещам разных видов способствует отбору вариантов, обладающих сниженной нейроинвазивностью (НИ), т.е. вирулентностью при периферическом заражении мышей, и сниженной гемагглютинирующей активностью (ГА). Репродукция ВКЭ в клетках млекопитающих, напротив, способствует повышению НИ и ГА.
В данной работе использовали штамм ВКЭ ЭК-328 и полученный из него в результате 17 парэнтеральных пассажей на клещах H. m. marginatum вариант М (в оригинальных работах - вариант 718/574) (Чунихин и Дживанян, 1977; Сhunikhin and Dzhivanyan, 1979; Дживанян и др., 1986, 1988, 1991). Клон 718/574 хранился в течение 10 лет при -200С и прошел еще 2 дополнительных пассажа через мозг б/п мышей. Мы назвали его вариантом М и показали, что по основным свойствам этот вирус не отличается от варианта 718/574. Методы, использованные при изучении вирусов, описаны в работе Romanova et al. (2007). Основные характеристики штамма Эк-328 и варианта М приведены в табл. 1.
Способ получения и основные свойства варианта М указывают на то, что этот вирус имеет селективное преимущество при репродукции в клещах. В этом заключении мы основываемся на нижеследующих соображениях. 1) В ранней работе в процессе двух независимых линий пассажей на клещах штамма ЭК-328, клонированного и без предварительного клонирования, сначала появлялась примесь мелкобляшечного вируса в популяции, а затем при последующих пассажах происходило вытеснение крупных бляшек мелкими (Чунихин и др., 1977, 1979; Т.И. Дживанян, личное сообщение). 2) Вариант М имеет более высокие титры при репродукции в клещах, чем родительский штамм ЭК-328. 3) В клетках СПЭВ у варианта М замедленный цикл репродукции, количество вируса, связанного с клетками, выше, чем количество свободного вируса.
Таблица 1. Характеристики родительского штамма ЭК-328 ВКЭ и адаптированного к клещам H. m. marginatum варианта М
| Характеристики | Штамм Эк-328 | Вариант М |
| титр вируса в клещах H. marginatum | 5,2+0,2 lgБОЕ/клещ | 6,9+0,2 lgБОЕ/клещ |
| титр вируса в мозге мышей после интрацеребрального (и/ц) заражения | 9,0+0,3 lgБОЕ/мозг | 7,9+0,3 lgБОЕ/мозг |
| нейровирулентность для б/п мышей (ЛД50 при и/ц введении) | 0,5 БОЕ | 0,1 БОЕ |
| нейроинвазивность для б/п мышей (ЛД50 при подкожном введении ) | 0,8 БОЕ | 1000БОЕ |
| Размер бляшек в культуре клеток СПЭВ | 7 мм | <1мм+7мм отношение 100:1 |
| характеристика репродукция в культуре клеток СПЭВ | Количество вируса в КЖ выше, чем в клетках | Замедленный цикл репродукции, количество вируса в КЖ ниже, чем в клетках |
| соотношение копий РНК к БОЕ для вируса в КЖ клеток СПЭВ (24 часа) | 2,2 lg | 2,3lg |
| ГА в КЖ клеток СПЭВ | + | - |
| наличие катодного преципитата вирионов с АТ в РИЭФ | + | - |
| наличие преципитата невирионного антигена в РИЭФ | + | + |
ЛД –летальная доза; БОЕ – бляшкообразующая единица; КЖ – культуральная жидкость; АТ – антитела; РИЭФ – ракетный иммунноэлектрофорез.
Поведение штамма ЭК-328 при разных способах заражения мышей и при размножении в культуре клеток показывает, что этот вирус по сравнению с вариантом М имеет преимущества при репродукции в клетках млекопитающих. В пользу этого свидетельствуют следующие факты: 1) более высокие титры в мозге мышей; 2) крупный размер бляшек в культуре клеток СПЭВ; 3) быстрый, по сравнению с вариантом М, цикл репродукции в культуре клеток СПЭВ, количество свободного вируса в течение всего цикла репродукции выше, чем количество вируса, связанного с клетками.
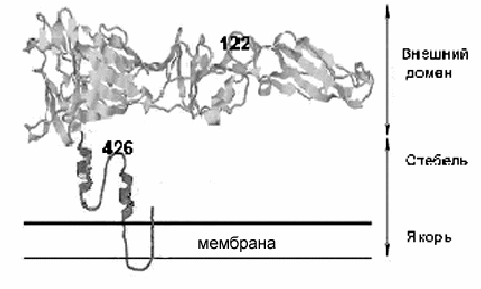
Были определены последовательности полных геномов данных вирусов. В табл. 2 приведены замены, которые были выявлены в геноме варианта М при сравнении с геномом штамма ЭК-328. Всего было обнаружено 15 н.т. замен, две из которых были в 5'-НТО, 5 - в структурных белках и 8 - в неструктурных белках. 6 н.т. приводили к аминокислотным заменам (а.к.) в сигнальной последовательности белка prМ, а также в белках Е, NS2a и NS4a. Одна из а.к. замен в белке Е в позиции 426 Thr706Ile расположена в стебле, а вторая - (122) Glu-Gly - в домене II (рис.2). Замены глютаминовой кислоты на глицин в позиции 122 белка Е описана ранее для варианта ВКЭ, полученного при адаптации штамма Найдорф к культуре клеток ВНК21 (Mandl et al.,2001; Kroschewski et al., 2003). Она приводит к повышению положительного заряда белка Е и повышению аффинности связывания вирионов с ГАГ клетки (Mandl et al., 2001), что сопровождается образованием мелких бляшек в культуре клеток почки эмбриона свиньи и снижением НИ для мышей. Следует отметить, что 122 позиция расположена в районе, непосредственно примыкающем к пептиду слияния белка Е ВКЭ и изменения в этом районе могут прямо влиять на пространственное положение cd-петли (пептида слияния) в составе димера белка Е при физиологических значениях рН и особенно в составе тримера при кислых значениях рН в эндосоме клетки.
Рис. 1. Схематическое изображение структуры белка Е ВКЭ.
Для проверки влияния замены в 122 позиции в контексте структуры белка Е данных вирусов на связывание вирионов с ГАГ клетки мы изучили сорбцию вирионов на гепарин-сефарозе (ГС) – аналоге ГАГ. Для этого вирусы в равной дозе в виде вируссодержащей КЖ инфицированных клеток СПЭВ были
Таблица 2. Замены в геноме варианта М по сравнению со штаммом ЭК-328
| область генома | нуклеотидная замена | аминокислотная заменаа |
| 5-НТО | А19 G/A | - |
| C42A | - | |
| сигнальный пептид prM | C470U | AlaVal |
| E | A1337G | Glu122Gly |
| C2190U | - | |
| C2249U | Thr426Ile | |
| U2362C | - | |
| NS1 | C3387U | - |
| G3438A | - | |
| NS2a | G3672U | Lys52Asn |
| NS3 | G4827A | - |
| NS4a | A6526G | Ser22Gly |
| G6584A | Arg41Lys | |
| NS4b | G7437C | - |
| NS5 | U9888G | - |
