Тема: Введение в предмет. Физико-химические свойства белков
| Вид материала | Документы |
- Контрольная работа По дисциплине физико-химические свойства и методы контроля качества, 77.41kb.
- Тематический план лекций по общей биохимии для студентов 2-го курса лечебного, педиатрического, 1643.39kb.
- Тема урока: Сера, ее физические и химические свойства, 107.64kb.
- Тема: «циклопарафины: строение, свойства, применение», 55.94kb.
- Тема работы: " Принципиально новый метод подготовки генома к секвенированию.", 28.4kb.
- Вопросы к коллоквиуму по теме: «Лекарственные растения и сырье, содержащие фенольные, 15.75kb.
- Программа дисциплины «Неорганическая химия», 23.21kb.
- Программы и задания фен по специальности «Химия» 3-й курс, VI семестр, 194.94kb.
- Программа учебной дисциплины "Аналитическая химия и физико-химические методы анализа", 239.87kb.
- Урок-лекция по теме: "Строение и химические свойства предельных углеводородов", 146kb.
Практическое занятие №1.
Задание к занятию №1.
Тема: Введение в предмет. Физико-химические свойства белков.
Актуальность темы.
Биохимия - фундаментальная теоретическая медицинская наука, занимающаяся изучением химических реакций и процессов, протекающих в живых организмах. Успешное развитие биохимии позволяет решить проблемы сохранения здоровья человека, выяснить причины различных болезней и изыскать пути их эффективного лечения.
Особая роль в жизнедеятельности живых организмов принадлежит белкам. От родителей детям передается генетическая информация о специфической структуре и функциях всех белков данного организма. Синтезированные белки выполняют многообразные функции: ускоряют химические реакции, выполняют транспортную, структурную, защитную функции, участвуют в передаче сигналов от одних клеток другим и таким образом реализуют наследственную информацию.
Учебные и воспитательные цели:
- Общая цель занятия:
1. Привить знания о строении и биологической роли белков и умение применять их в практической медицине.
2. Научить использовать знания о физико-химических свойствах белков для определения наличия белка в биологических жидкостях.
- Частные цели занятия:
1. Уметь определять наличие белка в биологических жидкостях.
2. Овладеть методиками проведения высаливания и денатурации белков.
1. Входной контроль знаний
1.1. Тестирование.
1.2. Устный опрос.
2. Основные вопросы темы:
2.1. Что такое биохимия, цели и задачи, стоящие перед ней. Место биохимии среди других наук. Значение
биохимии в практической деятельности врача.
2.2. Методы исследований, применяемые в медицине.
2.3. Белки - составная часть всех живых организмов. Биологическая роль белков, незаменимость в питании.
- Физико-химические свойства белков: молекулярная масса, изоэлектрическая точка, растворимость, осаждаемость.
- Понятие о высаливании, высаливающие факторы, механизм, обратимость, применение в медицине.
2.6. Понятие о денатурации, факторы, вызывающие денатурацию, механизм, обратимость, применение реакций осаждения белка для его обнаружения в биологических жидкостях.
2.7. Аминокислоты - структурные компоненты белков.
2.8. Цветные реакции на белки и аминокислоты.
3. Лабораторно-практические работы:
- Обнаружить наличие белка с помощью качественной цветной реакции на белки (биуретовая реакция).
3.2. Провести высаливание белков.
3.3. Провести денатурацию белка.
4. Выходной контроль
4.1. Ситуационные задачи.
5. Литература:
1. Материал лекций.
2. Николаев А.Я., Биологическая химия. М.: Высшая школа, 1989, С.5-52.
3. Берёзов Т.Т., Коровкин Б.Ф. Биологическая химия. М., Медицина, 1990 С.13-42.
4. Берёзов Т.Т., Коровкин Б.Ф. Биологическая химия. М., Медицина, 2004, С.15-49.
5. Кушманова О.Д., Иванченко О.М. Руководство к лабораторным занятиям по биологической химии. М.:
Медицина, 1983, №1(биуретовая реакция), №5, №6.
2. Основные вопросы темы:
2.1. Что такое биохимия, цели и задачи, стоящие перед ней. Место биохимии среди других наук.
Значение биохимии в практической деятельности врача.
Биологическая химия - наука, изучающая природу веществ, входящих в состав живых организмов, их превращения, а также связь этих превращений с деятельностью органов и тканей в условиях нормальной жизнедеятельности и патологии.
Главной целью биологической химии является формирование системных знаний о закономерностях и химическом строении основных веществ организма и молекулярных основах биохимических процессов, лежащих в основе жизнедеятельности организма в норме и патологии.
Исторически сложились три этапа развития биохимии. Статическая биохимия изучает состав, структуру и свойства выделяемых биологических соединений.
Главная задача биохимии состоит в том, чтобы достичь полного понимания на молекулярном уровне природы химических процессов, связанных с жизнедеятельностью клеток. Для её решения необходимо выделить из клеток многочисленные соединения, определить их структуру и установить их функции. (В качестве примера можно указать на многочисленные исследования, направленные на выяснение основ мышечного сокращения и ряда сходных процессов.) В итоге удалось выяснить ряд аспектов молекулярных основ мышечного сокращения.
Динамическая биохимия исследует превращения веществ в организме и значение этих превращений для процессов жизнедеятельности.
Функциональный этап связан с изучением связи химических процессов с физиологическими функциями.
2.2. Методы исследований, применяемые в медицине.
Между биохимией и медициной имеется широкая двусторонняя связь. Благодаря биохимическим исследованиям удалось ответить на многие вопросы, связанные с развитием заболеваний, а изучение причин и хода развития некоторых заболеваний привело к созданию новых областей биохимии.
Примерная последовательность при выделении из биологического материала такова:
Этапы исследования:
1.Гомогенизация;
2.Ультрацентрифугирование;
3. Экстракция;
4.Анализ (реэкстракция, термообработка, диализ, седиментация, электрофорез, изоэлектрическое фокусирование в градиенте рН, хроматография).
Объект исследования:
Орган, клетка, ткань


Гомогенат

С
 убклеточные структуры (ядра, митохондрии, лизосомы и т. д.)
убклеточные структуры (ядра, митохондрии, лизосомы и т. д.)Экстракт

Молекулярные биоструктуры
С различными отдельными методами исследования мы будем более подробно знакомиться по мере изучения определённых тем.
2.3. Белки - составная часть всех живых организмов. Биологическая роль белков, незаменимость в питании.
Белки - высокомолекулярные азотосодержащие вещества, построенные из остатков аминокислот, соединенных между собой пептидными связями. Белки - носители жизни, они наделены множеством уникальных функций, присущих только им: пластической, регуляторной, каталитической, рецепторной, защитной и др. Эти функции не могут быть заменены ни углеводами, ни жирами. Их незаменимость в питании определяется ещё и биологической ценностью.
- Физико-химические свойства белков: молекулярная масса, изоэлектрическая точка, растворимость, осаждаемость.
Аминокислотный состав и пространственная организация каждого белка в отдельности различны. Они обладают амфотерными, буферными, коллоидными и осмотическими свойствами.
Молекулярная масса белков колеблется от 6000(нижний предел) до 1000000 и выше в зависимости от количества полипептидных цепей в составе единой молекулярной структуры белка.
Изоэлектрическая точка большинства белков животных тканей лежит в пределах от 5,5 до 7,0. В изоэлектрической точке суммарный заряд белков равен нулю и белки не перемещаются в электрическом поле, наименее устойчивы в растворе и легко выпадают в осадок.
Растворимость различных белков колеблется в широких пределах, что зависит от структуры белка (полярные аминокислоты придают большую растворимость). Альбумины растворимы в воде и слабых растворах солей, протамины - в 60-80-% спирте, а коллаген и кератины нерастворимы в большинстве растворителей.
Стабильность растворам белков придают заряд белковой молекулы и гидратная оболочка. Между зарядом белка и гидратацией существует тесная связь: чем больше полярных аминокислот в белке, тем больше связывается воды. Некоторые белки гидратируются сильнее, а растворяются хуже. Например, коллаген связывает воды больше, чем многие хорошо растворимые глобулярные белки, но не растворим в воде.
- Понятие о высаливании, высаливающие факторы, механизм, обратимость, применение в медицине.
Процесс осаждения белков нейтральными солями (высокие концентрации солей щелочных и щелочноземельных металлов) называется высаливанием. Механизм состоит в том, что добавляемые анионы и катионы солевого раствора снимают гидратную оболочку белков и заряд, являющие факторами устойчивости.
Характерной особенностью белков, полученных высаливанием, является сохранение ими нативных биологических свойств после удаления соли. Высаливание белков является обратимой реакцией, так как осадок белка может вновь раствориться после уменьшения концентрации солей путем диализа или разведением водой.
В медицинской практике для высаливания чаще всего применяют сульфат аммония или натрия (высокие концентрации). Альбумины осаждаются при 100% насыщении (NH4)2SO4. Глобулины – в полунасыщенном растворе (NH4)2SO4.
Высаливание широко используется для разделения и очистки белков в научно-исследовательской работе и медицинской практике.
- Понятие о денатурации, факторы, вызывающие денатурацию, механизм, обратимость, применение
реакций осаждения белка для его обнаружения в биологических жидкостях.
Разрушение структуры белка и потеря им своих нативных свойств (биологических, физико-химических) называется денатурацией. Осажденный денатурированный белок, в отличие от белка, осажденного путём высаливания, утрачивает свои нативные свойства. Денатурирующие факторы делятся на:
1) физические (температура, радиация, ультрафиолетовое излучение)
2) механические (вибрация и т.д.)
3) химические (концентрированные кислоты, щелочи, соли тяжелых металлов и т.д.)
При непродолжительном действии и быстром удалении денатурирующих агентов возможна ренатурация белка с полным восстановлением исходной трехмерной структуры и нативных свойств его молекулы.
Денатурация используется для определения белка в моче при заболеваниях почек (пиелонефрите), мочевого пузыря (цистите), предстательной железы (простатите), а также при отравлении солями тяжелых металлов.
2.7. Аминокислоты - структурные компоненты белков.
Установлено, что при гидролизе чистого белка, не содержащего примесей, освобождается 20 различных
α- аминокислот. α- Аминокислоты представляют собой производные карбоновых кислот, у которых один водородный атом, у α- углерода, замещен на аминогруппу (-NH2), например:
α
R – CH - COOH
I
NH2
Все встречающиеся в природе аминокислоты обладают общим свойством – амфотерностью, т.е. каждая
аминокислота содержит как минимум одну кислотную и одну основную группы. Аминокислоты будут отличаться друг от друга химической природой радикала R, не участвующего в образовании пептидной связи при синтезе белка. Все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью.
2.8. Цветные реакции на белки и аминокислоты.
Существует два типа цветных реакций: 1) универсальные - биуретовая (на пептидную связь) и нингидриновая (на α-NH2-группу аминокислот); 2) специфические – только на определенные аминокислотные радикалы, например реакция Фоля (на аминокислоты, содержащие серу), реакция Миллона (на тирозин), ксантопротеиновая реакция (на ароматические аминокислоты) и др.
Практическое занятие №2.
Задание к занятию №2.
Тема: Строение простых белков.
Актуальность темы.
Особая роль в жизнедеятельности живых организмов принадлежит белкам. От родителей детям передается генетическая информация о специфической структуре и функциях всех белков данного организма. Синтезированные белки выполняют многообразные функции: ускоряют химические реакции, выполняют транспортную, структурную, защитную функции, участвуют в передаче сигналов от одних клеток другим и таким образом реализуют наследственную информацию.
Учебные и воспитательные цели:
- Общая цель занятия: привить знания о структурной организации белковой молекулы.
- Частные цели занятия: иметь представления о проведении кислотного гидролиза белков и
хроматографическом разделении аминокислот на бумаге.
1. Входной контроль знаний
1.1. Тестирование.
1.2. Устный опрос.
2. Основные вопросы темы:
2.1. Гидролиз белков, промежуточные и конечные продукты гидролиза, условия проведения, недостатки отдельных видов гидролиза.
2.2. Хроматографическое разделение аминокислот. Виды хроматографии, их значение.
- Структурная организация белка. Первичная, вторичная, третичная, четвертичная структура белка. Зависимость биологических свойств белка от особенностей строения белковой молекулы.
2.4. Химические связи, участвующие в формировании и поддержании уровней структурной организации белка (пептидная, водородная, дисульфидная и др.)
2.5. Изменение белкового состава организма: наследственные и приобретенные протеинопатии.
- Классификация белков. Простые и сложные белки. Краткая характеристика отдельных представителей.
3. Лабораторно-практические работы:
3.1. Провести кислотный гидролиз белков.
3.2. Провести хроматографическое разделение аминокислот на бумаге.
4. Выходной контроль
4.1. Ситуационные задачи.
5. Литература:
1. Материал лекций.
2. Николаев А.Я., Биологическая химия. М.: Высшая школа, 1989, С.9-53.
3. Берёзов Т.Т., Коровкин Б.Ф. Биологическая химия. М., Медицина, 1990, С.42-63.
4. Берёзов Т.Т., Коровкин Б.Ф. Биологическая химия. М., Медицина, 2004, С.49-77.
5. Кушманова О.Д., Иванченко О.М. Руководство к лабораторным занятиям по биологической химии. М.:
Медицина, 1983, №2, №3.
2. Основные вопросы темы:
2.1. Гидролиз белков, промежуточные и конечные продукты гидролиза, условия проведения, недостатки
отдельных видов гидролиза.
Гидролиз - это распад сложного вещества (белка) на более простые составные части, связанный с присоединением по месту разрыва связей воды.
В зависимости от применяющегося катализатора различают гидролиз кислотный, щелочной, ферментативный. Промежуточными продуктами гидролиза являются поли-, олиго-, дипептиды и конечные продукты - аминокислоты.
Гидролиз является важным методом исследования, применяемым для расшифровки первичной структуры белка. При кислотном гидролизе разрушаются некоторые аминокислоты: триптофан разрушается полностью, а серин, треонин, цистин, тирозин, фенилаланин - частично, однако процент разрушения этих аминокислот невелик. При щелочном гидролизе отмечается более выраженное разрушение аминокислот.
Белковые гидролизаты применяются в качестве лечебных препаратов для парентерального питания. Например, церебролизин - продукт кислотного гидролиза мозгового вещества крупного рогатого скота, гидролизин - продукт такого же гидролиза фибриллярных сгустков и цельной крови крупного рогатого скота.
2.2. Хроматографическое разделение аминокислот. Виды хроматографии, их значение.
В зависимости от природы адсорбента и механизма разделения веществ хроматографию подразделяют на несколько видов: адсорбционная, распределительная; ионообменная, осадочная, диффузионная. Различают хроматографические методы анализа и по технике выполнения их: колоночная и плоскостная (на бумаге или в тонком слое). В зависимости от агрегатного состояния фаз хроматографию подразделяют на газовую, жидкостную и газожидкостную. Различают виды хроматографии и по направлению движения растворителя (подвижной фазы): восходящая, нисходящая, одномерная, двухмерная и радиальная.
Довольно точным и доступным является метод распределительной хроматографии на бумаге (модификация адсорбционной хроматографии). При этом методе в качестве адсорбента используют специальную фильтровальную бумагу. Хроматографию проводят в закрытой камере, чтобы избежать испарения растворителя. Разделение смеси аминокислот методом распределительной хроматографии на бумаге используют для определения аминокислотного состава белка, для качественного и количественного определения аминокислот в биологических жидкостях и тканях. Этот метод позволяет выделить отдельные вещества из небольшого количества сложной смеси.
2.3.–2.4. Структурная организация белка. Первичная, вторичная, третичная, четвертичная структура белка.
Зависимость биологических свойств белка от особенностей строения белковой молекулы. Химические
связи, участвующие в формированиии поддержании уровней структурной организации белка
(пептидная, водородная, дисульфидная и др.)
Белки имеют 4 уровня структурной организации.
Первичная структура - это последовательное соединение аминокислотных остатков в полипептидную цепь. Она стабилизируется пептидными связями между аминокислотами, обеспечивая прочность ковалентного состава полипептидной цепи. Каждый индивидуальный белок уникален своей первичной структурой. Она определяет последующие уровни организации белковой молекулы.
Замена или утрата аминокислот в полипептидной цепи приводит к изменению структуры, физико-химических свойств и биологических функций белка. Например, при мутации гена, кодирующего полипептидную β-цепь гемоглобина (Нb) глутаминовая кислота в положении 6 замещается на валин, в результате чего мутантный Hb становится плохо растворим, теряет способность переносить кислород. При этом эритроциты приобретают форму серпа, отсюда название болезни - серповидно-клеточная анемия. В настоящее время расшифрована первичная структура многих белков: гемоглобина, миоглобина, инсулина, иммуноглобулинов, цитохромов, лизоцима, трипсина, химотрипсина и других.
Вторичная структура - это способ свертывания, скручивания, упаковки полипептидной цепи в спиральную или другую конформацию. Она возникает самопроизвольно, автоматически, что зависит от набора аминокислот и их последовательности. Различают 2 типа вторичной структуры: 1-α-спираль и 2 - слоисто-складчатая (β-структура).
α-спираль имеет винтовую симметрию:
а) ход спирали стабилизируется водородными связями между пептидными группами каждого 1-го и 4-го остатка аминокислот.
б) регулярность витков спирали.
в) равнозначность всех аминокислотных остатков независимо от строения их боковых радикалов.
г) боковые радикалы не участвуют в образовании α-спирали.
Высота одного витка (шаг спирали) равна 0,54 нм, в него входят 3,6 аминокислотных остатка, период регулярности равен 5 виткам (18 аминокислотных остатка). Длина одного периода - 2,7 нм.
Очень много в α-спирали цистеина. Благодаря своей SH-группе он может образовать дисульфидные связи между витками спирали.
Другой тип вторичной структуры называется β-структурой. Этот вид обнаружен в белках волос, мышц, ногтей и других фибриллярных белках. Состав таких полипептидных цепей имеет складчатую структуру. Её стабилизируют водородные связи между пептидными группировками отдельных участков цепи, чаще двух или нескольких полипептидных цепей, расположенных параллельно. В β-складчатых слоях отсутствуют S-S-связи (в этих участках нет цистеина). Боковые радикалы выступают наружу по обе стороны складчатого слоя.
β-структура образуется только при наличии в составе цепей определенных аминокислот, в частности, аланина и глицина. В молекулах многих нативных белков одновременно присутствует α-спиральные участки и β-складчатые слои.
Третичная структура - это трехмерная пространственная организация полипептидной спирали, или способ укладки полипептидной цепи в объеме.
Стабилизируют эту структуру 4 типа внутримолекулярных связей:
1 - ковалентные дисульфидные связи между остатками цистеина;
2 - нековалентные водородные связи (между С=О и – ОН, –NH2, –SH-группами);
3 - электростатическое взаимодействие заряженных групп в боковых радикалах аминокислот (NН3+ и СОО-);
4- гидрофобные ван-дер-ваальсовые взаимодействия между неполярными боковыми радикалами аминокислот.
По форме третичной структуры белки делят на глобулярные (ферменты, транспортные белки, антитела, гормоны) и фибриллярные (структурные) (кератин волос, ногтей; коллаген соединительной ткани, эластин связок; миозин и актин мышечной ткани).
Третичная структура определяет нативные свойства белка.
Четвертичная структура. Белки, обладающие этой структурой, называют олигомерными ("олиго" - несколько). Это означает, что они построены из нескольких субъединиц.
Четвертичная структура - это способ укладки в пространстве нескольких полипептидных цепей, обладающих первичной, вторичной и третичной структурами, которые могут быть как одинаковыми, так и разными.
Примеры белков, обладающих четвертичной структурой: гемоглобин - 4 субъединицы; пируватдегидрогеназа - 72 субъединицы. Субъединицы связаны между собой ионными, водородными, дисульфидными связями.
2.5. Протеинопатия - изменение белкового состава тканей организма.
Наследственные протеинопатии связаны с первичным повреждением в генетическом аппарате организма (серповидно - клеточная анемия). Белок не синтезируется или синтезируется с изменённой структурой.
При приобретённых протеинопатиях первичная структура не нарушена, а изменяется количество белка, его распределение в тканях или нарушается функция белка в связи с изменением условий в клетке (нарушение синтеза внутреннего фактора Касла).
2.6. Белки классифицируются на простые и сложные.
Простые белки построены из остатков аминокислот и при гидролизе распадаются соответственно только на свободные аминокислоты.
К простым белкам относят гистоны, протамины, альбумины, глобулины.
Альбумины и глобулины относятся к белкам, широко распространенным в органах и тканях животных.
Альбумины - это белки небольшой молекулярной массы (70 тыс.), они имеют избыточный "-" заряд и кислые свойства из-за большого содержания глутаминовой кислоты. Высаливаются при 100% насыщении (NH4)2SO4. Характерная их особенность - высокая адсорбционная способность, благодаря чему они могут выполнять транспортную роль. Альбумины поддерживают осмотическое давление, обуславливают рН крови, выполняют резервную функцию.
Глобулины - белки с большей молекулярной массой (в пределах 160-180 тыс.). Они слабокислые или нейтральные. Это неоднородная фракция, среди которой особо выделяют α1, α2, β, γ-глобулины. Глобулины выполняют защитную функцию, участвуют в свертывании крови, осуществляют транспорт холестерола, ряда витаминов, гормонов, ферментов, ионов меди и железа.
Гистоны - это белки основного характера, с молекулярной массой 12000-24000. Основные их функции заключаются в стабилизации пространственной структуры ДНК, а, следовательно, хроматина и хромосом. Регуляторная функция этих белков заключается в способности блокировать передачу генетической информации от ДНК к РНК.
Протамины значительно отличаются аминокислотным составом и структурой, обладают резко выраженными основными свойствами из-за большого (80%) содержания аргинина. Их молекулярная масса не превышает 5000. Они, как и гистоны, поликатионные белки и связываются с ДНК в хроматине спермиев.
Практическое занятие №3.
Задание к занятию №3.
Тема: Строение и биологическая роль сложных белков.
Учебные и воспитательные цели:
Общая цель: привить знания о строении и биологической роли нуклеопротеинов и умение применять их в практической медицине.
Частные цели: овладеть методом кислотного гидролиза нуклеопротеинов и уметь определять продукты их гидролиза; овладеть биуретовым методом определения общего белка в сыворотке крови.
1. Входной контроль знаний
1.1 Тесты.
1.2 Устный опрос.
2. Основные вопросы темы:
2.1. Нуклеопротеины. Схема гидролиза нуклеопротеинов.
2.2. Нуклеиновые кислоты, биологическая роль.
2.3 Химическое строение нуклеотидов.
2.4 Структуры нуклеиновых кислот.
2.5 Методы, применяемые при изучении строения нуклеопротеинов.
3.Лабораторно-практические работы:
3.1 Провести гидролиз нуклеопротеинов. Обнаружить продукты гидролиза нуклеопротеинов.
3.2 Определение общего белка биуретовым методом.
4. Выходной контроль (тесты, ситуационные задачи)
5. Литература:
5.1 Материалы лекций
5.2 Николаев А.Я. Биологическая химия. М.: Высшая школа, 1989.- с. 92-100, 428-430.
5.3 Берёзов Т.Т., Коровкин Б.Ф. Биологическая химия. М.: Медицина, 1990.- С.77-91.
5.4 Берёзов Т.Т., Коровкин Б.Ф. Биологическая химия. М.: Медицина, 2004.- С.96-113.
5.5 Кушманова О.Д., Ивченко Г.М. Руководство к занятиям по биологической химии М., 1983, раб. №7
2. Основные вопросы темы
2.1 Нуклеопротеины. Схема гидролиза нуклеопротеинов.
Нуклеопротеины - сложные белки, которые в качестве простетической группы имеют ДНК или РНК.
Схему гидролиза нуклеопротеинов можно представить следующим образом:
Нуклеопротеины

 Белок ДНК, РНК
Белок ДНК, РНК (гистоны)
(гистоны) полипептиды полинуклеотиды


а

 минокислоты мононуклеотиды
минокислоты мононуклеотиды нуклеозид Н3РО4

 пуриновые и пентоза
пуриновые и пентозапиримидиновые (рибоза или
основания дезоксирибоза)
2.2. Нуклеиновые кислоты, биологическая роль.
Нуклеиновые кислоты (ДНК и РНК) относятся к сложным высокомолекулярным соединениям, состоят из небольшого числа индивидуальных химических компонентов более простого строения. С нуклеопротеинами и, соответственно, нуклеиновыми кислотами непосредственно связаны, кроме того, такие биологические процессы, как митоз, мейоз, эмбриональный и злокачественный рост и др. Нуклеиновые кислоты выполняют ряд важных биологических функ-ций, не свойственных другим полимерным веществам. В частности, они обеспечивают хранение и передачу наследст-венной информации и принимают непосредственное участие в механизмах реализации этой информации путем программирования синтеза всех клеточных белков. Структурные компоненты нуклеиновых кислот выполняют, кроме того, функции кофакторов (коэнзим А и др.), аллостерических эффекторов, входят в состав коферментов (никотин-амидадениндинуклеотид, флавинадениндинуклеотид и др.), принимая тем самым непосредственное участие в обмене веществ, а также в аккумулировании (накоплении), переносе и трасформации энергии. Они являются предшествен-никами вторичных посредников (мессенджеров) – циклических мононуклеотидов (цАМФ и цГМФ), выполняющих
важную функцию в передаче внутриклеточных сигналов.
2.3 Химическое строение нуклеотидов.
Структурными единицами нуклеиновых кислот являются мономерные молекулы – мононуклеотиды. Следовательно, нуклеиновые кислоты представляют собой полинуклеотиды. Это продукты полимеризации мононуклеотидов, число и последовательность расположения которых в цепях ДНК и РНК определяются в строгом соответствии с программой,
заложенной в молекуле матрицы. Каждый нуклеотид содержит 3 химически различных компонента: гетероциклическое азотистое основание, моносахарид (пентозу) и остаток фосфорной кислоты. В состав нуклеиновых кислот входят азотистые основания двух типов: пуриновые – аденин (А), гуанин (G) и пиримидиновые – цитозин (С), тимин (Т) и урацил (U). В этой «триаде» мононуклеотида углевод занимает
среднее положение. В молекулы ДНК входят A, T, G, C, в РНК- A, C, G, U.


Номенклатура нуклеотидов.

2.4 Структуры нуклеиновых кислот. Под первичной структурой нуклеиновых кислот понимают порядок, после-
довательность расположения мононуклеотидов в полинуклеотидной цепи ДНК и РНК. Такая цепь стабилизируется 3',5'-фосфодиэфирными связями.
Вторичная структура. В соответствии с моделью Дж. Уотсона и Ф. Крика, предложенной в 1953 г. на основании ряда аналитических данных, а также рентгеноструктурного анализа, молекула ДНК состоит из двух цепей, образуя право-вращающую спираль, в которую обе полинуклеотидные цепи закручены вокруг одной и той же оси. Удерживаются цепи благодаря водородным связям, образующимся между их азотистыми основаниями. Обе цепи полинуклеотидов в биспиральной молекуле ДНК имеют строго определенное пространственное расположение, при котором азотистые основания находятся внутри, а фосфорильные и углеводные компоненты – снаружи. Избирательность взаимодействия пар А–Т и Г–Ц принято выражать термином «комплементарность», а соответствующие азотистые основания на-
зывают комплементарными. Уникальность структуры молекул ДНК и РНК определяются закономерностями, впервые установленными Э. Чаргаффом:
1) молярная масса пуринов равна молярной массе пиримидинов А+Г=Ц+Т;
2) количество аденина и цитозина равно количеству гуанина и тимина: А+Ц=Г+Т;
3) количество аденина равно количеству тимина, а количество гуанина равно количеству цитозина.
Стабильность А–Т оснований обеспечивается двумя водородными связями, а пар Г–Ц – тремя. Длина водородных связей между основаниями составляет около 0,3 нм, расстояние между витками (шаг спирали) равно 3,4 нм. На этом участке укладываются 10 нуклеотидных остатков, размер одного нуклеотида составляет 0,34 нм; диаметр биспиральной молекулы равен 1,8 нм.
Менее охарактеризована вторичная структура матричных и рибосомных РНК. Относительно вторичной структуры тРНК наиболее вероятной представляется модель, предложенная Р. Холли, плоское изображение которой напоминает клеверный лист. Во всех тРНК есть участки, взаимодействующие с рибосомами, места для связывания с аминокислотами и ферментами, а также специфическая последовательность трех нуклеотидов (триплет), называемая анти-
кодоном, которая оказывается комплементарной тринуклеотидной последовательности мРНК (кодону), кодирующей включение в белковую молекулу определенной аминокислоты.
Третичная структура нуклеиновых кислот.
Исследования молекул ДНК при помощи физических (в частности, кристаллографических) и физико-химических методов показали, что двойная спираль ДНК на некоторых участках может подвергаться дальнейшей спирализации с образованием суперспирали или открытой кольцевой формы. Оказалось также, что линейная ДНК может образоваться из кольцевой формы или существовать как таковая в природе. Образование кольцевой формы молекулы ДНК у бактерий или в митохондриях клеток животных часто вызвано ковалентным соединением их открытых концов. Известно, что суперспиральная (суперскрученная) структура обеспечивает экономную упаковку огромной молекулы ДНК в хромосоме: вместо 8 см длины, которую она могла бы иметь в вытянутой форме, в хромосоме человека молекула ДНК настолько плотно упакована, что ее длина составляет 5 нм. Обычно в ДНК встречаются положительные
и отрицательные супервитки, образованные за счет скручивания по часовой (правосторонней) или против часовой стрелки двойной спирали. Образование подобных супервитков катализируется специфическими ферментами,
получившими название топоизомераз. Подобные суперспирали соединяются с белками (гистонами), упакованными в бороздках, обеспечивая тем самым стабильность третичной структуры ДНК.
Данные о структуре тРНК свидетельствуют о том, что нативные молекулы тРНК имеют примерно одинаковую третичную структуру, которая отличается от плоской структуры «клеверного листа» большой компактностью за счет складывания различных частей молекулы. Третичная структура РНК в растворе в зависимости от ионной силы, температуры и рН среды может быть представлена компактной палочкой, компактным клубком; развернутой цепью.
В настоящее время получены доказательства значимости ван-дер-ваальсовых (диполь-дипольных и лондоновских) связей между азотистыми основаниями в стабилизации общей пространственной конфигурации нуклеиновых кислот.
2.5 Методы, применяемые при изучении строения нуклеопротеинов.
При изучении химического состава и строения нуклеиновых кислот перед исследователем всегда стоит задача выделения их из биологических объектов.
Для выделения нуклеиновых кислот из комплексов с белками необходимо прежде всего разрушить сильные многочисленные электростатические связи - между "+" заряженной молекулой белков и "-" заряженных молекулами нуклеиновых кислот . Для этого гомогенизированный материал обрабатывают 10% NaCl с последующим осаждением нуклеиновых кислот этанолом. В настоящее время для выделения нуклеиновых кислот в нативном состоянии пользуются фенольным методом, основанным на обработке нейтрально - забуференного раствора. Затем смесь подвергают центрифугированию, при этом денатурированный белок попадает в фенольную фазу, а нуклеиновые кислоты остаются в водной среде, из которой их осаждают на холоду добавлением 2-3-х объёмов этанола. Этим методом удается получить достаточно очищенные препараты нуклеиновых кислот (НК).
В настоящее время применяют ряд усовершенствованных методов разделения НК на фракции из суммарного препарата, полученного описанным выше методом. В их числе хроматография на геле фосфата кальция, ионообменная хроматография (в качестве адсорбентов применяют ДЭАЭ - целлюлозу, ДЭАЭ - сефадекс и др.), ультрацентрифугирование, хроматография по сродству на белковых носителях, метод распределения в двухфазных полимерных системах по Альбертсону, а также ферментативные чисто химические методы гидролиза.
3. Лабораторно-практическая работа.
3.2 Определение белка в сыворотке крови биуретовым методом.
Принцип метода. Метод основан на образовании окрашенных комплексных соединений меди при взаимодействии пептидных группировок молекул белков с биуретовым реактивом.
Ход определения.
| | Опытная проба |
| Рабочий биуретовый реактив | 5 мл |
| Сыворотка крови | 0,1 мл – 2 капли |
Пробу перемешивают и оставляют при комнатной температуре на 30 минут. По истечении времени измеряют оптическую плотность опытной пробы на фотоэлектрокалориметре при длине волны 540 нм.
Расчет концентрации белка производится по следующей формуле:
С= Еоп/ Ек х 80 г/л; Ек= 0,40
Практическое занятие №4.
Задание к занятию №4.
Тема: Строение и биологическая роль сложных белков.
Учебные и воспитательные цели:
Общая цель занятия: привить знания о строении и биологической роли гемопротеинов, гликопротеинов, фосфопротеинов и др.
Частные цели: уметь проводить гидролиз муцина, казеина; овладеть методом определения сиаловых кислот в сыворотке крови.
1. Входной контроль знаний
1.1 Тесты.
1.2 Устный опрос.
2. Основные вопросы темы:
2.1 Классификация сложных белков.
2.2 Хромопротеины. Гемопротеины, химическое строение гемоглобина, миоглобина. Аномальные гемоглобины.
2.3 Гликозилированный гемоглобин. Гликозилированные белки.
2.4 Гликопротеины. Химическое строение, биологическая роль.
2.4 Фосфопротеины. Химическое строение, биологическая роль.
3.Лабораторно-практические работы:
3.1. Выделить муцин из слюны и открыть в нем белковый и углеводный компоненты.
3.2. Определить количество сиаловых кислот в сыворотке крови.
3.3. Провести гидролиз казеина и обнаружить белок и фосфорную кислоту.
4. Выходной контроль (тесты, ситуационные задачи)
5. Литература:
5.1 Материалы лекций
5.2 Николаев А.Я. Биологическая химия. М.: Высшая школа, 1989.- С.29-30.
5.3 Берёзов Т.Т., Коровкин Б.Ф. Биологическая химия. М.: Медицина, 1990.- С.65-76.
5.4 Берёзов Т.Т., Коровкин Б.Ф. Биологическая химия. М.: Медицина, 2004.- С.78-95.
5.5 Кушманова О.Д., Ивченко Г.М. Руководство к занятиям по биологической химии М., 1983, раб. №10, 49.
2. Основные вопросы темы.
2.1 Классификация сложных белков.
Сложные белки содержат два компонента: белковую и небелковую части, называемые простетической группой. В зависимости от характера этой группы различают: хромопротеины, нуклеопротеины, металлопротеины, фосфопротеины, гликопротеины, липопротеины.
2.2 Хромопротеины. Гемопротеины, химическое строение гемоглобина, миоглобина. Аномальные гемоглобины.
Хромопротеины. Их подклассом являются гемопротеины, к которым относятся гемоглобин (Нb), миоглобин, цитохромы, каталаза.
Нb А1 имеет четвертичную структуру. Его молекулярная масса равна 66 000-68 000. Глобин - это белковая часть, состоящая из 4-х субъединиц, а каждая из субъединиц обозначается α, β. Всего 2 α-цепи, содержащие по 141 аминокислотному остатку и 2 β- по 146 аминокислот. Вторичные их структуры представлены в виде спиральных сегментов различной длины. Третичные структуры α- и β-цепей очень сходны. Внутри каждой субъединицы имеется гидрофобный "карман", в котором удерживается гем, благодаря ван-дер-ваальсовым связкам между неполярными участками гема и гидрофобными радикалами аминокислот (этих связей около 60). Гем - это тетрапиррольное соединение с атомом Fе+2, соединенного с азотами пирролов, 5-я связь с имидазольным кольцом гистидина глобина. Шестая координационная связь Fе+2 свободна и используется для связывания кислорода и других лигандов.
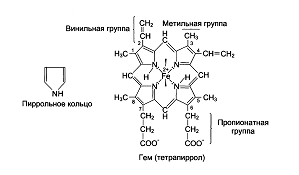
Белковая часть молекулы Нb влияет на свойства гема. Молекула Нb взаимодействует с различными лигандами. Очень высоко сродство Нb к оксиду углерода (II) - СО примерно в 300 раз больше, чем к О2, что говорит о высокой токсичности угарного газа. Эта форма носит название карбоксигемоглобина, Fe+2 не меняет валентности. При действии окислителей (например, нитрата натрия) образуется метгемоглобин, в котором Fe в степени окисления +3. Появление метгемоглобина в больших количествах вызывает кислородное голодание тканей. Наилучшим методом распознавания отдельных производных гемоглобина является исследование их спектров поглощения.
Возможно образование еще одного производного Нb - карбгемоглобина, когда Нb связывается с СО2, однако СО2 присоединяется не к гему, а к NH2 - группам глобина (НbNH2+СО2→ НbNHCOO-+Н+). Образование карбгемоглобина используется для выведения СО2 из тканей к легким. Этим путем выводится 10-15% СО2.
Гемоглобины могут различаться по белковой части, в связи с этим существуют физиологические и аномальные типы Нb.
Физиологические Нb образуются на разных этапах нормального развития организма, а аномальные - вследствие нарушений последовательности аминокислот в глобине.
Физиологические типы гемоглобинов отличаются друг от друга набором полипептидных цепей. Различают гемоглобины взрослых Нb А1 (96%), Нb А2 (2-3%), состоящий из 4 субъединиц: двух α-цепей и двух δ-цепей. Известен, кроме того, фетальный гемоглобин (гемоглобин новорожденных), обозначаемый HbF и состоящий из двух α-цепей и двух γ-цепей (1-2%). Нb А2 и Нb F обладают большим сродством к кислороду, чем Нb А1.
Общая группа заболеваний, связанная с Нb, носит название гемоглобинозов. Различают среди них гемоглобинопатии, например серповидноклеточная анемия, когда происходит замена при синтезе β-цепи в 6-ом положение глутаминовой кислоты на валин в β-цепях молекулы гемоглобина S. Эритроциты приобретает форму серпа, понижается сродство к О2. Болезнь протекает остро, и дети, гомозиготные по мутатному гену, часто умирают в детском возрасте.
Талассемия - это заболевание, при котором полностью нарушается синтез либо цепи α или β (отсюда и название α-талассемия или β-талассемия). При β-талассемии в крови наряду с HbA1 появляется до 15% НЬА2 и резко повышается содержание HbF – до 15–60%. Болезнь характеризуется гиперплазией и разрушением костного мозга, поражением печени, селезенки, деформацией черепа и сопровождается тяжелой гемолитической анемией. Эритроциты при талассемии приобретают мишеневидную форму.
Миоглобин имеет третичную структуру и представляет собой одну цепь Нb (153 аминокислоты). В отличие от Нb он в 5 раз быстрее связывает О2. Кривая насыщения имеет вид гиперболы. В этом кроется большой биологический смысл, поскольку миоглобин находится в глубине мышечной ткани (где низкое парциальное давление О2). Связывая О2, миоглобин создает кислородный резерв, который расходуется по мере необходимости, восполняя временную нехватку О2.
2.3 Гликозилированный гемоглобин. Гликозилированные белки.
Одним из основных механизмов повреждения тканей, в частности, при сахарном диабете является гликозилирование белков, приводящее к изменению их конформации и функций. Некоторые белки в норме содержат углеводные компоненты, причем образование таких гликопротеинов протекает ферментативно. Однако в организме человека может происходить и неферментативоне взаимодействие глюкозы со свободными аминогруппами белков- неферментативное гликозилирование белков. Неферментативное гликозилирование четко связано с гипергликемией. Это бывает при нарушении углеводного обмена, когда количество глюкозы в крови значительно больше нормы и, прежде всего, при сахарном диабете. Глюкоза крови при сахарном диабете в отсутствие инсулина не может проникнуть в ткани организма и связывается (ее альдегидная форма) с различными белками. Белки в этих комплексах меняют свои физико-химические свойства, при этом уменьшаются или теряются функции, выполняемые этими белками. Известны гликозилированный гемоглобин, гликозилированный альбумин, гликозилированный коллаген, гликозилированные липопротеины.
Гликозилирование гемоглобина идет в 2 этапа:
- Глюкоза неферментативно соединяется своей карбонильной группой с N-концевым остатком бета-цепей валина. Эта стадия обратима.
- Гликозилированный гемоглобин подвергается переустройству с образованием кетоамина. Эта стадия необратимая.
Известно, что эритроциты больных сахарным диабетом содержат процент минорного компонента Нb, так называемый гликозилированный Нb (Нb А1с).
К патогенезу осложнения диабета можно отнести тот факт, что у больных увеличивается количество Нb А1с (до 12-15%) по сравнению с допустимой концентрацией 4-6%. Так, при недостаточно компенсированном диабете общее соединение Нb А1с превышает 12%. Гликозилированный гемоглобин отражает процент гемоглобина крови, необратимо соединённый с молекулами глюкозы. Повышение уровня глюкозы крови при сахарном диабете значительно ускоряет данную реакцию, что приводит к повышению уровня гликозилированного гемоглобина в крови. Время жизни эритроцитов, которые содержат гемоглобин, составляет в среднем 120—125 суток. Именно поэтому уровень гликозилированного гемоглобина отражает средний уровень гликемии на протяжении примерно трёх месяцев. Чем выше уровень гликозилированного гемоглобина, тем выше была гликемия за последние три месяца и, соответственно, больше риск развития осложнений сахарного диабета.
Поражение сердечно-сосудистой системы является клиническим проявлением сахарного диабета. Микроангиопатия является причиной инвалидности и смерти больных. В возникновении микроангиопатий определенную роль играет гликозилирование белков, что приводит к возникновению нефро- и ретинопатии (катаракта, нарушение функции почек)
Коллаген составляет основу базальных мембран капилляров. Повышенное содержание гликозилированного коллагена ведет к уменьшению его эластичности, растворимости, к преждевременному старению, развитию контрактур. В почках такие изменения приводят к запустению клубочков и хронической почечной недостаточности.
Гликозилированные липопротеины, накапливаясь в сосудистой стенке, приводят к развитию гиперхолестеринемии и липидной инфильтрации. Они служат основой атером, происходит нарушение сосудистого тонуса, что приводит к атеросклерозу.
2.4 Гликопротеины. Химическое строение, биологическая роль.
Гликопротеины – сложные белки, содержащие, помимо простого белка или пептида, группу гетероолигосахаридов (содержание углеводов варьирует от 1 до 85%). В настоящее время их принято называть гликоконъюгатами. В состав гликоконъюгата входит углеводный компонент (гликановая фракция), ковалентно связанный с неуглеводной частью (агликановая фракция), представленной белком, пептидом, аминокислотой или липидом.
Гликопротеины классифицируются на истинные и протеогликаны. Моносахариды, связанные с конкретным белком, могут быть разными: это может быть глюкоза, фруктоза, манноза, глюкозамин, галактозамин, фруктозамин, сиаловая кислота и др. Те или иные моносахариды, связанные с белком, изменяют биохимические и иммунологические свойства белка, его пространственную конфигурацию и др. Важным частным случаем является связывание белков с сиаловой кислотой, приводящее к формированию сиалогликопротеинов.
Протеогликаны- высокомолекулярные соединения, состоящие из белка (5-10%) и гликозаминогликанов (гетерополисахаридов) (90-95%), напр. гиалуроновая кислота, хондроитинсульфаты. Они образуют основное вещество межклеточного матрикса соединительной ткани, выполняя «смазочную» функцию, что объясняется их способностью связывать большое количество воды, в результате чего межклеточное вещество приобретает желеобразный характер.
Гликопротеины выполняют разнообразные функции:
1) структурные молекулы
- клеточная стенка
- коллаген, эластин
- фибрины
- костный матрикс
2) "смазочные" и защитные агенты
- муцины
- слизистые секреты
3) транспортные молекулы для:
- витаминов
- липидов
- минералов и микроэлементов
4) иммунологические молекулы
- иммуноглобулины
- антигены гистосовместимости
- комплемент
- интерферон
5) гормоны
- хорионический гонадотропин
- тиреотропин
6) ферменты
- протеазы
- нуклеазы
- гликозидазы
- гидролазы
- факторы свертывания
7) места клеточных контактов/ распознавания
- клетка - клетка
- вирус - клетка
- бактерия - клетка
- гормональные рецепторы
2.5 Фосфопротеины. Химическое строение, биологическая роль.
Фосфопротеины- сложные белки, содержащие в качестве небелковой части остатки фосфорной кислоты. Фосфорная кислота в фосфопротеинах связана с гидроксильной группой серина и треонина, входящих в состав белка, эфирной связью. К ним относятся казеины - белки молока, вителлин яичного желтка, пр. Биологическая роль фосфопротеинов заключается в том, что они служат питательным материалом для эмбрионов и растущих организмов, являясь источником аминокислот и фосфорной кислоты. Фосфопротеины выполняют также энергетическую функцию, участвуя в образовании макроэргических молекул (АТФ, ГТФ), и пластическую функцию (входят в состав нуклеотидов, цАМФ). Особо следует отметить, что некоторые ключевые ферменты, регулирующие процессы внутриклеточного обмена веществ, существуют как в фосфорилированной, так и в дефосфорилированной форме. Этим подчеркивается значение акта фосфорилирования–дефосфорилирования, регулирующего процессы химической модификации макромолекул, участвующих в интегральных процессах метаболизма.
3. Лабораторно-практическая работа.
3.3. Провести гидролиз казеина и обнаружить белок и фосфорную кислоту.
Ход работы. В пробирку к 30 г казеина добавить 2 мл дистиллированной воды. Хорошо встряхнуть. Поставить в кипящую баню на 10 мин, разлить на 2 пробирки. В первой пробирке открыть фосфорную кислоту с молибденовым реактивом, а во второй- белок (биуретовая реакция).
Практическое занятие №5 (контрольное)
Задание к занятию №5.
Тема: Химия белка (контрольное занятие).
Цель: контроль полученных знаний
1. Основные вопросы темы:
- Что такое белки, роль белков в организме. Физико-химические свойства белков: молекулярная масса, растворимость, изоэлектрическая точка, высаливание, денатурация.
- Гидролиз как метод изучения состава белков. Виды гидролиза: кислотный, щелочной и ферментативный. Условия проведения гидролиза, его значение.
- Аминокислоты – составные части белков, их химическое строение.
- Природные пептиды. Образование пептидов. Отдельные пептиды организма, биологическая роль.
- Современные представления о строении белковой молекулы: первичная, вторичная, третичная и четвертичная структуры (методы их изучения, химические связи, удерживающие эти структуры).
- Классификация белков.
- Биологическая роль, характеристика простых белков: альбуминов, глобулинов, протаминов, гистонов.
- Биологическая роль и строение сложных белков: хромопротеинов, гликопротеинов, липопротеинов, металлопротеинов.
- Нуклеопротеины: биологическая роль, химическое строение нуклеиновых кислот.
- Гемопротеины. Биологическая роль, строение гема.
- Гликозилированные белки. Характеристика. Гликозилированный гемоглобин.
- Гликопротеины, структура, биологическая роль.
- Фосфопротеины, структура, биологическая роль.
- Определение белка в биологическом материале с помощью:
- цветных реакций: биуретовой, ксантопротеиновой, реакция Фоля;
- осадочных реакций: с 10% ТХУ, конц. НNО3, 5% Рb (СН3СОО)2.
2. Литература:
2.1 Материалы лекций
2.2 Николаев А.Я. Биологическая химия. М.: Высшая школа, 1989.-С.9-53, 92-105.
2.3 Берёзов Т.Т., Коровкин Б.Ф. Биологическая химия. М.: Медицина, 1990.- С.65-76.
2.4 Берёзов Т.Т., Коровкин Б.Ф. Биологическая химия. М.: Медицина, 2004.- С.19-114.
