Урок-лекция по теме: "Строение и химические свойства предельных углеводородов"
| Вид материала | Урок |
СодержаниеХод урока 5. Возбужденный атом углерода имеет электронную конфигурацию 6. Всем алканам присущи свойства Предельные углеводороды Ход урока |
- Модуль Предельные углеводороды, 224.21kb.
- Методическая разработка урока «Получение и химические свойства предельных одноатомных, 36.8kb.
- Урок презентация по теме «Углерод», 22.55kb.
- Тема: «циклопарафины: строение, свойства, применение», 55.94kb.
- Урок по теме: «Опорно-двигательная система. Строение, состав и свойства костей», 98.27kb.
- Строение и свойства металлических материалов лекция 2 Строение и свойства металлов, 103.5kb.
- Тема урока: Алкены. Получение, химические свойства и применение алкенов. Цели и задачи, 108.44kb.
- Ароматические углеводороды. Бензол представитель аренов. Строение молекулы и физические, 54.51kb.
- Тема урока: «Фосфор. Строение атома, аллотропия, свойства и применение фосфора», 43.99kb.
- Урок по химии в 9 классе, 113.98kb.
Урок-лекция по теме: "Строение и химические свойства предельных углеводородов"
Цели урока:
Сформулировать знания учащихся о пространственном строении алканов.
Продолжить формировать понятия о гомологах.
Рассмотреть химические свойства алканов, показать взаимосвязь между строением и свойствами.
Продолжить формирование умений анализировать, сравнивать, делать выводы;
развить навыки культуры общения.
Тип урока: сообщение новых знаний.
Вид урока: лекция + элементы беседы.
Оборудование:
Шаростержневая и объёмная модели молекулы метана.
Таблицы:
“Строение метана”;
“Строение этана и бутана”;
ХОД УРОКА
I. Организационный момент
II. Сообщение новых знаний
Знакомство с планом новой темы:
Особенности пространственного строения предельных углеводородов.
Анализ химических связей алканов.
Химические свойства.
Зависимость свойств предельных углеводородов от их строения, характера химических связей.
III. Изложение лекционного материала учителем в соответствии с планом
Современные представления о строении вещества не сводятся только к установлению порядка соединений атомов, но также включают рассмотрение пространственного строения молекул и электронной природы химических связей.
Предлагается написать молекулярную, электронную, структурную формулы метана, выяснить, что они показывают.
СН4 – молекулярная формула (качественный, количественный состав);
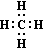 – электронная формула (ковалентная полярная связь);
– электронная формула (ковалентная полярная связь);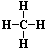 – структурная формула (порядок соединения атомов в молекуле).
– структурная формула (порядок соединения атомов в молекуле).Но данные формулы не отражают истинного строения молекул метана. Молекула метана не имеет плоского строения, как можно представить на основании структурной формулы.
IV. Работа с моделями молекулы метана
Молекула метана в действительности имеет форму тетраэдра. Тетраэдр – это пирамида, в основании которой лежит равносторонний треугольник. В центре тетраэдра находится атом углерода, а все его четыре валентности направлены к вершинам тетраэдра. Физическими методами исследования установлено, что валентные углы равны 109о28'.
Учащимся предлагаются проблемные вопросы:
Почему молекула метана имеет такую пространственную форму?
Чем объясняется направление валентных связей атома углерода от центра к вершинам тетраэдра?
Ответ следует искать в электронном строении атома углерода и молекулы метана.
С 1S2 2S2 2P2
 ––> C * 1S2 2S1 2P3
––> C * 1S2 2S1 2P3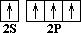
(основное состояние) (возбужденное состояние)
Так как на втором энергетическом уровне Р-подуровне есть свободная орбиталь, то на неё переходит один из 2S2-электронов. В результате этого атом углерода в возбуждённом состоянии имеет четыре неспаренных электрона, т.е. становится четырёхвалентным.
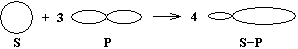
(негибридные электронные облака) (гибридные электронные облака)
Облака всех четырёх валентных электронов атома углерода выравниваются, становятся одинаковыми. При этом они принимают форму вытянутых в направлении к вершинам тетраэдра восьмёрок.
Явление, при котором происходит смешение и выравнивание по форме и энергии электронных облаков, называется гибридизацией.
Так как гибридизации подвергаются один S и три Р-электрона, то такое состояние называется SP3-гибридизацией.
Несимметричное распределение электронной плотности означает, что вероятность нахождения электрона по одну сторону от ядра больше, чем по другую. Гибридные электронные облака вытянуты в пространстве под углом 109о28' к вершинам воображаемого тетраэдра, и в этом направлении они перекрываются с электронными облаками атомов водорода.
Итак, молекула метана имеет тетраэдрическое строение, что обусловлено SP3-гибридизацией атома углерода, тетраэдрическим направлением четырёх гибридных электронных облаков атома углерода.
Сравнивая масштабную и шаростержневую модели молекул метана, можно отметить, что шаростержневая модель, появившаяся до возникновения электронной теории, более наглядно рассматривает строение молекулы метана.
V. Работа с таблицами “Строение метана” и “Строение этана и бутана”
Для активизации учащихся им предлагается рассмотреть данные таблицы и ответить на вопросы (анализ информации, заключённой в таблицах).
Что общего в строении молекул метана, этана, бутана вы видите?
Чему равны валентные углы в молекулах гомологов метана?
Почему углеродный скелет у молекулы бутана имеет зигзагообразную форму?
Виды химической связи в молекулах этана, бутана?
Проанализировав информацию, учащиеся делают выводы.
Для гомологов метана характерно:
тетраэдрическое строение атома углерода (SP3-гибридизация);
одинаковое значение всех валентных углов;
наличие С – С и С – Н химических связей.
VI. Анализ химических связей алканов
При рассмотрении второго вопроса плана обращается внимание на характер С – С и С – Н связей, являющихся ковалентными по характеру образования. Углерод-углеродные и углерод-водородные связи в алканах относятся к (сигма) связям.
(сигма) связь – это химическая связь, при образовании которой перекрывание электронных облаков происходит по прямой, соединяющей ядра атомов.
Эти связи разнообразны.
VII. Химические свойства алканов

Предельные углеводороды характеризуются малой реактивной способностью. Их называют инерционными, химически стойкими, парафинами (от латинского parum affinis – “мало сродства”).
В данной лекции познакомимся со взаимодействием алканов с кислородом, галогенами, термическим разложением, изомеризацией.
1. Горючесть алканов.
При поджигании (t = 600oС) алканы вступают в реакцию с кислородом, при этом происходит их окисление до углекислого газа и воды.
СnН2n+2 + O2 ––>CO2 + H2O + Q
например:
СН4 + 2O2 ––>CO2 + 2H2O + Q
Смесь метана с кислородом или воздухом при поджигании может взрываться.
Наиболее сильный взрыв получается при объёмных отношениях 1 : 2 (с кислородом) или 1 : 10 (с воздухом), т.к. метан и кислород вступают в реакцию полностью.
Подобные смеси опасны в каменноугольных шахтах. Чтобы обеспечить безопасность работы в шахтах, там устанавливают анализаторы, сигнализирующие о появлении газа, и мощные вентиляционные устройства.
С3Н8 + 5O2 ––>3CO2 + 4H2O + Q
Горение пропан-бутановой смеси можно продемонстрировать на примере газовой зажигалки.
При горении алканов выделяется много теплоты, что позволяет использовать их в качестве источника энергии. Но большая часть их используется в качестве сырья для получения других продуктов.
2. Разложение алканов.
СnН2n+2= C + H2
СН4 =C + 2H2
С4Н10 = 4C + 5H2
Метан в термическом отношении более устойчив, чем другие алканы. Причина этого в достаточной прочности С – Н связей.
3. Реакции замещения (протекают с галогенами и другими окислителями при определённых условиях: свет, температура).
СН4 + Cl2= CH3Cl + HCl
СН3Cl + Cl2 =CH2Cl2 + HCl
СН2Cl2 + Cl2= CHCl3 + HCl
СНCl3 + Cl2 =CCl4 + HCl
Механизм цепных реакций достаточно сложен, объяснение ему было дано русским учёным Н.Н. Семёновым, за что он в 1956 г. был удостоен Нобелевской премии.
4. Реакции изомеризации характерны не для всех алканов. Обращается внимание на возможность превращения одних изомеров в другие, наличие катализаторов.
С5Н12= C5H12
Уравнение вызывает недоумение, т.к. учащиеся не встречались с реакциями, при которых состав молекул не изменялся. Значит, химические реакции могут сопровождаться не только изменением состава веществ, но и изменением их строения, что часто встречается в органической химии. Чтобы выразить такое превращение, надо пользоваться структурными формулами.
AlCl3,400oC
C

 H3-CH2-CH2-CH2-CH3 CH3-CH-CH2-CH3
H3-CH2-CH2-CH2-CH3 CH3-CH-CH2-CH3CH3
VIII. Выводы
В конце лекции учащиеся записывают выводы, вытекающие из содержания лекции, включая пункт № 4 плана. Алканы (предельные углеводороды) характеризуются общими свойствами, на основании которых объединяются в гомологические ряды:
имеют общую формулу СnH2n+2;
все атомы углерода находятся в них в состоянии SP3-гибридизации;
имеют прочные ковалентные (сигма) связи;
обладают сходными химическими свойствами, способностью к полному, частичному, постепенному окислению.
Свойства алканов находятся в зависимости от электронно-пространственного строения, прочных химических связей.
IX. Обобщение
По завершении лекции каждый учащийся заполняет обобщающую таблицу о соответствующем гомологе по образцу, выдаваемому учителем.
| Название вещества | Молекулярная формула | Структурная формула | Уравнения реакций | Тип реакции |
| Метан | СН4 | 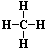 | СН4 + 2O2 ––> CO2 + 2H2O | Горение (полное окисление) |
| СН4= C + 2H2 | Разложение (частичное окисление) | |||
| СН4 + Cl2 = CH3Cl + HCl | Замещение (постепенное окисление) |
Выводы и обобщающая таблица являются кратким конспектом лекции.
X. Первичная проверка усвоения темы урока
После подведения итогов проводится небольшой тест.
1. Укажите ошибочное определение алканов:
а) предельные углеводороды;
б) карбоциклические соединения (в молекулах имеются циклы);
в) насыщенные углеводороды;
г) парафиновые углеводороды.
2. Общая формула алканов:
а) СnH2n;
б) СnH2n+1;
в) СnH2n+2;
г) СnН2n-2.
3. Признаки, характеризующие строение алканов:
а) SP3-гибридизация, плоская форма молекул 120о,
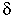 и п -связи;
и п -связи;б) SP-гибридизация, линейная форма молекул 1800
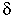 , и п-связи;
, и п-связи;в) SP3-гибридизация, форма молекул – тетраэдр 1090 28'
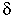 , п -связи.
, п -связи.4. Невозбуждённый атом углерода имеет электронную конфигурацию:
а) 1S2 2S1 2P3;
б) 1S2 2S2 2P2;
в) 1S2 2S2 2P3;
г) 1S2 2S2 2P4.
5. Возбужденный атом углерода имеет электронную конфигурацию:
а) 1S2 2S2 2P3;
б) 1S2 2S2 2P2;
в) 1S2 2S2 2P4;
г) 1S2 2S1 2P3.
6. Всем алканам присущи свойства:
а) вступать в реакцию замещения;
б) окисляться при обычных условиях;
в) гореть в кислороде;
г) реагировать с активными металлами.
7. Найдите ошибку.
а) Все алканы – химически активные вещества.
б) Для алканов характерны реакции присоединения.
в) Алканы окисляются с трудом при высоких температурах кислородом воздуха.
г) Для алканов характерны реакции с разрывом - связи С – С и С – Н.
Учитель предлагает варианты правильных ответов, учащиеся проводят самоконтроль
Предельные углеводороды
Обобщающий урок
10 класс
Цели. Обобщить и систематизировать знания учащихся о предельных углеводородах; отработать навыки составления химических уравнений, названий алканов по номенклатуре ИЮПАК, а также умение решать расчетные задачи на нахождение молекулярной формулы газообразного углеводорода.
Оборудование. Кроссворд «Предельные углеводороды» (12–15 шт.), таблицы 1 и 2, мини-кроссворды, рисунки-ребусы, магнитофон.
ХОД УРОКА
Организационный момент.
Разминка.
1. Какие органические вещества относят к углеводородам?
(Углеводороды – это органические соединения, состоящие из двух элементов: углерода и водорода.)
2. Как называют предельные углеводороды по международной номенклатуре?
(Алканы.)
3. Назовите общую формулу алканов.
(CnH2n+2.)
4. Напишите формулы алканов, имеющих в своем составе атомов углерода: а) 16; б) 21; в) 23.
(С16Н34, С21Н44, С23Н48.)
5. Напишите формулы алканов, имеющих в своем составе атомов водорода: а) 14; б) 20; в) 26.
(С6Н14, С9Н20, С12Н26.)
6. Укажите вид гибридизации, характерный для предельных углеводородов. (sp3-Гибридизация.)
7. Назовите угол и длину связи, характерные для алканов.
(Угол – 109°28' и длина углерод-углеродной связи – 0,154 нм.)
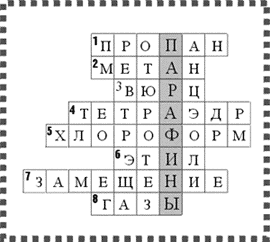
Кроссворд «Предельные углеводороды».

На каждую парту выдается по кроссворду, время решения которого 5 мин. После этого проверяют ответы. Ребята, которые ответили на все вопросы правильно и быстрее всех, получают оценку «отлично».
Для заполнения сетки кроссворда по горизонтали необходимо ответить на следующие вопросы.
По горизонтали:
1. Алкан, имеющий молекулярную формулу С3Н8.
2. Простейший представитель предельных углеводородов.
3. Французский химик, имя которого носит реакция получения углеводородов с более длинной углеродной цепью взаимодействием галогенопроизводных предельных углеводородов с металлическим натрием.
4. Геометрическая фигура, которую напоминает пространственное строение молекулы метана.
5. Трихлорметан.
6. Название радикала С2Н5–.
7. Наиболее характерный вид реакций для алканов.
8. Агрегатное состояние первых четырех представителей алканов при нормальных условиях.
Если ребята правильно ответили на вопросы, то в выделенном столбце по вертикали получат одно из названий предельных углеводородов.
Ответ.
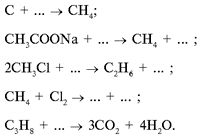
Конкурс «Восстанови запись».
Перед уроком учитель химии на доске пишет уравнения, демонстрирующие основные способы получения парафинов и их химические свойства. Но кто-то шутки ради стер часть записей. Необходимо их восстановить.
Конкурс «Проведи линию».
В двух столбцах табл. 1 приведены формулы алканов и их названия по номенклатуре ИЮПАК. Нужно соединить линией каждую формулу с соответствующим ей названием предельного углеводорода. Прежде чем приступить к выполнению задания, ребята повторяют основные правила составления названий парафинов:
1. Выбираем в формуле наиболее длинную углеродную цепь, нумеруем атомы углерода, начиная с того конца цепи, к которому ближе находится разветвление.
2. Называем радикалы, начиная с простейшего, и указываем цифрами их местоположение.
3. Даем полное название углеводороду по числу атомов углерода в нумерованной цепи.
Таблица 1
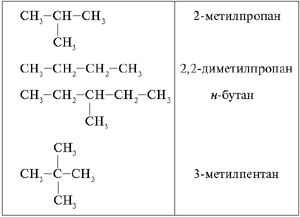
Сколько гомологов и сколько изомеров в этой таблице?
(Два изомера – 2-метилпропан и н-бутан; три гомолога – н-бутан, 2,2-диметилпропан, 3-метилпентан.)
Конкурс «Реши задачу».
Каждому ученику необходимо решить задачу своего варианта на нахождение химической формулы углеводорода по известным массовым долям углерода, водорода и по известной относительной плотности искомого углеводорода в газообразном состоянии. Условия этих задач представлены в табл. 2.
Таблица 2
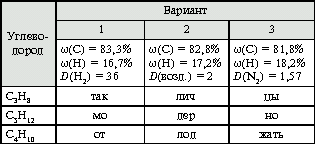
Если правильно решить задачу, т. е. определить углеводород из левого крайнего столбца, то из букв, расположенных под каждым вариантом, составится слово «молодцы».
(С5Н12 – 1-й вариант, С4Н10 – 2-й вариант, С3Н8 – 3-й вариант.)
Во время решения задач можно включить тихую спокойную музыку.
Конкурс «Зашифрованное письмо».
Прочитав предложения, найдите в них названия предельных углеводородов.
1. Цветок Таня посадила в красивый белый горшок.
2. Смета на строительство нового объекта была утверждена.
3. Красивое ожерелье, но на ней оно выглядело тускло и безлико.
4. В деревне про паночку ходили самые невероятные слухи.
Конкурс «Забавные задания».
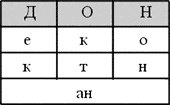
1. Впишите в мини - кроссворд названия предельных углеводородов таким образом, чтобы из их заглавных букв получилось название великой русской реки.
Задание.

Ответ.
2. Загадка. В названии какого кисломолочного продукта нужно убрать крайние буквы, чтобы получить название предельного углеводорода с массовой долей углерода 75%. (Сметана – метан.)
3. Названия каких алканов зашифрованы в ребусах?

(Октава – октан.)
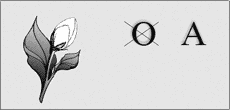
(Бутон – бутан.)

(Танк – этан.)
И.П.ФИЛИНОВА,
учитель химии и экологии школы № 172
(пос. Архара, Амурская обл.)
