Лекционный курс для подготовки к экзамену по дисциплине: «аналитическая химия» для учащихся заочного отделения
| Вид материала | Документы |
- Аналитическая химия, 348.94kb.
- Рабочая программа по дисциплине «Спектральные методы анализа» для специальности 020101, 175.88kb.
- Физическая и коллоидная химия, 407.03kb.
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- Программа «Специальная химия» (элективный курс по выбору профильной подготовки для, 68.39kb.
- Методические указания по выполнению домашней контрольной работы по дисциплине «Основы, 108.96kb.
- В г. Воскресенске > к э. н., доцент К. А. Артамонова 2009 г. Вопросы к экзамену, 14.63kb.
- Примерная программа наименование дисциплины аналитическая химия рекомендуется для направления, 147.22kb.
- Примерная программа наименование дисциплины «Неорганическая и аналитическая химия», 341.23kb.
- Учебное пособие по курсу «управление банковским продуктом» Составитель: к э. н., доцент, 955.86kb.
49. ФОТОЭЛЕКТРОКОЛОРИМЕТРИЯ. ОСНОВЫ МЕТОДА
В фотоэлектроколориметрии степень поглощения света (интенсивность окраски раствора) определяют с помощью фотоэлемента.
Фотоэлемент представляет собой металлическую пластинку, покрытую слоем полупроводника (селен, сульфид серебра и др.). Световой поток, попадая на фотоэлемент, возбуждает в нем электрический ток.
Величина возникающего фототока прямо пропорциональна падающему световому потоку (закон Столетова).
Возникающий ток регистрируется включенным в цепь чувствительным микроамперметром, отклонение стрелки которого пропорционально освещенности фотоэлемента.
Различают фотоэлементы, позволяющие проводить определения как в видимой, так и в ультрафиолетовой областях спектра.
Применение фотоэлементов дало возможность автоматизировать определение концентрации компонентов при химическом контроле технологических процессов.
Преобразование световой энергии в электрическую на фотоэлементе связано с явлением фотоэффекта.
44
Фотоэффектом называется отрыв электронов от атомов различных веществ под влиянием световой энергии.
Фотоэлектроколориметры в зависимости от числа используемых при измерении фотоэлементов делят на две группы: I) фотоэлектроколориметры с одним фото-элементом (однолучевые приборы); 2) фотоэлектро-колориметры с двумя фотоэлементами (двухлучевые).
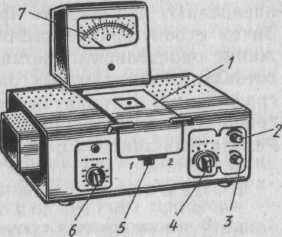
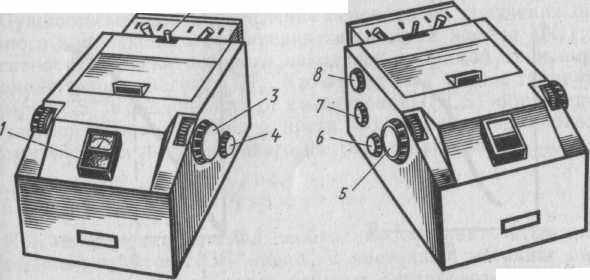
Конструкция колориметра КФК-2 Фотоэлектроколориметр
50. ХАРАКТЕРИСТИКА РЕФРАКТОМЕТРИЧЕСКОГО МЕТОДА АНАЛИЗА.
Метод рефрактометрического анализа или рефрактометрии (от лат. refractus — преломленный и греч. metreo — измеряю) основан на определении показателя преломления (коэффициента рефракции) и некоторых его функций. Метод основан на упругом взаимодействии электромагнитного излучения с анализируемым веществом в отличие от спектральных методов, уже рассмотренных в этой главе.
При прохождении излучения через прозрачную среду электрическая компонента электромагнитной волны испытывает взаимодействие с электронной системой частиц в исследуемой среде. Вследствие этого скорость распространения света в среде уменьшается по сравнению со скоростью в вакууме. Скорость распространения света в среде зависит от длины волны, поэтому показатель преломления также зависит от длины волны (λ).
Зависимость показателя преломления от длины волны называется дисперсией. Зависимость показателя преломления от плотности вещества связана с влиянием электронного распределения в среде на прохождение электромагнитной волны. Было установлено существование определенного соотношения между показателем преломления и плотностью среды, которое практически не зависит от плотности, температуры и агрегатного состояния вещества. Эта величина, которая, как и показатель преломления характеризует способность вещества преломлять свет, называется молекулярной рефракцией.
Для измерения показателя преломления используют приборы, называемые рефрактометрами. Существует несколько видов рефрактометров для измерения показателей преломления жидких, твердых и газообразных образцов. В этих приборах используются методы прямого измерения углов преломления света при прохождении им границы раздела двух сред; метод, основанный на явлении полного внутреннего отражения, а также на явлении
45
интерференции света.
Для жидкостей и твердых тел показатель преломления определяют, как правило, относительно воздуха, для газов — относительно вакуума.
Значения показателя преломления зависят от длины волны света и температуры.
51. ПОТЕНЦИОМЕТРИЯ. ПОТЕНЦИОМЕТРИЧЕСКОЕ ОПРЕ-ДЕЛЕНИЕ рН РАСТВОРОВ.
Потенциометрический метод анализа основан на определении разности электродных потенциалов, возникающих между двумя электродами, которые опущены в раствор определенного состава. Величина электродного потенциала φ зависит от состава и концентрации раствора (с), от природы электродов (φ°), температуры (Т) и других факторов.
Потенциометрический метод анализа применяют для определения показателей концентрации ионов в растворе (катионометрия и анионометрия), концентрации катионов водорода—рН, для потенциометрического титрования, т. д.
Основные направления потенциометрического метода анализа показаны следующей схемой:

 Потенциометрия
Потенциометрия
Родоксметрия Потенциометрическое
титрование
Ионометрия



рН-метрия Катионометрия Анионометрия
52. ЭЛЕКТРОДЫ ПОТЕНЦИОМЕТРИЧЕСКОГО МЕТОДА
Потенциометрическое титрование проводят в тех случаях, когда невозможно использовать химические индикаторы или при отсутствии необходимого индикатора. Окончание титрования устанавливают по резкому изменению потенциала индикаторного электрода вблизи точки эквивалентности.
Потенциометрические измерения проводят, опуская п сосуд с исследуемым раствором два электрода — электрод измерения (индикаторный), потенциал которого зависит от концентрации определяемых ионов в растворе, и электрод сравнения (стандартный), относительно которого измеряют потенциал электрода измерения. Потенциал электрода сравнения остается постоянным при изменении концентрации определяемых ионов. Измерение
разности потенциалов производят приборами потенциометрами.
Приборы комплектуются электродами, которые подразделяются на группы для работы с датчиком ДЛ-02 и для работы без датчика.
46
В химическом анализе находят применение несколько типов приборов для потенциометрического метода, одним из которых является рН-метр, милливольтметр лабораторный типа рН-340.
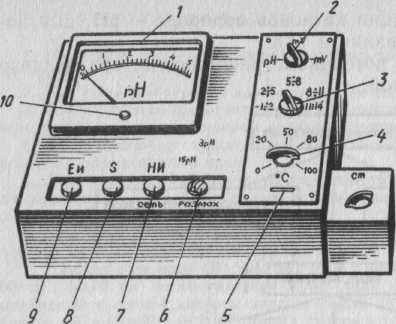
Передняя панель рН-метра
53. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА.
на избирательной способности некоторых твердых веществ адсорбировать (поглощать) различные компоненты, находящиеся в окружающей среде (жидкости и газе). Это явление называется сорбцией (адсорбцией), а поглотитель — сорбентом (адсорбентом). Количество поглощенного вещества зависит от природы его и сорбента, от структуры сорбента, а также от температуры и среды раствора. Наряду с процессом сорбции наблюдается обратный процесс — десорбция, при которой компонент удаляется с поверхности сорбента и переходит в окружающую среду (в раствор или газовую среду) без изменения первоначальных свойств.
В настоящее время большое применение получили высокомолекулярные органические или неорганические соединения (кислоты, гидроксиды и их соли), называемые ионитами или ионообменными смолами (фенолформальдегидные, полистерольные смолы, полиамины и др.). Иониты практически нерастворимы в воде, обладают ограниченной набухаемостью. Обмен ионов сорбента и раствора электролита происходит в эквивалентных отношениях. Частицы ионитов состоят
из неподвижного аниона R—[Аn-] (макроаниона) или катиона R—[Kt+] (макрокатиона) и соответственно подвижных катионов или анионов, способных обмениваться на другие подвижные ионы.
Иониты, содержащие неподвижные анионы и подвижные катионы, называются катионитами, а содержащие неподвижные катионы и подвижные анионы, — анионитами.
Большой интерес имеют биполярные иониты — амфолиты, которые проявляют свойства и катионита, и анионита.
Катиониты обменивают свои подвижные катионы на катионы электролита, находящиеся в растворе. Аниониты обменивают свои подвижные анионы на анионы раствора электролита.
Обменная сорбция зависит от рН раствора и свойств катионита, поэтому при анализе подбирают соответствующие катиониты.
Ионообменную хроматографию широко используют в количественном анализе. С помощью ионитов можно проводить очистку реагентов,
47
концентрировать разбавленные растворы и затем в них соответствующим методом анализа определять искомые компоненты. Для этого исследуемый раствор пропускают через колонку с R—[Аn-]-Н+ - катионитом (Н+-форма). Катионы из раствора поглощаются катионитом, а в растворе образуется эквивалентное количество кислоты, которую оттитровывают щелочью известной концентрации. Затем вычисляют содержание определяемого компонента в исследуемом растворе (по закону эквивалентов).
54. КЛАССИФИКАЦИЯ ХРОМАТОГРАФИЧЕСКИХ МЕТОДОВ АНАЛИЗА.
Хроматографический метод анализа широко применяют как в качественном, так и в количественном анализе для отделения примесей и получения химически чистых препаратов, для разделения и выделения компонентов из неорганических и органических сложных смесей. Выделенные компоненты определяют химическими, физическими и физико-химическими методами анализа. Применение хроматографии для разделения смесей значительно ускоряет проведение анализа, уменьшает потери определяемых компонентов.
В зависимости от агрегатного состояния разделяемой смеси различают газовую, жидкостную и газо-жидкостную хроматографию. По механизму разделения сорбционную, распределительную, ионообменную, осадочную и другие виды хроматографии. По способу проведения хроматографического процесса — колоночную, капиллярную, плоскостную (бумажную), тонкослойную.Большое значение в анализе неорганических соединений имеет ионообменная хроматография..
Ионообменная хроматография основана на способности сорбентов не только поглощать, но и обменивать поглощенные ими одни компоненты на другие, находящиеся в жидкой или газообразной фазе. К числу таких сорбентов относятся природные гидросиликаты — цеолиты. Кроме природных гидросиликатов ионообменными свойствами обладают искусственные гидросиликаты — пермутиты.
55. СПЕКТАЛЬНЫЕ МЕТОДЫ АНАЛИЗА
В основе данного метода анализа лежат следующие основные процессы:
1. взаимодействие исследуемого вещества с внешним электромагнитным излучением, приводящим к его частичному поглощению – абсорбции излучения;
2. взаимодействие исследуемого вещества с внешним электромагнитным излучением, приводящим к предварительному возбуждению атомов или молекул данного вещества, и последующему электромагнитному излучению – люминесценции;
3. самопроизвольная эмиссия (испускание) электромагнитного излучения анализируемым веществом в состоянии плазмы;
48
4. рассеяние внешнего электромагнитного излучения анализируемым веществом.
Методы спектрального анализа:
1) эмиссионные методы – основаны на явлении излучения электромагнитных волн возбуждёнными атомами;
2)люминесцентные методы – также основаны на излучении анализируемым веществом, которое предварительно возбуждается под действием электромагнитного излучения от ламп определённого типа, лазерного излучения или в результате химической реакции;
- атомный анализ – цель: установление элементного состава вещества;
- молекулярный спектральный анализ – предполагает идентификацию данного вещества;
- фотометрический анализ.
В основе спектроскопических методов анализа или спектрального анализа лежат следующие основные процессы:
- взаимодействие исследуемого вещества с внешним (диагностирующим) электромагнитным излучением, приводящим к его частичному поглощению — абсорбции излучения,
- взаимодействие исследуемого вещества с внешним электромагнитным излучением, приводящим к предварительному возбуждению атомов или молекул данного вещества, и последующему электромагнитному излучению — люминесценции,
- самопроизвольная эмиссия (испускание) электромагнитного излучения анализируемым веществом в состоянии плазмы (в пламени горелки, электрического разряда в газе: электрической дуге, искровом разряде или высокочастотном разряде);
- рассеяние внешнего электромагнитного излучения анализируемым веществом.
Методы анализа, основанные на явлении излучения электромагнитных волн предварительно возбужденными атомами, ионами или молекулами, называют эмиссионными методами.
Люминесцентные методы — спектроскопия люминесценции — также основаны на излучении анализируемым веществом. Однако в отличие от эмиссионных, люминесцентные (флуоресцентные) методы предполагают, что анализируемое вещество предварительно возбуждается под действием электромагнитного излучения от ламп определенного типа, лазерного излучения или в результате химической реакции (хемилюминесценция).
В целях качественного и количественного определения состава вещества исследуют спектры поглощения, испускания, люминесценции, отражения и рассеяния электромагнитного излучения.
Взаимодействие электромагнитного излучения с веществом может быть упругим или неупругим.
При упругом взаимодействии электромагнитной волны с частицей
49
исследуемого вещества энергия электромагнитной волны остается неизменной; изменяется только направление распространения волны.
Разделяют атомный и молекулярный спектральные анализы. Цель атомного спектрального анализа — установление элементного состава вещества. Одним из наиболее мощных методов элементного анализа является атомно-эмиссионный спектральный анализ. Этот метод основан на изучении спектров испускания свободных атомов и ионов в газовой фазе. Молекулярный спектральный анализ. Предполагает идентификацию данного вещества и/или определение его количества: концентрации, массы.
56. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Электрохимические методы анализа, называемые еще электроаналитическими, основаны на явлениях, происходящих на электродах или в межэлектродном пространстве. Они преимущественно используются при анализе растворов. Для любых электрохимических измерений необходима электрохимическая цепь или электрохимическая ячейка, составной частью которой являются анализируемый раствор (электролит) и электроды.
Широкий крут химических задач, решаемых с помощью электрохимических методов анализа, делает их конкурентоспособными по отношению к другим инструментальным методам. Электрохимическими методами анализа можно решить практически любую задачу химико-аналитического контроля: они пригодны для анализа неорганических и органических объектов.
Электрохимические методы характеризуются высокой чувствительностью (полярография, кулонометрия), широким интервалом определяемых концентраций (1 —10-9 моль/л), избирательностью и экспрессностью (ионометрия, электрогравиметрия), относительной простотой выполнения и невысокой стоимостью аппаратуры (кондуктометрия, потенциометрия), возможностью концентрирования в рамках самого метода (инверсионная вольтамперомет-рия) или в сочетании с другими методами (например, с хроматографией, экстракцией), легкостью автоматизации всего аналитического цикла.
В качестве классификационного признака наиболее часто используют измеряемый электрический или электрохимический параметр.
Методы:
- полярография – основана на получении и использовании зависимости между силой постоянного тока и напряжением, подаваемым на электроды;
- потенциометрия – основана на измерении потенциала индикаторного электрода в зависимости от концентрации определяемого иона;
- кулонометрия – основана на измерении количества электричества, израсходованного на электролиз определяемого вещества;
- кондуктометрия – основана на изучении зависимости между электропроводностью раствора и концентрацией в нём ионов.
50
57. МЕТОДЫ ТЕХНОХИМИЧЕСКОГО КОНТРОЛЯ.
Методы технохимического контроля разнообразны. Технологический контроль делится на следующие методы исследования: органолептические, физические, химические, бактериологические и биологические. При выборе методов исследования необходимо учитывать химический состав продуктов, процессы, происходящие в них при холодной и тепловой обработке, при хранении, транспортировке, и сроки их реализации. Срок хранения полуфабрикатов или готовых изделий существенно влияет на выбор метода контроля.
Органолептические методы исследования продуктов широко применяются при оценке их качества. Быстрота оценки позволяет широко пользоваться органолептическим методом особенно тогда, когда невозможно осуществить лабораторный контроль. Органолептическая оценка пищи — это определение ее качества по вкусу, цвету, внешнему виду, запаху и консистенции. Такое исследование партии блюд и полуфабрикатов перед их реализацией называется бракеражем.
Быстрое заключение о качестве позволяет немедленно принять меры для устранения, если это возможно, допущенных нарушений технологических правил или своевременно снять изделия с продажи. Специфика работы предприятий общественного питания требует иногда немедленного заключения о качестве изделий. При этом органолептическая оценка имеет огромное значение, так как многие лабораторные методы исследования длительны и результаты их могут быть получены, когда сроки реализации пищи будут превышены. Недостатками этого метода являются субъективность оценки, невозможность установить состав изделия. Несмотря на некоторую субъективность, этот метод контроля часто позволяет обнаружить такие дефекты и признаки порчи, которые нельзя заметить при самых точных аналитических исследованиях.
При оценке качества изделий не ограничиваются лишь органо-лептическими показателями, а применяют физико-химические методы исследования: колориметрию, рефрактометрию, нефелометрию, которые производят при помощи специальных приборов и аппаратов, а также определяют некоторые физические показатели: влажность, плотность, температуру изделия и др.
Колориметрированием определяют, например, степень термического окисления фритюрного жира.
Рефрактометрия основана на свойстве светового луча изменять свое направление при переходе из одной среды в другую. Каждому жиру, маслу, сахарному раствору соответствует определенный показатель преломления, который определяют по шкале рефрактометра Рефрактометрия осуществляется при помощи специальных приборов — рефрактометров. Известны рефрактометры самых различных конструкций и видов.
Нефелометрия основана на сопоставлении степени мутности исследуемого и стандартного растворов.
Химические методы исследования применяются для определения количества белка, жира, сахара, соли, кислотности и др.
51
Бактериологическими методами исследования пользуются при обследовании предприятий для выявления источников бактериального загрязнения, в случае пищевых отравлений и подозрения на их бактериальное происхождение, при подозрении на бактериальное загрязнение сырья, полуфабрикатов и готовых изделии.
58. СРЕДНЯЯ ПРОБА СЫРЬЯ.
Средняя проба сырья, полуфабрикатов, кулинарных и кондитерских изделий должна соответствовать всей партии. Пробы переносят в специальную посуду, для этого можно использовать комплект цилиндрических сосудов, изготовленных из пищевого алюминия. Сосуды имеют одинаковый диаметр, но разную высоту и, следовательно, разный объем. В верхней части сосуда имеется дужка, сквозь которую продевают шнурок для опломбирования. Такая дужка имеется и на плотной закрывающейся крышке. Крышки, одинаковые по диаметру, подходят ко всем сосудам. Комплект посуды состоит из одного сосуда вместимостью 0,8 л (для первых блюд), трех сосудов вместимостью 0,5 л (для вторых и третьих блюд), четырех сосудов вместимостью 0,3 л (для гарниров и соусов).
Отобранные пробы переносят в чистую сухую тару, плотно закрывают и пломбируют. Особое внимание следует обращать на тщательность переноса кулинарных изделий. Приставшие к тарелке плотные частицы супа счищают ложкой и присоединяют к пробе. При переносе второго блюда пробу делят на составные части: мясо или рыбу перекладывают в один сосуд, а гарнир с соусом или жиром — в другой.
В стандартах и технических условиях указывается количество единиц упаковки, подлежащих вскрытию, а также способы составления средней пробы. При отсутствии стандартов и технических условий для отбора пробы в небольшой партии вскрывают все единицы упаковки, если их не более пяти, а в более крупной — каждую вторую или третью, но не менее пяти. При выемке проб составляют акт в двух экземплярах, из которых один остается на предприятии, а другой отсылается в лабораторию. На изделия, приготовленные по особой рецептуре, составляют справку, в которой указывают состав и расход сырья и стоимость готовых изделий. Справку заверяют заведующий производством и калькулятор. На всех документах, сопровождающих пробы, ставят печать предприятия.
Поскольку большинство полуфабрикатов, блюд и кулинарных изделий являются скоропортящимися или особо скоропортящимися, реализация продукции должна осуществляться в сжатые сроки (1—2 ч). Поэтому методы контроля качества пищевых продуктов должны быть экспрессными.
52
59. ПОРЯДОК ПРОВЕДЕНИЯ БРАКЕРАЖА СЫРЬЯ.
Для получения изделий высокого качества необходим контроль сырья Более или менее длительное хранение, а также возможное нарушение правил транспортировки сырья может быть причиной ухудшения его свойств.
Контроль качества продовольственных товаров и порядок проверки сырья излагаются в соответствующих инструкциях.
На предприятиях общественного питания поступающее сырье обычно подвергают органолептической оценке и проверяют его качество в соответствии с данными, указанными в сопроводительных документах. Контроль сырья осуществляют материально-ответственные лица — заведующий складом или кладовщик, заведующий производством и представитель санитарной службы.
При несоответствии качества сырья сертификату или накладной материально-ответственное лицо и руководитель предприятия составляют акт. Если сырье вызывает сомнение в доброкачественности, следует отобрать пробу и отправить ее на анализ в санитарно-пище-вую лабораторию. Качество полуфабрикатов, выпускаемых предприятием-изготовителем, контролирует начальник или мастер цеха, или бракер отдела технического контроля, или лаборатория.
