Программа курса "Охрана окружающей среды"
| Вид материала | Программа курса |
- Рабочая программа элективного курса «Химия и охрана окружающей среды», 82.96kb.
- Программа дисциплины дпп. Р. 01 Экология и охрана окружающей среды цели и задачи курса, 147.68kb.
- Тема : «Загрязнение и охрана окружающей среды», 38.66kb.
- Тематический план проведения семинаров и курсов повышения квалификации на 2012 год, 2025.98kb.
- В. Н. Масляев охрана окружающей среды учебное пособие, 1544.73kb.
- Практикум по экологическому мониторингу окружающей среды Учебное пособие, 949.79kb.
- Рабочая программа (очное обучение) По В. 01. 01 (В. 01. 02.) Основы подготовки питьевой, 188.69kb.
- Программа города москвы «охрана окружающей среды», 1463.79kb.
- Рабочая программа по дисциплине сд ф. 05 «Техника защиты окружающей среды» для студентов, 202.99kb.
- Ведомственная целевая программа «Охрана окружающей среды на территории Республики Карелия, 583.24kb.
Программа курса "Охрана окружающей среды"
ФЕН НГУ, 3 семестр, гр. 41,42, 43
ХИМИЧЕСКИЕ АСПЕКТЫ ОХРАНЫ ОКРУЖАЮЩЕЙ СРЕДЫ (3 октября)
Химическая эволюция Биосферы, факторы, ее определяющие. В.И.Вернадский о роли и биогеохимических функциях живого вещества. Экосистемы (биогеоценозы), взаимосвязь живых и косных компонент. Техногенные потоки веществ в современной биосфере. Химические загрязнения и их последствия.
ОХРАНА АТМОСФЕРЫ (10 октября)
Экологические проблемы атмосферы. Влияние углекислого газа. Влияние метана. Основные фотохимические процессы. Исследование фотохимических механизмов превращения органических соединений, характерных для природной среды, и модельных соединений.
ХИМИЯ ГИДРОСФЕРЫ (17 октября)
Гидросфера, гидрологический цикл. Химический состав поверхностных, подземных, океанических вод, роль процессов жизнедеятельности. Миграция и трансформация веществ в природных водах, роль кислотно-основных, окислительно-восстановительных условий, процессов комплексообразования. Загрязнения природных вод.
Геохимия техногенных систем (применительно к отходам горно-рудной промышленности) (24 октября)
Типизация техногенных систем (по составу, морфологическим типам, присутствующим реагентам). Основные факторы и механизмы изменения вещества. Перераспределение элементов и их различных форм нахождения в зависимости от изменения физико-химических параметров среды, возраста, наличия геохимических барьеров. Внешние связи. Миграция химических элементов с водными потоками, концентрация, формы нахождения, причины осаждения-растворения вторичных соединений. Формирование аномалий токсичных элементов в водах, донных осадках, почвах, растительности. Прогнозная оценка воздействия техногенных систем на природные компоненты. Возможные меры защиты окружающей среды от вредного влияния отходов.
МЕТОДЫ ОПРЕДЕЛЕНИЯ МАКРО- И МИКРОЭЛЕМЕНТОВ В ПРИРОДНЫХ И ТЕХНОГЕННЫХ СИСТЕМАХ (31 октября)
Трансформация и транспорт веществ в окружающей среде. Содержание макро- и микрокомпонентов в природных средах. Элементный и вещественный анализ объектов окружающей среды. Современные методы определения микроэлементов в водах, почвах, донных осадках, растениях, атмосферных аэрозолях. Методы определения микроэлементов на уровне химических форм. Изучение трансформации микроэлементов на уровне химических форм в реальных природных и техногенных системах
Неблагоприятные последствия ухудшения окружающей среды для здоровья человека и оценка их риска (14 ноября)
Динамика промышленных выбросов и динамика заболеваемости и распространенности некоторых полифакторных заболеваний в последние 3 десятилетия. Неблагоприятные биологические эффекты химических соединений (в т.ч. специфические взаимодействия с молекулярными мишенями и неспецифическое повреждение биологических макромолекул). Субпопуляции, восприимчивые к неблагоприятным эффектам воздействия чужеродных соединений. Методологии оценки риска (США, ЕЭС, Россия).
Адаптационные процессы взаимодействия живых организмов с химическими факторами внешней среды (28 ноября)
Адаптация растений к условиям внешней среды, их взаимодействие с окружающей средой через вторичные метаболиты (токсины, гормоны), а также адаптация живых организмов через изменение ферментативной активности. Основные метаболические пути и способы их регуляции при меняющихся условиях внешней среды (ангидробиоз, аноксия, гипоксия, выключение активного метаболизма). Токсикологические аспекты экологической биохимии. Основные ферменты метаболизма 1-й фазы (цитохром Р450) и 2-й фазы (трансферазы), а также их участие в метаболизме чужеродных соединений-ксенобиотиков. Метаболизм пестицидов и других промышленных химикатов. Токсификация как негативное проявление действия ксенобиотиков.
ПРОБЛЕМЫ НОРМИРОВАНИЯ И КОНТРОЛЯ СОСТОЯНИЯ ОКРУЖАЮЩЕЙ СРЕДЫ (12 декабря)
Судьба загрязняющих веществ и их воздействие на организмы в природных системах. Понятие «здоровье экосистемы». Различие подходов санитарно-гигиенического и экологического нормирования загрязняющих веществ в объектах окружающей среды. Принципы комплексного нормирования и мониторинга состояния природных экосистем.
Примерные темы рефератов
- Эволюция химического состава биосферы. Биосфера как термодинамическая система. Экзо- и эндогенные потоки вещества и энергии.
- Биогеохимические функции живого вещества в биосфере (по В.И.Вернадскому).
- Элемент (Hg, Cu, Cd, Pb … - по выбору) в биосфере (кларки, формы нахождения, техногенные потоки, содержание в организмах, токсичность, методы анализа).
- Строение атмосферы – состав, давление, температура. Зависимость параметров атмосферы от высоты.
- Роль углекислого газа в атмосфере, источники и стоки углекислого газа.
- Роль метана в атмосфере. Источники и стоки метана.
- Фотохимические процессы в атмосфере. Механизмы вывода примесей из атмосферы.
- Абиотические и биотические процессы формирования химического состава природных вод (океанических, речных, озерных, почвенных, подземных – по выбору).
- Карбонатная система в природных водах.
- Химические процессы трансформации загрязняющих веществ в природных водах.
- Потенциальная и реальная опасность складированных отходов обогащения руд: закономерности изменения вещества отходов под действием факторов окружающей среды.
- Формирование водных и ветровых аномалий химических элементов (механизмы миграции, физические и химические формы нахождения элементов, причины их рассеяния или концентрирования).
- Геохимические барьеры как способ минимизации вредного влияния отходов на окружающую среду (нейтрализация кислоты, осаждение металлов).
- Трансформации мышьяка в природе и в зонах техногенеза. Методы исследования.
- Метилртуть в природе: происхождение, пути превращения, воздействие на живые организмы. Методы определения метилртути в природных и биологических объектах.
- Методы анализа, применяемые для мониторинга микроэлементов в природе.
- Токсификация как негативное проявление действия ксенобиотиков.
- Ферменты в биохимической адаптации.
- Проблемы нормирования и мониторинга состояния природных экосистем.
Основная литература
1. Богдановский Г.А. Химическая экология. 1994, М., Изд МГУ.
2. Химия окружающей среды. Под ред. Дж.О.М.Бокриса. 1982,М.,"Мир".
3. Исидоров В.А. Экологическая химия. С.-Петербург, 2002.
4. Тинсли И. Поведение химических загрязнителей в окружающей среде. 1982, М., "Мир".
5. Андруз Дж., Бримблекумб П., Джиккелз Т., Лисс П. Введение в химию окружающей среды. (1999) М.: Мир.
6. Шуваева О.В. Современное состояние и проблемы элементного анализа вод различной природы. Аналитический обзор. Новосибирск, 1996. 48с.
7. Харборн Дж. Введение в экологическую биохимию. 1985, М., Мир,. 308 с.
8. Хочачка П., Сомеро Дж. Биохимическая адаптация. 1988, М., Мир,. 568 с.
9. Гуляева Л.Ф., Райс Р. Биологические эффекты токсических соединений (курс лекций). 2005, Изд-во Новосибирского Гос. Ун-та-- 208 с.
Дополнительная литература
1. Коптюг В.А. Химия и устойчивое развитие. В журн. "Химия в интересах устойч. развития", 1993, т.1, №3.
2. Иванов В.В. Экологическая геохимия элементов. 1996-1997, Кн. 1-5. М., Недра.
3. Сухенко С.А. Ртуть в водохранилищах: новый аспект антропогенного загрязнения биосферы. Аналитический обзор, сер.«Экология», вып. 36. Изд-во ГПНТБ, Новосибирск, 1995, 59 с.
4. Кузубова Л.И., Шуваева О.В., Аношин Г.Н.. Метилртуть в окружающей среде. Распространение, образование в природе, методы определения. Аналитический обзор, серия «Экология», вып.59, Изд-во ГПНТБ, Новосибирск, 2000.
5. Милашкевский А.З., Павлоцкая Ф.И. и др. Содержание и формы нахождения микроэлементов в приземном слое воздуха и атмосферных осадках. Геохимия, 1977, N 11, с.1673.
Рекомендуемый режим освоения дисциплины – по материалам каждой прослушанной лекции ознакомиться с соответствующими разделами основной литературы. По завершении лекционного курса выбрать тему реферата, для подготовки которого использовать дополнительную литературу, а также курсы лекций по разным разделам химии. Реферат следует структурировать (введение, формулировка цели работы, основная часть, выводы или заключение, список использованной литературы).
Зачет по курсу – по материалам реферата, который в печатном виде нужно сдать на кафедру химии окружающей среды (к. 306) до 19 декабря
Дополнительные материалы к лекциям
БИОСФЕРА (эволюция, состав, структура)
Окружающая человека среда - Биосфера Земли, структура и химический состав которой претерпели существенные изменения в ходе эволюции, в значительной степени - благодаря химической работе живого вещества (В.И.Вернадский). Именно химические аспекты функционирования Биосферы в естественном и нарушенном состояниях будут рассматриваться в данном курсе лекций. Представим эволюцию Биосферы в масштабе годичного исчисления (1сут = 12,6 млн.лет, 1 час – 525 тыс. лет, 1 мин = 8750 лет, 1 сек – 146 лет):
- 31 дек. Господство млекопитающих Окислит. сост. атмо- "31 декабря":
млн.лет и гидросферы, наличие 16 час - ископаемые остатки
осадочных пород, почв… древнейших людей
1 дек. Развитие млекопитающих
начало освоения суши 23 ч. 54 мин. - появление
400 первые рыбы Точка Пастера [O2] 1% совр. Homo sapiens
1 ноя. Развитие позвоночных Снижение [CO2] в атмо- 23 ч 58 мин - развитие земледелия
и гидросфере 23 ч 59 мин 58 сек - начало пром.
революции, возникновение
- 1 окт. Быстрый рост жизн.форм Техносферы
в морях, появл.беспозвоночных
1 сент. Первые клетки, характ. для Точка Юри [O2]0.1%
животных и высш. растений от современного
1 авг. Первые сложноорг. клетки Формирование единого Мирового океана
В атмосфере - продукты дегазации мантии
- 1 июля Высокое разнообр. бактерий при отсутствии кислорода
1 июня Восстановительная среда с высокой
1 мая Рост разнообразия бактерий кислотностью поверхностных вод,
3400 1 апр Первые фотосинт. бактерии миграция металлов - в низших
1 март Появл. колоний бактерий степенях окисления, кристаллизация и
1 февр Первые бактерии дифференциация изверженных пород
4600 1 янв Процессы генериров. органич. молекул
Современный химический состав Биосферы обусловлен длительной работой "живого вещества" (по В.И.Вернадскому). Учитывая темпы развития техносферы, масштабы, пути и формы техногенного потока химических элементов, реализующиеся в рамках Биосферы, их воздействие на структуру и функционирование биоценозов, этот состав и процессы его поддержания могут быть нарушены.
Биосфера - единый комплекс живых и косных компонент, связанных обменом веществом и энергией, в термодинамическом плане - почти закрытая, но существенно неизолированная система; длительное и крупномасштабное совершение работы обусловлено потоком внешней энергии в форме излучения Солнца:
Н. Км Экзогенные потоки Массы: Земли - 6 1023 т
2.3 105эрг/см2сек ; 2.5 106т/год атмосферы - 5 1015 т
20 ---------------------Внешняя граница------------ Внутренние потоки: гидросферы - 1.6 1018 т
Н2О: атм.осадки 5.2 1014 т/г литосферы - 1.7 1018 т
в т.ч. соли 7.5 109 т/г биомасса суши - 2.5 1012 т
0 ___________________________________ речн.сток 3.7 1013 т/г океана - 7 10 9 т
в т.ч. соли 5 109 т/г
Живое вещество /год.продуктивность/ суши - 1.7 1011 т/г
10 океана - 8 1010 т/г
---------------------Внутренняя граница ------------ Биол.оборот (т/г): С - 1.3 1011, О - 3 1011, N - 5.4 109, Ca,K 109,
Эндогенные потоки Si, P, S, Mg, Cl, Na…> 108
- (60-70) эрг/см2сек; (2-3)109т/год
Именно живое вещество выполняет роль преобразователя энергии излучения в форму, способную осуществлять химическую работу. Биогеохимические функции живого вещества (В.И.Вернадский) /газовые, кислотно-основные, концентрационные 1 и 2 рода, окислительно-восстановительные, биохимические 1 и 2 рода/ реализуются совокупностью: продуцентов (350 тыс.видов, 2.4 1012 т), создающих первичную продукцию - органич.в-во - из простых неорганических в-в; питающихся ими консументов (1.5 млн.видов, 2.3 1010 т) - вторичная продукция; редуцентов (75 тыс.видов, 1.2 1010 т), разлагающих первичную и вторичную продукцию до простых неорганических веществ, замыкающих цикличность вещества. Упрощенно эти процессы можно представить равновесием ( - продуценты, - редуценты): 106СО2 + 122Н2О + 16NH3 + H3PO4 + Ca,Mg,K,Na,Fe,Si… + (h) (СН2О)106(NH3)16H3PO4(Ca,Mg,K,S,Na,Fe,Si…) + 138O2; в анаэробных условиях вместо О2 в качестве окислителя редуценты могут использовать нитрат или сульфат, тогда продуктами разложения биомассы будут N2, H2S.
Высокое разнообразие форм (видов) живого вещества, сложившееся в ходе эволюции, обеспечивает устойчивое функционирование сообществ (биоценозов) при вариациях внешних условий. При этом цикличность использования косного вещества определяется кинетической согласованностью разнонаправленных процессов.
По условиям использования внешней энергии и косного вещества наземные и водные сообщества отличаются. Разумно выделить менее крупные, чем Биосфера, но целостные объекты, для которых сохраняются такие свойства, как способность длительное время сохранять свои структурные и функциональные характеристики.
Биогеоценоз (Сукачев, 1940) - однородный участок земной поверхности с определенным составом живых (биоценоз) и косных (геоценоз) компонент и динамическим взаимодействием между ними, целостная, многокомпонентная, самоподдерживающаяся, имеющая активную средообразующую функцию, исторически сложившаяся и очерченная рамками ландшафта природная система. Менее содержательный, но получивший большее распространение термин – экосистема - (Тенсли, 1935): единый природный комплекс, образованный живыми организмами и средой их обитания, в котором живые и косные компоненты связаны между собой обменом веществ и энергии.
Биогеоценозы (экосистемы) являются более открытыми (по веществу) объектами, чем Биосфера в целом, но их границы не могут быть произвольными и должны отвечать условию сохранения структурных и функциональных характеристик.
Устойчивость (буферная емкость) биогеоценозов (экосистем) к изменению внешних условий (химического состава, потоков веществ и энергии) зависит от разных факторов и, как правило, повышается по мере усложнения видового разнообразия живых компонент. При внешнем воздействии, превышающем буферную емкость данной экосистемы, она может перейти в другое состояние, характеризующееся иным набором структурных и функциональных характеристик, что влечет и изменение направленности и кинетики реализующихся в ней химических процессов.
Такие нарушения могут быть вызваны как непосредственным, так и опосредованным воздействием, за границами данной экосистемы (напр., изменение состава и количества речного стока повлияет на прибрежные и океанические экосистемы). При этом принципиальное значение имеет само понятие загрязнения природной среды (в отличие от более общего понятия загрязнения объектов, имеющих специализированное назначение (производственные и бытовые помещения, питьевая вода, продукты питания и т.п.), для которых нормативы чистоты устанавливаются с учетом санитарно-гигиенических и иных требований.
Загрязнение природной среды – введение человеком, прямо или косвенно, вещества или энергии, влекущее за собой неблагоприятные последствия такого характера, как угроза здоровью людей, нанесение вреда живым ресурсам, экосистемам, ценностям ландшафта, а также помехи законным видам использования природных ресурсов.
ХИМИЯ АТМОСФЕРЫ
Атмосфера - наиболее подвижная часть Биосферы, через которую осуществляется перенос вещества в форме газов, водных растворов и твердых частиц (аэрозолей); кроме того, через атмосферу поступает и излучается энергия, что в значительной степени определяет протекание крупномасштабных химических процессов в Биосфере. Поэтому состав и процессы в атмосфере играют важную роль в функционировании Биосферы в целом и отдельных экосистем. Кларковый состав современной атмосферы (сухая, на уровне поверхности, в среднем), в объемных %:
N2 78.084 Ne 1.821 10-3 Rn 6 10-5 N2O 5 10-5 H2O2 4 10-8
O2 20.946 He 5.239 10-4 H2 5 10-5 Xe 8.7 10-6
Ar 0.934 CH4 1.5 10-4 CO 10-4 - 10-6 NH3 2.6 10-6
CO2 0.030 Kr 1.14 10-4 O3 10-5 - 10-6 NO2 2.6 10-6 - 5 10-8
Несмотря на то, что основную часть атмосферы составляют всего три газа, а остальные представлены как примеси, именно малые составляющие играют важную роль в фотохимических реакциях, регулирующих радиационный баланс Земли, спектральные характеристики излучения, поступающего на поверхность и излучаемого в космос.
Основные типы фотохимических реакций
Ионизация: N2 + 25.0 eV N + N+ + e- = 49.5 nm
H = 1001200 km О2 + 19.0 eV O + O+ + e- = 65.0 nm
102.7 nm N + 14.6 eV N+ + e- = 85.3 nm
Диссоциация СН4 + 8.6 eV CH22- + 2Н+ = 145 nm
H= 70120 km H2O + 7.2 eV H+ + OH- = 175 nm
102.7 242.4 nm
Образование радикалов: О2 + 5.1 eV O + O* = 242.4 nm
O3 + 4.6 eV O2 + O* = 288.4 nm
Существование различных частиц с высокими энергиями порождает разнообразные вторичные процессы: обмена - O+ + N2 NO+ + N, переноса заряда O2++NO O2+NO+, диссоциативной рекомбинации NO+ + e- N + O. Фотохимические реакции разных типов реализуются во всем объеме атмосферы, в т.ч. за пределами Биосферы (поэтому химический состав атмосферы меняется с высотой) и служат "фильтром" коротковолнового излучения, поступающего в Биосферу, и длинноволнового (теплового) излучения Земли. Как видим, роль малых составляющих состава атмосферы чрезвычайно важна для поддержания параметров Биосферы. Отсюда - нарушение химического состава атмосферы, наиболее легко доступное именно по отношению к примесным газам, может вызвать существенные негативные эффекты. В настоящее время некоторые из них приобрели глобальный характер:
"Парниковый эффект": по Кондратьеву, экранирование длинноволнового излучения Земли в атмосфере приводит к повышению температуры на поверхности Земли на 33.2о, при вкладе H2O - 20.6о, СО2 - 7.2, O3 - 2.4, N2O - 1.4, CH4 - 0.8o. Прямой выброс в атмосферу с наземных источников или двигателями ракет, самолетов в самой атмосфере этих газов или веществ, инициирующих их синтез или распад в атмосфере, как и других веществ, способных к фотохимическим превращениям в длинноволновой области, может привести к изменению средней температуры в Биосфере.
"Озоновые дыры" - при малом содержании озона в атмосфере O3 играет важную роль в "отфильтровывании" коротковолнового излучения. Интенсивное разрушение озона, например, за счет каталитического действия NO или Cl по реакциям:
O3 + NO NO2 + O2 O3 + Cl ClO + O2 Каждая частица NO или Cl может
NO2 + O NO + O2 ClO + O Cl + O2 разрушать десятки и сотни молекул O3
O3 + O 2O2 O3 + O 2O2
может приводить к повышению потока ультрафиолетового излучения. Интересно отметить, что источником Cl на высотах 20-30 км, где концентрация озона максимальна, могут быть пары фторхлоруглеродов - химически инертных и потому считавшихся безвредными, но способных к фотохимической деструкции в верхних слоях атмосферы. Таким образом, опосредованное воздействие безвредных инертных веществ обусловлено их трансформацией в естественной природной среде, результатом которого оказывается серьезное нарушение общих параметров Биосферы. Источником NO могут быть высокотемпературные процессы сжигания топлива в двигателях ракет и самолетов, при которых становится возможным окисление молекулярного азота воздуха, а также природные пожары (торфяников, лесов и т.д.).
"Кислотные дожди" - глобальная проблема, обусловленная техногенными выбросами в атмосферу газообразных веществ, способных либо непосредственно (напр, пары кислот), либо после фотохимических превращений абсорбироваться мокрыми осадками и придавать им кислую реакцию. Так, SO2 в результате фотохимических реакций превращается в SO3, а после абсорбции в каплях дождя - в серную кислоту; оксиды азота - в азотную кислоту. При дефиците нейтрализующих катионов эти кислоты остаются в свободном состоянии. Расчетное значение рН для дистиллированной воды, находящейся в равновесии с атмосферным воздухом при фоновом содержании СО2, SO2, NH3 можно оценить из их растворимости (по закону Генри) и соответствующих констант диссоциации; оно равно 5.8. В регионах с "кислотными дождями" рН достигает 4 и ниже, а в туманах бывает ниже 3. Такая кислотность обычно связана с повышенным содержанием оксидов серы, реже - азота, иногда (локально) - паров HF в атмосфере, причем из-за высокой подвижности воздушных масс может наблюдаться на значительном удалении от источника техногенных выбросов. Однако кислотные выпадения могут быть следствием дефицита катионов основного характера относительно анионов, что наблюдается в ряде удаленных от урбанизированно-промышленных зон "фоновых" регионах, в частности, в тундре, высокогорных областях. Т.о., общая причина закисления атмосферных осадков – разбаланс между катионами и анионами в их ионном составе: [H+] = ([HCO3-) + [SO42-) + [Cl-] + [NO3-] + [HCOO-] + …) - ([NH4+] + [Ca2+] + [Mg2+] + [Na+] + [K+] + …). При этом все анионы могут иметь предшественниками газы атмосферы, а в составе катионов большинство не имеет летучих форм и должны поступать из эрозионных и морских источников в виде твердых частиц. Типичные данные по суммарной минерализации W, мг/л, и долевому распределению ионов (% эквивалентов относительно суммы катионов или анионов, соответственно) для разных регионов таковы:
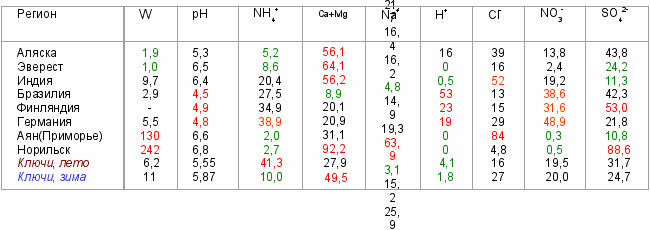
Минимальная минерализация осадков – на Аляске и Эвересте, причем на Аляске они слегка закислены, а на Эвересте (как и в Индии) – защелочены (избыток катионов из эрозионных источников). Максимальная минерализация осадков в фоновом регионе (Аян, побережье Охотского моря; высокая концентрация натрия и хлорида морского происхождения, низкая – сульфатов, нитратов, аммония) и в промышленном Норильске (огромная концентрация сульфатов с избытком компенсируется кальцием, в результате вместо закисления имеет место защелачивание осадков). Причина закисления осадков в Бразилии (при малой величине W) – повышенная доля нитратов, продуктов сжигания биомассы (сахарного тростника). На юге Западной Сибири (пос. Ключи, окрестности Академгородка) рН дождевых осадков ниже «нормального» значения (5,8), несмотря на высокую долю аммония, а в снежных выпадениях – близко к нормальному за счет более высокого содержания Ca, источником которого являются аэрозольные частицы, захватываемые снежинками.
При малой величине щелочного резерва в почвах и поверхностных водах выпадение кислотных осадков может привести к закислению почв и водоемов, что нарушает функционирование наземных и водных экосистем. Т.о., последствия загрязнения атмосферы проявляются в других природных средах и зависят от химической трансформации и путей переноса загрязняющих веществ.
Помимо газовых составляющих атмосферы для массопереноса и химических процессов значительную роль играют атмосферные аэрозоли (АА) - твердые частицы с размерами от 0.5 до 20 мкм, содержание которых достигает 50 мкг/м3; они во многом определяют оптические свойства атмосферы, и, следовательно, климат. Источники АА: газофазные реакции (образов. тв. сульфата аммония из газообразных NH3 и SO3); испарение мелких капель морской воды (морской источник); эрозия и эмиссия с наземной поверхности мелких частиц почв, пород, дорожной пыли (эрозионные источники); выбросы вулканов; пожары; техногенные выбросы.
Мелкие частицы могут находиться в атмосфере длительное время и переноситься на тысячи км, тогда как более крупные оседают вблизи точки эмиссии. Их химический состав отличается ввиду различий источников и механизмов образования и трансформации в атмосфере. Выведение аэрозольных частиц на наземную поверхность может происходить как вымывание осадками (аэрозоли играют роль ядер конденсации капель из пара) или непосредственно (сухое осаждение). Интересно отметить, что в составе АА водорастворимые соли могут составлять от нескольких % в летний период до 50-70 % зимой, что связано с сезонными вариациями мощности эрозионных источников (изоляция наземной поверхности снегом препятствует эоловому выносу продуктов эрозии в атмосферу). С пространственными и сезонными вариациями действия разных источников формирования АА связано и непостоянство состава атмосферных осадков.
Атмосферный перенос веществ в виде жидких осадков и аэрозольных частиц - часть вещественного обмена между разными экосистемами внутри Биосферы, играет важную роль в биогеохимических циклах элементов. Существуют оценки, согласно которым с поверхности Океана в атмосферу поступает 5.37 109, а с поверхности суши 2.16 109 т/г минеральных солей. Учитывая региональные различия в количестве осадков и направлениях их воздушного переноса, можно заключить, что вклад вещественного обмена в системе атмосфера-поверхность различается для разных экосистем, и это определяет различия в их функционировании.
