Программа курса "Охрана окружающей среды"
| Вид материала | Программа курса |
| Химия гидросферы Вода как растворитель Воды атмосферы Поверхностные воды Почвенные воды Подземные воды Химия литосферы Геохимическая классификация элементов Гольдшмидта |
- Рабочая программа элективного курса «Химия и охрана окружающей среды», 82.96kb.
- Программа дисциплины дпп. Р. 01 Экология и охрана окружающей среды цели и задачи курса, 147.68kb.
- Тема : «Загрязнение и охрана окружающей среды», 38.66kb.
- Тематический план проведения семинаров и курсов повышения квалификации на 2012 год, 2025.98kb.
- В. Н. Масляев охрана окружающей среды учебное пособие, 1544.73kb.
- Практикум по экологическому мониторингу окружающей среды Учебное пособие, 949.79kb.
- Рабочая программа (очное обучение) По В. 01. 01 (В. 01. 02.) Основы подготовки питьевой, 188.69kb.
- Программа города москвы «охрана окружающей среды», 1463.79kb.
- Рабочая программа по дисциплине сд ф. 05 «Техника защиты окружающей среды» для студентов, 202.99kb.
- Ведомственная целевая программа «Охрана окружающей среды на территории Республики Карелия, 583.24kb.
ХИМИЯ ГИДРОСФЕРЫ
Гидросфера - вторая по массе часть Биосферы, представлена водными растворами, взаимодействующими с атмо- и литосферой, играет значительную роль в массопереносе веществ; вода - неотъемлемый компонент живых организмов, кроме того, образует среду для водных экосистем. В Биосфере находится во всех фазовых состояниях. Природные воды генетически связаны между собой, образуют общий гидрологический цикл: испарение - осадки - речной сток. Этот цикл (577 тыс.км3/год) реализуется в Биосфере; он сопряжен с более общим геологическим циклом воды на Земле, включающим гидратацию и дегидратацию пород и перемещение вод в недрах. Массы вод в разных частях Биосферы и периодичность их возобновления:
Тыс.км3 Время обновления
Океан 1370000 2500 лет
Ледники 35300 10000 -"- При годовой продукции сухой биомассы 2.5 1011 т и среднем
Подземные воды 10530 1400 -"- содержании воды в организмах 80 %, весь объем вод Биосферы
Озера 176.4 17 -"- мог бы пройти через живые организмы примерно за 1.2 млн. лет,
Почвенные воды 16.5 1 -"- т.е. за ничтожно малый период существования Биосферы.
Болота 11.5 5 -"- Это показывает роль биотических процессов, реализующихся в
Реки 2.1 16 дней ничтожно малой по массе части Биосферы, но существенно
Атмосф.воды 1.3 8 -"- интенсивнее, чем в косном мире.
Вода в организмах 1.1 часы
Всего: 1500000 т
Физические и химические свойства воды, по сравнению с гидридами 6 группы, во многом аномальны (температуры плавления и кипения, зависимость плотности от температуры и давления, теплоемкость, диэлектрическая проницаемость, поверхностное натяжение и др.), что имеет важное значение для функционирования Биосферы. Живые организмы приспособлены к этим свойствам (сезонность вегетационного периода, капиллярный механизм питания в растениях, органы движения у гидробионтов и т.д.).
Вода как растворитель (амфотерность, высокая диэл.проницаемость, ажурная структура) обладает уникальной способностью не только растворять различные классы соединений, но и дифференцировать их свойства (напр., по окислительно-восстановительным свойствам, при диссоциации слабых кислот, в т.ч. аминокислот белков). Поэтому природные воды всегда являются многокомпонентными растворами с широкими вариациями концентраций растворенных веществ и, соответственно, свойств раствора. При характеризации их химического состава выделяют растворенные газы, минерализацию (главные ионы - Na+, Ca2+, Mg2+, гидрокарбонат, сульфат, хлорид), биогенные элементы (соединения азота, фосфора, железа, кремния), микрокомпоненты, растворенные органические вещества (РОВ).
Воды атмосферы насыщены ее газами, имеют высокий окислительный потенциал, относительно малую минерализацию (в фоновых регионах около 10-15 мг/л) и концентрацию микроэлементов (в Евр.части России: Fe 140, Zn 60, P 41, Ni, Mn 25, Cu,Cr 10, Hg 0,25 мкг/л), РОВ определяются летучими природными веществами.
Поверхностные воды, находящиеся в контакте с атмосферой и формирующиеся из осадков, в своем составе содержат вещества, поступающие из подстилающих горных пород и почв. В зависимости от условий, минерализация и содержание микрокомпонентов могут быть значительно выше, чем в атмосферных осадках, в составе газов могут присутствовать газы восстановительной обстановки (метан, сероводород), в составе РОВ - автохтонные (образующиеся в самом водоеме) и аллохтонные (привнесенные с водосборной территории) продукты жизнедеятельности. Эти воды могут быть пресными (минерализация до 1 г/л), солоноватыми (1 - 10 г/л), солеными (10 - 50 г/л), рассолами (более 50 г/л).
Почвенные воды, находящиеся в зоне активных биотических процессов, содержат больше газов биогенного происхождения, как правило, более кислые и более минерализованные, содержат значительные количества РОВ.
Подземные воды зоны активного водообмена, располагающиеся над водоупорным слоем, по своему составу являются промежуточными между поверхностными и глубинными водами затрудненного водообмена, находящимися в динамическом равновесии с вмещающими породами при высоких давлениях и температурах до 350о. Минерализация последних может достигать 640 г/л, содержание газов (преимущественно CH4, H2S, CO2, N2, благородные газы) - нескольких л/л, РОВ может быть высоким и определяться веществами нефтяного ряда.
Т.о., факторы, определяющие химический состав природных вод, образующих единый цикл, разнообразны. Их подразделяют на абиотические (физико-географические /рельеф, климат, выветривание, почв.покров/, геологические /состав пород, гидрогеологические условия/, физико-химические /свойства растворенных в-в, кислотно-основные, окислительно-восстановительные условия, ионный обмен/) и биотические, обусловленные процессами жизнедеятельности.
Рассмотрим влияние окислительно-восстановительной обстановки.
Область термодинамической устойчивости жидкой воды определяется реакциями:
1/4 O2 + H+ + e- 1/2 H2O (1) Eo = 1.229 V p = -lg[e] = po + lg[O2]1/4 + lg[H+] = 20.75 - 0.17 - рН
H2O + e 1/2 H2 + OH- (2) Eo = 0 p = 0 - pH (для равновесия с H2)
Диаграмма устойчивости жидкой воды в координатах ре - рН (диаграммы Пурбэ) ограничена двумя линиями, отвечающими этим равновесиям, между которыми реализуются разнообразные окислительно-восстановительные обстановки природных вод (рис. 1):
р



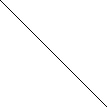 е
е 20 1/4 O2 + H+ + e- Кинетическая заторможенность реакции (1) приводит к реализации другой реакции
1/2 H2O, 1/2 O2 + H+ + e- 1/2 H2O2, peo = 11.5, pe = 11.5 +1/2 lg ([O2]/[H2O2] - pH 15 - pH
1
 5 и верхняя линия существования жидкой воды смещается примерно на 5 ре вниз (показана
5 и верхняя линия существования жидкой воды смещается примерно на 5 ре вниз (показана 2 пунктиром).
Положение различных геохимических типов природных вод на ре - рН диаграмме:
1 - грунтовые воды; 2 – кислые термальные воды; 3 – дождевые воды; 4 – океанические воды;
10 3 5 – воды глубоких эвтрофных озер, углекислотные подз. воды; 6 – азотные термальные воды;
1 7 - болотные воды; 8 – почвенные, богатые РОВ воды, не контактирующие с атмосферой.
Таким образом, в зависимости от условий нахождения природные воды характеризуются широким
5 7 5 разнообразием ок.-восст. потенциала, что, в свою очередь, определяет направленность процессов
4 превращений многих растворенных веществ. Рационально определить потенциалзадающую систему,
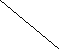 8 по термодинамическим и кинетическим критериям превосходящую другие возможные оксредсистемы
8 по термодинамическим и кинетическим критериям превосходящую другие возможные оксредсистемы 0 6 в данных условиях. Напр., наличие резервуара кислорода атмосферы в поверхностных водах, органики
в донных осадках, сульфилов при контакте подземных вод с рудным телом определяет общий ок.-восст.
Н2 потенциал водного раствора и состояние многих растворенных веществ (NO3-- NO2-- N2 - NH4+,
-
 5 S2- - S6+, Fe3+ - Fe2+, Hg2+ - Hgo и т.п.). Следовательно, миграция, доступность для организмов,
5 S2- - S6+, Fe3+ - Fe2+, Hg2+ - Hgo и т.п.). Следовательно, миграция, доступность для организмов, 0 5 7 9 14 рН токсичность одних и тех же элементов в природных водах различны и зависят от величины pe.
Рис.1.
В качестве примера на рис. 2 показана диаграмма Пурбэ для Fe (при общем содержании растворенных форм 10-5 М); в зависимости от окислительно.-восстановительной обстановки термодинамически стабильными могут быть разные формы Fe, обладающие разной растворимостью.
2



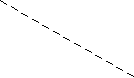 0 Основные реакции превращений форм железа
0 Основные реакции превращений форм железа р
 е Fe3+ 2 Fe3+ + e- Fe2+ peo = 13.0 (1)
е Fe3+ 2 Fe3+ + e- Fe2+ peo = 13.0 (1) 
 1 О2 Fe(OH)2 (s) Fe2+ + 2 OH- Ksp = 2.0 10-15 (2)
1 О2 Fe(OH)2 (s) Fe2+ + 2 OH- Ksp = 2.0 10-15 (2) 10 3 Fe(OH)3 (s) Fe3+ + 3 OH- Ksp = 6.0 10-38 (3)
Fe2+ Fe(OH)3 (s) + e- Fe(OH)2 (s) peo = 13.0 (4)
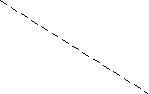 0 Fe(OH)3 (s) Линия 1, отвечающая реакции (1) восстановления Fe3+ , инвариантна по рН.
0 Fe(OH)3 (s) Линия 1, отвечающая реакции (1) восстановления Fe3+ , инвариантна по рН.Положение линии 2, отвечающей фазовому равновесию (3), найдем из про-
 изведения растворимости: [OH-]3 = 6 10-28/10-5, откуда рН = 3.25.
изведения растворимости: [OH-]3 = 6 10-28/10-5, откуда рН = 3.25. 4 5 Линия 3, отвечающая совокупности реакций (1) и (3), получается подстановкой [Fe3+] из
4 5 Линия 3, отвечающая совокупности реакций (1) и (3), получается подстановкой [Fe3+] из-10 Н2 Fe(OH)2 ур.(3) в уравнение pe = peo + lg [Fe3+] /[Fe2+], что приводит к pe = 23 – 3 pH.
Аналогично положение линии 4 определится рН = 9.15, а линии 5 - из уравнения (4),
 0 7 рН 14 pe = peo - lg [ОН- ] = 4.5 + рН
0 7 рН 14 pe = peo - lg [ОН- ] = 4.5 + рН Рис. 2.
Кислотно-основные состояния в природных водах определяют направленность многих химических процессов (растворение, гидролиз, комплексообразование…). В поверхностных водах обычно роль буфера играет карбонатная система:
СО2(г) В водной фазе рН регулируется соотношением
молекулярной формы и карбонат-иона, которые
(СО2+Н2СО3)aq HСO3- CO32- CaCO3o CaCO3 s сопряжены с комплексными формами металлов в
растворе, СО2 в атмосфере и СаСО3 в осадках.
CaHCO3+ Молекулярная форма потребляется в фотосинтезе
(C6H12O6)b и выделяется при дыхании биоты (С6Н12О6), что
определяет суточный ритм, сезонные и пространственные вариации рН. Тем самым, биотические процессы в водных экосистемах оказывают воздействие на направленность различных реакций и распределение ряда металлов по формам.
Комплексообразование в природных водах может происходить как с неорганическими лигандами, так и с РОВ различной природы. Поскольку разные химические формы одного и того же элемента обладают разной миграционной способностью, биодоступностью и токсичностью, эти процессы имеют важное значение. Так, увеличение доли нейтральных гидроксо- и карбонатных комплексов металлов и доли форм, связанных с высокомолекулярными РОВ в пресных водах снижает токсичность ионов металлов для водных организмов и способствует выведению в донные осадки за счет лучшей сорбции на взвешенных частицах.
Очевидно, что природные воды представляют сложную многокомпонентную динамичную систему, в которой состояние и свойства растворенных веществ зависят от сочетания различных факторов. Специального внимания заслуживают пресные воды, поскольку именно они наиболее интенсивно используются человеком (2.5 тыс. т воды в год на 1 чел., т.е. примерно 1.5 1014 т/год, что сравнимо с объемом воды во всех реках мира). Поверхностные воды - эволюционно сложившиеся гидроэкосистемы, в которых за счет внутриводоемных процессов формируется и поддерживается определенный химический состав воды. Воздействие техносферы на функционирование этих экосистем может быть непосредственным (изменение их водности, температуры, сброс загрязняющих веществ) и опосредованным ("кислотные дожди", сведение лесов и организация агроценозов на водосборной площади). При превышении буферной емкости пресноводных экосистем к тому или иному воздействию их функционирование, способность сохранять естественные процессы формирования химического состава, могут быть нарушены. В итоге качество воды может оказаться неприемлемым для водоснабжения. Альтернативой поверхностным пресным водам в некоторых регионах являются подземные воды. Однако их возобновление и процессы самоочищения замедлены относительно поверхностных водоемов, и проблема исчерпания или загрязнения подземных вод уже стала актуальной.
ХИМИЯ ЛИТОСФЕРЫ
В границы Биосферы входит часть литосферы, ее верхняя оболочка – земная кора, химический состав и свойства которой отличаются от более глубоких слоев. Эта часть литосферы находится во взаимодействии с атмо- и гидросферой, химический состав которых в значительной мере отражает длительное действие химической работы живого вещества (Вернадский). С другой стороны, литосфера является наиболее консервативной частью Биосферы, и ее состав в большей степени определяется общими факторами состояния твердого вещества в р,Т,Х-условиях на поверхности планеты Земля. Состав, свойства, структура земной коры определяют границы и потоки веществ в эволюционно сложившихся экосистемах. Действие общих факторов состояния земной коры отражает кларковый состав, вес.% (в скобках - порядковый номер элемента)
Солнце Метеориты Земля в целом Земная кора Атомные кларки Число минералов
H (1) 42 O (8) 35 O (8) 33 O (8) 47.2 58.0 1221
He(2) 36 Fe(26) 25 Fe(26) 29 Si (14) 27.6 20.0 500
O (8) 1 Si(14) 18 Si(14) 17 Al (13) 8.86 6.6 350
C (6) 0.3 Mg(12) 14 Mg(12) 13 Fe(26) 5.10 2.0 350
N (7) 0.08 S (16) 2 S (16) 2 Ca(20) 3.6 2.0
Si(14) 0.07 Ni(28) 1.4 Ni(28) 2 K (19) 2.6 1.4 43
Mg(12) 0.03 Ca(20) 1.4 Ca(20) 1.6 Na(11) 2.6 2.4 100
S (16) 0.03 Al(13) 1.3 Al(13) 1.4 Mg(12) 2.1 2.0 43
Состав метеоритов в Солнечной системе, Земли в целом и земной коры схожий и отличается от состава Солнца (ядерные реакции), что свидетельствует о наличии общих закономерностей их устойчивости. Они проявляются на кривых lgK-N (Ферсман): преобладание легких элементов; преобладание четных элементов (правило Оддо-Гаркинса); "избыточными" (кларки которых выше средних) являются элементы с номерами, кратными 6, 12 или 18:
 2 O S Ca Fe Sr Ba W
2 O S Ca Fe Sr Ba W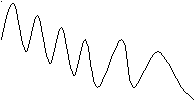 N 8 14 20 26 38 56 74
N 8 14 20 26 38 56 74 Lg K 6 6 6 12 18 18
Lg K 6 6 6 12 18 18-
 12
12N
Земная кора в сравнении с Землей в целом обогащена легкими Si, Al ("СиАлическая оболочка"), что объясняется более ранней кристаллизацией из расплава "корки" из соединений этих элементов (дифференциация в ходе остывания поверхности планеты) с кислородом. Это определяет главную геохимическую особенность литосферы Земли - высокий кларк кислорода (объемный кларк 91.8 !), формирование уникальной твердой кремнекислородной оболочки. Эти элементы образуют и основное количество минералов, различие физических и химических свойств которых определяет разнообразие слагающих литосферу пород в определенных р, Т, Х -условиях.
Эти условия меняются при переходе от глубинных слоев Земли к поверхности. Геохимическая классификация элементов Гольдшмидта (1911) связывает вертикальную неоднородность распределения элементов с их атомными объемами: сидерофильные элементы (тяготеющие к центру планеты) - Fe, Ni, Co… всего 14 - имеющие минимальный объем; атмофильные - H, N, благородные газы, всего 8 - имеющие максимальный объем; халькофильные, концентрирующиеся ближе к ядру Земли над сидерофильными, на кривых lgK(об)-N занимают восходящие ветви - Si,Al,Cu,Zn,Ag,Hg…всего 20; литофильные, концентрирующиеся в верхних слоях, на кривых lgK(об) - N занимают нисходящие ветви.
Закономерности распределения элементов в литосфере - первый уровень ее организации; важно, в каких формах они находятся (горные породы и минералы, магмы, рассеянные элементы) и за счет каких факторов способны мигрировать в геологических процессах. Закономерности образования минералов обусловлены свойствами кристаллической решетки, энергией ее образования, размером атомов. Миграция атомов в геологических процессах обусловлена не только способностью образовывать минералы. Выделяют внутренние и внешние факторы миграции. К первым относят свойства связи атомов в решетке, химические свойства соединения, свойства кристаллической решетки (в т.ч. полиморфизм), гравитационные свойства, радиоактивность (часть их обобщается в подходе Ферсмана). К внешним факторам относят концентрации, температуру, давление, степень ионизации расплава и раствора, окислительно-восстановительный потенциал среды, рН, поверхностные силы. В реальных условиях сочетание этих факторов определяет образование ассоциаций минералов в литосфере. Общее число минералов ( 2000) сравнительно невелико; они образованы ограниченным числом элементов. Большинство других не способны к образованию самостоятельных минералов и находятся в рассеянном состоянии, как входящие в структуру минерала-носителя по законам изоморфизма или в неупорядоченном состоянии, так и сорбированные поверхностью или в микроминералогических формах. Все это определяет их неравномерное распределение в литосфере.
В верхнем слое литосферы наблюдается дальнейшая дифференциация элементов. При растворении пород за счет их взаимодействия с водами с последующим выносом растворенных продуктов происходила трансформация минералов и пород. В современном минеральном составе океана, по расчетам В.М.Гольдшмидта (1954) на 1 кг воды приходится 0.6 кг первичных изверженных пород.
Внесено совр. содержание Внесено совр. содержание
0.6кг пород г/кг г-экв/кг г/0.6кг пород г/кг г-экв/кг
Cl- 0,29 19,3534 0,54582 Na+ 17,0 10,7638 0,46806
SO42- 0,9(0,3S) 2,7007(0,9S) 0,05623 Mg2+ 13,0 1,2970 0,10666
HCO3- - 0,1427 0,00234 Ca2+ 22,0 0,4080 0,02035
Br- 0,0030 0,0659 0,00083 K+ 15,0 0,3875 0,00991
F- 0,160 0,0013 0,00007 Sr2+ 0,25 0,01364 0,00031
По этим расчетам можно заключить, что катионный состав современных вод Океана сформировался за счет выноса с континентов продуктов растворения первичных пород. В самом океана при изменении рН, ок.-восст. обстановки часть привнесенного материала выпадала в донные осадки.
На континентах в результате смены восстановительной обстановки на окислительную и кислой реакции гидросферы на нейтральную и слабощелочную формировались осадочные породы (в т.ч. карбонаты), отличные по своему составу от коренных, изверженных пород. В свою очередь, они трансформируются при изменении внешних условий. Геохимическое значение имеет процесс углекислотного химического выветривания: CaCO3 + CO2 + H2O Ca(HCO3)2, 2NaAlSi3O8 (альбит)+ 2CO2 + 11H2O Al2Si2O5(OH)4 (каолинит) + 2Na+ + 2HCO3- + 4H4SiO4, приводящий к образованию растворимых продуктов при взаимодействии твердой породы, атмосферного воздуха и воды.
Миграция растворенных форм с водными потоками (в т.ч. в подземных водах) может локально изменяться на геохимических барьерах (испарительном, сорбционном, кислородном, сульфидном, щелочном, окислительно-восстановительном…), возникающих при локальном резком изменении геохимической обстановки. Активизации процессов изменения состава пород на таких барьерах часто способствуют живые организмы (напр., тионовые бактерии ускоряют окисление нерастворимых сульфидов до растворимых сульфатов).
Роль биотической деятельности в формировании состава литосферы проявляется не только в изменении общего состава атмо- и гидросферы и образовании захоронений отмершей неокисленной органики. Наиболее активная часть литосферы - почвы, как в силу дисперсности (площадь поверхности частиц почвы достигает 20 км2/м3), увеличивающей газо- и водопроницаемость, так и за счет наличия химической активности функциональных групп гуминовых и фульвокислот. Ежегодно образуется 120 млрд.т опада листвы и отмирает 12-15 млрд.т корней растений, перерабатываемых деструкторами с образованием гумусовых веществ. Повышенная кислотность и восстановительная среда, наряду с комплексообразующим действием органических кислот, способствуют изменению миграции многих металлов. Поэтому в почвах реализуется существенная часть эволюционно сложившихся биогеохимических циклов элементов в Биосфере, определяющих возможность длительного совершения химической работы в практически закрытой термодинамической системе. Частью этих циклов является биотический оборот элементов, имеющий особую роль в функционировании наземных экосистем.
Воздействие человека на химические процессы в литосфере имеет разнообразный характер: разработка месторождений, изменение ландшафта, водных потоков, распашка земель и т.д. В частности, при добыче угля, руд металлов в шахтах активизируется деятельность тионовых бактерий, окисляющих сульфидную серу в сульфат; это способствует увеличению кислотности вод и концентрации в них металлов. Откачка шахтных вод на поверхность влечет резкое изменение условий функционирования местных экосистем. Организация золоотвалов на ТЭЦ, различных хвостохранилищ в горнодобывающих и перерабатывающих отраслях не только изменяет границы естественных экосистем, но приводит к появлению новых форм твердого вещества, нарушению процессов вещественного обмена с грунтовыми водами. Процессы изменения свойств извлеченных на поверхность минералов и пород, приводящие к повышенной миграции ряда элементов, в т.ч.токсичных, происходят медленно и негативные экологические последствия могут проявиться через многие десятилетия после завершения разработки конкретного месторождения. Проблема "химических бомб замедленного действия" становится все более актуальной в густонаселенных странах Европы, где давно прекращена добыча и переработка руд. Эти примеры показывают возможные последствия техногенеза, затрагивающие состояние литосферы на уровне отдельных экосистем; в глобальном масштабе такие последствия могут проявиться как изменение геохимических циклов элементов, в первую очередь с низкими кларковыми содержаниями, находящихся в литосфере, перераспределением их в Биосфере. В настоящее время техногенные потоки ряда элементов, извлеченных из литосферы, достигли или превосходят естественные потоки.
