Роль цитомегаловирусной инфекции в патологии плода и новорожденного. Поиск новых противовирусных средств. 03. 00. 06. Вирусология
| Вид материала | Автореферат диссертации |
- Акушерство перечень практических занятий на 4 курсе лечебного факультета на II семестр, 29.23kb.
- Тульская областная научная медицинская библиотека акушерство и гинекология. 2011., 190.44kb.
- Он оказался общебиологическим феноменом, 359.5kb.
- Белорусскйи государственный медицинский университет гемолитическая болезнь новорожденных, 220.18kb.
- Влияние скэнар-терапии на течение беременности, родов, состояние новорожденного и ребенка, 146.76kb.
- 1. Модель пациента, 802.59kb.
- «Владивостокский государственный медицинский университет мз рф», 551.74kb.
- Оказания перинатальной помощи в Республике Беларусь, 72.85kb.
- Ю. И. Ишпахтин Научные основы охраны здоровья женщины, матери, плода, новорожденного, 39.31kb.
- И. Л. Элбакидзе, В. Ф. Ордынский,, 76.7kb.
Исследование показало, что при применении базисной терапии элиминация вирусов отмечена в 23,1%, а при включении Виферона - в 38,5% (таблица №5). В целом, при использовании Виферона в 69,3% случаев у недоношенных детей обнаружена положительная динамика (снижение количества инфекционного вируса или его элиминация), тогда как при базисной терапии - только в 23,1% случаев.
Совместно с д.м.н., проф. Дегтяревой М.В. для оценки эффективности действия Виферона дополнительно были обследованы две группы детей с ВУИ при различных жизнеугрожающих состояниях неонатального периода. Первую группу составили недоношенные новорожденные дети (n=87) с клиническими признаками ВУИ, находившиеся в отделении реанимации и интенсивной терапии Городской Больницы №8 и получавшие Виферон в дополнение к базовой терапии. Во вторую группу (n=108) были включены дети, получавшие только базовую терапию.
Таблица 6. Сравнение показателей летальности у детей с ВУИ, получавших и не получавших терапию Вифероном.
| Патологические состояния | Количество летальных исходов (базисная терапия + Виферон) | Количество летальных исходов (базисная терапия) | Статистическая значимость различий (2-сторонний точный критерий Фишера) |
Энтероколит | 2/45 (4,4%) | 6/20 (30%) | 0,008 OШ=0,109 95% ДИ (0,013-0,706) ОР=0,148 95% ДИ (0,021-0,739) |
| Пневмония | 2/63 (3,2%) | 7/29 (24,1%) | 0,004 OШ=0,103 95% ДИ (0,014-0,607) ОР=0,132 95% ДИ (0,019-0,64) |
| ВУИ смешанной этиологии | 4/81 (4,9%) | 7/38 (18,4%) | 0,036 OШ=0,23 95% ДИ (0,05-0,96) ОР=0,27 95% ДИ (0,07-0,96) |
Анализ показателей смертности при всех изученных патологических состояниях показал, что уровни летальности между группами леченых и не леченых Вифероном детей в большинстве случаев различались в 2-3 раза. В таблице 6 представлено количество летальных исходов у детей с энтероколитом, пневмонией и с ВУИ смешанной этиологии.
Всего при использовании базисной терапии умерло 20 из 87 детей (22,3%), тогда как при терапии с применением Виферона показатель летальности был существенно ниже и составил 4,2%. Таким образом, применение Виферона позволило снизить показатели летальности в 5,3 раза.
Анализ включения метаболической и иммунной терапии в комплексное лечение беременных женщин и недоношенных детей.
Исследование биологических сред новорожденных детей с признаками ВУИ и материала аутопсии плодов и умерших новорожденных методом БКМ установило присутствие инфекционно-активного ЦМВ в 16,8% - 49% случаев. Высокий процент выявления ЦМВ требует мероприятий по укреплению неспецифического иммунитета и противовирусной терапии. При этом существенное значение имеет состояние здоровья беременных, которым при выявлении активной вирусной инфекции назначают специфические антивирусные препараты, которые высокотоксичны для плода и не всегда разрешены во время беременности. Возможной альтернативой этому является использование иммунокоррегирующей и метаболической терапии. В данном разделе работы проведена сравнительная оценка влияния метаболической терапии и Виферона на течение и исход беременности женщин с ОАГА.
Метаболические препараты в предгравидарной подготовке были использованы у 260 женщин, инфицированных ЦМВ в возрасте от 22 до 28 лет, у которых проведен анализ анамнестических данных, мониторинг течения беременности, и прослежены исходы родов. Работа была проведена на базе вирусологической и бактериологической лабораторий НПП «Питательные среды» (директор – проф., академик РАМНТ Меджидов М.М.). Женщины состояли на учете в ЖК №2 г. Махачкалы и были обследованы совместно с к.м.н. Сулеймановой И.Г. Женщины были разделены на три группы: основную группу (1) составили 106 женщин с ОАГА в возрасте 22-28 лет, взятых под наблюдение за 2-4- месяца до наступления настоящей беременности. В этой группе проведен полный комплекс клинико-лабораторного обследования с последующей предгравидарной подготовкой. На основании выявления наиболее значимых факторов риска внутриутробного инфицирования проводилась комплексная традиционная терапия, после чего была запланирована беременность. Женщины основной группы кроме традиционной терапии получали метаболическую терапию до беременности и во время беременности. Продолжительность терапии составляла 10-12 дней в месяц. Вторую группу (n=82) составили женщины с ОАГА, находившиеся под наблюдением с конца II триместра беременности и прошедшие неполный курс метаболической терапии. В третью группу вошли 72 женщины с ОАГА, взятые на учет с первых недель беременности без подготовки к ней. Все женщины были обследованы, получали специфическое лечение, коррекцию биоценоза, но не получали метаболическую терапию.
Обследование проводили дважды – при становлении на учет в женскую консультацию и за 3-6 недель до родов. По выявлению возбудителей ИППП на первый срок обследования все группы были идентичны. При повторном обследовании частота обнаружения микоплазмы, уреаплазмы и вторичной бактериальной флоры у женщин в первой группе была значительно снижена. Обследование женщин второй и третьей групп перед родами показало достоверно высокую частоту таких заболеваний как микоплазмоз и ВПГИ во второй группе. В женщин в третьей группе были обнаружены микоплазмы, уреаплазмы, ВПГ и иная патогенная и условно-патогенная флора.
Анализ течения беременности показал, что ранний и поздний гестоз во 2 и 3-й группах отмечались несколько чаще, чем в 1-й группе. Угроза прерывания беременности в сравниваемых группах отмечалась в 1,8-1,9 раз достоверно чаще, чем у женщин 1-й группы. Женщины из 2 и 3-й группы в три раза чаще, чем женщины 1-й группы болели острыми респираторными вирусными инфекциями, протекающими в более тяжелой форме. Острые респираторные заболевания могли быть одной из причин обострения хронических болезней, которые в группах сравнения наблюдались у каждой второй женщины (56,1% и 55,6%) по сравнению с 21,7% - в основной группе. Хроническая гипоксия и задержка внутриутробного развития плода отмечались во 2 и 3-й группах значительно чаще (р<0,005). Преждевременные роды в группах сравнения отмечались в 2,5 раза достоверно чаще, чем в основной группе. В 1-й группе 65% родов прошли без каких-либо акушерских осложнений, в то время как в группах сравнения различные осложнения в родах и послеродовом периоде были отмечены у большинства женщин (76,4%-78%). Из 260 живыми родились 258 младенцев. Исходы родов у женщин сравниваемых групп представлены в таблице №7. У 23,6% новорожденных 1-й группы были отмечены признаки ВУИ. В группах сравнения 63,8% - 66,7% детей, родились с признаками ВУИ. У 26 новорожденных из второй группы (32,5%) и 34 новорожденных из третьей группы (47,2%) в среднем через 2,5-36 часов ухудшилось состояние с нарастанием симптомов сердечной и легочной недостаточности и инфекционного токсикоза, что требовало перевода их в отделение реанимации новорожденных. Всего в отделение реанимации было переведено 46 детей, из которых в 61,3% случаев было подтверждено ВУИ.
Таблица 7. Состояние новорожденных в сравниваемых группах.
| Состояние новорожденных | 1 группа (n=106) | 2 группа (n=82) | 3 группа (n=72) |
| Родились живыми | 106 | 80 | 72 |
| Умерли в пери- и неонат. периодах | 0% ±1,9 | 8,5% ±3,1 (p< 0,02) | 13,9%± 4,1(p< 0,01) |
| Недоношенные | 9,4%± 2,8 | 23,2%± 4,7(p<0,02) | 23,6±%5,0 (p< 0,02) |
| Масса тела донош. | 3486,2 ±548,3 | 3322,2 ±340,1 | 3322,2± 341,1 |
| Оценка по шкале Апгар: 6-7 баллов | 0%± 1,9 | 31,3% ±5,2(p< 0,001) | 38,9%± 5,8(p< 0,001) |
| 7-8 баллов | 58,5%±4,8 | 31,3%± 5,2 (p<0,001) | 27,8%± 5,3(p<0,001) |
| 8-9 баллов | 40,6%± 4,7 | 37,5%± 5,4 | 33,3% ±5,5 |
| Гипотрофия | 2,8% ± 1,6 | 8,8% ±3,2 (н/з) | 11,1%± 3,7 (p< 0,05) |
| Клинические признаки ВУИ | 23,6% ±4,1 | 63,8% ±5,4 (p<0,001) | 66,7± 5,6 (p< 0,001) |
Примечание: Оценка по шкале Апгар, относительное количество новорожденных с признаками гипотрофии и внутриутробного инфицирования во второй группе вычислялся от числа живорожденных (n=80).
Таким образом, проведение предгравидарной подготовки за 2-4 месяца до беременности с использованием метаболической терапии приводит к существенному снижению осложнений в родах и послеродовом периоде, снижает вероятность внутриутробного инфицирования плода и новорожденного. Позволяет улучшить течение периода адаптации новорожденных и ведет к снижению перинатальной и младенческой смерти.
В ранее проведенных исследованиях была показана высокая эффективность применения генно-инженерного рекомбинантного препарата виферон, представляющего собой -2-интерферон, ассоциированный с антиоксидантами, и обладающего иммуностимулирующим и противовирусным эффектом, в профилактике внутриутробного инфицирования плода (ВУИ). Исследования проводились в третьем триместре беременности, начиная с 28 недель [Тареева Т.Г., 2000]. Для обоснования возможности более ранней иммунокоррекции при помощи виферона-500000 МЕ мы провели сравнительный анализ включения виферона в комплексное лечение беременных, начиная со второго триместра беременности. Работа проводилась совместно с лабораторией онтогенеза и коррекции системы интерферона НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи (заведующая лабораторией – д.б.н., проф. В.В. Малиновская) и 2-м акушерским отделением МОНИИАГ МЗ РФ (заведующая отделением – д.м.н. С.В. Новикова).
Под наблюдением находилось 74 беременные с ОАГА. Исследования проводились в динамике гестации, начиная с 12-16 недель беременности до родов. Были применены общеклинические, ультразвуковые, вирусологические (ПЦР, ПЦР-RT, БКМ, ИФА) и иммунологические (определение альфа-ИФН, гамма-ИФН) методы исследования. Исследования проводились до начала терапии вифероном, после окончания лечебного курса и накануне родоразрешения. У 40,9% женщин во время предыдущих беременностей отмечено обострение герпесвирусной инфекции (ГВИ), вызванной ВПГ и/или ЦМВ. Смешанная урогенитальная инфекция была выявлена у 42 из 74 беременных (56,8%).
Частота суммарного обнаружения маркеров ГВИ у беременных женщин в динамике показана на рисунке 4. Женщину считали инфицированной, при обнаружении маркеров ГВИ в любом из исследованных биологических сред хотя бы одним из методов. При обследовании на 12-16 неделе у 15 из 74 женщин (20,3%) были выявлены прямые маркеры ГВИ, при повторном обследовании (26-32 неделя беременности) у 18 из 46 женщин (39,1%). Различия в выявлении маркеров ГВИ на 12-16 и на 26-32 неделях гестации статистически значимы (р=0,008). Надо отметить, что у 8 из 18 женщин маркеры ГВИ были впервые обнаружены при вторичном обследовании на 26-32 неделях беременности.
При третьем обследовании (37-39 недели беременности) маркеры ГВИ были выявлены у 8 из 23 беременных, что составило 34,8%. У 4 из 8 женщин маркеры ГВИ впервые были обнаружены при третьем обследовании, уже непосредственно перед родами.
РИС. 4. Частота обнаружения маркеров ГВИ у беременных женщина на различных сроках беременности.
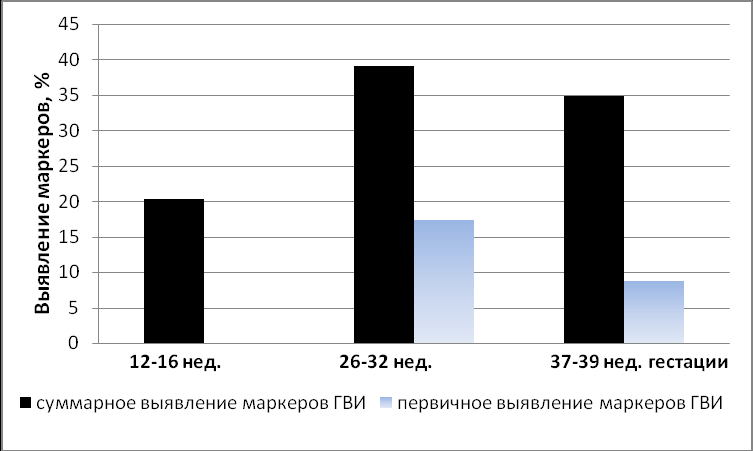
Из 27 случаев первичного обнаружения маркеров ГВИ на разных сроках беременности 15 случаев было выявлено к концу 1 триместра, 8 случаев к концу 2 триместра и 4 случая к концу третьего триместра. Как видно из рисунка 4, почти у четверти беременных женщин (26,1%) вирус впервые обнаруживается к концу 2 и 3 триместра беременности. Это указывает на необходимость неоднократного обследования беременных на наличие маркеров ГВИ. Исследование, проведенное в динамике, показало, что с увеличением срока гестации частота выявления маркеров ЦМВ и ВПГ остается на относительно высоком уровне, при этом вирусная нагрузка оставалась низкой.
Для выявления различных форм ЦМВИ мы пользовались классификацией, предложенной ранее [С.Г. Чешик и др., 2001]. Латентная форма ГВИ, при которой определяются только антитела IgG, была выявлена у 40,3% женщин. Реактивированная форма ГВИ, при которой определяются специфические антитела класса IgM одновременно с IgG, была диагностирована у 2,9% женщин. Персистирующая форма ГВИ, характеризующаяся вирусовыделением при отсутствии антител класса IgM в крови, на разных сроках беременности впервые была установлена в 51,4% случаев.
В дополнение к базисной терапии с 14 недель беременности 28 женщин получали Виферон-500000 МЕ по следующей схеме: ежедневно в течение 10 дней по 1 свече 2 раза в день (20 свечей); затем дважды в неделю по 1 свече 2 раза в день– 10 свечей. Базисную терапию получали 46 беременных. Результаты повторного вирусологического обследования женщин представлены в таблице №8.
Таблица 8. Результаты повторного обследования беременных на наличие маркеров ЦМВ и ВПГ.
| | Базисная терапия + Виферон | Р | Базисная терапия |
| Элиминация вирусов | 8 (28,5%) | р=0,025 | 3 (6,5%) |
| Реактивация ЦМВ и ВПГ | 0 (0%) | р=0,014 | 11 (23,9%) |
| Прежнее кол-во ЦМВ и ВПГ | 3 (10,7%) | p ›0,05 | 5 (10,9%) |
Анализ показал, что у 28,5% беременных, получавших в дополнение к базисной терапии препарат Виферон, вирус элиминировал из организма. В группе беременных, не получавших Виферон, вирус элиминировал только в трех наблюдениях из 46 (6,5%). Ни в одном наблюдении у женщин, получавших Виферон, не отмечено реактивации ЦМВ и ВПГ инфекции во время беременности, в то время как у женщин, получавших только базисную терапию, реактивация инфекции была зарегистрирована почти у четверти (23,9%). В прежнем количестве ЦМВ и ВПГ сохранялись почти у 11% обследованных из обеих групп.
Суммируя результаты применения метаболической и иммунной терапии у беременных можно констатировать:
- статистически значимую элиминацию вируса при повторных лабораторных исследованиях биологических сред после применения метаболической и иммунной терапии по сравнению с базисной терапией;
- отсутствие и/или снижение количества рецидивов ВПГ и ЦМВ – инфекций у беременных с ОАГА;
- снижение общего числа случаев внутриутробной инфекции более чем в 3 раза, в том числе тяжелых ее форм (внутриутробная пневмония, сепсис) с 26,7% до 5,2%;
- уменьшение с 25% до 11,3% случаев перинатальной патологии неинфекционного генеза (ЗВУР, хроническая гипоксия, асфиксия при рождении, нарушение мозгового кровообращения);
- снижение в 2-2,5 раза общей частоты осложнений беременности (ФПН, гестоз, угроза прерывания беременности).
Поиск новых субстанций природного происхождения, обладающих противовирусной активностью в отношении ЦМВ человека in vitro.
Новые препараты для лечения ЦМВИ у беременных и новорожденных, несомненно, должны обладать высокой антивирусной активностью в сочетании с незначительной токсичностью для клеток и организма в целом. Поэтому поиск природных, натуральных веществ, представляется весьма перспективным для создания лекарственных средств нового поколения.
За последнее время быстро развивающейся областью медицинской химии является химия фуллеренов и соединений на их основе. Установлена уникальная химическая структура этих соединений, ряд из которых обладают разнообразной биологической активностью: повышение устойчивости клеток к токсическим соединениям, образуют аддукты, являются антиоксидантами, обладают адъювантными свойствами, не вызывают аллергенных реакций, проникают через липидные мембраны, модулируя трансмембранный перенос ионов, обладают нейропротективными свойствами. Расширение спектра веществ, обладающих анти-ЦМВ активностью, позволило бы решить проблему резистентности, неизбежно возникающую при применении химиопрепаратов однонаправленного действия.
Часть работы была посвящена изучению противовирусной активности аминокислотных производных фуллерена и оценке возможности использования АПФ в комбинированной терапии вместе с патентованными препаратами для лечения ЦМВИ в системе in vitro. Три водорастворимые аминокислотные производные фуллерена - аминокапроновая кислота (С60-АКК), Na – соли аминокапроновой кислоты (С60- Na – АКК) и Na – соли аминомасляной кислоты (С60- Na – АМК) были синтезированы в ИНЭОС им. С.И. Несмеянова РАН.
Исследование цитотоксического действия АПФ на фибробласты человека показало, что степень цитотоксического действия АПФ выраженная в 50% цитотоксической дозе (СС50) составила для С60-Na-АКК- 1500мкг/мл и С60-Na-АМК- 1200 мкг/мл, а для С60-АКК – 100мкг/мл.
Изучение противовирусной активности всех трех АПФ в лечебной схеме показало, что соли АПФ оказывают более выраженное антивирусное действие по сравнению с С60-АКК. Анализ кривых позволил определить эффективную концентрацию препаратов, необходимую для подавления вирусной активности на 50% (эффективная доза - ЭД50). ЭД50 для С60-Na-АКК составила 0,6 мкг/мл, ЭД50 для С60-АКК – 2,7 мкг/мл, а для С60-Na-АМК- 22 мкг/мл. Низкая токсичность и выраженный антивирусный эффект С60-Na-АМК и С60-Na-АКК определили наш выбор этих препаратов для дальнейшего анализа, где был определен индекс пролиферации (IP50), который подтвердил, что изученные вещества обладают относительно низким антипролиферативным действием. IP50 для С60-Na-АКК составил 160 мкг/мл, а для С60-Na-АМК - 550 мкг/мл. По совокупности полученных данных соли АПФ представлялись весьма перспективными, и в дальнейшем было изучено их влияние на репродукцию инфекционно активного вируса в культуре клеток. Заражение клеток ЦМВ с ИМ 0,01БОЕ/кл. позволило установить, что С60-Na-АКК вызывает 50% подавление инфекционной активности вируса при концентрации 1,3 мкг/мл, а С60-Na-АМК – при 2,2 мкг/мл, ХТИ = 1153 и 545, соответственно.
Как показали полученные данные, АПФ достоверно подавляют инфекционную активность ЦМВ, выявленную в культуральной жидкости от клеток, зараженных с высокой и низкой множественностью. При этом степень подавления репродукции вируса находилась в зависимости от концентрации вещества и инфекционной множественности ЦМВ.
Для определения профилактического противовирусного эффекта АПФ культуру клеток обрабатывали за 24 часа до инфекции. При заражении с МИ 0,001 БОЕ/кл и концентрации С60-Na-АМК от 22мкг/мл до 0,022 мкг/мл, 100% вирусспецифическое поражение клеток в обработанном АПФ варианте задерживалось на 1-2 дня. При 220 мкг/мл – на 7 дней. 50% подавление бляшкообразования отмечалось при концентрации 0,22 мкг/мл при МИ 0,001 БОЕ/кл. ХТИ составил 5454. При постановке опытов по профилактической схеме с С60-Na-АКК заметного изменения по времени появления и по проценту пораженных клеток в опыте и контроле не наблюдалось.
При вирулицидной схеме воздействия вирус (МИ 0,01 БОЕ/кл) инкубировали в течение 1 часа при 370С с различными концентрациями веществ - С60-Na-АКК в концентрациях от 0,1 до 10 мкг/мл; а С60-Na-АМК в концентрациях от 0,022 до 220 мкг/мл. При использовании С60-Na-АМК в концентрации 220 мкг/мл инактивация вируса происходила полностью. В течение времени наблюдения (14 дней) не отмечалось появление характерного ЦПД вируса, в то время как в контроле в 100% клеток наблюдалось ЦПД. При концентрации С60-Na-АМК 22 мкг/мл активность вируса была снижена на 2,0 lg. Подсчет БОЕ показал, что 50% ингибирующая доза соответствует 0,22 мкг/мл. ХТИ составил 5454. При использовании этой концентрации наблюдали задержку в развитии ЦПД на 4 суток. Аналогичная постановка опыта для С60-Na-АКК при различных концентрациях (10,0, 1,0 и 0,1 мкг/мл) показала, что 50% подавление образования бляшек наблюдается при 1,0 мкг/мл. ХТИ = 1500. С60-Na-АКК в концентрации 0,1мкг/мл не влияла на вирусную активность, а в концентрации 10 мкг/мл снижала титр вируса на 0,97 lg.
Таким образом, 2 из 3-х производных фуллерена являются высокоэффективными ингибиторами репродукции ЦМВ человека в системе in vitro. ХТИ в различных вариантах схем и концентраций для С60-Na-АКК составил 1150-2600; для С60-Na-АМК – 545-5450.
Одной из задач исследования была оценка сочетанного антивирусного эффекта фуллерена и виферона in vitro. Для этого АПФ и ганцикловир вносили в культуральную среду однократно через час после заражения в концентрации 1мкг/мл, С60-Na-АМК вносили в концентрации 0,22 мкг/мл. Для виферона использовали профилактическую схему, когда клетки обрабатывали за 24 часа до заражения раствором, содержащим 50МЕ виферона. При комбинированной схеме ганцикловир вносили в концентрации 0,24 мкг/мл, т.е. в концентрации в 4 раза меньшей, чем рекомендовано в инструкции. АПФ использовали в концентрации 0,1 мкг/мл. Концентрация виферона в комбинированной схеме также была уменьшена до 10 МЕ/мл.
При иммуноцитохимическом исследовании на 7 сутки после заражения в контрольной инфицированной культуре было 42,8% (900/2100) пораженных клеток. Статистическая обработка результатов показала, что все вещества значительно подавляют развитие ЦПД по сравнению с зараженной культурой (Р<0,0005). В культуре, обработанной ганцикловиром, количество зараженных клеток не превышало 8,0% (186/2300), фуллереном 9,2% (211/2300). При обработке вифероном количество инфицированных клеток было больше 498/2900 (17,1%). При изучении сочетанного эффекта фуллерена с вифероном и ганцикловира с вифероном оказалось, что антивирусный эффект более выражен у пары ганцикловир+виферон. Количество инфицированных клеток при обработке культуры ганцикловиром и вифероном не превышало 2,1% (50/2300), в культуре обработанной вифероном и АПФ обнаружено 3,6% (85/2300) инфицированных клеток. Данные однозначно указывают на то, что при комбинированном использовании препаратов достижение противовирусного эффекта происходит при снижении концентраций соединений, что имеет явное преимущество перед использованием анти-ЦМВ препаратов в отдельности.
Для суждения о механизме действия АПФ на ЦМВИ in vitro были проведены дальнейшие опыты. Эффективность С60-Na-АМК в профилактической и в вирулицидной схемах позволила предположить, что вещество действует на ранних этапах взаимодействия вирус – клетка. Для проверки данного предположения фибробласты инфицировали ЦМВ в присутствии исследуемого соединения и фиксировали через 2 часа после внесения вируса, а затем окрашивали МКА к белку ЦМВ рр65, который в случае инфицирования вирусом клетки уже через час обнаруживается в ее ядре [Landolfo S., 2003]. Было установлено, что при МИ 0,01 БОЕ/кл. С60-Na-АМК в концентрации 22 мкг/мл достоверно подавляло проникновение ЦМВ в клетки на 69,8% (p<0,0005) по отношению к инфицированной культуре (48% окрашенных клеток в контроле против 14,5% в присутствии АПФ).
Для того, чтобы выяснить, на какие стадии жизненного цикла вируса оказывают влияние АПФ, было проведено иммуноцитохимическое окрашивание клеток с использованием МКА к сверхраннему, раннему и позднему белкам ЦМВ. В качестве положительного контроля были использованы фоскарнет и ганцикловир. Известно, что подавляя активность вирусной ДНК полимеразы, данные препараты ингибируют репликацию ДНК ЦМВ и блокируют экспрессию поздних генов, кодирующих структурные белки в ЦМВ – инфицированных клетках [De Clercd, 2001].
При концентрации 2,2 мкг/мл С60-Na-АМК снижала количество клеток окрашенных МКА к IEp72 и рр65, на 37% и 62%, соответственно. Эти значения находятся на уровне снижения экспрессии этих белков в инфицированных клетках в присутствии фоскарнета, С60-Na-АКК не влияла на синтез сверхранних и ранних белков.
Наиболее эффективно вещества подавляли экспрессию поздних генов. Динамика экспрессии позднего структурного белка gB ЦМВ в культуре ФЛЭЧ в присутствии различных химиопрепаратов представлена на рисунке 5.
РИС. 5. Динамика выявления белка gB в ЦМВ-инфицированных фибробластах человека в присутствии различных химиопрепаратов.
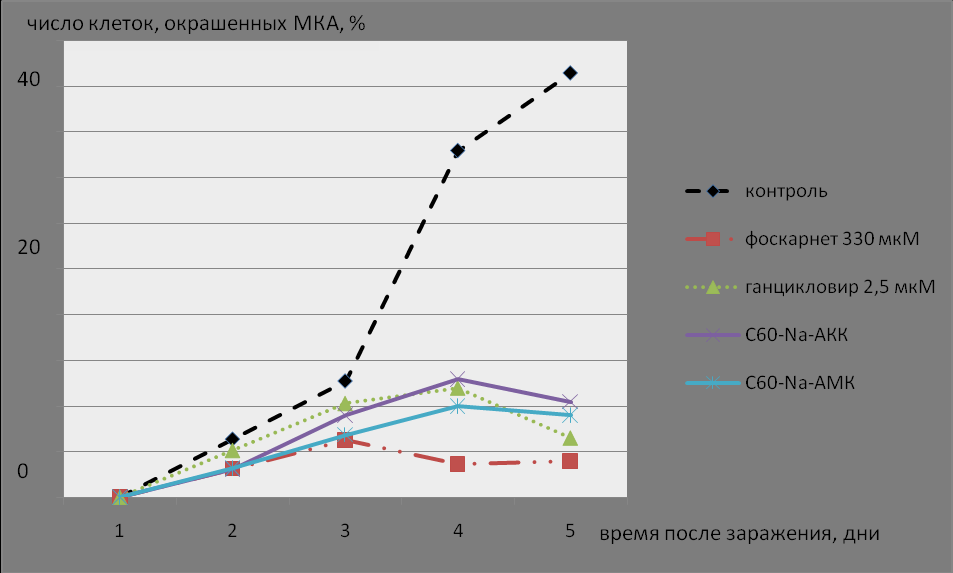
В инфицированной культуре около 40% клеток на 5 сутки экспрессировали gB. В культуре обработанной АПФ количество клеток экспрессирующих gB достигало только 8-9% (р<0,0001). В культуре, обработанной Ганцикловиром или Фоскарнетом, экспрессия gB отмечалась в 6-7,5%. Полученные результаты позволяют заключить, что АПФ подавляют синтез поздних вирусных белков подобно Ганцикловиру и Фоскарнету, что является косвенным свидетельством ингибирования репликации вирусной ДНК.
Для подтверждения данного вывода прямым методом была проведена серия экспериментов по количественному изучению динамики накопления ДНК ЦМВ в культуре инфицированных фибробластов методом ПЦР в реальном времени (таблица №9).
Таблица 9. Накопление ДНК ЦМВ в инфицированных клетках методом ПЦР в реальном времени при действии различных веществ.
| Дни после заражения | Виферон | Фуллерен | Фуллерен+ Виферон | Ганцикловир | Ганцикловир+ Виферон | Контроль вируса |
| 4 сутки | отр | отр | отр | отр | отр | 26,80* |
| 7 сутки | 27,23 | 25,96 | отр | 27,55 | 26,62 | 18,73 |
| 10 сутки | 19,22 | 21,70 | 22,97 | 22,60 | 26,09 | 13,72 |
* Значение Ct. Положительный контроль тест-системы (Сt =19.11) соответствует 20000 копий ДНК/мл.
В качестве препаратов сравнения были использованы Виферон и Ганцикловир. Результаты ПЦР и ПЦР real – time показывают, что АПФ, Виферон и Ганцикловир препятствуют накоплению вируса в клетке до 7 суток после заражения. Надо отметить, что значения Сt на 7 сутки для всех использованных веществ были на уровне нижнего предела использованной тест-системы (25,96 - 27,55). На 7 сутки количество ДНК в исследованных образцах было снижено на 2,0 lg. Ингибирующая активность проявлялась также и через 10 дней после заражения. При совместном использовании Виферона с АПФ и Ганцикловиром ингибирующий эффект был более длительным и выраженным.
Суммируя полученные данные, можно заключить, что в ЦМВ - инфицированных клетках существует несколько вирусных мишеней воздействия для С60-Na-АКК и С60-Na-АМК, направленных на подавление инфекционного процесса в пермиссивных клетках in vitro. Для раскрытия молекулярных механизмов антивирусного действия каждого из изученных соединений необходимы дальнейшие исследования.
Возможность комбинирования Виферона с другими лекарственными средствами специфической противовирусной терапии дает основание для разработки принципиально новых схем комбинированной терапии цитомегаловирусной инфекции, позволяющих снизить терапевтические концентрации лекарственных соединений и, следовательно, избежать проявления побочных токсических эффектов при сохранении высокой противовирусной эффективности. Использование препаратов с различными механизмами действия позволит также избежать появления устойчивых к терапии мутантных штаммов вируса. Для того, чтобы выявить клеточные мишени, на которых направлено действие С60-Na-АКК и С60-Na-АМК, необходимо понимать процессы, происходящие в инфицированной клетке после проникновения внутрь клетки и влияние вируса на жизненный цикл клетки. Для этого были проведены опыты, описанные в следующем разделе работы.
Действие ЦМВ на пролиферативную активность клеток ФЛЭЧ.
Одним из показателей пролиферативной активности клеток является митотический индекс. Подсчет митотических фигур в контрольной и инфицированной ЦМВ культурах ФЛЭЧ показал, что в неинфицированной культуре митотический индекс достигал максимального уровня (2,3ο/οο) на 2-й день после пересева клеток, после чего снижался до 0,2 ο/οο к 4 дню. В то же время в культуре, зараженной ЦМВ с МИ 1-5 БОЕ/кл, величина митотического индекса постоянно возрастала, достигая на 4-й день после инфицирования 13,6 ο/οο.
В инфицированной культуре к концу первого дня инфекции наблюдались митотические фигуры, в которых расположение хромосом и их морфология не соответствовали ни одной из нормальных стадий митоза и характеризовались неправильным расположением хромосом, повышенной степенью их конденсации и фрагментацией части хромосом. Доля патологических митозов среди общего числа митотических клеток к 40 часам после заражения достигала 80%.
Было высказано предположение, что митотические клетки с аномальной морфологией не способны завершить деление. Подсчет митотических фигур, соответствующих стадиям анафазы и телофазы, показал, что если в контрольной культуре ФЛЭЧ их доля от общего числа митозов составляла в среднем 17%, то на 3-й и 4-й день суммарная доля анафазных и телофазных пластинок снижалось до 1%.
На тех же препаратах проводился подсчет клеток на единицу площади. Оказалось, что в то время как в контрольной культуре эта величина возрастала с 1-го по 4-й день культивирования, в инфицированной культуре число клеток на единицу площади существенно не увеличивалось. Следовательно, в ЦМВ-инфицированной культуре наблюдалась остановка деления клеток. Возможно, что блок клеточного цикла наблюдается на стадии митоза и связан с появлением патологии митотических клеток. Аномальные митотические фигуры при инфицировании активно делящихся клеток ФЛЭЧ появлялись в течение первых суток после заражения. Это наводило на мысль, что патология митоза развивается вне зависимости от синтеза вирусной ДНК, репликация которого начинается, в среднем, через 24 часа после проникновения вируса в клетку.
Для ответа на вопрос, связана ли патология митозов с репликацией вирусной ДНК и экспрессией вирусных белков была проведена серия опытов. Культуру заражали ЦМВ в присутствии ганцикловира, являющегося ингибитором репликации вирусной ДНК и вирусом, предварительно инактивированным УФ. Степень подавления синтеза ДНК ЦМВ оценивали по числу клеток, содержащих поздний вирусный белок gB с помощью МКА. На 3-и сутки после заражения интактным вирусом 35% клеток содержали белок gB. В культуре обработанной ганцикловиром число клеток, содержащих поздний антиген, не превышало 3%. Проникновение вирусных частиц внутрь клеток контролировали путем окраски МКА к белку рр65, который является мажорным белком тегумента. Было обнаружено, что 82% клеток содержали белок рр65 после обработки культуры инактивированным вирусом. Обработка вируса ультрафиолетом (УФ) приводила к снижению экспрессии сверхранних и ранних генов в 15 раз. При этом, появление патологических митозов в одинаковой степени наблюдалось во всех трех культурах.
Результаты подсчета митотического индекса и доли патологических митозов во всех культурах на 3 сутки показали, что в контрольной культуре было 9,3о/оо, в инфицированной культуре 19,8о/оо, из которых 9,7о/оо (48,9%) были патологическими. В культуре, зараженной вирусом, обработанным УФ, митотический индекс составил 15,7 о/оо, из них 7,2 о/оо (45,9%) митозов были с различной степенью патологии. В культуре, обработанной ганцикловиром, митотический индекс был несколько меньшим и составил 10,6 о/оо. Патология митоза наблюдалась в 6,0 о/оо, т. е. в 56,6% из всех митотических фигур в культуре. К 5-м суткам в культуре клеток после заражения вирусом обработанным УФ и в присутствии ганцикловира, также как и в культуре, инфицированной интактным вирусом, количество митозов с аномальной морфологией было близким и превышало 50%. Таким образом, было установлено, что подавление репликации ДНК ЦМВ, а также инактивация УФ транскрипции вирусных генов не препятствуют появлению патологических митозов.
