Роль цитомегаловирусной инфекции в патологии плода и новорожденного. Поиск новых противовирусных средств. 03. 00. 06. Вирусология
| Вид материала | Автореферат диссертации |
- Акушерство перечень практических занятий на 4 курсе лечебного факультета на II семестр, 29.23kb.
- Тульская областная научная медицинская библиотека акушерство и гинекология. 2011., 190.44kb.
- Он оказался общебиологическим феноменом, 359.5kb.
- Белорусскйи государственный медицинский университет гемолитическая болезнь новорожденных, 220.18kb.
- Влияние скэнар-терапии на течение беременности, родов, состояние новорожденного и ребенка, 146.76kb.
- 1. Модель пациента, 802.59kb.
- «Владивостокский государственный медицинский университет мз рф», 551.74kb.
- Оказания перинатальной помощи в Республике Беларусь, 72.85kb.
- Ю. И. Ишпахтин Научные основы охраны здоровья женщины, матери, плода, новорожденного, 39.31kb.
- И. Л. Элбакидзе, В. Ф. Ордынский,, 76.7kb.
Клинический материал. Объектами исследования у новорожденных служили моча, кровь, слюна и ликвор - по показаниям, в случаях смерти ребенка - отпечатки и лизаты от 3-5 органов. У беременных женщин исследовали кровь, мочу и урогенитальный соскоб. Цельную кровь и мочу центрифугировали в течение 10 мин при 1000 об./мин. В лунки 24 - луночной панели с клетками ФЛЭЧ вносили по 0,2 мл лейкоцитарной фракции и по 0,2 мл клеток из осадка мочи. Ликвор и слюну разводили в 2 раза средой ИГЛА-МЕМ без сыворотки и вносили в культуру клеток в объеме 0,2 мл.
Выявление возбудителей ВУИ в материале аутопсии. Выявление возбудителей ВУИ в пробах органов погибших плодов и новорожденных, у которых при жизни или при патологоанатомическом исследовании возникло подозрение на врожденную инфекцию, проводили четырьмя методами: иммуноцитохимическим, быстрым культуральным методом (БКМ), ПЦР и ПЦР in situ. Были исследованы материалы аутопсии различных органов (мозга, сердца, легких, печени, почек, селезенки, тимуса, плаценты). Детекцию антигенов Adeno, HRSV, Rub, HSV в мазках – отпечатках органов осуществляли прямым методом иммунофлюоресценции с помощью антител, разработанных в НИИ гриппа РАМН (ООО «Предприятие по производству диагностических препаратов», Санкт-Петербург). Антигены HSV 1,2 и HCMV определяли с помощью МКА к белкам р72, рр65 и gB HCMV, 4А1 и gB HSV, полученных ранее в лаборатории клеточной инженерии (НИИ вирусологии им. Д.И. Ивановского РАМН, Москва). Антигены энтеровирусов выявляли в РНИФ с помощью ПКА (ФГУП «ИПВЭ им. М.П. Чумакова РАМН», Москва).
Быстрый культуральный метод (БКМ). Для определения инфекционной активности ЦМВ в клиническом материале использовали количественный вариант БКМ, который проводили согласно Методическим рекомендациям Роспотребнадзора №02.030-08 [Москва, 2008]. Клетки ФЛЭЧ высаживали в 24-луночные панели в концентрации 250 тыс. клеток в 1 мл. В культуру вносили клинический материал и проводили совместное центрифугирование клеток ФЛЭЧ с клиническими образцами в течение 35 мин. при 2500 об./мин. После отмывки вносили среду поддержки – среду Игла-МЕМ с 2% ЭТС. Через 24 часа клетки фиксировали в холодном ацетоне – 10 минут для проведения реакции непрямой иммунофлюоресценции, либо в охлажденном метаноле (-200С) в течение 20 минут для реакции иммунопероксидазного окрашивания. Для обнаружения ЦМВ использовали МКА к белкам ЦМВ [Макарова и др., 1994]. Выявляющими антителами служили антимышиные антитела, коньюгированные с FITC или конъюгированные с пероксидазой хрена. Подсчет окрашенных клеток проводили на 2,5х105 клеток ФЛЭЧ. Положительные результаты представляли в количестве вирусных частиц (в.ч.) на 0,2 мл клинического материала. Чувствительность БКМ соответствовала активности 5 вирусных частиц в 1 мл [Адиева и др., 2008].
Полимеразная цепная реакция (ПЦР). Выделение ДНК производили с помощью сертифицированных коммерческих наборов «ДНК-сорб-А-М», «ДНК-сорб-В», «ДНК-сорб-С» и «Реамикс» согласно инструкции фирмы-производителя. ПЦР в качественном варианте проводили с помощью коммерческих наборов ООО НПФ "Гентех» и ФГУН ЦНИИ эпидемиологии Роспотребнадзора согласно инструкции фирмы-производителя. Исследование аутопсийного материала проводили с помощью модифицированного совместно с НПФ “Литех” nested варианта ПЦР. Чувствительность определения ДНК составила 103 молекул вирусной ДНК в 1 мл.
Полимеразная цепная реакция в реальном времени (ПЦР real time). ДНК ЦМВ из лизированных клеток выделяли с помощью «ДНК-сорб-АМ» ФГУН ЦНИИЭ Роспотребнадзора. ПЦР - амплификацию проводили с применением набора реагентов для выявления ДНК цитомегаловируса человека (HCMV) в клиническом материале методом ПЦР с гибридизационно - флуоресцентной детекцией «АмплиСенс® CMV-FL» (ФГУН ЦНИИЭ Роспотребнадзора). Детекцию продуктов ПЦР - амплификации в количественном варианте осуществляли при помощи прибора «iQ iCycler» (Bio-Rad, США), согласно рекомендации производителя тест-систем.
Полимеразная цепная реакция in situ (ПЦР in situ). Метод ПЦР in situ был модифицирован и использован для анализа фиксированных препаратов-отпечатков аутопсийного материала и препаратов монослойных культур клеток. Препараты готовились на стеклах с адгезивным покрытием (Histobond). В качестве положительных контролей использовали зараженные клетки ФЛЭЧ и Vero. В работе были использованы праймеры, направленные к гену ДНК-полимеразы ВПГ и к консервативному сверхраннему региону ЦМВ. Визуализацию проводили с помощью светового микроскопа. В препаратах от пациентов, инфицированных ВПГ и ЦМВ, наблюдались темно-коричневые точки - метки на поверхности или внутри клеток. Далее подсчитывали количество клеток, содержащих метку, и общее количество клеток на препарате.
Твердофазный иммуноферментный анализ (тИФА). Определение антител к ЦМВ классов M и G в сыворотке крови проводили методом твердофазного иммуноферментного анализа (тИФА), используя коммерческие тест-системы НПО «Диагностические системы» (Нижний Новгород). Для выявления антител класса IgM использовали тест-систему «ДС-ИФА-АНТИ-ЦМВ-М», для выявления антител класса IgG «ДС-ИФА-АНТИ-ЦМВ-G. Анализ и интерпретацию результатов осуществляли в соответствии с инструкциями фирмы-производителя.
Авидность антител. Индекс авидности (ИА) специфических IgG к ЦМВ в сыворотке крови определяли с помощью тест-систем «ДС-ИФА-АНТИ-ЦМВ-G Авидность» (НПО «Диагностические системы», Нижний Новгород). Оценку результатов осуществляли в соответствии с инструкциями фирмы-производителя.
Реакция непрямой иммунофлюоресценции (Рниф). Клетки ФЛЭЧ, неинфицированные и инфицированные ЦМВ, промывали 0,1 М фосфатно-солевым буфером рН 7,4 и фиксировали. Использовали различные способы фиксации в зависимости от поставленных задач. Для анализа препаратов при пероксидазном окрашивании - абсолютным метанолом фиксировали 10 мин при -20ºС; охлажденным ацетоном для Рниф - 10 мин при +4ºС; для анализа морфологии клеток 3% параформальдегидом на фосфатном буфере 15 мин при комнатной температуре с последующей обработкой 0,1% раствором Тритона Х-100 на буфере PBS в течение 8 мин.
На фиксированные препараты наносили очищенные моноклональные антитела (МКА) и инкубировали в течение 1 часа при 370С. Затем клетки промывали буфером PBS и инкубировали с антителами, конъюгированными с флуорохромом ФИТЦ в течение 30 минут при 370С, с пероксидазой хрена - в течение 1 часа при 370С (DakoCytomation, Дания). Для окраски хроматина ядер использовали флуорохром DAPI в концентрации 1мкг/мл. После окраски стекла заключали в глицерин или в мовиол. Препараты анализировали с помощью флюоресцентного/светового микроскопа Olympus BX – 51 (Япония), оснащенного объективами 4х, 10х, 40х и цифровой камерой Olympus U-CMAD3.
Интерфероновый статус. Изучение интерферонового статуса проводили в лаборатории онтогенеза и коррекции системы интерферона НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи (заведующая лабораторией – д.б.н., проф. В.В. Малиновская). Концентрации альфа-ИФН и гамма-ИФН определяли методом твердофазного ИФА. Для альфа-ИФН использовали тест-систему производства ООО «Протеиновый контур» (С.-Петербург, Россия), для тестирования гамма-ИФН применяли набор реагентов Biosource IFN (Бельгия). В качестве индукторов использовали: для альфа-ИФН – вирус болезни Ньюкасла (ВБН), для гамма-ИФН – ФГА. Чувствительность тест-систем для иммуноферментного определения альфа-ИФН составляла 5 пкг/мл, для определения гамма-ИФН – 3 пкг/мл.
Определение цитотоксичности производных фуллерена. Цитотоксичность определяли по влиянию на жизнеспособность клеток ФЛЭЧ, которую оценивали методом исключения витального красителя трипанового синего. Цитотоксичность (ЦД) характеризовали как концентрацию каждого из тестируемых соединений, вызывающую гибель подавляющего большинства клеток или 50% клеток в популяции (ЦД95 и ЦД50, соответственно) на 4-е сутки после внесения АПФ – так называемая хроническая цитотоксичность или (ЦД50). Определяли также концентрацию, вызывающую гибель 50% клеток в течение 24 часов, соответствующую острой цитотоксичности (ОЦД50).
Пролиферативная активность клеток ФЛЭЧ в присутствии АПФ. Влияние АПФ на репликацию ДНК ФЛЭЧ анализировали методом радиоавтографии. Клетки ФЛЭЧ вносили в 24-луночные панели в низкой концентрации (6х104кл./мл). На следующий день после посадки вносили АПФ в различных концентрациях. Через 24, 48 и 72 часа инкубации вносили в культуральную жидкость радиоактивно меченый тимидин (3Н-ТД). За 50%-ую ингибирующую дозу (ИД50) принимали концентрацию препарата, вызывающую 50% подавление включения радиоактивного тимидина в ДНК клеток.
Определение антивирусной активности АПФ. Для определения анти-ЦМВ активности использовали три схемы воздействия АПФ: лечебную, профилактическую и вирулицидную.
Лечебная схема. Монослой клеток заражали вирусом с различной множественностью инфицирования (1,0 БОЕ/кл. – 0,001 БОЕ/кл). После адсорбции в течение 1 часа при 37˚С дважды промывали и вносили поддерживающую среду, содержащую 2% сыворотки и аминопроизводные фуллерена в различных концентрациях.
Профилактическая схема. На клеточный монослой вносили среду поддержки, содержащую АПФ в различных концентрациях, и инкубировали в течение 24 часов. После обработки клетки дважды промывали и заражали вирусом с различной множественностью инфицирования (1,0 БОЕ/кл. – 0,001 БОЕ/кл) в течение 1 часа при 370С. Монослой клеток дважды промывали и вносили среду поддержки.
Вирулицидная схема. Вирус с МИ 0,01 БОЕ/кл инкубировали совместно с АПФ в различных концентрациях в течение 1 часа при 370С. Затем вирус, инкубированный с АПФ, наносили на монослой клеток и выдерживали в течение 1 часа. Монослой клеток дважды промывали и вносили среду поддержки.
Антивирусную активность во всех схемах оценивали по способности ЦМВ к бляшкообразованию и по цитопатогенному действию вируса (ЦПД). Концентрацию вещества, вызывающую подавление ЦПД вируса на 50% по отношению к контролю, принимали за 50%-ую эффективную дозу (ЭД50). Химиотерапевтический индекс (ХТИ), или индекс селективности (ИС), рассчитывали как отношение концентрации препарата, вызывающей клеточную деструкцию (ЦД50) или снижающую синтез клеточной ДНК на 50% (ИД50), к концентрации, вызывающей 50% антивирусный эффект (ЭД50).
Определение продукции инфекционно активного вируса. Для определения влияния АПФ на репродукцию ЦМВ клетки заражали вирусом с МИ 0,1 БОЕ/кл. и 0,01 БОЕ/кл. После адсорбции вносили АПФ в различных концентрациях. При развитии в контроле (без АПФ) 100%-ого ЦПД отбирали культуральную среду из опытных и контрольных культур и заражали неинфицированные клетки ФЛЭЧ, которые культивировали в среде Игла с 2% сыворотки без АПФ. Об активности урожая вируса судили по цитопатогенному действию в динамике инфекционного процесса.
Изучение динамики накопления ДНК ЦМВ методом ПЦР в реальном времени. Монослой ФЛЭЧ заражали ЦМВ с МИ 0,01 БОЕ/кл. После адсорбции вируса вносили изучаемые вещества в соответствующей концентрации. На 4, 7 и 10-е сутки клетки промывали 0,1М фосфатно-солевым буфером и обрабатывали трипсином. Осадок клеток обрабатывали лизирующим буферным раствором и исследовали методом ПЦР real-time.
Радиоавтография. В клетки ФЛЭЧ, выращенные на покровных стеклах в 24- луночных панелях, вносили радиоактивно меченый 3Н-ТД на 1 час в концентрации 1 мкКю/мл для включения в реплицирующуюся ДНК. Фиксацию проводили через различные интервалы времени смесью этилового спирта и концентрированной уксусной кислоты в соотношении 3:1 в течение 40 минут. Затем стекла с клетками обрабатывали холодной 5% трихлоруксусной кислотой 3 раза в течение 5-10 минут для удаления невключившегося предшественника и промывали водой. После высушивания на воздухе покровные стекла монтировали на предметные стекла клетками вверх. Все препараты с радиоактивной меткой покрывали фотоэмульсией типа М (НИИ химфотопроект, Москва) и экспонировали в течение 6-7 дней в темноте. Проявляли амидоловым проявителем и окрашивали гематоксилином Карацци.
Статистическая обработка. Для статистической обработки полученных результатов использован ПК и пакет прикладных программ Statistika V6.0.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ.
Для оценки факторов риска внутриутробного инфицирования большое значение имеет состояние здоровья матери. Мы провели ретроспективный анализ анамнестических данных 658 матерей умерших (плодов, умерших новорожденных и детей, умерших на первом году жизни). Было отмечено, что только 35% матерей умерших считали себя практически здоровыми. Даже среди матерей до 20 лет, где были и подростки, здоровых было только 51,2%. С увеличением возраста матерей количество здоровых снижалось, и уже в возрасте от 25 до 30 лет их оказалось достоверно меньше (40%; р <0,001), чем среди молодых матерей, а среди женщин старше 30 лет здоровыми себя считали только 20,9%. Подавляющее большинство имели те или иные хронические болезни, среди которых наиболее частыми были болезни мочеполовой системы.
У матерей умерших был отмечен и отягощенный акушерско-гинекологический анамнез (ОАГА). В анамнезе у женщин было отмечено большое количество искусственного прерывания беременности. Даже у женщин до 20 лет их количество составило 12,8%. С увеличением возраста женщин количество медабортов значительно увеличивалось, и у женщин старше 30 лет их количество достигло 69,6% (нередко не по одному разу). Кроме искусственного прерывания беременности в анамнезе отмечались выкидыши, мертворождения, замершая беременность, смерть ребенка в раннем неонатальном периоде, в том числе и у женщин моложе 20 лет. Настоящая беременность и роды независимо от возраста практически у всех протекали с обострением хронических болезней, с острыми респираторными заболеваниями (иногда по несколько раз), с различными осложнениями (анемия, угроза прерывания часто на протяжении всей беременности, маловодие, многоводие, длительный безводный промежуток, слабость родовой деятельности, стремительные роды), которые могли стать причиной острой или хронической гипоксии плода. В подавляющем большинстве случаев женщины не проходили предгравидарную подготовку.
Активная ЦМВИ у беременных по данным серологического анализа имела место в 30% случаев смерти ребенка. Рецидивы кожной формы простого герпеса были зарегистрированы у 60,7% беременных женщин.
Скрининговое вирусологическое исследование 3796 небеременных и беременных женщин выявило в подавляющем большинстве случаев смешанную инфекцию. Энтеровирусы в популяции были выявлены от 34,6% до 90% случаев (в том числе, антигены Коксаки А - в 34,6% случаев, Коксаки В – в 38% случаев), вирус краснухи был обнаружен у 19-23% обследованных. Частота определения антигенов ВПГ составила 11-13%. В 7,8% случаев в обеих группах была выявлена папиломавирусная инфекция, ВПЧ преимущественно 16 типа. Важно отметить, что ЦМВ был обнаружен в 19,1% случаев у небеременных женщин и статистически значимо чаще (26,2%; р=0,001) - у беременных женщин.
Таким образом, ухудшающееся состояние здоровья женщин и инфекционные заболевания, в числе которых ЦМВИ занимает существенное место, являются фактором риска перинатального инфицирования плода, патологии и смерти в перинатальном и младенческом возрасте.
Разработка алгоритма диагностики ЦМВИ у новорожденных детей с осложненным течением раннего неонатального периода.
Недоношенные новорожденные дети представляют особую группу риска по развитию внутриутробной ЦМВИ, однако до настоящего времени нет общепринятого алгоритма диагностики ЦМВИ у новорожденных детей с признаками ВУИ. В связи с этим были обследованы 204 новорожденных ребенка, родившихся в ГБ №8 Департамента здравоохранения города Москвы. Обследованные дети были разделены на 4 группы: первую группу (группа 1) составили недоношенные новорожденные дети (n=107) c гестационным возрастом (ГВ) 29,8±2,8 недель с клиническими признаками ВУИ. Во 2-ю группу были включены недоношенные новорожденные дети без клинических признаков ВУИ (18 детей, ГВ - 34,6±1,2 недель). Контрольную группу (группа 3) составили доношенные новорожденные дети без признаков ВУИ (32 ребенка, ГВ - 38,9±0,8 недель). Отдельную группу (группа 4) составили 47 детей с признаками ВУИ, первично обследованных в возрасте 1-3 месяцев.
Проведен анализ частоты выявления ЦМВ у детей на первой неделе жизни. Ребенка рассматривали как инфицированного, если маркеры ЦМВИ были обнаружены, по крайней мере, в одном из полученных от него образцов клинического материала. Данные по частоте выявления маркеров ЦМВИ приведены в таблице 2. Анализ показал, что ДНК ЦМВ была выявлена во всех группах, в том числе доношенных и недоношенных новорожденных без признаков ВУИ. Наиболее часто ДНК ЦМВ выявлялась в 4-й группе, даже значительно чаще (р <0,001), чем у новорожденных с ВУИ, обследованных на первой неделе жизни.
Таблица 2. Выявление прямых маркеров ЦМВИ у новорожденных детей.
| Группы детей | ДНК (ПЦР) | Инфекционная активность (БКМ) |
| группа 1 (основная) недоношенные с ВУИ | 15,9% (17/107) | 16,8% (18/107) |
| группа 2 (сравнения) недоношенные без ВУИ | 5,6% (1/18) | 0% (0/18) |
| группа 3 (контрольная) доношенные | 6,3% (2/32) | 0% (0/32) |
| группа 4 (дополнительная) | 46,8% (22/47) | 29,7% (14/47) |
Инфекционно активный вирус был выявлен только у детей с ВУИ и ни в одном случае во 2 и 3 группах. Более частое выявление ДНК и инфекционно активного вируса в 4 группе может свидетельствовать об обострении врожденной инфекции или о постнатальном инфицировании.
Если учитывать результаты обследования двумя методами, то ДНК и/или инфекционно активный вирус у новорожденных с ВУИ, обследованных на первой неделе жизни был выявлен у 28 из 107 обследованных (26,2%), то есть на 9-10% чаще, чем каждым методом отдельно. Таким образом, обследование двумя метода повышает эффективность лабораторной диагностики.
При анализе выявления маркеров ЦМВИ в различных биологических средах было установлено, что наиболее часто инфекционно активный ЦМВ выявлялся в моче (14,5%), а в крови только в 1% случаев. ДНК ЦМВ в моче выявлялась в 18,7%, и несколько реже - в крови 13,3%. Суммарно тем или другим методом в моче ЦМВ обнаружен в 41% случаев, в слюне – в 27%, в крови и в ликворе у 14-18% детей с признаками ВУИ. Наши данные согласуются с результатами других исследователей, которые показали, что в моче ЦМВ обнаруживается в количествах в 180 раз больших, чем в крови [Halwachs-Baumann G., 2002]. В целом ДНК ЦМВ выявлялся в 85 из 710 проб (12,1%), а инфекционно активный вирус в 52 из 710 проб (7,3%), то есть достоверно чаще (р=0,003).
Представляло интерес выяснить вирусную нагрузку в клинических материалах от обследованных детей. Данные количественного изучения ЦМВ во всех положительных образцах показали, большая часть образцов, в которых был обнаружен инфекционно активный ЦМВ, содержали 10-50 вирусных частиц, максимальные значения достигали 5000 вирусных частиц, что свидетельствует о большей вирусной нагрузке при инфицировании недоношенных новорожденных детей. Сходная тенденция была выявлена в результате анализа ДНК. Результаты показали, что в группе детей с признаками ВУИ вирусная нагрузка и инфекционная активность ЦМВ достоверно выше по сравнению с контрольной группой. Прямая корреляция между величиной вирусной нагрузки и интенсивностью клинических симптомов при врожденной ЦМВИ была недавно констатирована в работе исследователей США [Arav-Boger R., Pass R., 2007].
Для выяснения связи между данными БКМ и ПЦР был проведен анализ относительного количества ДНК в клинических образцах методом ПЦР - RT. Вычисляли значение порогового цикла Ct для каждого образца путем определения точки, при которой флюоресценция превышала фоновое значение. Сравнивали результаты для проб, в которых БКМ была обнаружена инфекционная активность ЦМВ, с результатами для проб, отрицательных по БКМ. Статистическая обработка показала, что в образцах, положительных по данным БКМ, вирусная нагрузка была достоверно выше, чем в пробах, отрицательных по результатам БКМ. Данные настоящей работы совпадают с результатами исследователей, изучавших прямые маркеры герпесвирусных инфекций методами ПЦР - RT и БКМ [J.van Doornum G., 2003].
Изучение показателей специфического гуморального иммунитета у новорожденных детей (выявление антител классов IgG и IgM и определение индекса авидности специфических антител) представлено в таблице №3.
Таблица 3. Результаты обследования новорожденных детей с помощью серологических методов.
| Группы детей | Выявление анти-ЦМВ IgM-АТ | Отсутствие анти-ЦМВ IgG-АТ | Авидность анти-ЦМВ-IgG-АТ (ИА) | |
| <0,6 | >0,6 | |||
| 1-я (основная) | 0,93% (1/107) | 8,4% (9/107) | 38,6% (32/83*) | 61,4% (51/83*) |
| 2-я (сравнения) | 0% (0/18) | 16,7% (3/18) | 33,3% (5/15*) | 66,7% (10/15*) |
| 3-я (контрольная) | 0% (0/32) | 9,4% (3/32) | 13,8% (4/29*) | 86,2% (25/29*) |
| 4-я (дополнительная) | 23,4% (11/47) | 19,1% (9/47) | 33,3% (12/36*) | 66,7% (24/36*) |
* авидность IgG определяли только у детей, у которых было достаточно материала и в сыворотках крови которых были выявлены АТ к ЦМВ класса IgG;
Анализ показал, что у подавляющего большинства детей всех групп присутствовали антитела класса IgG. У 1 ребенка из основной группы на первой неделе жизни были идентифицированы маркеры острого инфекционного процесса – анти-ЦМВ-IgM. Невысокая частота выявления анти-ЦМВ-АТ класса IgM у новорожденных детей отмечалась и другими авторами [Nelson et.al., 1997]. В 4-й группе (впервые обследованные в 1-3 мес.) показатель частоты выявления анти-ЦМВ IgM составил 23,4% (р<0,001). Важно отметить, что у 9 из 11 детей с анти-ЦМВ-IgM антитела класса G отсутствовали, но были выявлены ДНК и инфекционно активный вирус.
Оценка авидности IgG-АТ показала, что у большинства обследованных были выявлены высокоавидные АТ. Антитела с низким или промежуточным значением ИА выявлялись практически с одинаковой частотой у детей с ВУИ и в группе сравнения. В контрольной группе была отмечена наиболее низкая частота выявления низкоавидных антител (13,8%; р=0,026). Необходимо отметить, что у 65,4% детей с ВУИ, в крови которых АТ класса IgG отсутствовали, либо обладали ИА<0,6, были выявлены прямые маркеры ЦМВ.
При количественном анализе IgG анти-ЦМВ антител в группе детей с признаками инфицирования (группа 1 и 4) выявлялись антитела с низкой концентрацией достоверно чаще, чем в группах без ВУИ (p<0,05).
Анализ прямых и непрямых маркеров ЦМВИ (рис. 1) при оценке риска развития инфекционного процесса у новорожденных детей показал, что в группе инфицированных детей ДНК и инфекционная активность вируса выявляются в больших количествах, антитела IgG - в низкой концентрации и с низким индексом авидности.
РИС. 1. Частота выявления прямых и непрямых маркеров ЦМВИ у недоношенных новорожденных.
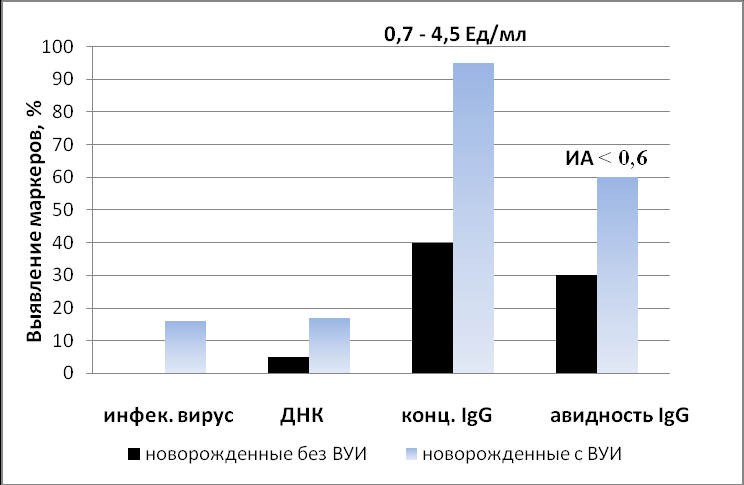
У детей без признаков инфицирования инфекционный вирус не выявляется, ДНК вируса обнаруживается в низких количествах и в небольшом проценте случаев (5-6%). IgG антитела характеризуются высокой концентрацией и ИА>60. Наличие низких концентраций материнских типоспецифических нейтрализующих антител у новорожденных детей увеличивает риск постнатального инфицирования ребенка [Hill J. and Roberts S., 2005]. Надо учитывать, что у недоношенных новорожденных детей доля антител, обладающих нейтрализующими свойствами, зависит от гестационного возраста. Так, только к 34-й неделе гестации 99% нейтрализующих материнских антител обнаруживаются в периферической крови плода [Karen et.al., 2006]. Это указывает на то, что специфическая диагностика ЦМВИ при оценке риска развития активного инфекционного процесса у новорожденных детей, особенно у недоношенных, требует использования комплекса лабораторных методов.
Изучение маркеров в динамике показало, что через 1-3 месяца после рождения у 19,2%, отрицательных при первичном обследовании, вирус был обнаружен впервые, через 4-7 мес. еще у 11,5% детей, отрицательных по ЦМВ при рождении впервые появились прямые маркеры ЦМВИ. Эти данные свидетельствуют о том, что для достоверной диагностики ЦМВИ необходимо неоднократное обследование.
Таким образом, на первом году жизни у недоношенных новорожденных детей с клиническими признаками ВУИ в 65,4% случаев на разных сроках были выявлены прямые маркеры ЦМВИ, что согласуется с результатами других исследований [Maschmann et.al., 2001; Меджидова и др., 2005], подтверждающими высокий риск развития ЦМВИ у этой группы новорожденных детей. Следует отметить, что в целом при повторных исследованиях количество вирусной нагрузки увеличивалось. Это может быть связано с инфицированием в неонатальном периоде при вскармливании грудным молоком [Lawrence et.al, 2006], а также с отсроченным проявлением внутриутробной бессимптомной ЦМВИ, которое отмечалось рядом авторов [Barbi et.al., 2003; Maligner et.al., 2003].
Частота выявления серологических показателей и вирусных маркеров в динамике проведено у 75 недоношенных детей с ВУИ из 1-й группы (рис.2).
РИС. 2. Динамика выявления серологических маркеров ЦМВИ у недоношенных новорожденных детей.

Изучение маркеров в динамике показало прямую корреляцию между обнаружением или отсутствием ЦМВ и серологическими показателями. При активации ЦМВИ в 68,4% случаев при повторном исследовании происходило либо выведение высокоавидных (по всей видимости, материнских IgG-АТ), либо появление собственных низкоавидных IgG-АТ с ИА<0,6 (52,6%), либо резкое снижение активности IgG-АТ и выявление анти-ЦМВ IgM (15,8%). Это и могло служить основной причиной обнаружения ЦМВ в клинических материалах и развития ЦМВИ при последующих исследованиях. В 75% случаев элиминация вируса сопровождалась появлением собственных анти-ЦМВ IgG или сменой низкоавидных IgG-АТ (50%) на высокоавидные или повышением активности IgG антител в несколько раз (25%). Известно, что низкоавидные антитела циркулируют в периферической крови приблизительно в течение 20 недель после первичной инфекции, затем авидность IgG-АТ увеличивается и остается высокой в течение всей жизни [Lazzarotto T., 2008]. За время проведения исследования в 1-й группе отмечены 12 летальных исходов (11,2%); при этом у 7 из 12 детей (58,3%) были выявлены прямые маркеры ЦМВИ. В контрольной группе летальных исходов не было.
Для анализа частоты выявления ЦМВИ в различных органах было исследовано 147 органов от 47 мертворожденных и 252 органа от 88 умерших, умерших на первом году жизни и (таблица 4). Патологоанатомические исследования проводились сотрудниками кафедры патологической анатомии (зав. кафедрой – д.м.н., проф. Талалаев А.Г.).
Таблица 4. Выявление ЦМВ в различных органах у мертворожденных и детей, умерших в течение первого года жизни.
| Изученные органы | Мертворожденные | Дети, умершие на первом году жизни | ||||
| Общее число проб (n) | Число положительных проб, (%) | Р | Общее число проб (n) | Число положительных проб, (%) | ||
| мозг | 41 | 9 (21,9%) | р=0,33 | 61 | 20 (32,8%) | |
| печень | 37 | 7 (18,9%) | р<0,02 | 55 | 25 (45,5%) | |
| легкое | 33 | 5 (15,2%) | р<0,0001 | 48 | 44 (91,6%) | |
| почка | 27 | 7 (25,9%) | р<0,03 | 43 | 24 (55,8%) | |
| сердце | 9 | 1 (11,1%) | р=0,87 | 45 | 9 (20,0%) | |
| Всего | 147 | 29 (19,7%) | р<0,0001 | 252 | 122 (48,4%) | |
При патологоанатомическом исследовании у умерших были выявлены признаки врожденной генерализованной вирусной инфекции, которая проявлялась как различными воспалительными изменениями (менингит, энцефалит, гепатит, миокардит, пневмония и др.), так и фетодиспластическими изменениями и/или с пороками развития органов. Анализ показал, что ЦМВ выявляется практически во всех исследованных органах: легкие, сердце, печень, почки, мозг. При этом в материалах аутопсии обнаружен как ДНК вируса (ПЦР), так и антигены (РНИФ) и инфекционно активный ЦМВ (БКМ).
В целом у умерших на первом году жизни маркеры ЦМВ обнаруживались значительно чаще, чем у мертворожденных (48,4% против 19,7%, р<0,0001). Необходимо отметить, что в группе детей, умерших на первом году жизни, инфекционно активный ЦМВ определялся значительно чаще, чем у мертворожденных (р<0,05).
Если говорить о суммарном выявлении прямых маркеров ЦМВИ хотя бы одним из методов в любом из исследованных органов, то в группе детей, умерших на первом году жизни ЦМВ был обнаружен в 61,5% случаев, в случаях мертворождения - в 35,4% случаев.
Более частое выявление ЦМВ в материалах детей, умерших на первом году жизни, может свидетельствовать о реактивации врожденной инфекции (учитывая положительные результаты быстрого культурального метода, который позволяет выявить инфекционно активный вирус). Но при этом нельзя исключить и факт постнатального инфицирования. Одной из причин этого может быть иммунодефицитное состояние в группе детей высокого риска. Как показало исследование отпечатков тимуса 60 умерших детей, у 48 (80%) были выявлены антигены различных вирусов. При патологоанатомическом исследовании в 8% случаев был поставлен диагноз врожденного неклассифицированного иммунодефицита (в 65,7% случаев на фоне врожденной вирусной инфекции), что позволяет предположить ее участие в развитии иммунодефицита и наоборот: активацию инфекционного процесса на фоне иммунодефицита.
Проведенное вирусологическое исследование отпечатков органов мертворожденных и плацент с использованием сывороток к широкому спектру антигенов показало совпадение частоты выявления одних и тех же возбудителей в 82% случаев. При параллельном исследовании отпечатков органов умерших и клеток осадка мочи их матерей вскоре после мертворождения или смерти ребенка в раннем неонатальном периоде ВПГ и ЦМВ существенно чаще (р<0,002) выявлялись у плодов и умерших в течение первых суток новорожденных, чем в клетках осадка мочи их матерей, что может свидетельствовать об активном инфекционном процессе в организме плода.
При гистологическом исследовании плацент умерших детей то или иное поражение плаценты выявлено в 100% случаев. Наиболее часто выявлялась гипоплазия плаценты (79%), в 51,3% - морфологическая незрелость. Кроме того были выявлено преждевременное старение плаценты, кровоизлияния, тромбоз сосудов, флебит пупочной вены, краевое прикрепление, абсолютно короткая или длинная пуповина, тощая пуповина, хроническая фетоплацентарная недостаточность. В плаценте и пуповине выявлялись различные воспалительные изменения (базальный и париетальный децидуит, интервиллузит, хориоамнионит, фуникулит, мембранит), которые достоверно чаще отмечались в случаях мертворождения (68,6% и 39,4%, р<0,001). При исследовании плацент мертворожденных или умерших новорожденных методом ПЦР ДНК ЦМВ выявлена в 56% случаев, в группе детей без клинических признаков ВУИ ДНК ЦМВ была обнаружена в 3,2% случаев. Воспалительные реакции в плаценте имели как альтеративно-продуктивный, так и гнойный характер, в ряде случаев с некрозом. Обнаружение ЦМВ сопровождалось некротическими и другими изменениями в плаценте.
Выявленные изменения в тканях и органах плодов и умерших детей при патологоанатомическом исследовании в подавляющем большинстве случаев являются следствием ассоциированного (одновременного или последовательного) инфицирования различными возбудителями в разные сроки гестации. При анализе частоты выявления различных патогенов было установлено, что самым частым компонентом смешанной инфекции был один или несколько серовариантов энтеровирусов. В отличие от ВПГ, ЦМВ нам не удалось выявить существенных различий в частоте выявления энтеровирусов у плодов, умерших новорожденных и детей, умерших на первом году жизни. Если учитывать только результаты выявления герпесвирусных инфекций, то смешанная ВПГ и ЦМВ инфекция одновременно у мертворожденных была выявлена в 45,4%, тогда как, у умерших на первом году жизни в 86%. То есть частота смешанной ВПГ и ЦМВ инфекции с увеличением возраста умерших детей существенно возрастает (р=0,001).
Нами был впервые использован метод ПЦР in situ для выявления ЦМВ в отпечатках органов. Метод ПЦР in situ был разработан на основе двух методов – метода полимеразной цепной реакции и метода гибридизации in situ и сочетал в себе их достоинства: высокую чувствительность с возможностью морфологического исследования. Сравнительный анализ эффективности различных лабораторных методов показал, что метод ПЦР in situ обладает не меньшей чувствительностью по сравнению с классическим методом ПЦР. Анализ количества инфицированных клеток в препаратах методом ПЦР in situ показал, что наиболее интенсивно накопление ДНК ЦМВ происходит в тканях мозга и почек.
Суммируя полученные данные можно заключить:
- для повышения эффективности диагностики врожденной ЦМВИ и прогноза ее развития у недоношенных новорожденных детей необходимо использовать комплекс методов, в том числе определение авидности анти-ЦМВ;
- при вирусологическом обследовании недоношенных детей с признаками ВУИ недостаточно однократного изучения клинических материалов на первой неделе жизни. У большинства новорожденных ЦМВ элиминировал к 1-3 мес. жизни, тогда как у некоторых детей вирусы впервые обнаруживался лишь через 1-3 мес. после рождения, еще у части других детей - в возрасте 4-7 мес.
- предпочтительным объектом скринингового исследования для диагностики внутриутробной ЦМВИ является моча, в которой вирус накапливается чаще всего и в больших количествах, чем в других клинических материалах;
- выявление высокоавидных анти-ЦМВ IgG антител имеет положительное прогностическое значение, так как у большинства обследованных детей в динамике оно сопровождалось отсутствием выявления прямых маркеров ЦМВ. Напротив, отсутствие анти-ЦМВ антител или присутствие низкоавидных антител к ЦМВ имеют отрицательное прогностическое значение, так как ассоциируются с появлением маркеров ЦМВ через 1-6 месяцев после рождения;
- герпесвирусные инфекции, также как и инфекции иной этиологии, играют существенную роль в перинатальной патологии, а также в смерти плода и новорожденного;
- метод ПЦР in situ обладает не меньшей чувствительностью по сравнению с классическим методом ПЦР и позволяет оценить не только интенсивность синтеза вирусной ДНК, но также выявить индивидуальную внутритканевую и внутриклеточную локализацию вирусов.
С учетом вышеизложенного, предлагается следующий алгоритм лабораторного обследования недоношенных новорожденных детей с клиническими признаками ВУИ и материала аутопсии плодов и умерших детей:
- анализ мочи на 1-й неделе жизни (до 3 недель жизни) методом БКМ для выявления внутриутробной ЦМВИ;
- исследование клинических материалов в динамике через 1, 3 и 6-7 месяцев после рождения для установления возможной реактивации ЦМВИ и развития инфекции у недоношенных новорожденных детей с ВУИ;
- определение активности и авидности специфических антител класса IgG в совокупности с определением прямых маркеров ЦМВ для оценки риска развития активного инфекционного процесса у новорожденных детей;
- при обнаружении ЦМВ в клинических материалах БКМ в количествах, превышающих по инфекционной активности 10-50 и более вирусных частиц в 1 мл, оценивать необходимость использования терапевтических средств;
- использование молекулярно-биологических методов, основанных на выявлении ДНК (ПЦР и ПЦР in situ) для установления этиологического агента и изучения патогенеза ЦМВИ в материалах аутопсии.
В 76,5% случаев у недоношенных детей с подозрением на ВУИ был подтвержден диагноз на первой неделе жизни. При этом ВУИ вирусной этиологии встречалась значительно чаще, чем бактериальной (34,6% против 18,5%). У недоношенных новорожденных детей с клиническими признаками ВУИ показатели индуцированной продукции альфа-ИФН и гамма–ИФН значительно варьировали и потому особый интерес представлял вопрос о влиянии лечения Вифероном на интерфероновый статус недоношенных новорожденных детей с признаками ВУИ при рождении.
Анализ уровней ИФН-альфа и ИФН-гамма до лечения и через 1 – 2 месяца после лечения был проведен при обследовании 30 детей. Было установлено, что количества сывороточного и спонтанного альфа-ИФН были низкими и не различались до и после лечения (медианы 5 пкг/мл).
В связи с высокой вариабельностью значений индуцированного альфа-ИФН дети данной группы были разделены на 2 подгруппы: в подгруппу 1А (n=13) вошли дети с высоким исходным уровнем (>100 пкг/мл) индуцированного альфа-ИНФ, в подгруппу 1Б (n=17) – с низким уровнем цитокина (<100 пкг/мл) до лечения.
РИС. 3. Изменение уровня индуцированного альфа-ИФН у новорожденных детей с клиническими признаками ВУИ в результате базового лечения с применением Виферона.
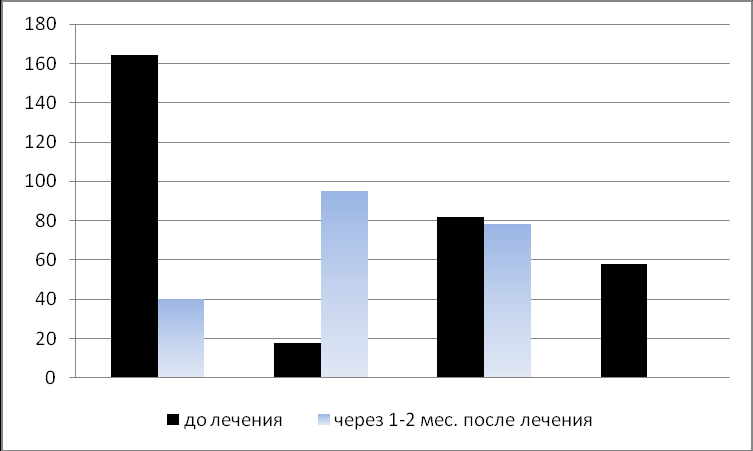
Подгруппа 1А Подгруппа 1Б Подгруппа 1В Контроль
По вертикали – значения медианы альфа-ИФН, пкг/мл; По горизонтали – недоношенные новорожденные дети с ВУИ: подгруппа А – дети с исходно высоким уровнем альфа-ИФН, получавшие базовое лечение с Вифероном; подгруппа Б – дети с исходно низким уровнем альфа-ИФН, получавшие базовое лечение с Вифероном; подгруппа В – дети, получавшие базовое лечение без Виферона; контроль – здоровые доношенные дети.
Количественный анализ альфа-ИНФ показал, что в подгруппе 1А в результате базового лечения с применением Виферона уровень альфа-ИНФ снижался в 4 раза. В подгруппе 1Б, напротив, выявлено увеличение уровня индуцированного альфа-ИНФ, который приближался к уровню в контрольной группе. У детей без виферона уровни альфа–ИНФ фактически не изменялись. Это свидетельствует об иммунокорригирующем действии Виферона. Оно проявлялось в разнонаправленном изменении уровней индуцированной продукции альфа-ИФН лейкоцитами недоношенных детей из обеих подгрупп группы детей с ВУИ.
Результаты повторного вирусологического обследования детей представлены в таблице №5.
Таблица 5. Результаты повторного исследования биологических сред у детей методом БКМ на ЦМВ и ВПГ.
| | Базисная терапия + Виферон | Базисная терапия |
| Элиминация вирусов | 38,5% | 23,1% |
| Снижение кол-ва ЦМВ и ВПГ | 30,8% | - |
| Прежнее кол-во ЦМВ и ВПГ | 30,7% | 76,9% |
| Положительная динамика | 69,3% | 23,1% |
