На правах рукописи
| Вид материала | Автореферат |
- Печатная или на правах рукописи, 21.09kb.
- Удк 796/799: 378 , 770.24kb.
- На правах рукописи, 399.58kb.
- На правах рукописи, 726.26kb.
- На правах рукописи, 1025.8kb.
- На правах рукописи, 321.8kb.
- На правах рукописи, 552.92kb.
- На правах рукописи, 514.74kb.
- На правах рукописи, 670.06kb.
- На правах рукописи, 637.26kb.
На правах рукописи
КОРСАКОВ
Михаил Константинович
Синтез и функционализация производных изоксазола
Специальность 02.00.03 – Органическая химия
А В Т О Р Е Ф Е Р А Т
диссертации на соискание ученой степени
кандидата химических наук
Иваново
2006
Работа выполнена на кафедре органической химии Ярославского
государственного педагогического университета имени К.Д. Ушинского
Научный руководитель: доктор химических наук, профессор
Дорогов Михаил Владимирович
Официальные оппоненты: доктор химических наук, профессор
Плахтинский Владимир Владимирович
доктор химических наук
Стужин Павел Анатольевич
Ведущая организация: Российский университет дружбы народов
Защита состоится « 13 » ноября 2006 года в 10 часов на заседании диссертационного совета Д 212.063.01 в ГОУ ВПО «Ивановский государственный химико-технологический университет»
по адресу: 153000, г. Иваново, пр. Ф. Энгельса, д. 7.
С диссертацией можно ознакомиться в библиотеке Ивановского
государственного химико-технологического университета
Автореферат разослан «_9_»__октября__ 2006 г.
Ученый секретарь
д
 иссертационного совета
иссертационного совета доктор химических наук,
профессор Хелевина Ольга Григорьевна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. В настоящее время проблема создания современной отечественной химико-фармацевтической индустрии выдвигается в ряд важнейших элементов национальной безопасности, а разработка эффективных методов синтеза биологически активных соединений рассматривается как один из ключевых этапов в развитии базовых технологий этой индустрии. В связи с этим, в области органической химии проводится все больше целенаправленных исследований, связанных с изучением методов синтеза и функционализации оригинальных гетероциклических соединений, обладающих потенциальными практически значимыми биологическими свойствами и являющихся перспективными кандидатами для создания лекарственных препаратов различного назначения. Использование гетероциклических соединений в этих исследованиях имеет перспективу по целому ряду причин, таких как огромное количество возможностей структурного разнообразия этих веществ, высокую статистическую вероятность проявления их мишень-специфичной активности, прогнозируемые низкие токсические эффекты. В частности, производные изоксазола с каждым годом находят всё более широкое применение в качестве объектов для фармакологических исследований и, как результат, в качестве коммерчески доступных лекарственных препаратов, таких как, сульфизоксазол (противовоспалительное средство), валдекоксиб (анальгетик), эдонентан (препарат для лечения гипертонии и сердечно-сосудистых заболеваний), изокарбоксазид (психотерапия), циклосерин (противотуберкулёзный антибиотик), лефлюномид (лекарство для лечения ревматизма) и т.д.
Данная работа является частью научных исследований, проводимых на кафедре органической химии Ярославского государственного педагогического университета имени К.Д. Ушинского в рамках договоров о научно-исследовательской работе с химической компанией “Chemical Diversity Inc.”, Сан-Диего, США (2003-2004 гг.), и с ООО “Исследовательский Институт Химического Разнообразия”, г. Долгопрудный, Московской обл. (2004-2006 гг.) в соответствии с программой «Биоскрининг активных веществ для создания готовых лекарственных форм и средств защиты растений на базе ООО “Исследовательский институт химического разнообразия”», включённой в Федеральную целевую программу Министерства образования и науки РФ «Исследования и разработки по приоритетным направлениям развития науки и техники (2002-2006 годы) ».
Цель работы. Разработка методов синтеза новых гетероциклических соединений – производных изоксазола, отличающихся большим химическим разнообразием молекулярных фрагментов и рассматривающихся в качестве объектов для дальнейших биомедицинских испытаний. Для достижения этой цели в работе решались следующие задачи:
- разработка методов получения новых производных 3,5-диметилизоксазола путём его функционализации и последующих превращений сульфо- и нитропроизводных.
- разработка методов получения новых двуядерных соединений, содержащих изоксазольный цикл, их функционализация и превращения.
Научная новизна. Получение неизвестных ранее 3-метил-4-сульфамоил- (или -4-нитро)-5-винилизоксазолов конденсацией соответствующих 4-сульфамоил (или 4-нитро) производных 3,5-диметилизоксазола с ароматическими и гетероциклическими альдегидами и диметоксиметил-диметиламином. Установление факта метилирования N-монозамещенных сульфамоильных фрагментов до соответствующих N,N-дизамещенных сульфамидов в процессе реакции конденсации диметилизоксазолов с диметоксиметил-диметиламином и факта переаминирования диметиламиновинильного фрагмента в 3-метил-4-сульфамиол-5-аминовинил-замещенных изоксазолах активными аминами.
Разработка подходов к синтезу и последующим превращениям новых двуядерных соединений, содержащих изоксазольный цикл, конкретно 5-арилизоксазолов, 5-гетерилизоксазолов, 4-арилизоксазолов, 3-гетерилизоксазолов. Сульфофункционализация данных соединений с установлением точного положения сульфогруппы в случаях селективного сульфохлорирования и с установлением строения и соотношения изомерных продуктов в случаях неселективного сульфохлорирования.
Практическая значимость работы. В результате проведенных исследований разработаны новые мультистадийные схемы синтеза широкого круга не описанных ранее потенциально биолологически активных соединений, характерной особенностью которых является наличие изоксазольного цикла, связанного с большим количеством структурно разнообразных фрагментов.
Апробация работы и публикации. По материалам диссертации опубликованы 4 научные статьи и 4 тезисов докладов научных конференций. Результаты работы были доложены на VII научной школе-конференции по органической химии, Екатеринбург, июнь 2004 г., на X Всероссийской научной конференции “Карбонильные соединения в синтезе гетероциклов”, Саратов, 20-24 сентября 2004 г., на XLI Всероссийской конференции по проблемам математики, информатики, физики и химии, Москва, 18-22 апреля 2005.г., на Международной конференции по химии гетероциклических соединений, посвященной 90-летию со дня рождения профессора А.Н. Коста, Москва, 17-21 октября 2005 г., на 60-ой Международной конференции “Чтения Ушинского”, Ярославль, 2-3 марта 2006 г., на XLII Всероссийской конференции по проблемам математики, информатики, физики и химии, Москва, 17-21 апреля 2006 г.
Положения, выносимые на защиту.
Синтез 4-сульфо- и 4-нитропроизводных 3,5-диметилизоксазола и способность данных соединений к превращениям до соответствующих 5-винилизоксазолов, содержащих разнообразные заместители при винильном фрагменте.
Использование различных синтетических подходов для получения 5-арилизоксазолов и 5-гетерилизоксазолов и реализации возможностей структурного разнообразия данных соединений.
Исследования в одном из наименее изученных направлений химии изоксазолов - получение и функционализация 4-арилзамещенных изоксазолов.
Синтез 3-гетерилизоксазолов на основе реакции циклоприсоединения гидроксиламина к 1,3-дикарбонильному субстрату и особенности сульфофункционализации данных соединений.
Структура работы. Диссертация состоит из введения, литературного обзора, химической и экспериментальной частей, выводов и списка использованной литературы. Работа изложена на 142 страницах, включает 76 схем, 15 рисунков и 4 таблицы. Список литературы включает 73 источника.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1. Функционализация 3,5-диметилизоксазола и новые направления превращений его сульфо- и нитропроизводных
Известно, что значительный недостаток электронной плотности в изоксазоле препятствует его функционализации посредством реакции электрофильного замещения. Однако наличие двух метильных групп в молекуле 3,5-диметилизоксазола увеличивает электронную плотность кольца и способствует сульфо- и нитрофункционализации данной гетероциклической системы.
1.1 Сульфамидные производные 3,5-диметилизоксазола
Установлено, что 3,5-диметилизоксазол-4-сульфонилхлорид 2, полученный по известной методике нагреванием 1,3-диметилизоксазола 1 в избытке хлорсульфоновой кислоты при температуре 130 ºC, активно взаимодействует с различными аминами (HNR1R2), в частности, с 3а-г в ацетонитриле при 60 ºC в течении 3 ч с образованием соответствующих сульфамидов 4а-г с выходом 67-95 % (схема 1).
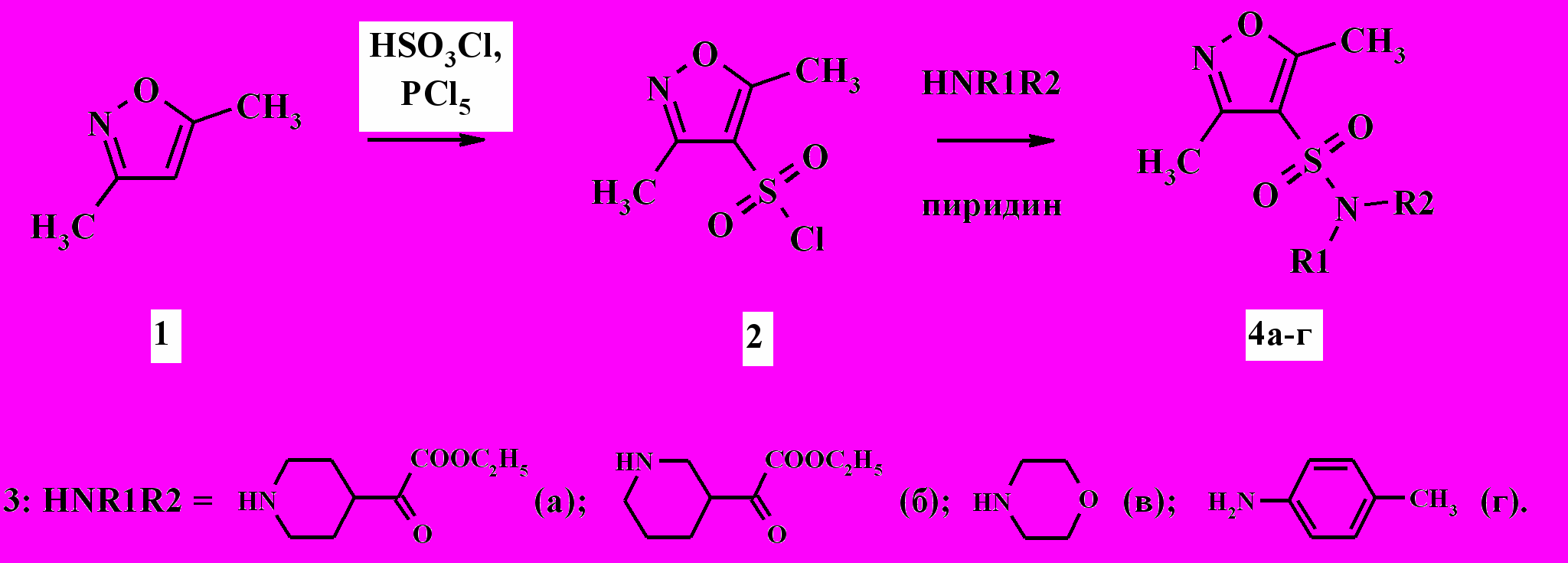
Схема 1
Щелочной гидролиз сульфамидов 4а,б в присутствии каталитических количеств этанола приводит к образованию кислот 5а,б, которые в реакции с первичными и вторичными аминами различного строения HNR1R2 в присутствии 1,1-карбонилдиимидазола (КДИ) были превращены в соответствующие амиды 6а,б с выходом 45-80 % (схема 2).
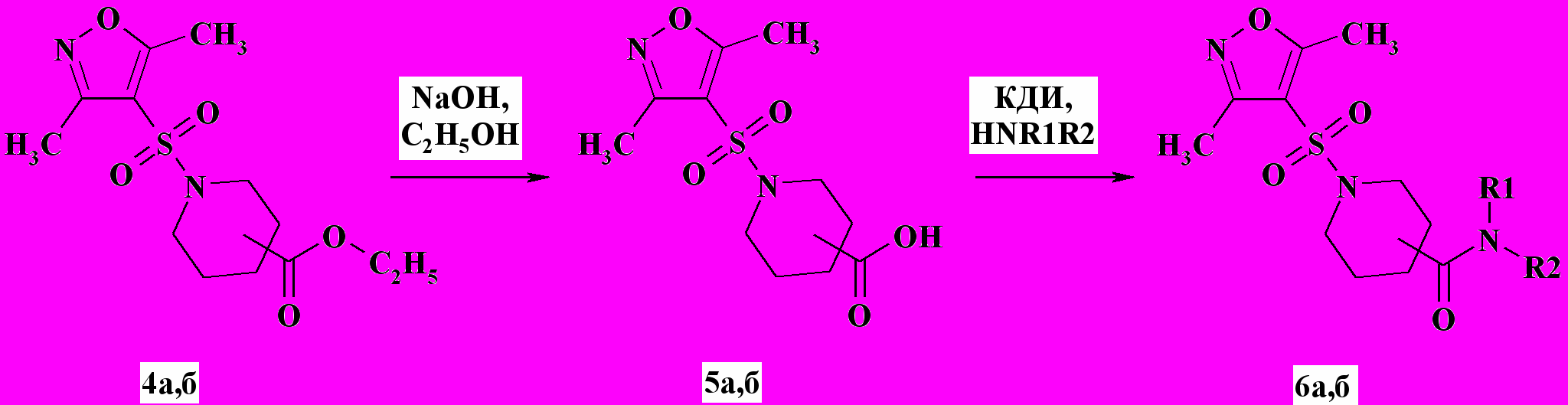
Схема 2
1.2 Сульфамидные производные 3-метил-5-аминовинил замещенных изоксазолов
Установлено, что электроноакцепторные сульфамидные заместители в положении 4- изоксазольного цикла активируют метильную группу в реакциях конденсации с активными карбонильными соединениями, например с диметоксиметил-диметиламином, с получением соответствующих аминовинил производных 7а-в с выходом 76-88 %. Дополнительными опытами, проводившимися в аналогичных условиях, установлено, что диметоксиметил-диметиламин не взаимодействует с несульфированным 1. При длительном кипячении соединений 7 в ДМФА с аминами, например морфолином, были синтезированы продукты переаминирования 8а-в с выходом 40-72 %. Установлено, что реакция протекает обратимо, поэтому для полного переаминирования необходим трехкратный избыток амина-реагента (схема 3).
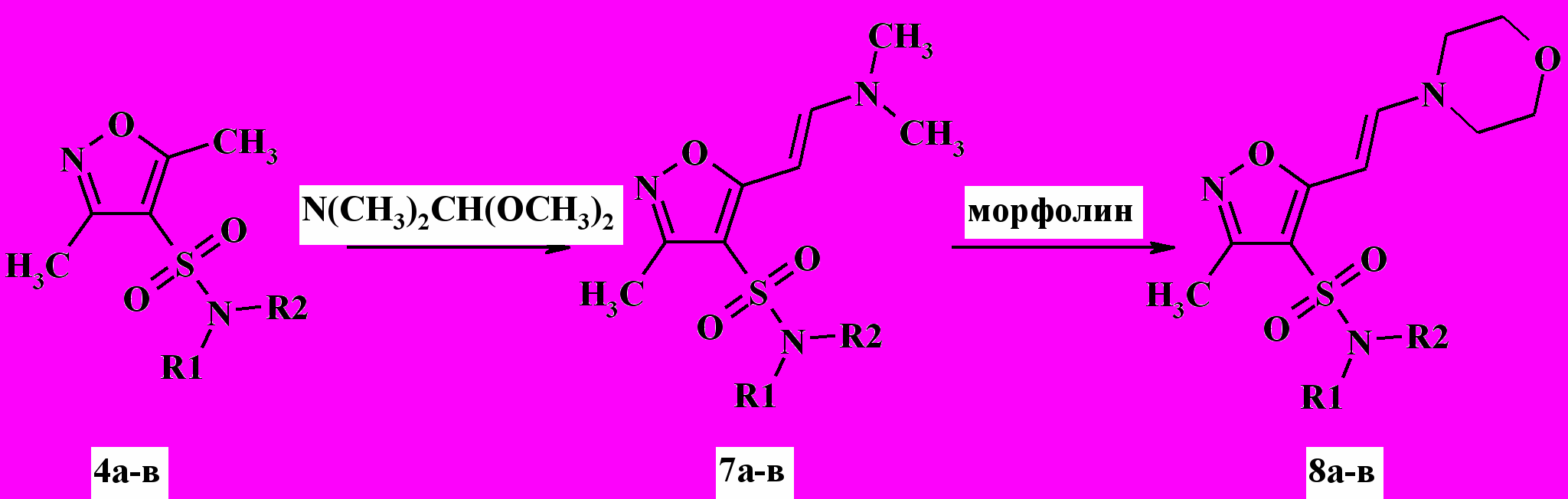
Схема 3
Совокупностью данных совмещенной жидкостной хроматографии – масс-спектрометрии (ЖХ-МС) и 1Н ЯМР-спектроскопии установлено, что конденсация протекает региоселективно и стереоселективно. Образование исключительно 5-аминовинил производных 7, находящихся в транс-форме, было доказано методом рентгено-структурного анализа (РСА). Причина региоселективности протекания реакции заключается в преимущественном протекании реакции в направлении образования промежуточного 5-карбаниона. Результаты расчета энергии локализации методом АМ1 свидетельствуют о значительно большей стабильности 5-карбаниона по сравнению с изомерным 3-карбанионом.
Установлено, что в случае использования в реакции N-замещенных сульфамидов 4, например производного п-толиламина 3г, конденсация сопровождалась метилированием азота сульфамидного фрагмента (схема 4).
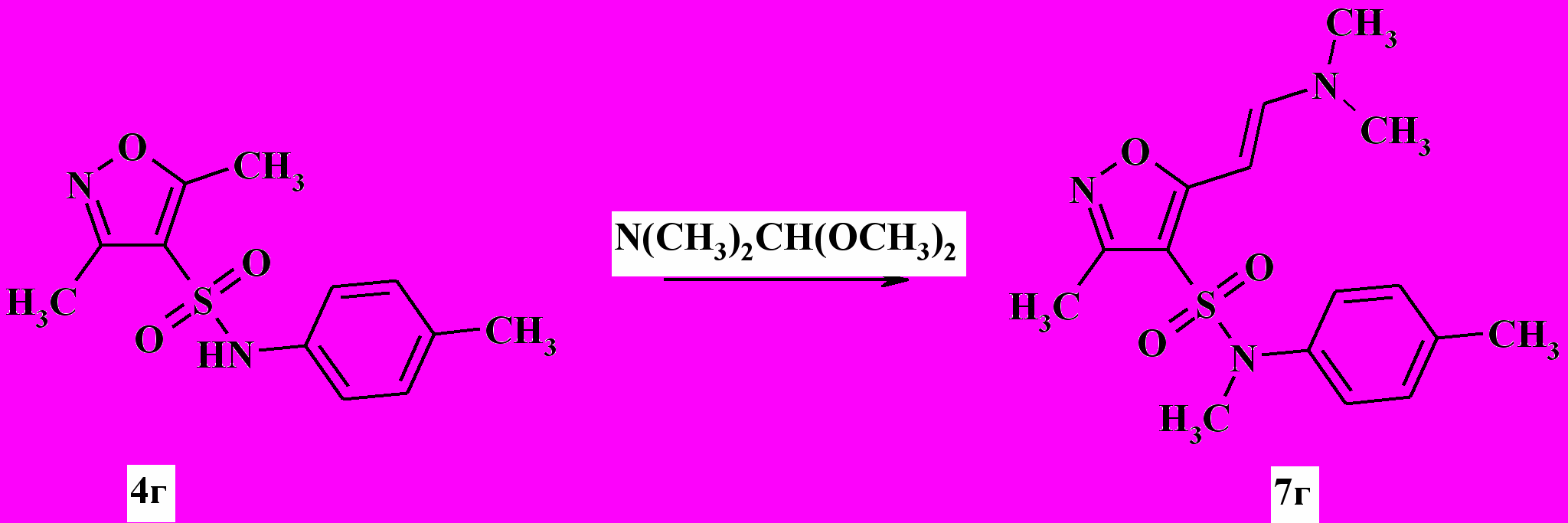
Схема 4
1.3 Сульфамидные производные 3-метил-5-винил замещенных изоксазолов
В другом синтетическом направлении мы использовали способность 5-метильной группы соединения 4а к конденсации с ароматическими и гетероциклическими альдегидами. Реакции проводили в водно-спиртовом растворе гидроксида калия при 60 °C в течение 30 мин. В этих условиях конденсация сопровождалась щелочным гидролизом сложноэфирной группы, приводя к образованию кислот 9а-в (схема 5). Региоселективность конденсации доказана совокупностью данных 1Н ЯМР-спектроскопии и ЖХ-МС. В реакции с морфолином в присутствии КДИ из кислот 9а-в были получены соответствующие карбоксамиды 10а-в с выходом 68-87 %. Строение описанных соединений доказано данными 1H ЯМР-спектроскопии.
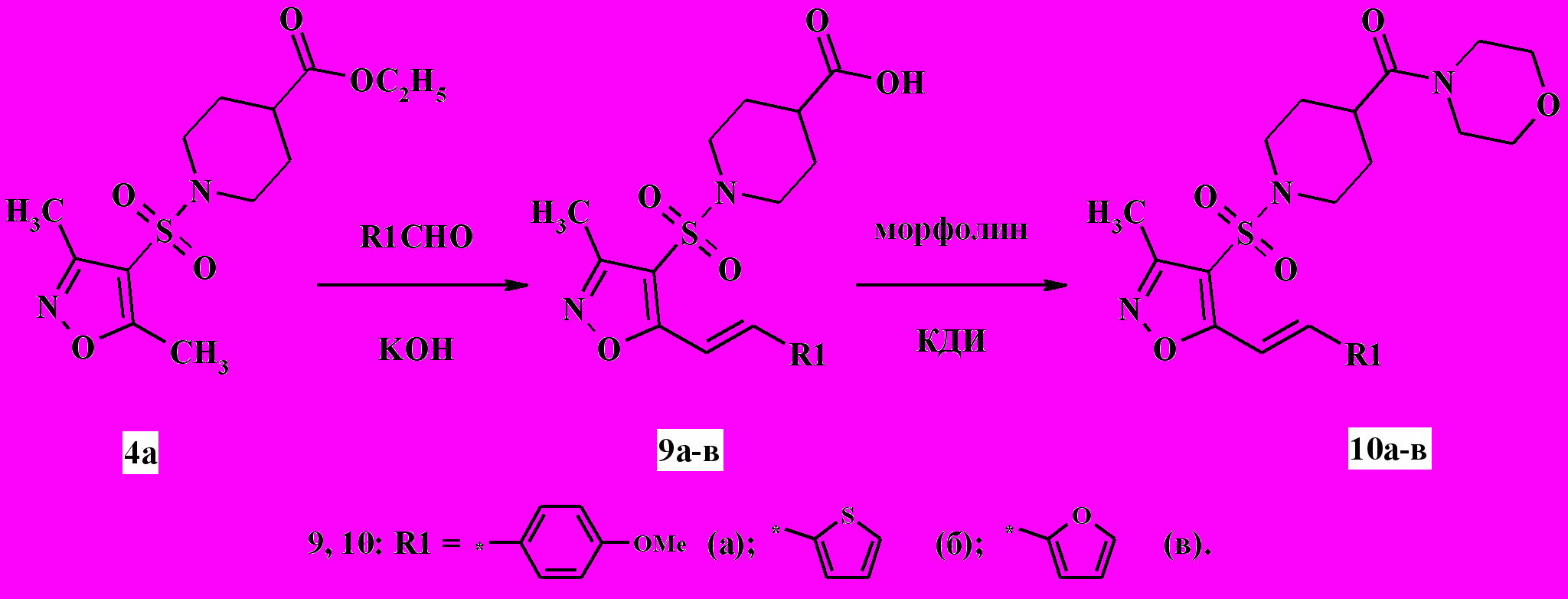
Схема 5
1.4 Сульфамидные производные 3-метил-4-нитро-5-винилизоксазолов
При нагревании 3,5-диметилизоксазола 1 до 130 °C в смеси концентрированных азотной и серной кислот синтезирован 3,5-диметил-4-нитроизоксазол 11. Аналогично сульфамидам 4, он активно конденсируется с ароматическими альдегидами с образованием соответствующих 5-винилизоксазолов 12а-в (схема 6).

Схема 6
Отмечено, что реакция конденсации альдегидов с 4-нитропроизводным изоксазола 11 протекает значительно быстрее и в более мягких условиях, чем с 4-сульфамидным производными 4. Образование продуктов конденсации 12а-в происходило при 25 °C в присутствии пирролидина в этаноле за 1 мин. Это объясняется тем, что электроакцепторное влияние нитрогруппы сильнее, чем сульфамидной группы. По данным 1Н ЯМР-спектроскопии и ЖХ-МС реакция протекает региоселективно и стереоселективно.
При нагревании соединений 12а-в в смеси хлорсульфоновой кислоты и пятихлористого фосфора были получены соответствующие бензол- и тиофенсульфохлориды 13а-в, которые затем путем реакции сульфамидирования с морфолином в присутствии пиридина были превращены в соответствующие сульфамиды 14а-в. Во всех трех случаях сульфохлорирование протекает региоселективно, без образования других возможных изомеров. Строение полученных соединений подтверждено данными 1Н ЯМР-спектроскопии и ЖХ-МС.
2. Синтез двуядерных соединений, содержащих изоксазольный цикл, их функционализация и превращения
В ряде публикаций последних лет показана высокая биологическая активность двуядерных соединений, содержащих изоксазольный цикл, связанный посредством С-С связи с другим арильным или гетероциклическим фрагментом. Это обстоятельство и обуславливает интерес к поиску новых путей синтеза таких систем.
2.1 Замещенные 5-арил- и 5-гетерилизоксазолы
Известно два основных метода синтеза изоксазольного цикла: путем присоединения гидроксиламина к диэлектрофильным субстратам и путем 1,3-циклоприсоединения нитрил N-оксидов к непредельным субстратам. В нашей работе мы использовали реакцию циклоприсоединения гидроксиламина к 1,3-дикетонам, полученным конденсацией Кляйзена, что позволяет синтезировать двуядерные соединения, содержащие изоксазольный цикл (5-арил- и 5-гетерилизоксазолы).
Взаимодействие этилацетата 16 с рядом ацетил производных бензола, тиофена и фурана 15а-з в гексане (или в смеси гексана и диоксана) под действием гидрида натрия и небольшого количества этанола (для инициирования реакции) приводит к образованию соответствующих натриевых производных 1,3-дикетонов 17а-з (схема 7). Под действием уксусной кислотой на соединения 17 были получены соответствующие 1,3-дикетоны, представляющие собой, по данным 1Н ЯМР-спектроскопии, смесь енольной 18 и кетонной 19 формы. Суммарный выход соединений 18/19 (в расчете на исходный кетон) составлял более 50 %, за исключением производных фурана 18/19з, выход которых составил 6 %. При кипячении соединений 17б-г с йодметаном в диоксане течение 6 ч происходит метилирование положения 2- в результате эффекта переноса реакционного центра, приводящее к образованию 2-метил-1,3-дикетонов 20а-в. В итоге, при кипячении всех полученных 1,3-дикетонов 18/19 и 20 с солянокислым гидроксиламином в спирте в присутствии пиридина, происходит региоселективная циклоконденсация с образованием 5-арил- и 5-гетерилизоксазолов 21а-л. Образования других возможных региоизомеров, по данным 1Н ЯМР-спектроскопии и ЖХ-МС, не происходит.
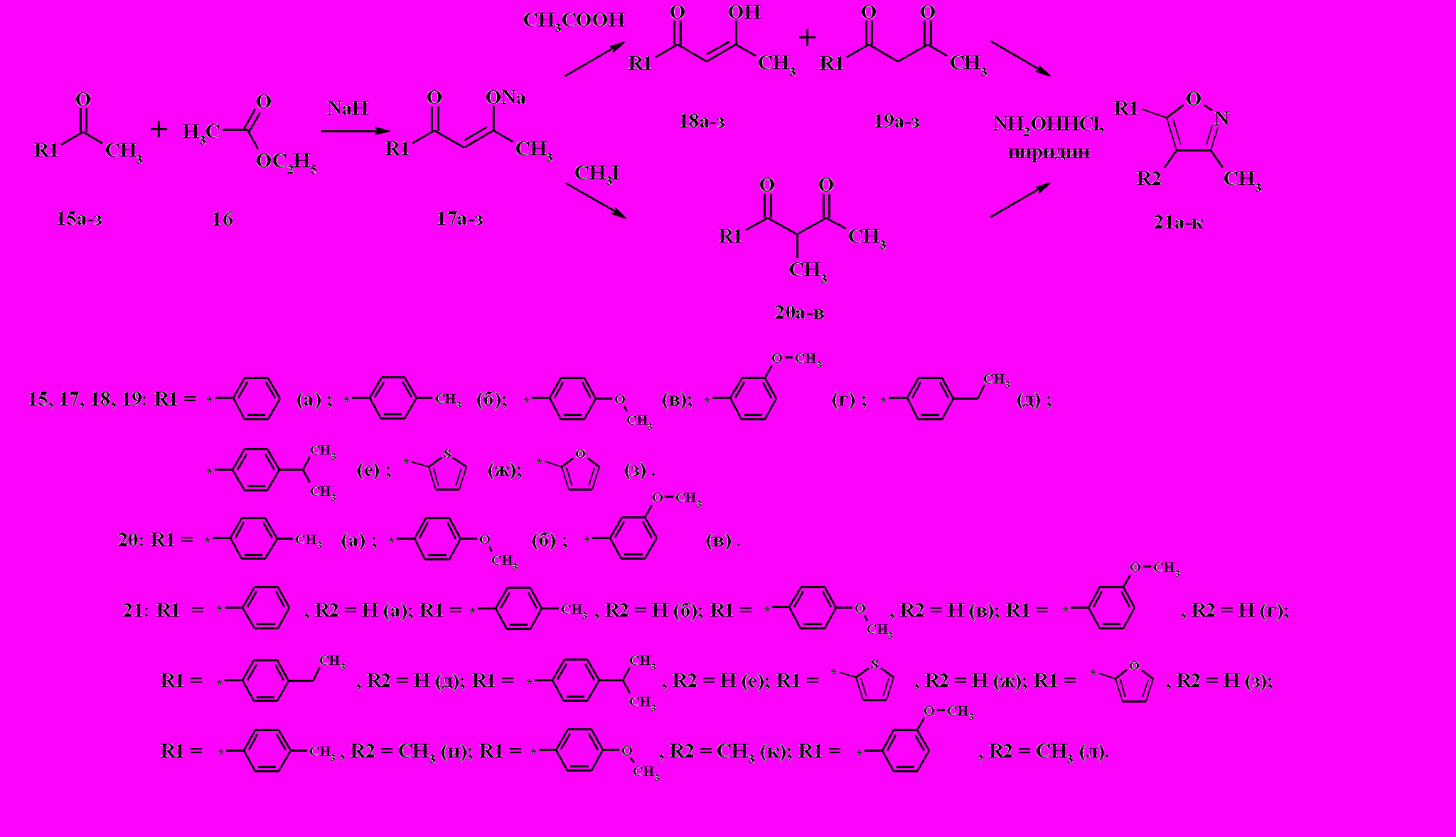 Схема 7
Схема 7Что касается 5-фуранизоксазолов, то более высокие выходы этих соединений (до 70 %) были получены при альтернативной конденсации этилового эфира фуран-2-карбоновой кислоты 22 с ацетоном 23 (схема 8, соединения 21з,м).
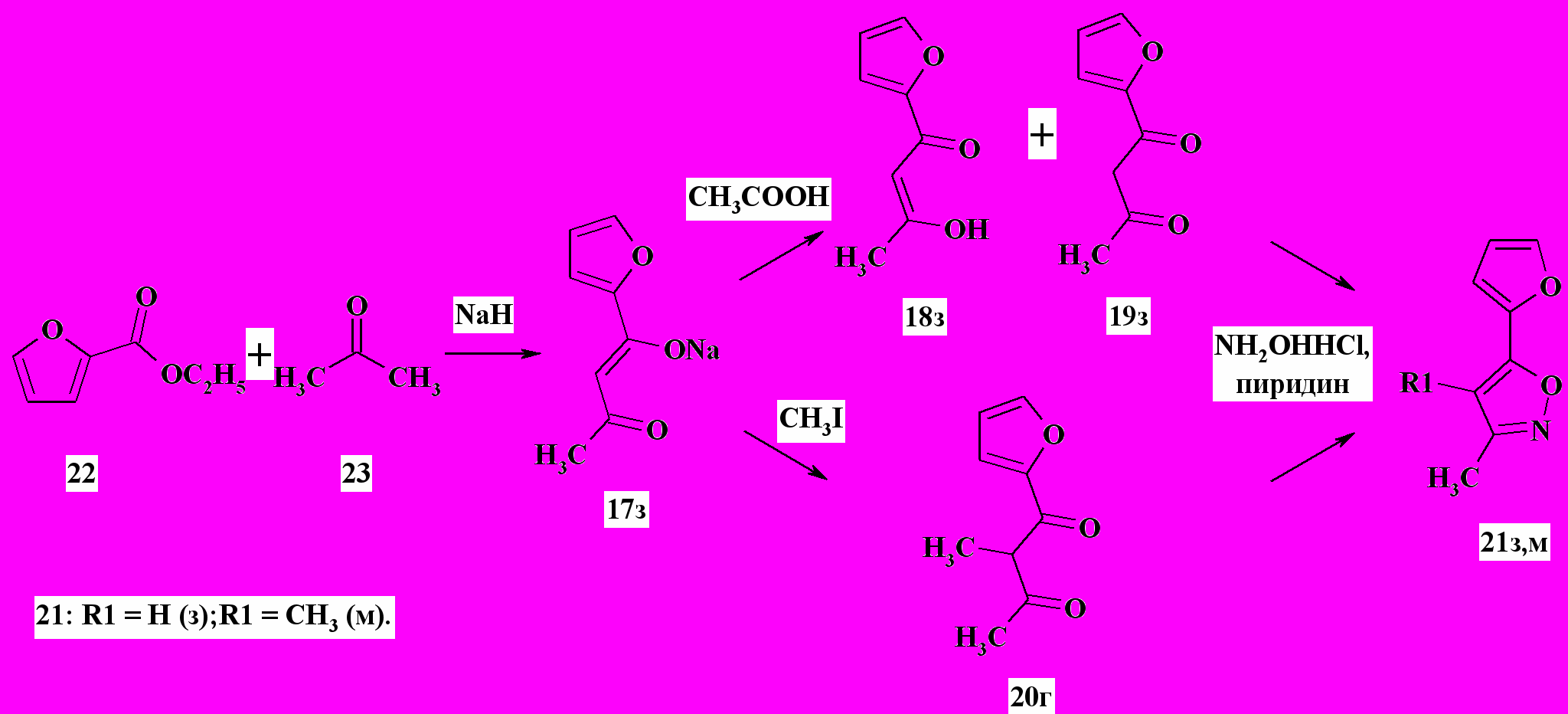
Схема 8
При взаимодействии ацетилпроизводных бензола, тиофена и пиридина 15в,ж,и-л с диэтилоксалатом были получены соответствующие натриевые производные дикетонов 25а-д, которые легко преобразовывались in situ до карбонильных соединений 26а,б под действием уксусной кислоты (схема 9). Попытка получить из них one pot методом (кипячение образующихся карбонильных соединений с солянокислым гидроксиламином в этаноле в течение 3 ч) соответствующие изоксазолы дала положительный результат только для 5-арил и 5-тиенил производных 27а,б. Было обнаружено, что использование производных пиридина 25в-д не приводят к изоксазолам даже при длительном кипячении 26в-д в этаноле (более 10 ч). Установлено, что производные пиридина региоселективно трансформируются в оксимы 28а-в и лишь при кипячении последних в избытке хлорокиси фосфора в течение 1 ч происходит дегидратация, сопровождающаяся циклизацией в целевые 5-пиридинилизоксазолы 27в-д с выходом 80 %. Строение образующихся соединений 25-28 устанавливалось методами 1Н ЯМР-спектроскопии и ЖХ-МС.
Двуядерные соединения, имеющие в своём составе изоксазольный цикл и ароматическое ядро, использовались для получения соответствующих сульфопроизводных. Действием 10-кратного избытка хлорсульфоновой кислоты и 20 %-ного избытка пятихлористого фосфора на соединения 21а-м и 27а,б были получены соответствующие сульфохлориды. Пятихлористый фосфор использовали для смещения равновесия в реакции образования сульфохлорида из сульфокислоты. Полученные сульфохлориды активно взаимодействуют с аминами с образованием соответствующих сульфамидов с выходом более 60 %.
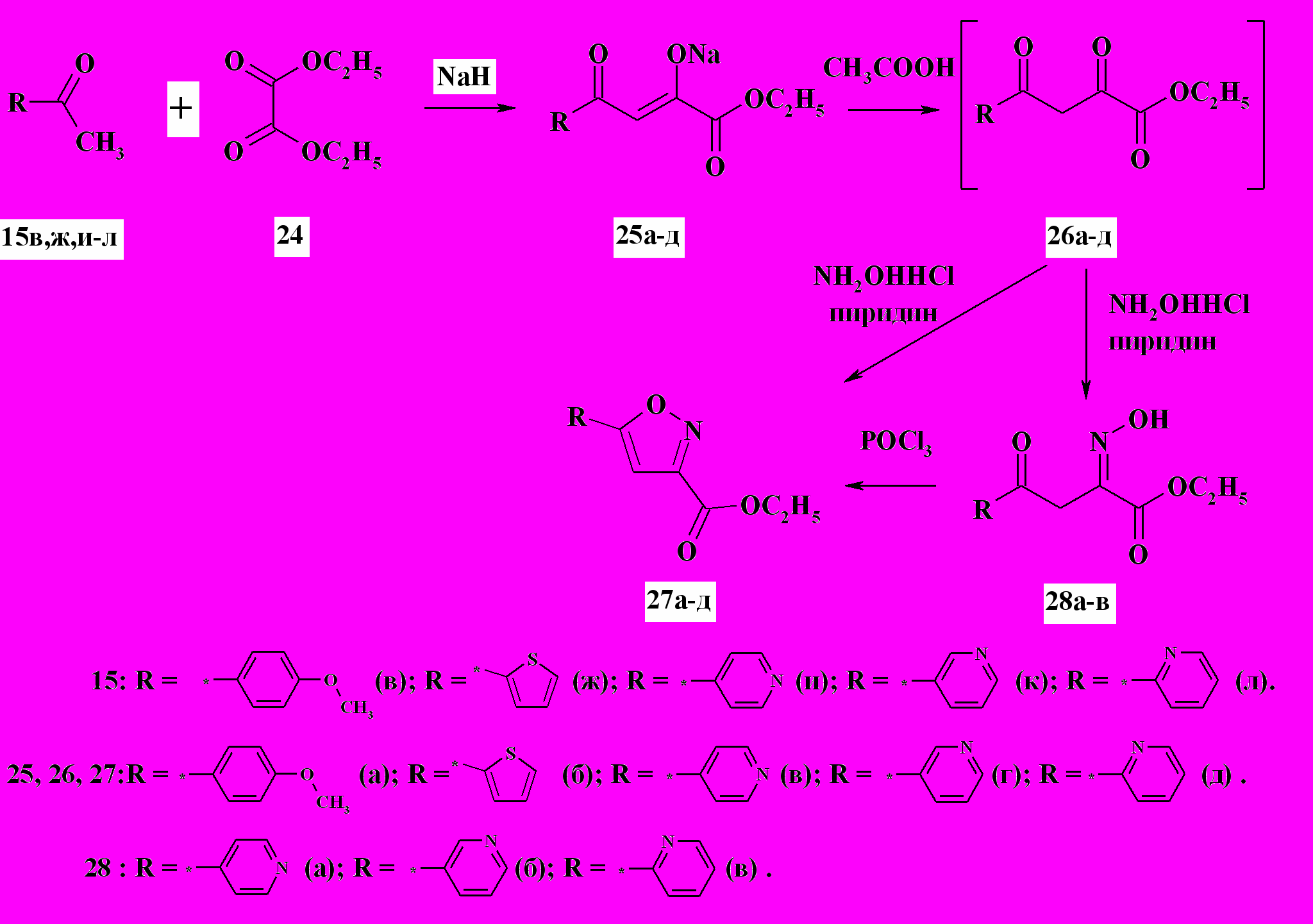
Схема 9
При сульфохлорировании 3-метил-5-фенилизоксазола 21а была получена смесь 4- и 3- сульфохлоридов 29 и 30 в соотношении 40:60 (% моль) соответственно с общим выходом 90 % (схема 10). Установлено, что изменение температурного режима реакции и соотношения исходных реагентов не влияет на соотношение изомеров. Не удалось разделить изомерные сульфохлориды хроматографически, однако дробной кристаллизацией из этанола удалось разделить полученные на их основе сульфамиды 31 и 32.
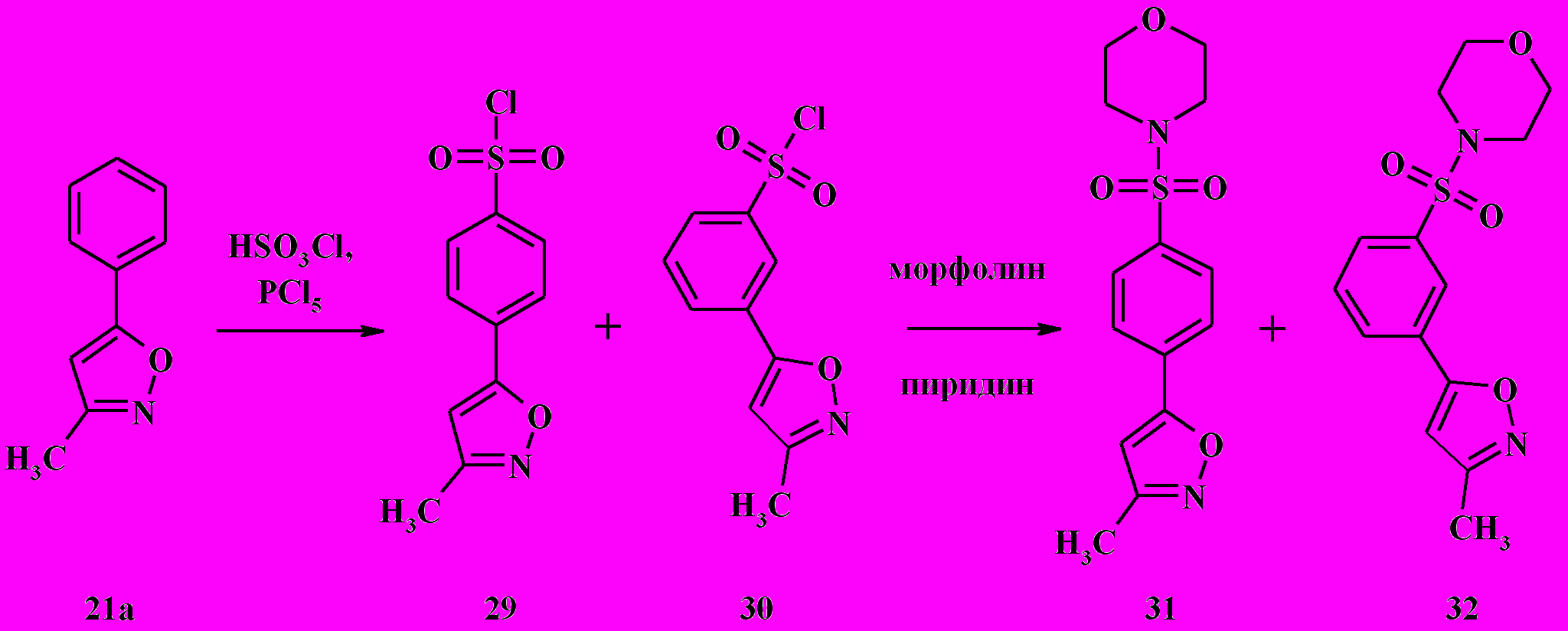
Схема 10
При сульфохлорировании ряда 4/-замещенных 3-метил-5-арилизоксазолов 21б,в,д,е и 3,4-диметил-5-арилизоксазолов 21и,к, а также этилового эфира 5-(4-метокси-фенил)-изоксазол-3-карбоновой кислоты 27а происходит региоселективное образование сульфохлоридов 33а-ж с выходом 65-85 % (схема 11). Реакция получения 33а,б,д-ж проходила при 60 ºC в течение 2 ч, а соединения 33в,г образовывались при 90 ºC в течение 4 ч, что вероятно связано со стерическими затруднениями, вызванными этильным и изо-пропильным заместителем в 4/-положении. Соответствующие сульфамиды 34а-ж были получены из сульфохлоридов 33а-ж. Строение соединений доказано совокупностью методов 1Н ЯМР-спектроскопии и ЖХ-МС.

Схема 11
При сульфохлорировании метилзамещенного изоксазола 21г в течение 2 ч при 60 ºC была получена смесь изомерных сульфохлоридов 35а и 36а в соотношении 40:60 (% моль) соответственно, которые удалось эффективно разделить методом жидкостной хроматографии (схема 12). Строение синтезированных на их основе сульфамидов 37а и 38а было однозначно доказано корреляционной 1Н-1Н спектроскопией методом NOESY. Взаимодействия, обусловленные ядерными эффектами Оверхаузера, представлены на рисунке.
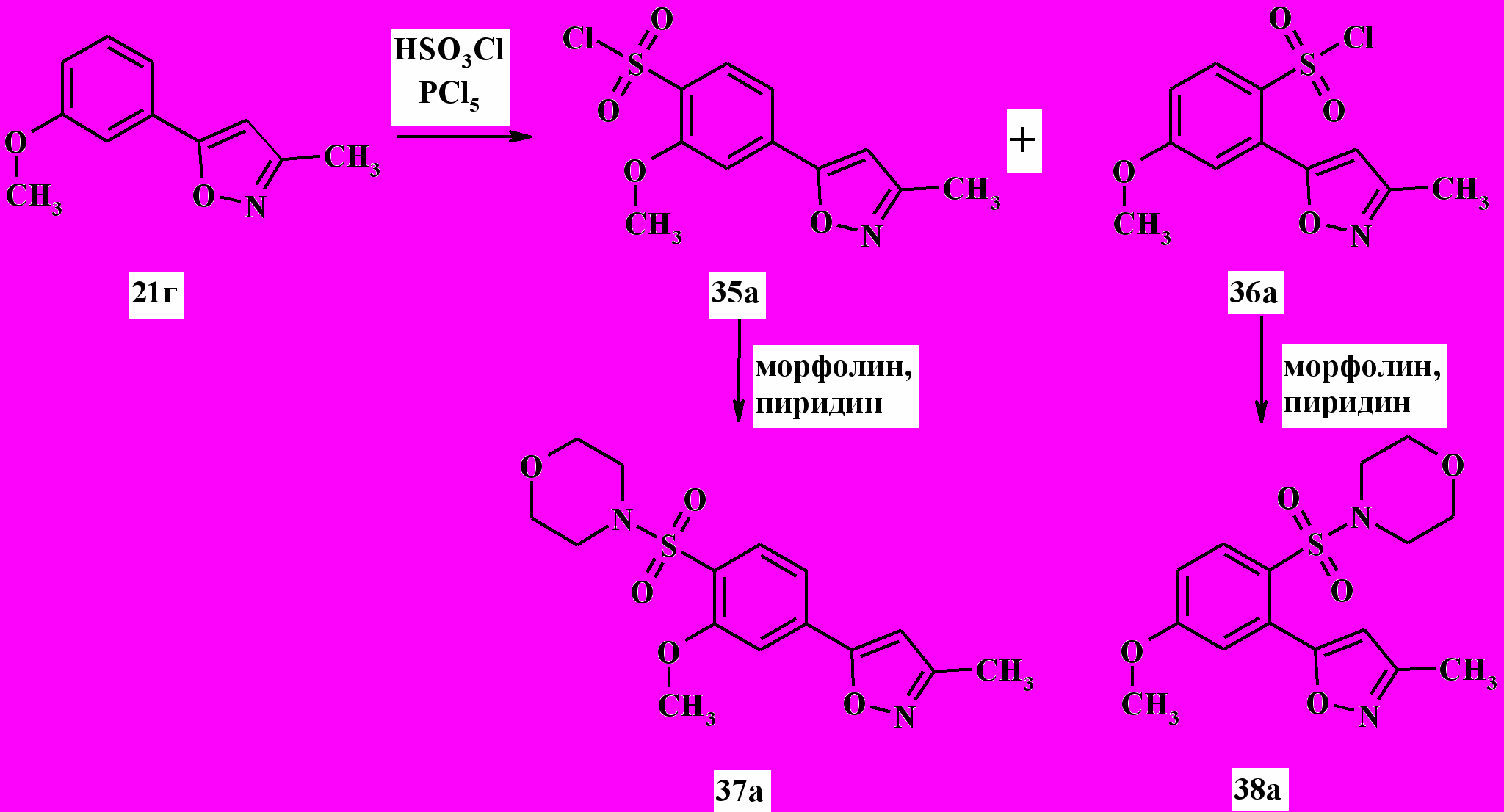
Схема 12
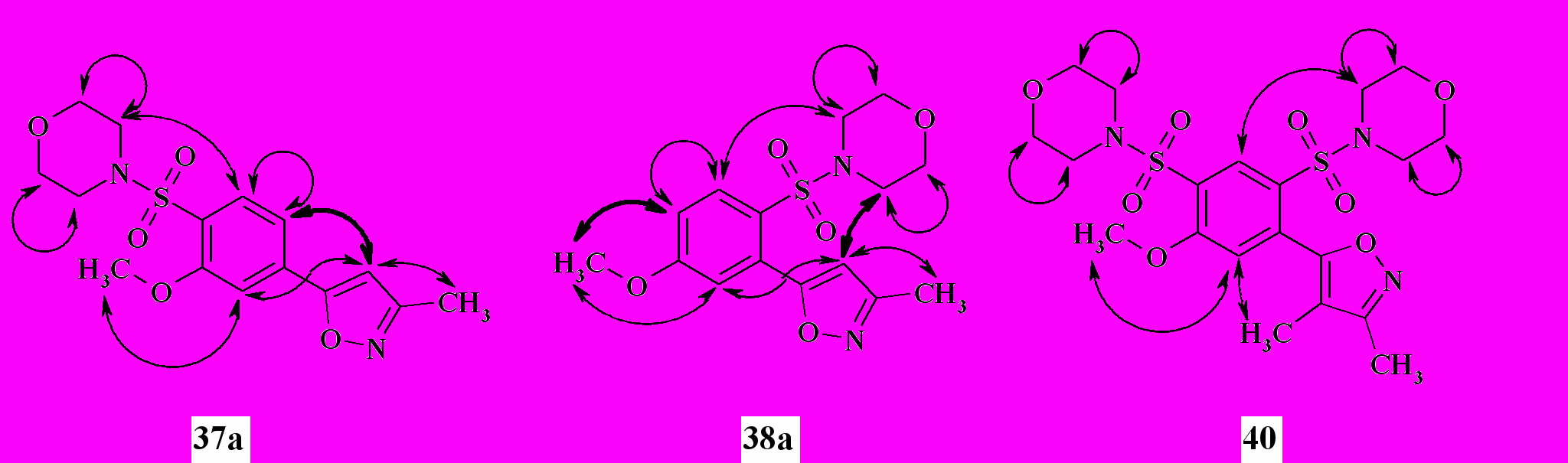
Рисунок. Схема взаимодействий протонов по данным корреляционной 1Н-1Н спектроскопии методом NOESY для соединений 37а, 38а и 40
Интересным оказался результат сульфохлорирования диметилзамещенного изоксазола 21л. Кроме ожидаемых продуктов монозамещения в положения 4/- 35б и 6/- 36б, методом жидкостной хроматографии был выделен дисульфохлорид 39 (схема 13). Структура синтезированного на его основе сульфамида 40 была доказана корреляционной 1Н-1Н спектроскопией методом NOESY (рисунок) и ЖХ-МС анализом. Установлено, что изменение температуры сульфохлорирования в диапазоне 20…60ºC не приводит к изменению эквимолярного соотношения продуктов 35б и 36б, однако с ростом температуры увеличивается относительное количество дисульфохлорида 39.
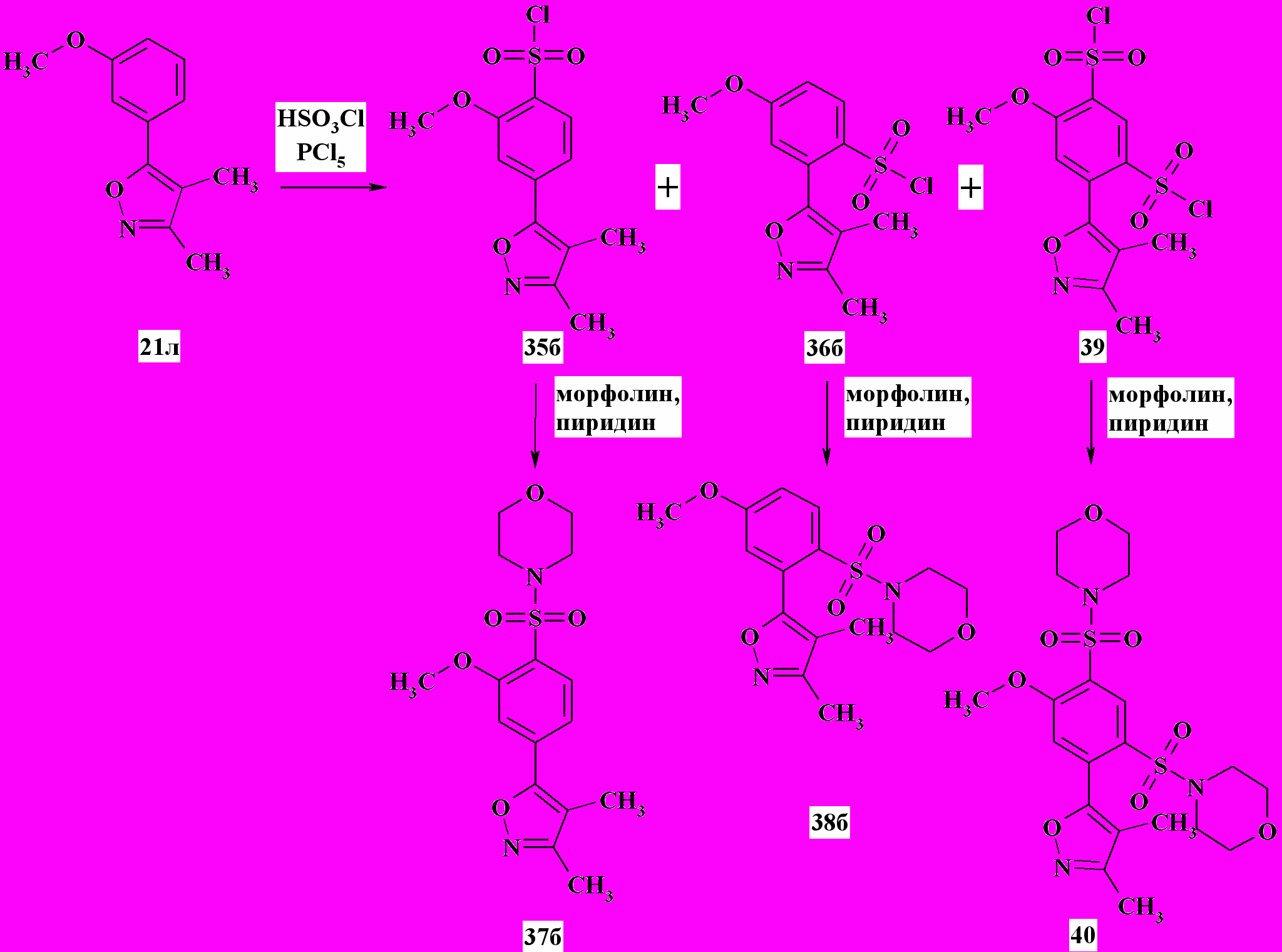
Схема 13
Что касается двуядерных соединений 27б и 21ж,з,м, имеющих в своём составе тиофеновый или фурановый циклы, то было установлено, что при их нагревании в избытке хлорсульфоновой кислоты происходит региоселективное сульфохлорирование незамещенного α-положения гетероцикла, не содержащего азот, с образованием соответствующих сульфохлоридов 41а-г с выходом 70-75 % (схема 14). Их строение, а так же строение синтезированных на их основе сульфамидов 42а-г, доказано методами 1Н ЯМР-спектроскопии и ЖХ-МС.
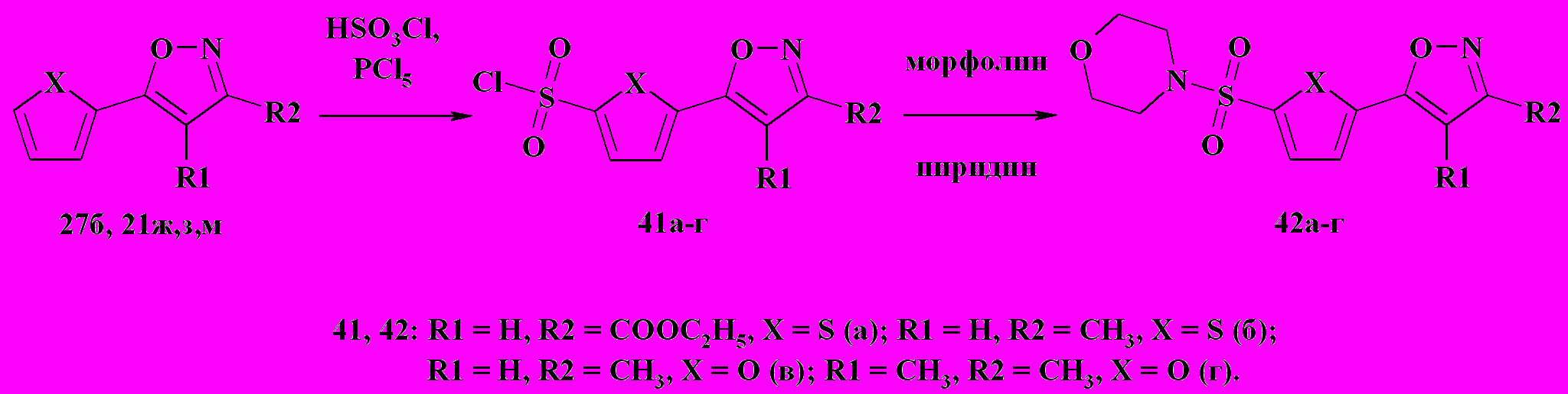
Схема 14
Что касается 5-пиридинизоксазолов 27в-д, то щелочной гидролиз этих соединений в присутствии каталитических количеств этанола приводит к получению соответствующих кислот 43а-в, на основе которых последовательно были получены хлорангидриды 44а-в (нагревание кислоты при 60 ºC в толуоле с избытком тионил хлорида и каталитическим количеством ДМФА) и карбоксамиды 45а-в (нагревание хлорангидрида до 60 ºC в ацетонитриле с амином, например с морфолином, в присутствии пиридина) (схема 15). Строение полученных соединений подтверждено данными 1Н ЯМР-спектроскопии и ЖХ-МС.
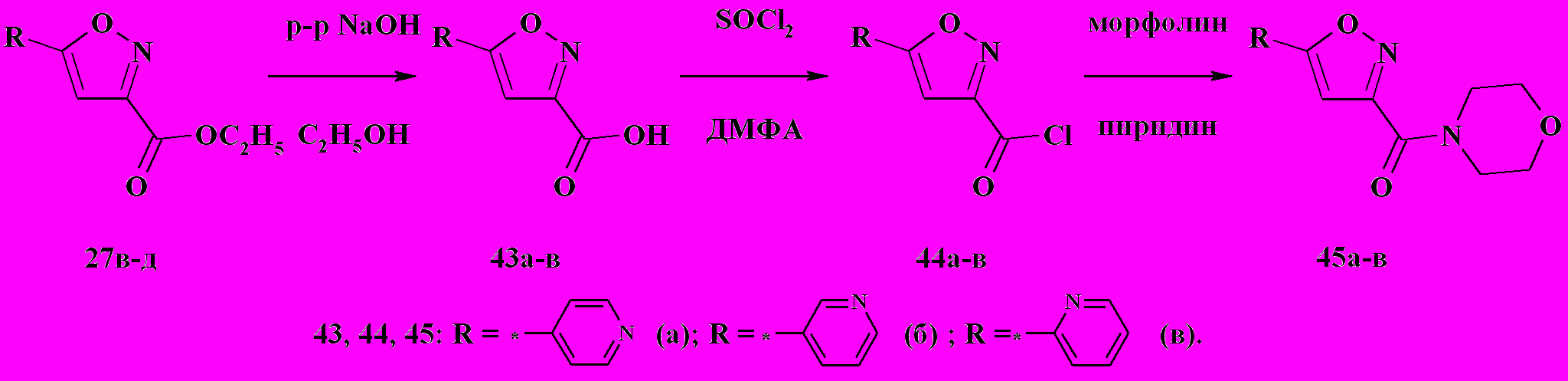
Схема 15
Реакции, представленные на схемах 10-15 показывают возможности расширения структурного разнообразия молекул синтезированных двуядерных соединений 5-арил и 5-гетерилизоксазолов.
2.2 Замещенные 3-гетерилизоксазолы
Неожиданный результат был получен при взаимодействии трифторсодержащих 1,3-дикетонов 46а,б с гидроксиламином. Первоначальный синтетический план предполагал получение 5-гетерил-3-трифторметилизоксазолов по аналогии с реакциями, представленными на схемах 7 и 8. Однако, при кипячении реагентов в этаноле в присутствии пиридина вместо ожидаемых изоксазолов были выделены соединения, которые по данным масс-спектрометрии, были идентифицированы как соответствующие оксимы. Но это предположение противоречило результатам 1Н ЯМР- и ИК-спетроскопии. На основании совокупности спектральных данных стало очевидно, что полученные соединения представляют собой не оксимы, а изомерные им дигидроизоксазололы 47а,б (схема 16).
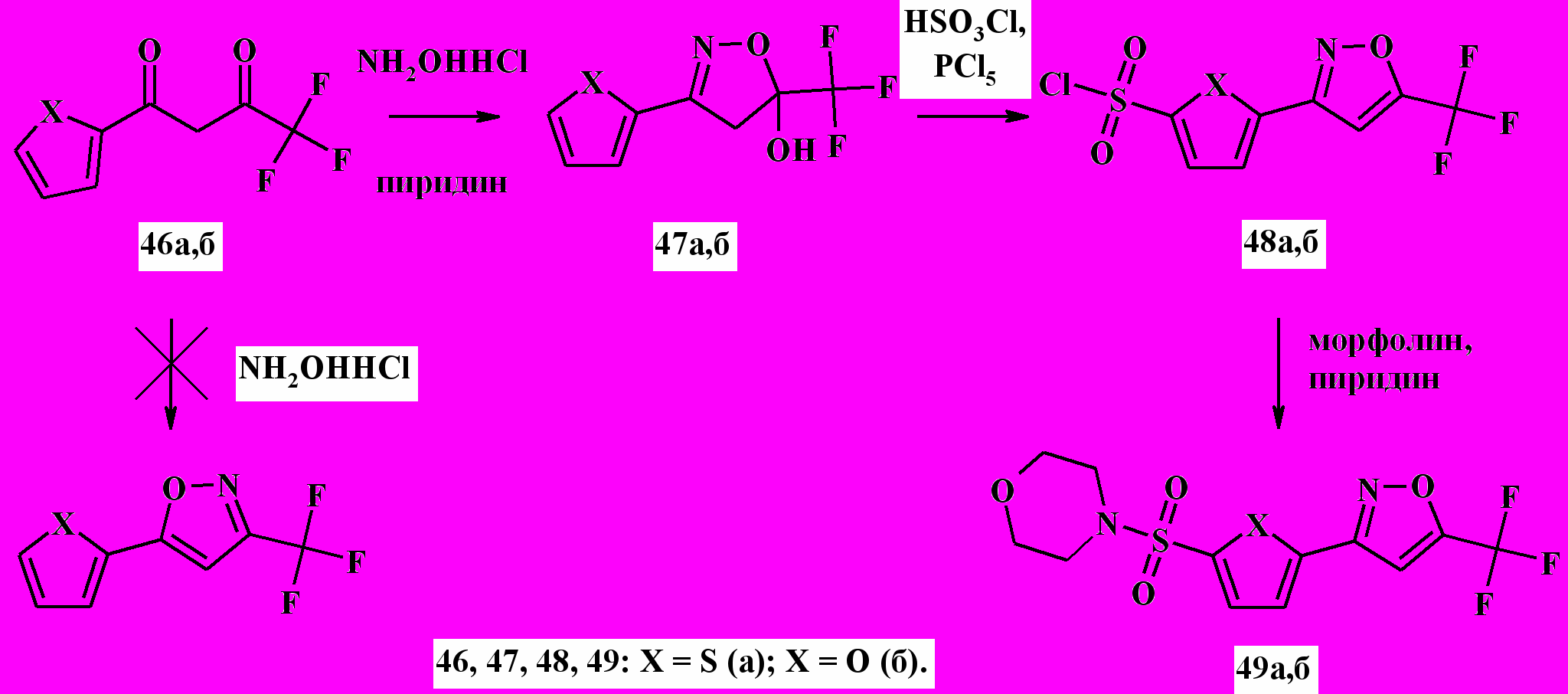
Схема 16
Методом 13С ЯМР-спектроскопии было определено положение гетероциклического и трифторметильного заместителя в в дигидроизоксазольном цикле. Было обнаружено, что сигнал С-5 атом углерода имеет константу дальнего взаимодействия с атомами фтора, что свидетельствует о нахождении трифторметильного заместителя в 5-положении. При распаде соединений 47а,б под действием электронного удара также были обнаружены характерные для определенного строения фрагменты. Было отмечено, что реакция циклоприсоединения гидроксиламина к 1,3-дикарбонильному субстрату протекает региоселективно, вне зависимости от основности среды.
Кипячение соединений 47а,б в течение 24 ч в этаноле не приводит к дальнейшей дегидратации с образованием изоксазольного цикла. Однако нагревание их в десятикратном избытке хлорсульфоновой кислоты в присутствии пятихлористого фосфора до 50-80 ºC приводило к сульфохлорированию, сопровождающемуся дегидратацией изоксазололового цикла с образованием сульфохлоридов 48а,б. На их основе были синтезированы соответствующие сульфамиды 49а,б. Строение полученных соединений было определено методами 1Н и 13С ЯМР-спектроскопии и масс-спектрометрии. РСА соединения 49а подтвердил сделанные нами выводы о положении заместителей в изоксазольном и тиофеновом (фурановом) циклах.
2.3 Замещенные 4-арилизоксазолы
Одним из наименее изученных направлений химии изоксазолов является синтез 4-арил замещенных 3,5-диалкилизоксазолов. Опробованные нами немногочисленные известные из литературы методики one pot синтеза 4-арилизоксазолов с использованием в качестве основания триэтиламина или водно-спиртового раствора гидроксида натрия приводили к образованию целевого продукта с низким выходом и большим количеством побочных продуктов. Был предложен новый метод синтеза 3,5-диметил-4-арилизоксазолов 52а-в высокой степени чистоты с выходом 50-60 % путем последовательного получения нитроаддуктов 51 и конденсации их с нитроэтаном в присутствии этилата натрия (схема 17). На основании анализа реакционных смесей методами 1Н ЯМР-спектроскопии и ЖХ-МС и литературных данных предложен вероятный механизм циклоконденсации, включающий промежуточное образование нестабильных динитроаддуктов и Н-изоксазол-2-олов.
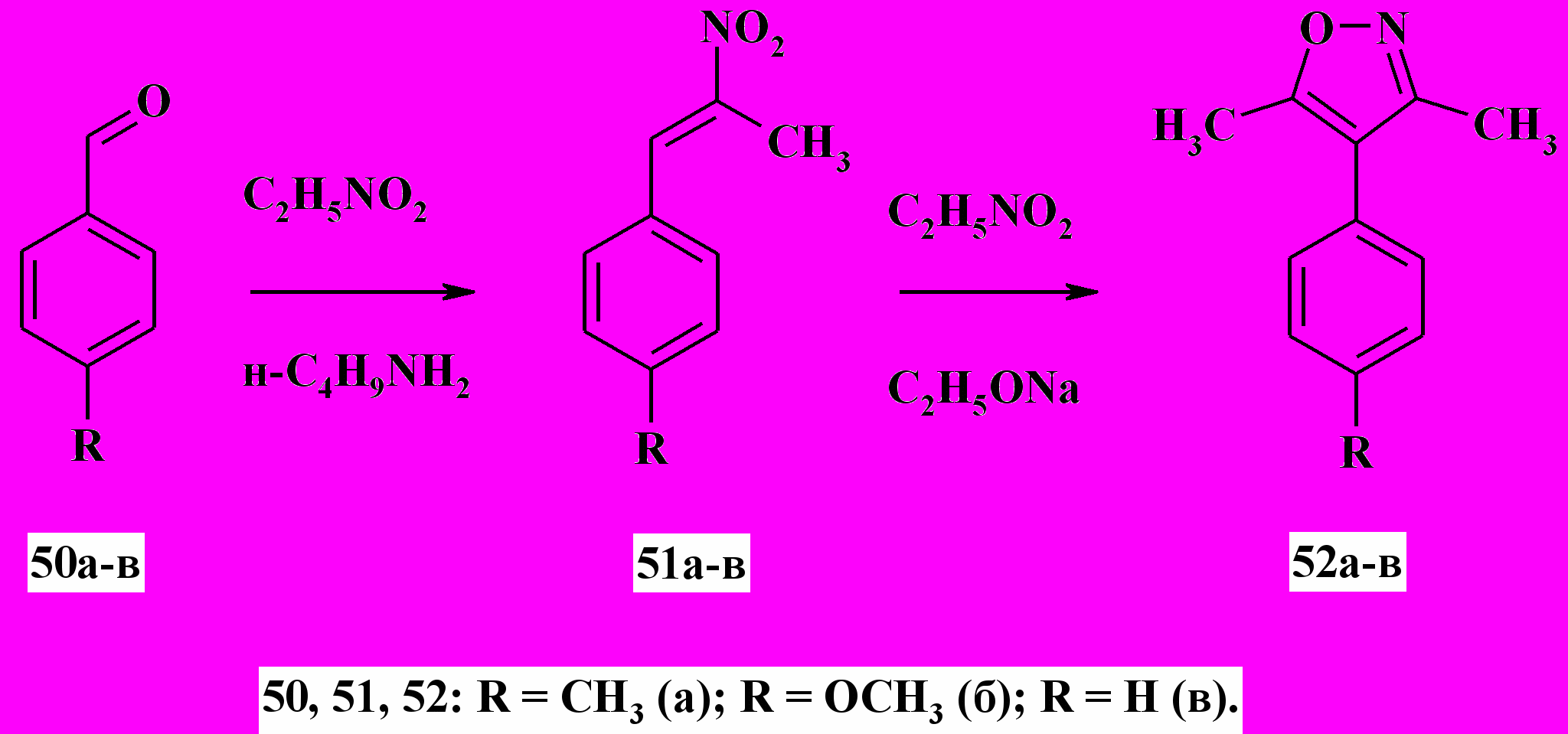
Схема 17
Нагреванием соединений 52а,б при 60 ºC в смеси хлорсульфоновой кислоты и пятихлористого фосфора были получены сульфохлориды 53а,б (схема 18). Их строение, а так же строение синтезированных на их основе сульфамидов 54а,б, доказано методами 1Н ЯМР-спектроскопии и ЖХ-МС.
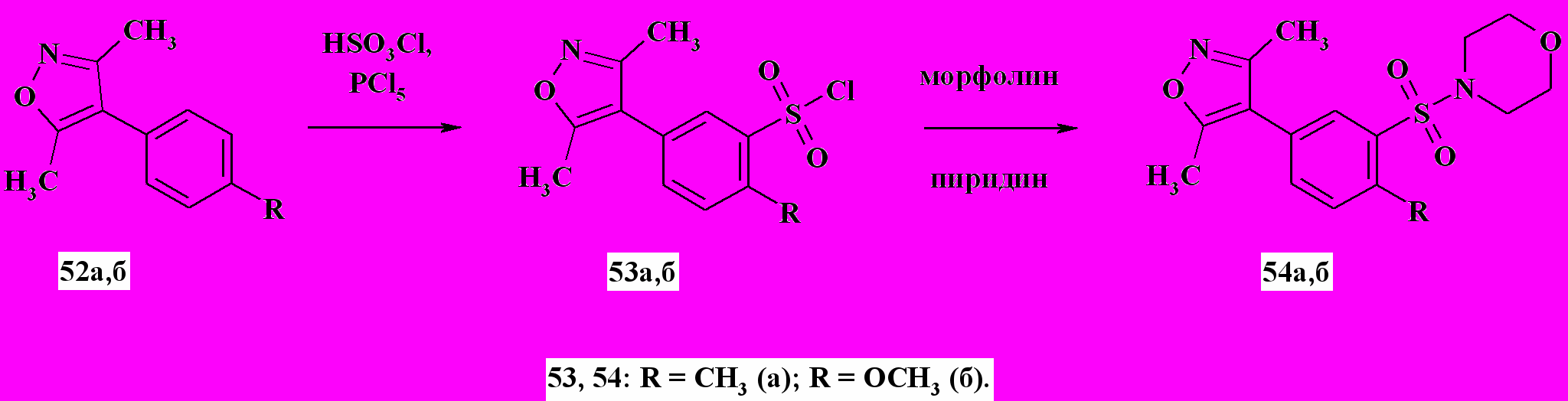
Схема 18
В случае сульфохлорирования соединения 52в при 60 ºC были получены два изомерных сульфохлорида 53в и 55 в соотношении 10:90 (% моль) соответственно (схема 19). Данные соединения не удалось разделить хроматографически, однако после сульфамидирования смеси 53в и 55 (с использованием морфолина) кристаллизацией из гексана удалось выделить мажорный продукт - п-сульфамид 56.
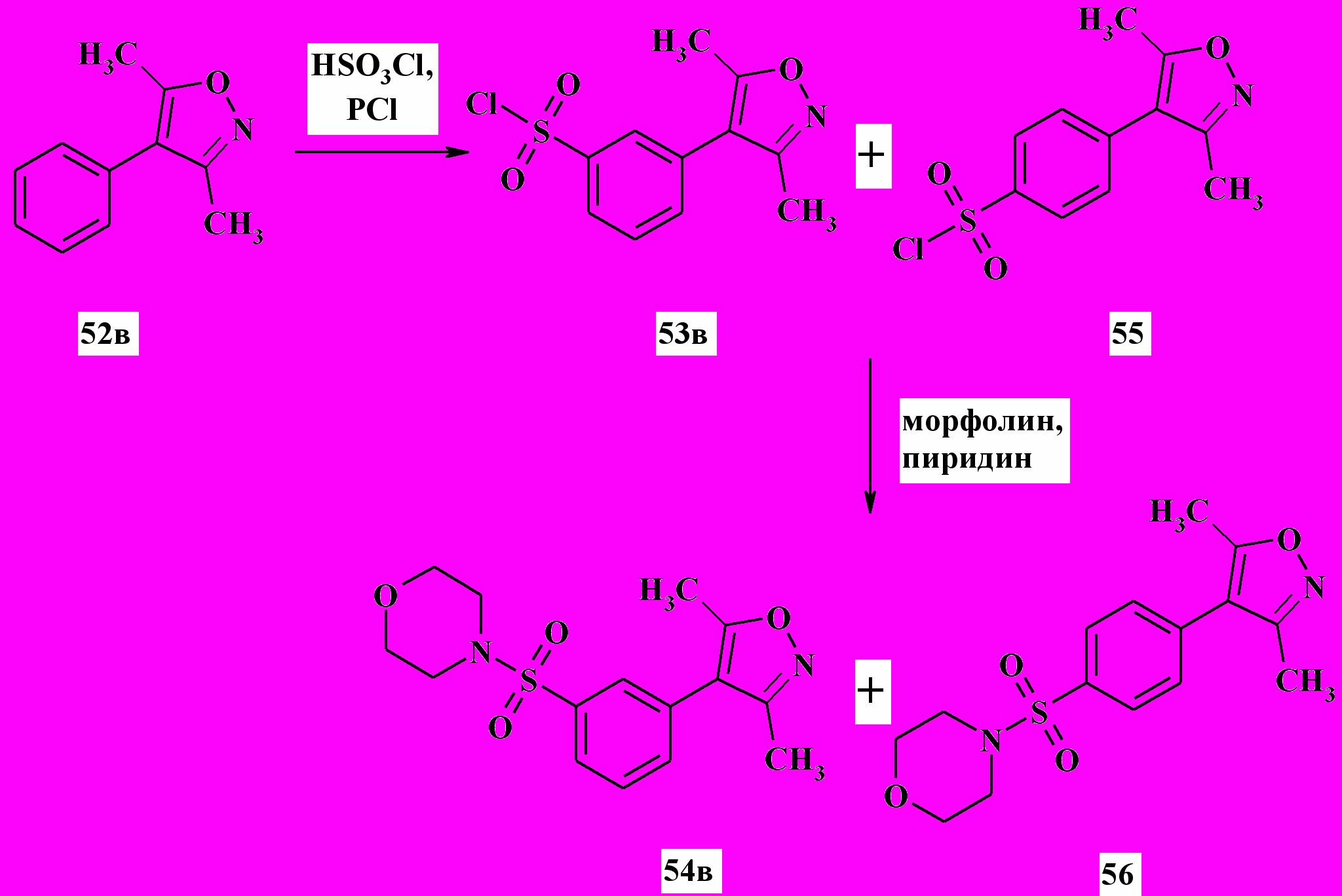
Схема 19
Выводы
- Разработаны методы синтеза 4-сульфамоил- и 4-нитро-5-винил-3-метилизоксазолов, основанные на сульфохлорировании (нитровании) 3,5-диметилизоксазола и последующей региоселективной конденсации 4-сульфамоил- и 4-нитро-3,5-диметилизоксазолов с диметоксиметил-диметил амином и с ароматическими и гетероциклическими альдегидами.
- Показаны возможности дальнейших превращений 4-сульфамоил- и 4-нитро-5-винил-3-метилизоксазолов. Установлена возможность переаминирования диметиламино-винильного фрагмента в 4-сульфамоил-5-(2-диметиламино-винил)-3-метилизоксазолах активными аминами. Обнаружено, что в случае N-замещенных 4-сульфамоил-3,5-диметилизоксазолов конденсация сопровождается метилированием сульфамидной группы.
- С использованием реакции циклоприсоединения гидроксиламина к различным 1,3-дикетонам синтезированы двуядерные соединения, содержащие изоксазольный цикл и различные ароматические или гетероциклические фрагменты в положении 5- изоксазольного цикла (5-арил- и 5-гетерилизоксазолы). Разработан метод мультистадийного синтеза 5-пиридинилизоксазол-3-карбоновых кислот и их карбоксамидных производных.
- Обнаружено, что взаимодействие 4,4,4-трифтор-1-гетерил-бутан-1,3-дионов с гидроксиламином приводит к образованию 3-гетерил-5-трифторметил-4,5-дигидроизоксазол-5-олов. Установлено, что при действии на 3-гетерил-5-трифторметил-4,5-дигидроизоксазол-5-олы хлорсульфоновой кислоты происходит сульфохлорирование, сопровождающееся дегидратацией дигидроизоксазолольного цикла, приводящее к образованию 5-(5-трифторметилизоксазол-3-ил)-гетеро-2-сульфонилхлоридов.
- Разработан новый метод синтеза 3,5-диметил-4-арилизоксазолов путем циклоконденсации (2-нитропропенил)-арилов с нитроэтаном. Методами совмещённой жидкостной хроматографии – масс спектрометрии и 1Н ЯМР-спектроскопии выявлен ряд интермедиатов этого процесса.
- На основе полученных 3-метил-4-нитро-5-винилизоксазолов, замещённых 5-арилизоксазолов, 5-гетерилизоксазолов, 4-арилизоксазолов и 3-гетерилизоксазолов синтезирован ряд ранее не известных сульфохлоридов и соответствующих сульфамидных производных. Положение сульфогруппы в этих соединениях определено с помощью методов одно- и двумерной спектроскопии 1Н ЯМР.
Основное содержание диссертации опубликовано в работах:
- Корсаков М.К., Филимонов С.И., Дорогов М.В. Библиотеки структурных аналогов на основе диметилпиразола и диметилизоксазола // Тез. докл. VII научной школы-конференции по органической химии. – Екатеринбург. 2004. – С. 330.
- Синтез и свойства сульфамидных производных 3,5-диметилизоксазола / М.К. Корсаков, С.И. Филимонов, М.В. Дорогов // Изв. вузов. Химия и хим. технология. – 2004. – Т. 47. Вып. 10. – С. 114-117.
- Корсаков М.К., Филимонов С.И. Дорогов М.В. Синтез и свойства сульфамидных производных 3,5-диметиоизоксазола. // Карбонильные соединения в синтезе гетероциклов: Сб. науч. тр. / Под ред. проф. А.П. Кривенько. – Саратов. “Научная книга”, 2004. С. 149-151.
- Синтез замещенных 4-сульфонилизоксазолов / С.И. Филимонов, М.К. Корсаков, М.В.Дорогов и др. // Изв. вузов. Химия и хим. технология. – 2005. – Т. 48. Вып. 5. – С. 131-137.
- Дорогов М.В., Корсаков М.К. Синтез ряда комбинаторных библиотек сульфамидных производных 5-фенил-изоксазола // Тез. докл. XLI Всероссийской конференции по проблемам математики, информатики, физики и химии. Секция химии. – Москва, 18-22 апреля 2005. – С. 67.
- Корсаков М.К., Филимонов С.И. Дорогов М.В. Синтез новых сульфамидных производных 5-тиофен-2-ил-азолов // Тез. докл. Международной конференции по химии гетероциклических соединений, посвященной 90-летию со дня рождения профессора Алексея Николаевича Коста. – Россия, Москва, 17-21 октября 2005. – С. 208.
- Корсаков М.К., Дорогов М.В. Синтез 3,5-диметил-4-арил-изоксазолов и их сульфамидных производных // Тез. докл. XLII Всероссийской конференции по проблемам математики, информатики, физики и химии. Секция химии. – Москва, 17-21 апреля 2006. – С. 31.
- S.I. Filimonov, M.V. Dorogov, M.K. Korsakov et al. Convenient synthesis of novel 5-substituted 3-methylisoxazole-4-sulfonamides // J. Heterocycl. Chem. – 2006. V.43, № 43. P.663-671.
