Рабочая программа и задание на контрольную работу для студентов IV курса специальности
| Вид материала | Рабочая программа |
- Рабочая программа и задание на контрольную работу с методическими указаниями для студентов, 116.18kb.
- Рабочая программа и задание на контрольную работу c методическими указаниями для студентов, 843.29kb.
- Рабочая программа и задание на контрольную работу с методическими указаниями для студентов, 526.56kb.
- Рабочая программа и задание на контрольную работу с методическими указаниями для студентов, 1259.29kb.
- Рабочая программа и задание на контрольную работу для студентов III курса специальности, 246.08kb.
- Рабочая программа и задание на контрольную работу с методическими указаниями для студентов, 201.3kb.
- Рабочая программа и задание на контрольную работу №1 для студентов Vкурса Специальности, 315.79kb.
- Рабочая программа и задание на контрольную работу с методическими указаниями для студентов, 162.08kb.
- Рабочая программа и задание на контрольную работу для студентов Vкурса специальности, 296.41kb.
- Рабочая программа и задание на контрольную работу с методическими указаниями для студентов, 188.99kb.
РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ ОТКРЫТЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ ПУТЕЙ. СООБЩЕНИЯ
4/4/1
Одобрено кафедрой Утверждено деканом факультета
«Физика и химия» «Управление процессами перевозок»
Утверждено
КОРРКОРРОЗИЯ И МЕРКОРРОЗИЯ И МЕРЫ БОРЬБЫ С НЕЙ
Рабочая программа
и задание на контрольную работу
для студентов IV курса
специальности
290800. ВОДОСНАБЖЕНИЕ И ВОДООТВЕДЕНИЕ
МОСКВА 2007
Рабочая программа разработана на основании примерной учебной программы данной дисциплины, составленной в соответствии с государственными требованиями к минимуму содержания и уровню подготовки инженера специальности 290800.
С о с т а в и т е л и : канд. техн. наук, проф. Н.И. ЗУБРЕВ,
д_р хим. наук, проф. А.Н. ПРЯХИН,
преп. М.М. КСЕНОФОНТОВА
Рецензент:
канд. хим. наук А.Н. МИТРОФАНОВА (МГУ им. М.В. Ломоносова)
Курс - IV.
Всего часов - 95.
Лекционные занятия - 8 ч.
Лабораторные занятия - 8 ч.
Контрольные работы - 1 (КОЛИ1Н:СТDО).
Зачет (с оценкой) - 1 (количество).
Самостоятельная работа -- 64 ч.
ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ
В процессе изучения курса химии студент должен выполнить одну контрольную работу. Решение задач и ответы на теоретические вопросы должны быть коротко, но четко обоснованы. При решении задач нужно приводить весь ход решения и математические преобразования.
Контрольная работа должна быть аккуратно оформлена, написана четко и ясно, иметь поля для замечаний рецензента. Номера и условия задач необходимо переписывать в том порядке, в каком они указаны в задании. В начале работы следует указать учебный шифр студента, номер варианта и полный список номеров задач этого варианта. В конце работы следует дать список использованной литературы с указанием года издания.
Работа должна иметь подпись студента и дату.
Если контрольная работа не зачтена, ее следует выполнить повторно в соответствии с указаниями рецензента и представить вместе с незачтенной работой. Исправления следует выполнять в конце работы, после рецензии, а не в тексте.
Контрольная работа, выполненная не по своему варианту, преподавателем не рецензируется и не засчитывается как сданная.
Каждый студент выполняет вариант контрольных заданий, обозначенный последними цифрами номера студенческого билета.
1. ЦЕЛИ И ЗАДАЧИ ДИСЦИПЛИНЫ
1.1. Цель преподавания дисциплины
Проблема коррозии металла и железобетона во всем мире имеет большое значение из-за огромных потерь от коррозионных разрушений, которые по своим объемам сравнимы с затратами по созданию новых крупных отраслей производства.
Железнодорожный транспорт имеет специфические особенности, которые способствуют ускорению коррозионного износа транспортных сооружений, оборудования и подвижного состава. Железнодорожный транспорт работает в сложных природных условиях, подвергаясь, постоянному негативному воздействию атмосферной среды, переменных нагрузок и вибраций разной интенсивности. Кроме того, большая часть его производственных предприятий, обслуживающих подвижной состав, работает с агрессивными растворами.
В результате этих процессов происходят интенсивные коррозионные разрушения, требующие эффективных методов их защиты.
Целью подготовки студентов по дисциплине «Коррозия и меры борьбы с ней» является получение будущими инженерами путей сообщения комплекса теоретических и практических знаний в области обеспечения надежности строительнх конструкций И сооружений в условиях воздействия агрессивных сред при проектировании, строительстве и эксплуатации объектов железнодорожного транспорта.
1.2. Задачи изучения дисциплины
Изучив дисциплину, студент должен:
1.2.1. ЗНАТЬ основы теории коррозии конструкций и сооружений в условиях воздействия агрессивных сред, особенности коррозии конструкций и сооружений железнодорожного транспорта; методы защиты от коррозии, методы анализа коррозионной обстановки.
1.2.2. УМЕТЬ анализировать объекты железнодорожного транспорта и выявлять элементы, наиболее подверженные коррозии, про водить диагностику коррозионных процессов, сравнивать и анализировать варианты защитных мероприятий в зависимости от особенностей агрессивной среды и конструкции, планировать работы по защите конструкций от коррозии, восстановлению антикоррозионной защиты и определять эффективность мер защиты металлов и железобетона от коррозии.
1.2.3. ИМЕТЬ ПРЕДСТАВЛЕНИЕ о развитии методов и средств защиты от коррозии ·за рубежом, об основных характеристиках, контактирующих со строительными конструкциями сред, о принципах и методах электрохимической защиты.
2. СОДЕРЖАНИЕ ДИСЦИПЛИНЫ
Введение
Назначение курса. Понятие о коррозии строительных конструкций [3, с. 3-21].
2.1. Коррозионные процессы
Коррозия металлов и причина ее возникновения. Классификация коррозионных процессов [1, с. 130-132]. Химическая и электрохимическая коррозия. Виды поляризации и ее расчет. Водородная и кислородная деполяризация. Теория пассивации. Действие хлорид-ионов и активно-пассивные элементы. Термодинамика и кинетика электрохимической коррозии. Влияние водородного показателя на скорость коррозии металлов. Коррозия железа в кислотах. Влияние потока жидкости на коррозию в природных водах. Защитные свойства окалины и· различных оксидов [1, с. 136-141; 3, с. 14-17; 4, с. 10-21]. Коррозия сплавов. Факторы, влияющие на агрессивность атмосферы. Механизм коррозионного растрескивания по напряжениям стали и других металлов. Растрескивание и адсорбция. Скорость роста трещин. Водородное растрескивание. Коррозионная усталость. Фреттинг-коррозия [1, с. 148-155; 3, с. 28-31; 4, с. 27-41].
2.2. Основные виды коррозии и коррозионные разрушения
Атмосферная коррозия. Подземная коррозия. Факторы, определяющие агрессивность грунтов. Характеристики питтингов. Микробиологическая коррозия. Тионовые бактерии. Железобактории. Межкристаллитная коррозия. Контактная коррозия. Дифференциальная аэрация конструкции. Коррозия под действием блуждающих токов. Оценка коррозионной стойкости металлов [1, с. 148-158; 3, с. 35-37, 38-42].
2.3. Защита металлов и сплавов от коррозии
Металлические инеметаллические покрытия. Классификация и методы получения. Никелевые, свинцовые, кадмиевые, оловянные и алюминиевые покрытия. Неорганические покрытия. Силикатные эмали. Лакокрасочные и полимерные покрытия [1, с. 159-161; 3, ер. 84--96]. Электрохимическая защита. Катодная защита. Критерии защиты. Перезащита. Анодная защита. Изменение состава окружающей среды. Пассиваторы и ингибиторы. Противокоррозионные смазки. Летучие ингибиторы. Деаэрация. Механизм коррозии котлов и способы их защиты [1, с. 165-176; 3, с. 97-99,
З. ПЕРЕЧЕНЬ ТЕМ ЛЕКЦИОННЫХ ЗАНЯТИЙ
| № п/п | Тема | Количество часов |
| 1 | Классификация коррозионных процессов | 2 |
| 2 | Химическая и электрохимическая коррозия | 2 |
| 3 | Коррозия металлов в различных условиях | 2 |
| 4 | Защита металлов и сплавов от коррозии | 2 |
4. ПЕРЕЧЕНЬ ТЕМ ЛАБОРАТОРНЫХ РАБОТ
| №п/п | Тема | Количество часов |
| 1 | Электродные процессы | 4 |
| 2 | Коррозия металлов | 4 |
5. ПЕРЕЧЕНЬ ТЕМ. КОТОРЫЕ СТУДЕНТЫ ДОЛЖНЫ ПРОРАБОТАТЬ САМОСТОЯТЕЛЬНО
Понятие о межфазной разности потенциалов. Строение двойного электрического слоя на границе металл-раствор. Внутренняя и внешняя контактная разность потенциалов. Возникновение разности потенциалов при контакте разнородных металлов [1, с. 88-93; 4, с. 17-25].
Электродные потенциалы и ЭДС гальванических элементов. Роль контактных потенциалов и двойных ионных слоев в образовании ЭДС гальванических цепей [3, с. 12-14; 4, с. 27-41].
Термодинамический расчет равновесных электродных потенциалов. Электроды первого и второго рода. Газовые электроды. Амальгамные электроды. Окислительно-восстановительные электроды. Уравнение Нернста. Термодинамический расчет ЭДС обратимых гальванических цепей [1, с. 136-141; 3, с. 18-26; 4, с. 47-58].
Химические цепи. Концентрационные элементы. Уравнение диффузного потенциала и ЭДС концентрационной цепи с жидкостной границей. Влияние температуры на ЭДС гальванического элемента. Кислородный электрод и элемент дифференциальной аэрации. Диаграмма Пурбе [3, с. 26-31; 4, с. 65-87].
Коррозия бетона первого типа. Растворимость цементного камня в системе продукты гидратации-вода. Влияние технологических показателей на стойкость бетона к коррозии [2, с. 112-138; 5, с. 27-41; 6, с. 4-7].
Коррозия бетона второго типа. Теоретические основы углекислотной коррозии. Действие кислот на цементный камень и влияние скорости обмена агрессивной среды на скорость коррозии [2, с. 148-203; 5, с. 49-65].
Коррозия бетона третьего типа. Сульфатная коррозия.
Деформация расширения. Коррозия бетона при кристаллизации солей в его порах [2, с. 148-203; 5, с. 49-65].
Основные особенности коррозии арматуры. Влияние напряжения на коррозию стали. Коррозионное растрескивание арматуры [2, с. 327-351; 5, с. 217-230].
Коррозионная стойкость железобетонных конструкций в напряженном состоянии. Стойкость напряженного бетона. Влияние агрессивной среды на стойкость предварительно напряженных железобетонных конструкций [2, с. 353-385, 443-470; 6, с. 30-35].
6. ИНФОРМАЦИОННО.МЕТОДИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
ДИСЦИПЛИНЫ
Основная литература:
- Зубрев Н.И. Инженерная химия на железнодорожном транспорте. - М.: Желдориздат, 2002.
- Дробашева Т.И. Общая химия. Ростов-н/Д: Феникс, 2004.
- Сборник задач по электрохимии. Уч. пос. под. ред. Колпаковой Н.А. М: Высшая школа, 2003.
Дополнительная литература:
2. Москвин В.М., Иванов Ф.М., Алексеев С.Н. Коррозия бетона и железобетона, методы их защиты. - М.: Стройиздат,J980. - 420 с.
3. Жуков А.П., Малахов В.И. Основы металловедения и теории коррозии. - М.: Транспорт, 1988.
4. Малахов В.И., Тютина К.М. Коррозия и основы гальваностегии. -М.: Химия, 1987.
5. Мербек К., Мереин В. Польмяни Г.В. Антикоррозионная защита санитарно-технического оборудования. Пер. с нем. - М.: Стройиздат, 1990.
6. СНиП 2.03.П-85. Защита строительных конструкций от коррозии. − М.: Стройиздат, 1986.
ЗАДАНИЕ НА КОНТРОЛЬНУЮ РАБОТУ
Контрольные вопросы
Гальванические элементы
1. Определите электродный потенциал цинка, опущенного в раствор его соли с концентрацией ионов Zn+2 = 0,001 моль/л.
2. Исходя из значений стандартных электродных потенциалов и ∆G0298 укажите можно ли в гальваническом элементе осуществить следующую реакцию:
Fe0 + Cd2+ = Fe2+ + Cd0.
3. Составьте схемы двух гальванических элементов, в одном из которых цинк - отрицательный электрод, а в другом - положительный.
4. Определите значение электродного потенциала меди, погруженной в 0,0005н раствор Cи(N03)2.
5. Что является окислителем и восстановителем в гальваническом элементе, составленном из олова и серебра, которые погружены в растворы их солей с одинаковой концентрацией? Составьте схему гальванического элемента и определите значение ЭДС гальванического элемента и ∆G0298. Укажите можно ли осуществить данную реакцию.
6. Составьте схему работы гальванического элемента, образованного железом и свинцом, по груженными в 0,005М растворы их солей. Рассчитайте ЭДС этого элемента и изменение величины энергии Гиббса.
7. Какие процессы происходят у электродов медного концентрационного гальванического элемента, если у одного из электродов концентрация ионов меди − 1 моль/л, а у другого − 10-3 моль/л? В каком направлении движутся электроны во внешней цепи? Ответ дайте на основе ЭДС и ∆G0298 этой цепи.
8. ЭДС гальванического элемента, образованного никелем, погруженным в раствор его соли с концентрацией ионов Ni2+ равной 10-4 моль/л и серебром, погруженным в раствор его соли, равна 1,108 В. Определите концентрацию ионов Ag+ в растворе его соли.
9. Гальваническая цепь составлена железом, погруженным в раствор его соли с концентрацией ионов Fe2+ равной 0,001 моль/л и медью, погруженной в раствор ее соли. Какой концентрации должен быть раствор меди, чтобы ЭДС цепи стала равной нулю?
10. Найти электродвижущую силу элемента, образованного цинковым электродом, погруженным в 0,1 М раствор азотнокислого цинка и свинцовым электродом, погруженным в 2 М раствор азотнокислого свинца.
11. Рассчитайте ЭДС элемента, образованного никелевым электродом, погруженным в 0,1 М раствор сернокислого никеля и медным электродом, по груженным в 0,2 М раствор сернокислой меди. Составьте схему элемента.
12. Какие процессы будут происходить при работе гальванического элемента, составленного из пластинок алюминия и серебра, погруженных: первая в 0,01 М раствор соли алюминия, а вторая - в 2 М раствор азотнокислого серебра? Определите ЭДС гальванического элемента и стандартную энергию Гиббса.
13. Определите электродный потенциал олова, погруженного в 0,001 н раствор сернокислого олова.
14. Исходя из значений стандартных электродных потенциалов: рассчитайте для 298 К значения ∆G0298 реакций: а) Zn + H2S04 = ZnS04 + Н2,
б) Сu + 2Ag+ = Сu2+ + 2Ag.
15. Исходя из величин стандартных окислитсльно-восстановительных потенциалов и значения ∆G0298 определите, будет ли работать гальванический элемент, в котором на электродах протекают процессы:
а) Hg0 - 2е = Hg2+,
б) РЬО2 + 4Н+ + 2е = Pb2+ + 2Н2О.
Коррозия металлов
16. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадет в кислую среду? Дайте схему образующегося при этом гальванического элемента.
17. При нарушении целостности поверхностного слоя медного покрытия на алюминии коррозия протекает вследствие образования гальванопары, за 45 с работы которой на катоде выделилось 0,09 л водорода (измеренного при нормальных условиях). Какая масса алюминия растворилась за это время, и какую силу тока дает эта гальванопара?
18. Исходя из величин ∆G0298 определите, какие из приведенных ниже металлов будут подвергаться коррозии во влажном воздухе по уравнению:
Ме + Н2О + 02 > Ме(ОН)2, где Ме - Mg, Сu, Аu.
19. Какие металлы (Fe, Ag, Са) будут разрушаться в атмосфере влажного воздуха насыщенного диоксидом углерода? Ответ дайте на основании вычисления ∆G0298 соответствующих процессов.
20. Алюминий склепан с медью. Какой из металлов будет подвергаться коррозии, если эти металлы попадут в кислотную среду?
Составьте схему гальванического элемента. Подсчитайте ЭДС и ∆G0298 этого элемента для стандартных условий.
21. Железо покрыто никелем. Какой из металлов будет корродировать в случае разрушения поверхности покрытия. Коррозия происходит в кислой среде. Составьте схему образующегося гальванического элемента.
22. Олово спаяно с серебром. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадет в щелочную среду?
Ответ дайте на основании вычисления ЭДС и ∆G0298 образующегося гальванического элемента.
23. Железо покрыто хромом. Какой из металлов будет подвергаться коррозии в случае нарушения поверхностного слоя покрытия в атмосфере промышленного района (влажный воздух содержит СО2, H2S, S02 и др.)? Составьте схему процессов, происходящих на электродах образующегося гальванического элемента.
24. При работе гальванического элемента, образовавшегося при коррозии алюминия, который находится в контакте с хромом, за 1- мин. 20 с его работы на хромовом электроде восстановилось 0,034 л кислорода. Определите на сколько уменьшилось при этом масса алюминиевого электрода и чему равна сила тока прошедшего во внешней цепи гальванического элемента?
25. Гальванический элемент, образовавшийся при коррозии хрома спаянного со свинцом, дает ток силой 6 А. Какая масса хрома окислится и сколько литров водорода выделится за 55 с работы этого элемента?
26. Медь покрыта оловом. При нарушении оловянного покрытия образуется гальванический элемент, который дает ток силой 7,5 А. Какая масса олова растворится, и сколько литров водорода выделится на медном катоде за 25 мин?
27. При работе гальванического элемента за 1,5 мин. образовалось 0,125 г Fe(OH)2. Вычислите объем кислорода, израсходованный на получение Fe(OH)2. Сколько электричества протекло по внешней цепи гальванического элемента за это время?
28. При нарушении поверхностного слоя цинкового покрытия на железе происходит коррозия из-за образования гальванического элемента. За 48 с работы этого элемента через внешнюю цепь протекло 550 Кл электричества. Какая масса цинка растворилась при этом, и какой объем водорода выделился на железном катоде?
29. При коррозии железа покрытого кадмием в кислой среде образуется гальванический элемент. Определите, как изменится ЭДС гальванического элемента из-за концентрационной поляризации железного анода и перенапряжения водорода (∆Е = 0,8 В), если концентрация иона Fе2+ возросла до 0,15 моль/л?
30. Никель находится в контакте c золотом во влажном воздухе, насыщенном сероводородом. Коррозия никеля происходит вследствие образования гальванического элемента, ЭДС которого равна 0,285 В. Определите, как изменится ЭДС гальванического элемента, если концентрация ионов никеля возрастет с 0,1 М до 0,25 моль/л, а перенапряжение выделения водорода на золоте равно 0,15В?
31. Железо находится в контакте с никелем. Какой из металлов будет окисляться при коррозии в кислой среде? Дайте схему образующегося при этом гальванического элемента.
32. Блуждающий ток силой 0,7 А проходит через подземный участок трубы, имеющей диаметр 50,8 мм и длину 0,6096 м. Какова начальная скорость коррозии?
Электролиз водных растворов
33. При электролизе водного раствора АgNОз с нерастворимым анодом в течение 25 мин. при силе тока 3А на катоде выделилось 4,8 г серебра. Рассчитайте выход по току и электрохимический эквивалент серебра.
34. Определите время, необходимое для получения 1 кг металлического натрия при электролизе расплава гидроксида натрия при силе тока 2500 А. Выход по току равен 35%. Какой объем кислорода был выделен?
35. При токе силой 2 А в течение 40 мин выделилось на катоде 4,542 г некоторого металла. Вычислите электрохимический эквивалент этого металла в г/А·ч.
36. Найдите толщину отложившегося при электролизе на железной проволоке слоя олова (плотность олова 7298 кг/м3), если длина проволоки 2 м, а диаметр ее 0,0004 м. Ток силой 2,5 А в течение 30 мин пропускали через раствор SnC12. Выход по току 93%.
37. Вычислите время, в течение которого должен быть пропущен ток в 1,5 А через раствор цинковой соли, чтобы покрыть металлическую пластинку слоем цинка толщиной 2,5xl0-5 м, если6 общая площадь поверхности пластинки 0,1 м2, а выход по току 90,5%. Плотность цинка 7133 кг/м3.
38. Железный предмет площадью 0,08 м2 помещен в качестве катода в раствор соли никеля. Какова толщина отложившегося слоя никеля? Плотность никеля - 8900 кг/м3. Ток силой 3,15 А пропускали в течение 42 мин.
39. При рафинировании меди током 25 А выделяется за 4 час 112 г меди. Рассчитайте выход по току.
40. Через раствор соли Ni(NО3)2 в течение 2,45 ч пропускали ток силой 3,5А. Определите, на сколько грамм за это время уменьшилась масса никелевого анода.
41. Какую массу алюминия можно получить при электролизе расплава АIО3, если в течение 1 ч пропускать ток силой 20000А при выходе по току 85%?
42. Вычислите время, в течение которого надо пропускать ток силой 2,5 А через расплавленный хлористый свинец для того, чтобы на катоде выделилось 20 г металла? 43. Вычислите время, в течение которого надо пропускать ток силой 2А для получения 20 г едкого натрия электролизом водного раствора хлористого натрия.
44. Деталь подверглась марганцеванию. Электролит раствор MnS04. Сила тока 5 А. Вычислить выход металла покрытия (марганца) по току, если в течение 1 ч на поверхности детали осело 3,078 г чистого марганца.
45. Деталь была оцинкована за 1 ч 40 мин. Электролит раствор ZnS04. Масса металла покрытия (цинка) равна 7,8456 г. Выход по току - 77,2 %. Чему была равна сила тока?
46. Сколько потребуется времени для выделения на катоде 1 г-экв меди (из раствора CuSO4 при силе тока 10 А, если выход по току равен: а) 100%; б) 89,3%?
47. Из раствора FeS04 на катоде выделилось 624,6 мг Fe. Количество использованного электричества равно 1 А.ч. Чему равен выход металла по току?
48. Деталь хромируется в водном растворе Сr2(SО4)3. Сила тока - 3 А. Определить продолжительность электролиза, если на поверхности детали необходимо нанести электрокристаллизацией 1,3 г хрома и если выход по току принять равным 40%.
49. Электрический ток силой 6 А в течение 1 ч 14 мин 24 с осадил на катоде 8,14 г металла из химического соединения, в котором он двухвалентен. Чему равна атомная масса металла, и какой это металл?
50. Для получения 1 м3 хлора при электролизе водного раствора хлорида магния было пропущено через раствор 2423 А·ч электричества. Вычислите выход по току.
Таблица 1
Стандартные электродные потенциалы ( 0 )
некоторых металлов ( ряд напряжений ) при 298К.
| Электродная полуреакция | 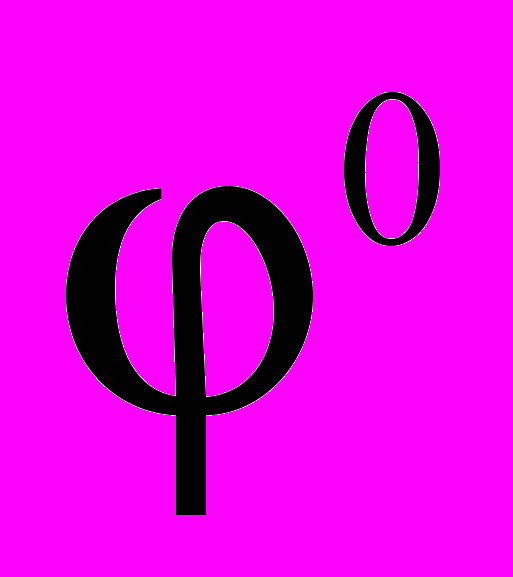 , В , В | Электродная полуреакция | 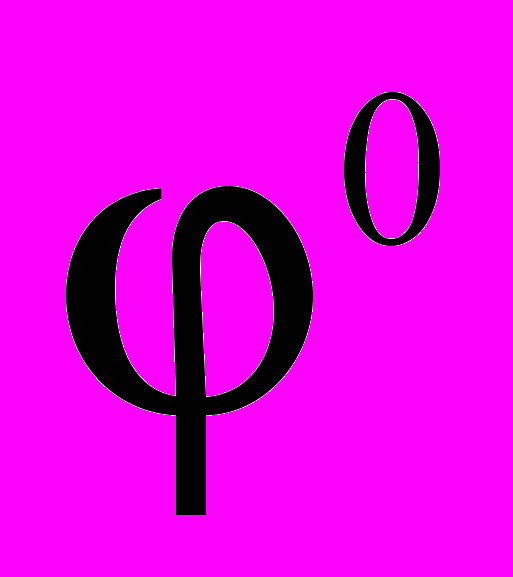 , В , В |
| Li+ (водн.) + 1e- = Li (тв.) | -3.045 | Cd2+ (водн.) + 2e- = Cd (тв.) | -0.403 |
| Rb+ (водн.) + 1e- =Rb(тв.)  | -2.925 | Co2+ (водн.) + 2e- = Co (тв.) | -0.277 |
| K+ (водн.) + 1e- = K (тв.) | -2.924 | Ni2+ (водн.) + 2e- = Ni (тв.) | -0.250 |
| Cs+ (водн.) + 1e- = Cs (тв.) | -2.923 | Sn2+ (водн.) + 2e- = Sn (тв.) | -0.136 |
| Ba2+ (водн.) + 2e- = Ba (тв.) | -2.905 | Pb2+ (водн.) + 2e- = Pb (тв.) | -0.126 |
| Ca2+ (водн.) + 2e- = Ca (тв.) | -2.866 | Fe3+ (водн.) + 3e- = Fe (тв.) | -0.037 |
| Na+ (водн.) + e- = Na (тв.) | -2.714 | 2H+ (водн.) + 2e- = H2 (г.) | 0.000 |
| Mg2+ (водн.) + 2e- = Mg (тв.) | -2.363 | Sb3+ (водн.) + 3e- = Sb (тв.) | +0.200 |
| Al3+ (водн.) + 3e- = Al (тв.) | -1.663 | Bi3+ (водн.) + 3e- = Bi (тв.) | +0.215 |
| Ti2+ (водн.) + 2e- = Ti (тв.) | -1.630 | Cu2+ (водн.) + 2e- = Сu (тв.) | +0.337 |
| Zr4+ (водн.) + 4e- = Zr (тв.) | -1.539 | Cu+ (водн.) + e- = Cu (тв.) | +0.520 |
| Mn2+ (водн.) + 2e- = Mn (тв.) | -1.179 | Ag+ (водн.) + e- = Ag (тв.) | +0.799 |
| V2+ (водн.) + 2e- = V (тв.) | -1.175 | Hg2+ (водн.) + 2e- = Hg (ж.) | +0.850 |
| Cr2+ (водн.) + 2e- = Cr (тв.) | -0.913 | Pd2+ (водн.) + 2e- = Pd (тв.) | +0,987 |
| Zn2+ (водн.) + 2e- = Zn (тв.) | -0.763 | Pt2+ (водн.) + 2e- = Pt (тв.) | +1,188 |
| Cr3+ (водн.) + 3e- = Cr (тв.) | -0.744 | Au3+ (водн.) + 3e- = Au (тв.) | +1,498 |
| Fe2+ (водн.) + 2e- = Fe (тв.) | -0.440 | Au+ (водн.) + e- = Au (тв.) | +1,692 |
Таблица 2
Стандартные теплоты ( энтальпия ) образования Н0298;
энтропии S0298 и энергии Гиббса образования G0298
некоторых веществ
| Вещество | Н0298 кДж/моль | S0298 Дж ( моль К ) | G0298 кДж/моль |
| 1 | 2 | 3 | 4 |
| Простые вещества | |||
| Ag(к) | 0 | 42,55 | 0 |
| Аl( к) | 0 | 28,33 | 0 |
| Br( г) | 0 | 152,21 | 0 |
| C( графит) | 0 | 5,74 | 0 |
| Cl( г) | 0 | 222,95 | 0 |
| Cu | 0 | 33,14 | 0 |
| Fe( к) | 0 | 27,15 | 0 |
| H2( г) | 0 | 130,52 | 0 |
| Hg(ж) | 0 | 75,90 | 0 |
| Mg( к) | 0 | 32,68 | 0 |
| N2( г) | 0 | 191,50 | 0 |
| О2(г) | 0 | 205,04 | 0 |
| S(к, ромб.) | 0 | 32,9 | 0 |
| Ti(k) | 0 | 30,6 | 0 |
| Неорганические соединения | |||
| Ag2O(к) | -31,1 | 121,0 | -11,3 |
| AgNO3 (к) | -124,5 | 140,9 | -33,6 |
| Al2O3( к) | -1676 | 49,9 | -1582 |
| Al2(SO4)3 (к) | -3442 | 239,2 | -3101 |
| BaCO3(к) | -1202 | 112,1 | -1164,8 |
| ВaO( к) | -553,54 | 70,29 | -525,84 |
| Ba (OH)2(к) | -943,49 | 100,83 | -855,42 |
| CO( г) | -110,53 | 197,55 | -137,15 |
| CO2(г) | -393,51 | 213,66 | -394,37 |
| CaO( к) | -635,09 | 38,07 | -603,46 |
| CaCO3 (к) | -1206,83 | 91,71 | -1128,35 |
| Ca(OH)2 | -985,12 | 83,39 | -897,52 |
| CS2 | +115,28 | | |
| CrCl3(к) | -556,47 | 123,01 | -486,37 |
| FeO(к) | -264,8 | 60,75 | -244,3 |
| Fe2O3(к) | -822,16 | 87,45 | -740,34 |
| Fe3O4(к) | -1117,1 | 146,2 | -1014,2 |
| Fe(OH)2(к) | -561,7 | 88,0 | -479,7 |
| Fe(OH)3(к) | -826,6 | 105,0 | -699,6 |
| HCl( г) | -92,31 | 186,79 | -95,30 |
| H2O( к) | -291,85 | (39,33) | - |
| H2O( ж) | -285,83 | 69,95 | -237,23 |
| H2O( г) | -241,81 | 188,72 | -228,61 |
| Н2О2(ж) | -187,8 | 109,5 | -120,4 |
| HCN( г ) | 135,0 | 113,1 | 125,5 |
| H2SO4(ж) | -813,99 | 156,90 | -690,14 |
| HNО3(ж) | -173,00 | 156,16 | -79,90 |
| HgCl2 | -229,00 | 242,3 | -197,4 |
| HgO(к) красн. | -90,9 | 70,29 | -58,6 |
| HgS(к)α | -59,0 | 82,4 | -51,4 |
| KCl( к) | -436,68 | 82,55 | -408,93 |
| K2Cr2O7(к) | -2067,27 | 291,21 | -1887,85 |
| KMnO4(к) | -828,89 | +171,54 | -729,14 |
| KNO3 (к) | -493,2 | 132,93 | -393,1 |
| K2SO4(к) | -1433,69 | 175,56 | -1316,04 |
| MnO2(к) | -521,49 | 53,14 | -466,68 |
| MgC( к) | -601,49 | 27,07 | -569,27 |
| MnSO4(к) | -3089,50 | 348,1 | -2635,1 |
| NH3(г) | -46,2 | 192,5 | -16,7 |
| NH4Cl( к) | -314,2 | 94,5 | -203,2 |
| NaBr | -151,86 | 62,1 | - |
| NaOH( ж) | -426,35 | 64,43 | -380,29 |
| Na2SO3( к) | -1089,43 | 146,02 | -1001,21 |
| Na2SO4(к) | -4324,75 | 591,87 | -3644,09 |
| Pb3O4(к) | -723,41 | 211,29 | -606,17 |
| PbCl2(к) | -359,82 | 135,98 | -314,56 |
| PbО2(к) | -276,56 | 71,92 | -217,55 |
Таблица 3
Варианты контрольного задания
| Номер варианта | Номера задач | ||||
| 1 | 1 | 11 | 21 | 31 | 41 |
| 2 | 2 | 12 | 22 | 32 | 42 |
| 3 | 3 | 13 | 23 | 33 | 43 |
| 4 | 4 | 14 | 24 | 34 | 44 |
| 5 | 5 | 15 | 25 | 35 | 45 |
| 6 | 6 | 16 | 26 | 36 | 46 |
| 7 | 7 | 17 | 27 | 37 | 47 |
| 8 | 8 | 18 | 28 | 38 | 48 |
| 9 | 9 | 19 | 29 | 39 | 49 |
| 0 | 10 | 20 | 30 | 40 | 50 |
