Лабораторная работа №10
| Вид материала | Лабораторная работа |
- Методические указания к лабораторным работам Лабораторная работа, 357.24kb.
- Лабораторная работа №3 кпк лабораторная работа №3 Тема: карманный персональный компьютер, 173.34kb.
- Методические возможности стенда Особенности работы на стендах уилс-1 Ознакомительное, 1487.3kb.
- Лабораторная работа по курсу «Физические основы микроэлектроники», 136.21kb.
- Лабораторная работа, 166.92kb.
- Самостоятельная работа по учебным пособиям, 471.48kb.
- Конспект урока в 9 классе по теме: «Магний», 84.54kb.
- Лабораторная работа №1 Введение в Windows. Работа с окнами и приложениями в Windows, 67.41kb.
- Знакомство c Excel, 1212.51kb.
- Лабораторная работа, 105.21kb.
Студент:
Группа:
Дата сдачи работы:
Лабораторная работа № 10
КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
Цель работы:
Основные понятия: коррозия: химическая, электрохимическая; коррозионный гальванический микроэлемент; анодные и катодные процессы; коррозия с водородной деполяризацией и кислородной деполяризацией; легирование; анодные и катодные защитные покрытия; катодная и протекторная защита металлов от коррозии; электрохимический потенциал; ЭДС гальванического элемента
Основные уравнения:
Уравнение Нернста для металлического электрода при 298 К:
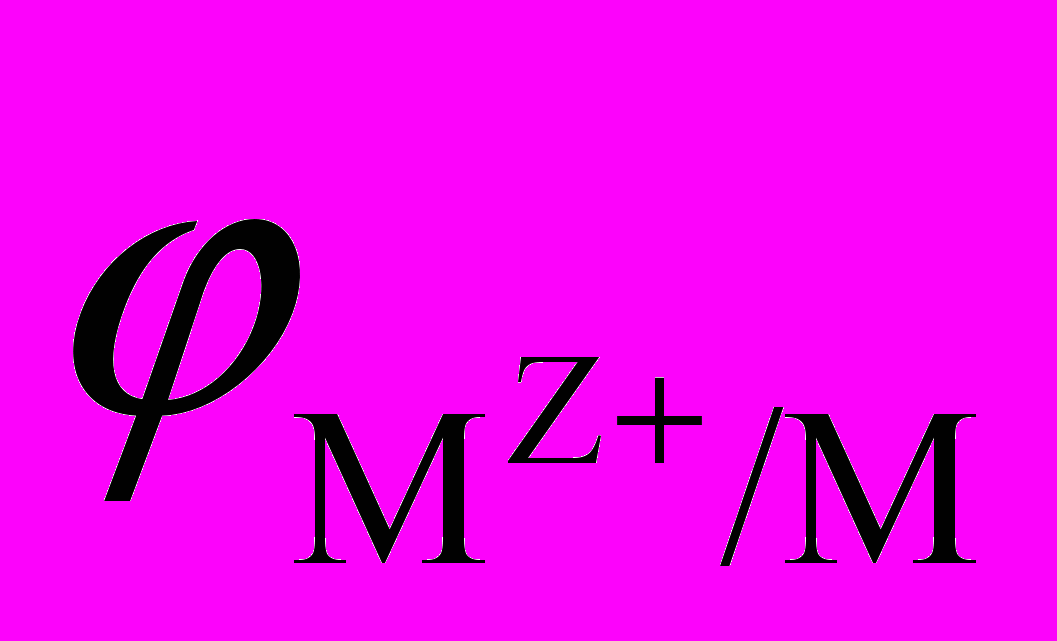 =
= 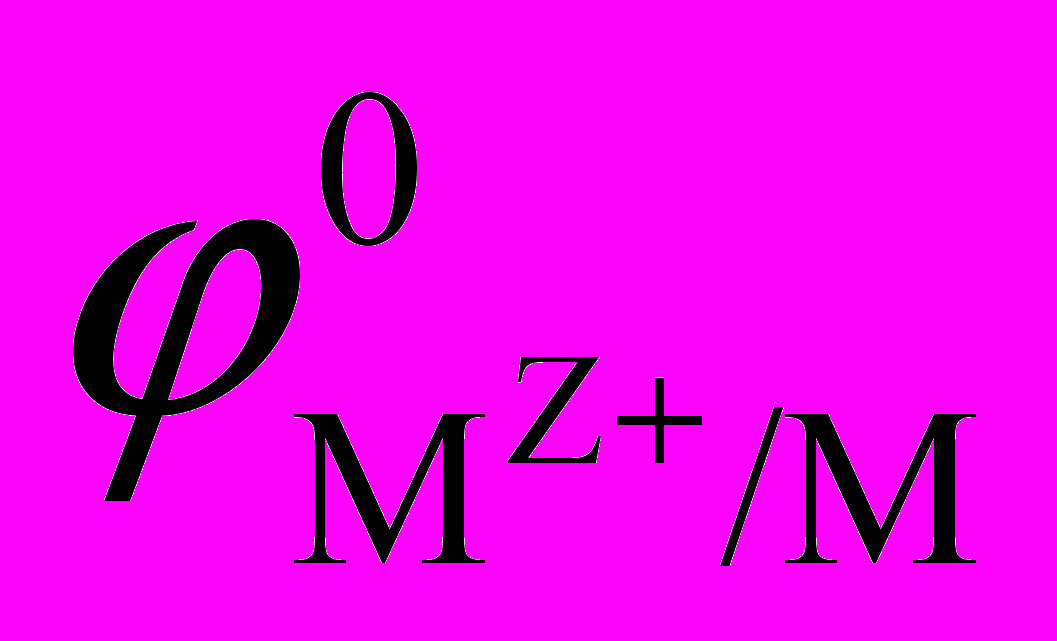 +
+ 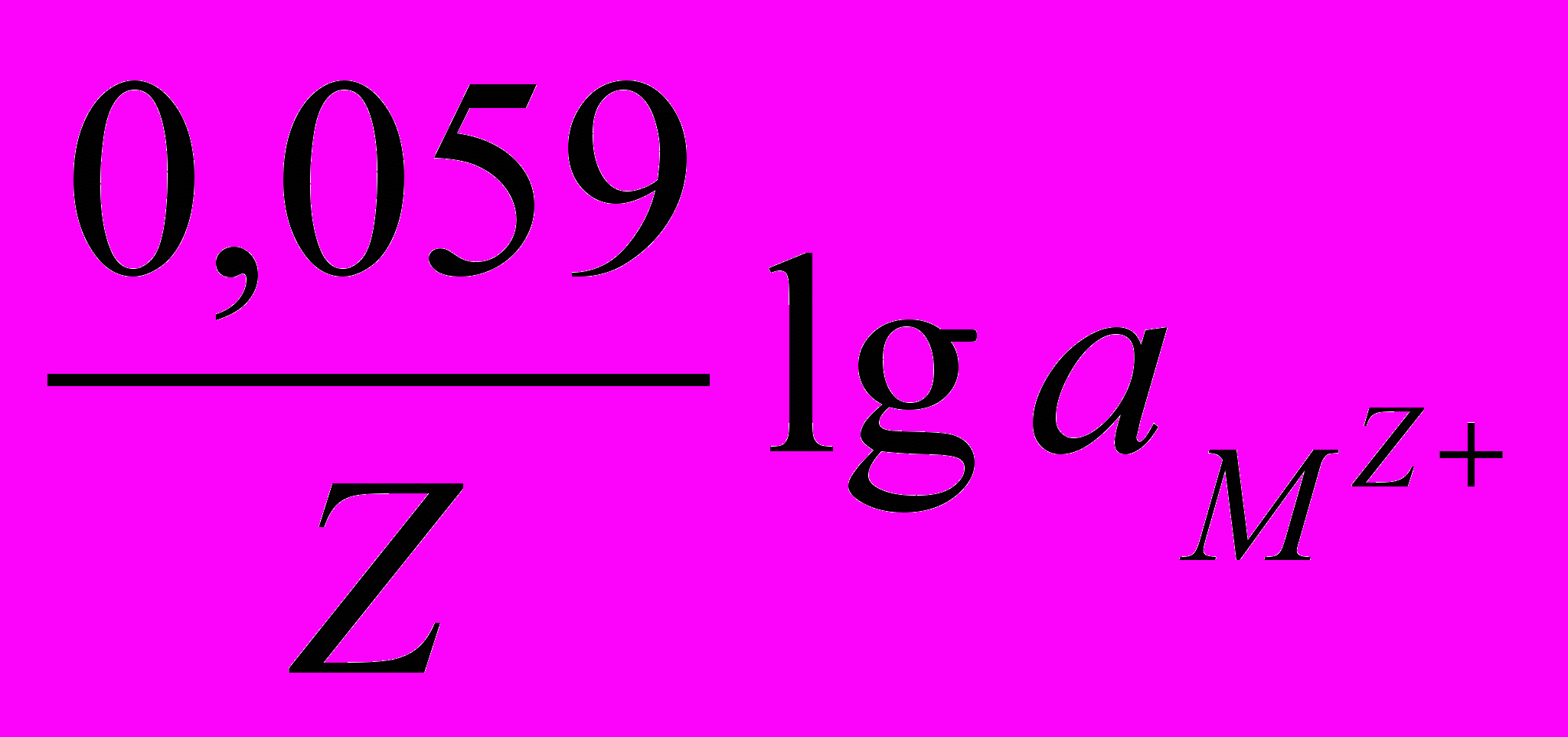
Уравнение Нернста для водородного электрода при 298 К:
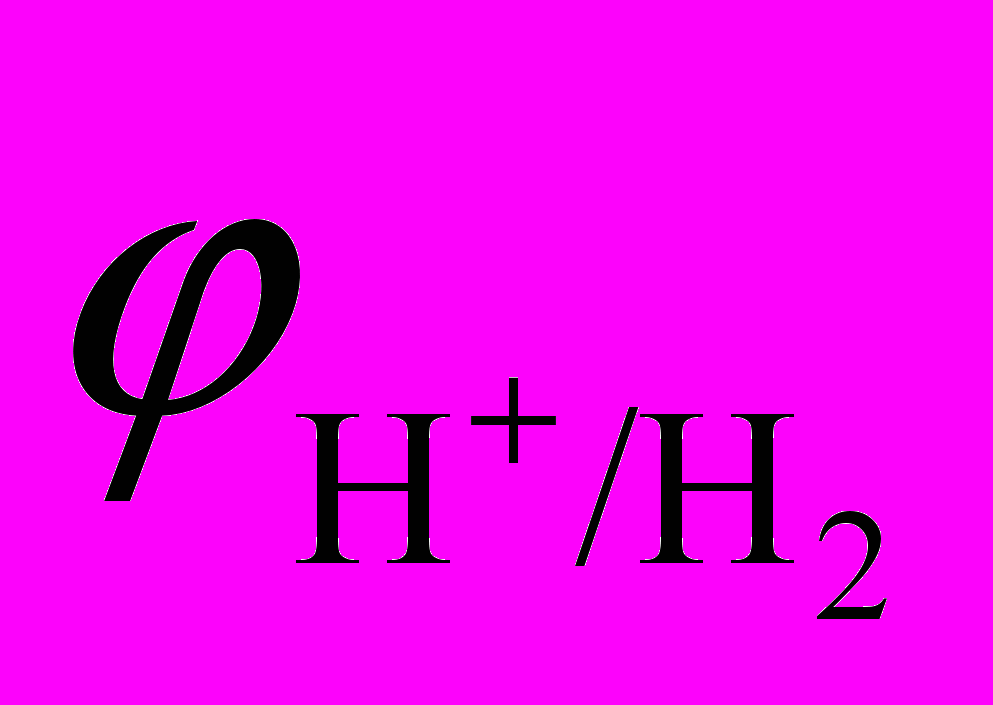 = – 0,059 рН
= – 0,059 рНУравнение Нернста для кислородного электрода при 298 К:
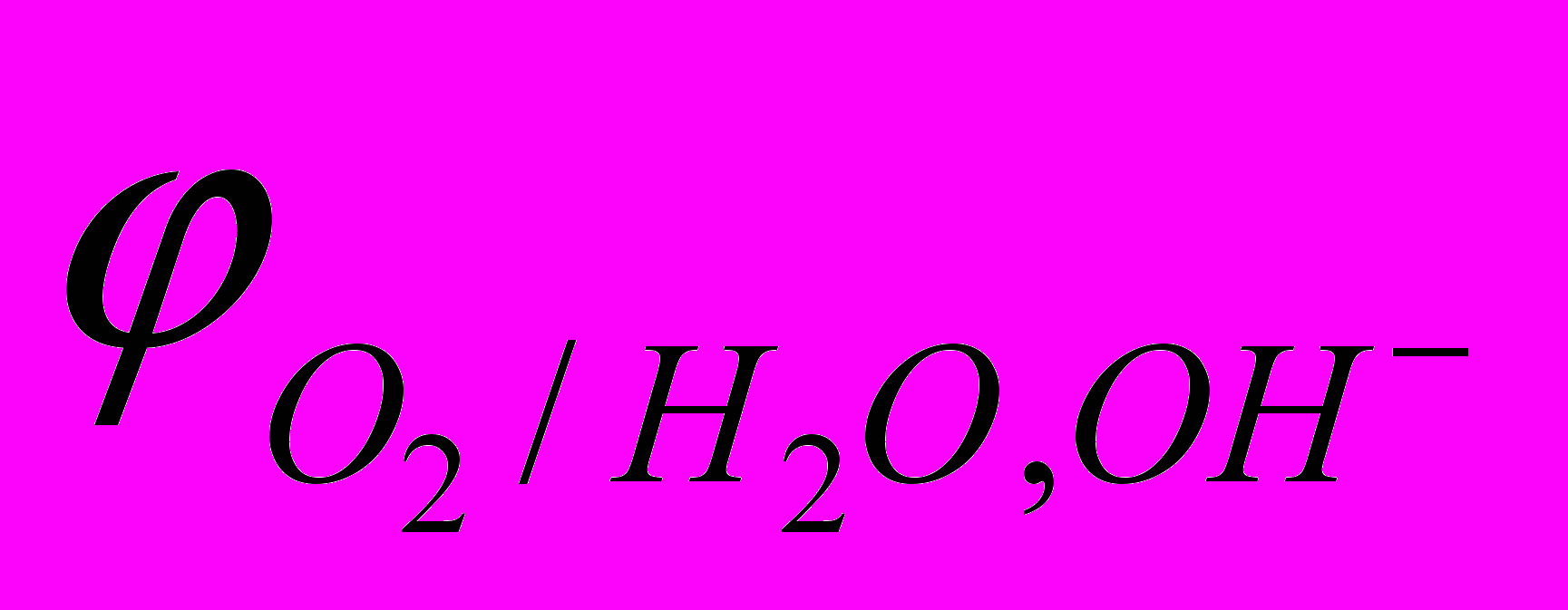 = 1,228 – 0,059 рН
= 1,228 – 0,059 рНЭДС гальванического элемента: Е = к – а
Качественные методы определения коррозионной стойкости металлов:
Железа: по интенсивности синего окрашивания водного раствора в присутствии красной кровяной соли K3[Fe(CN)6] – индикатора ионов Fe2+ или в присутствии желтой кровяной соли K4[Fe(CN)6] – индикатора ионов Fe3+:
Fe2+ + K3[Fe(CN)6] = KFe[Fe(CN)6] + 2K+
Желтый раствор Синий раствор (или осадок)
Fe3+ + K4[Fe(CN)6] = KFe[Fe(CN)6] + 3K+
Желтый раствор Синий раствор (или осадок)
Свинца: по интенсивности осадка желтого цвета в присутствии йодида калия:
Pb2+ + 2KI = PbI2 + 2K+
Желтый осадок
Опыт 1. Коррозия железа в различных электролитах
Таблица 1. Результаты эксперимента
| Коррозионная среда | Индикатор коррозии железа | Окраска раствора с железной пластиной | Уравнения коррозионных процессов |
| Н2О дистиллированная | K3[Fe(CN)6] | | |
| Водный раствор NaCl | K3[Fe(CN)6] | | |
| Водный раствор MgCl2 | K3[Fe(CN)6] | | |
| Водный раствор NaOH | K3[Fe(CN)6] | | |
| Водный раствор Cl2 | K4[Fe(CN)6] | | |
Выводы: (объясняют происходящие процессы; сравнивают интенсивность коррозии железа в данных средах)
Опыт 2. Коррозия стали в результате неравномерной аэрации
Состав ферроксил-индикатора: NaCl, K3[Fe(CN)6], фенолфталеин, агар-агар
Рис.1. Коррозия стали под каплей ферроксил-индикатора (с указанием окраски индикатора)
Уравнения коррозионных процессов:
Выводы: (указывают действие составных частей ферроксил-индикатора; определяют тип коррозионного процесса)
Опыт 3. Коррозия при контакте двух различных металлов
Металлы: цинк Zn (
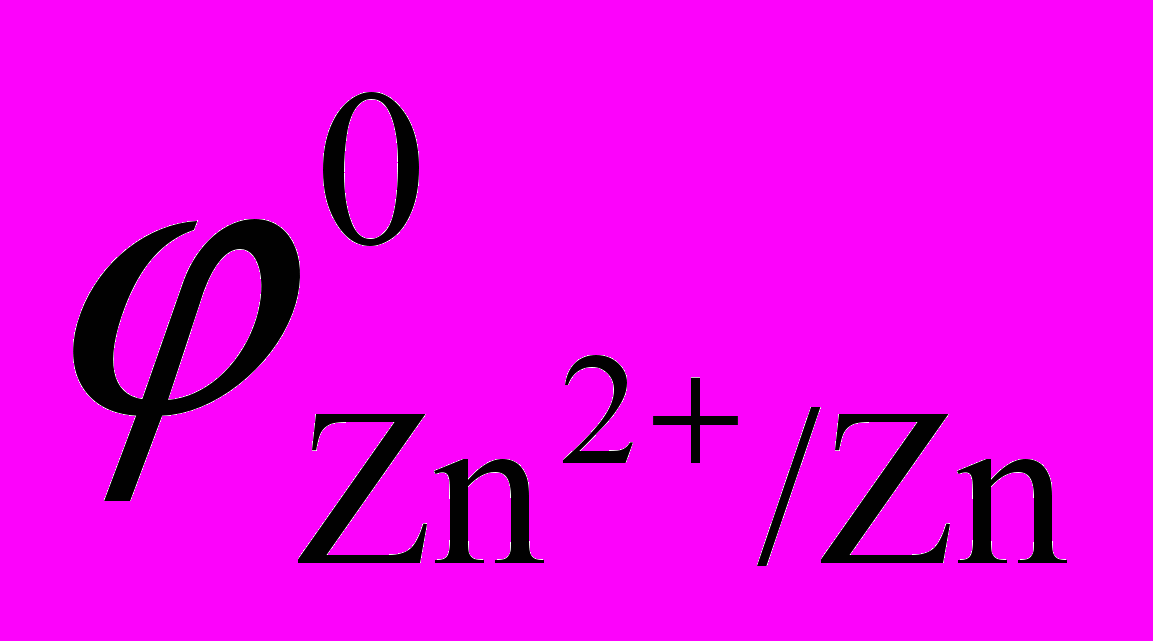 = ), медь Cu (
= ), медь Cu (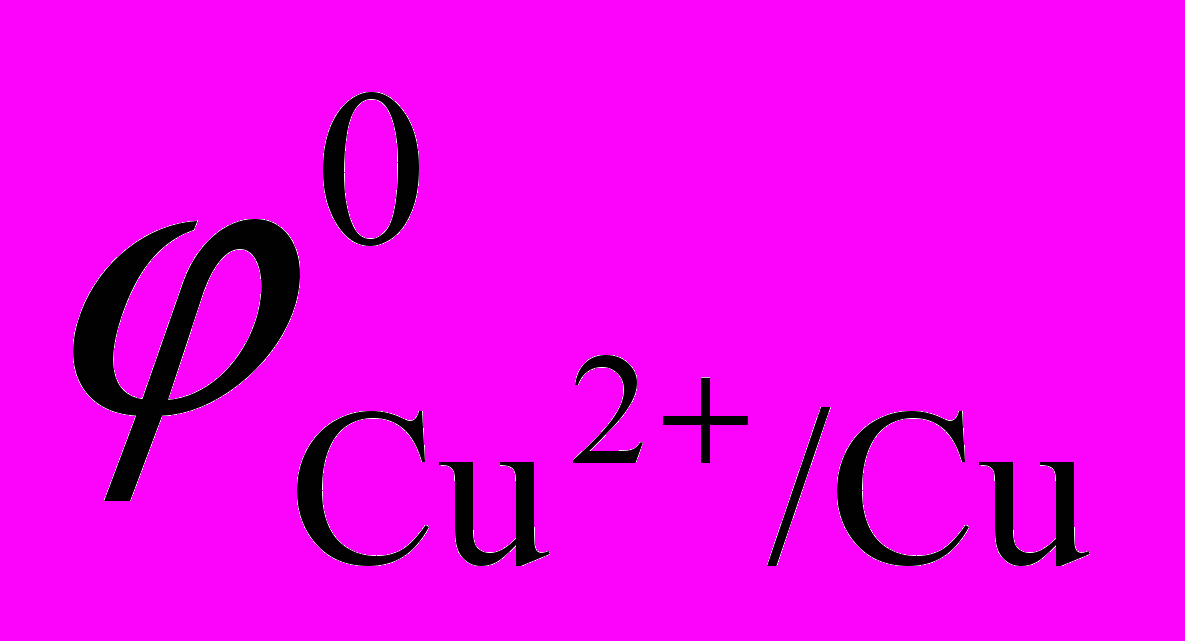 = )
= )Коррозионная среда: водный раствор серной кислоты H2SO4
Рис.2. Выделение пузырьков водорода: а) без контакта металлов и б) при контакте металлов
Уравнения коррозионных процессов:
а) б)
Расчет ЭДС коррозионного гальванического элемента:
Выводы: (объясняют происходящие процессы; определяют тип коррозионного процесса)
Опыт 4. Коррозия легированной стали в кислотном растворе
Коррозионная среда: водный раствор серной кислоты H2SO4
Индикатор коррозии железа: K3[Fe(CN)6]
Таблица 2. Результаты эксперимента
| Металлическая пластина | Окраска водного раствора с пластиной | Скорость выделения пузырьков газа | Уравнения коррозионных процессов |
| железная | | | |
| из нержавеющей стали | | | |
Выводы: (сравнивают интенсивность синей окраски водного раствора в присутствии индикатора и скорость выделения пузырьков газа; указывают, какой газ выделяется; объясняют причину различного поведения исследованных металлических пластин; определяют тип коррозионного процесса)
Опыт 5. Катодные и анодные защитные металлические покрытия
Коррозионная среда: водный раствор серной кислоты H2SO4
Индикатор коррозии железа: K3[Fe(CN)6]
Стандартные потенциалы:
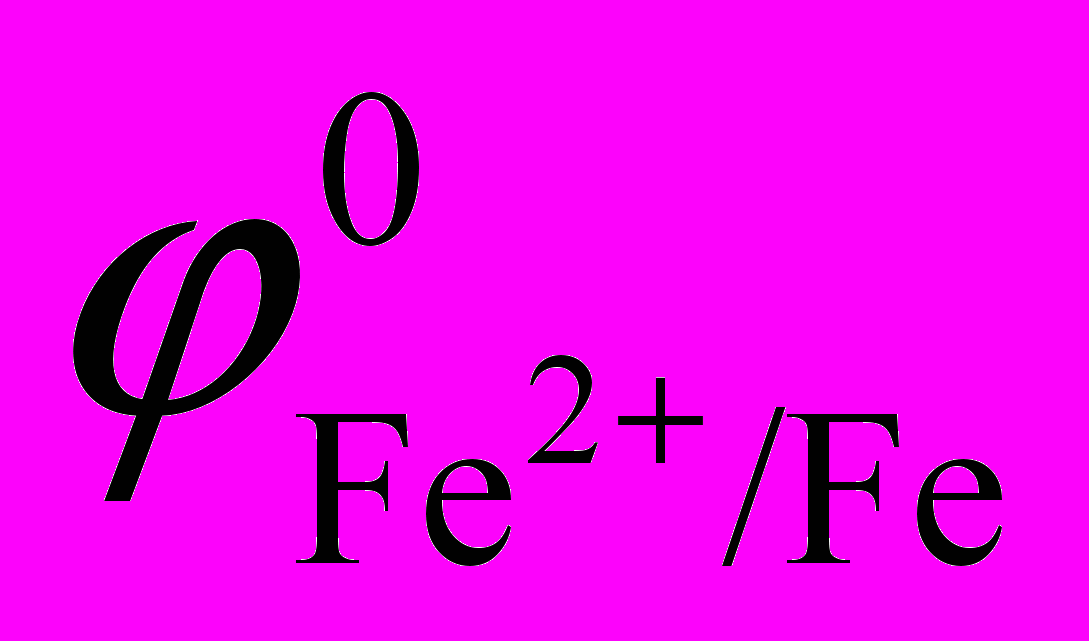 = ;
= ;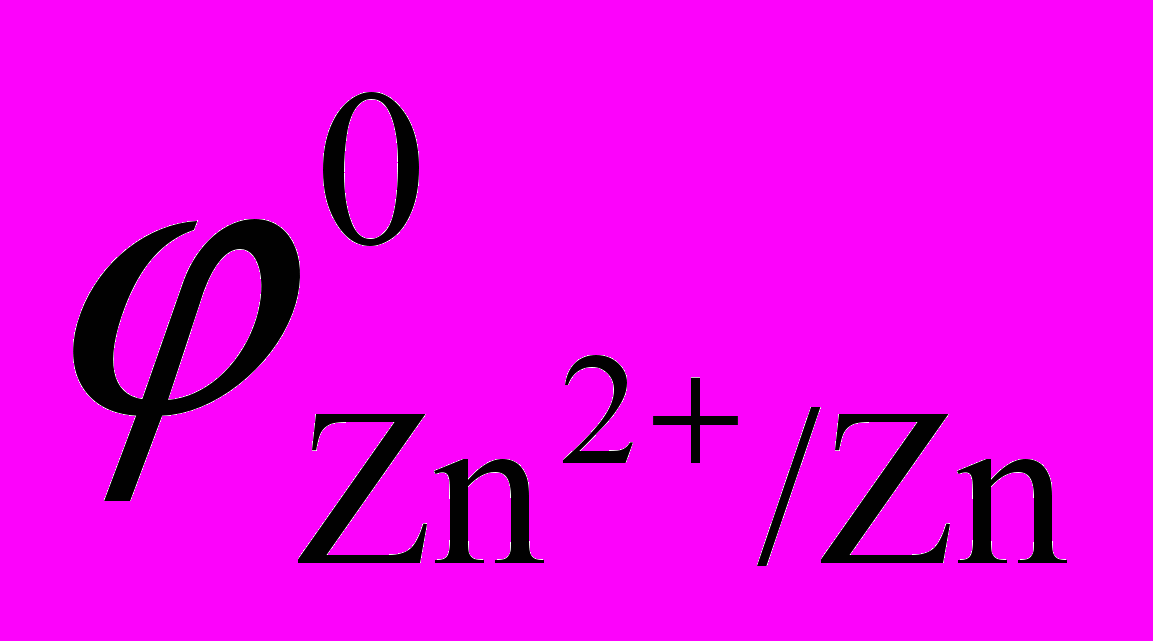 = ;
= ; 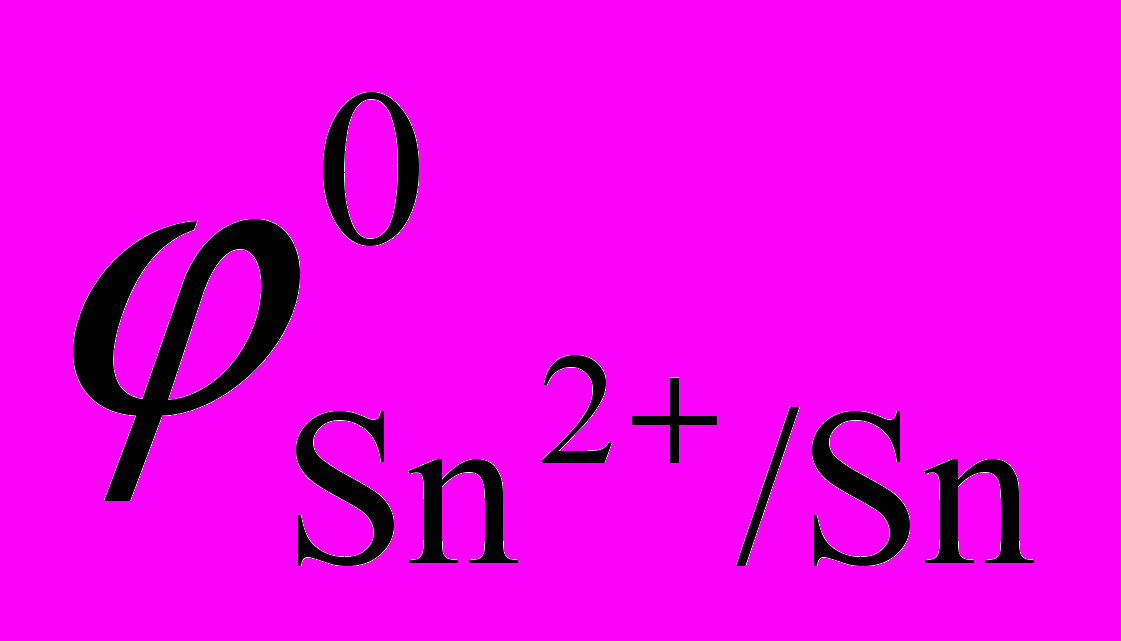 =
=Таблица 3. Результаты эксперимента
| Металлическая пластина | Окраска водного раствора с пластиной | Скорость выделения пузырьков газа | Уравнения коррозионных процессов |
| из оцинкованного железа | | | |
| из луженого железа | | | |
Выводы: (сравнивают интенсивность синей окраски водного раствора в присутствии индикатора и скорость выделения пузырьков газа; указывают, какой газ выделяется; объясняют причину различного поведения исследованных металлических пластин; определяют тип коррозионного процесса; указывают, какое покрытие относится к покрытиям анодного типа, какое – к катодного; объясняют принцип защитного действия в каждом случае; указывают, как нарушение покрытия влияет на процесс коррозии железа )
Опыт 6. Катодная защита железа
Коррозионная среда: водный раствор NaCl
Индикатор коррозии железа: K3[Fe(CN)6]
Таблица 4. Результаты эксперимента
| Металлическая пластина | Окраска водного раствора с пластиной | Выделение пузырьков газа на электродах | Уравнения электрохимических процессов |
| Железная | | – | |
| Железный стержень, соединенный с отрицательным полюсом внешнего источника тока | | | |
| Железный стержень, соединенный с положительным полюсом внешнего источника тока (перемена полярности) | | | |
Выводы: (сравнивают интенсивность синей окраски водного раствора в присутствии индикатора; указывают, какие газы выделяются на электродах при соединении железа с отрицательным и положительным полюсами внешнего источника тока; объясняют причину различного поведения исследованных металлических пластин; определяют тип коррозионного процесса; указывают, в каком случае осуществляется защита железа от коррозии; объясняют принцип действия катодной защиты металлов)
Опыт 7. Протекторная защита
а) Протекторная защита стали
Коррозионная среда: водный раствор серной кислоты H2SO4
Индикатор коррозии железа: K3[Fe(CN)6]
Стандартные потенциалы:
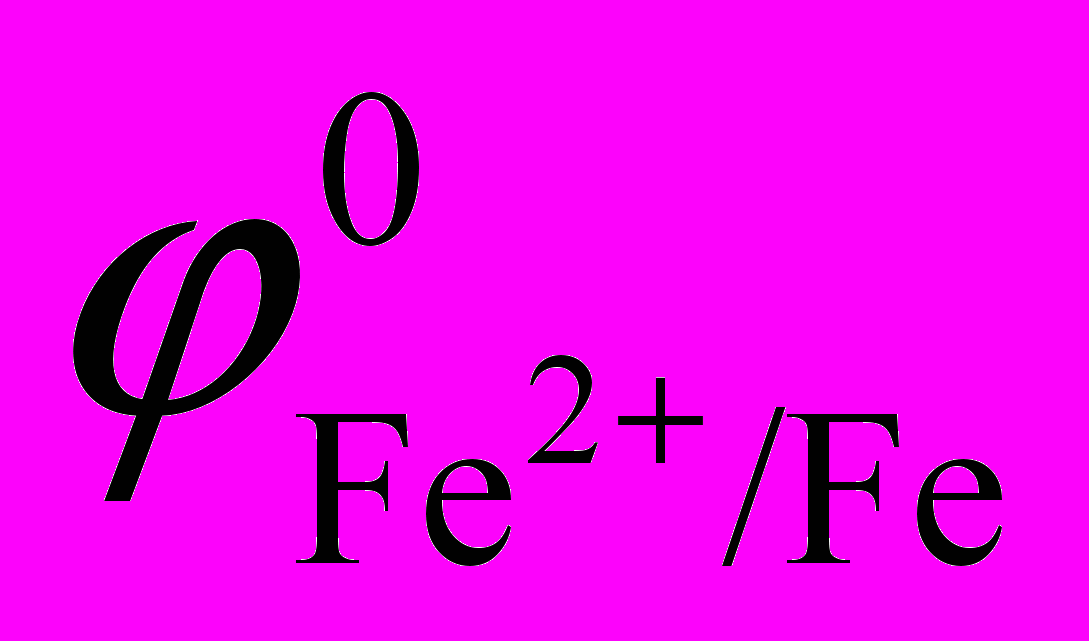 = ;
= ;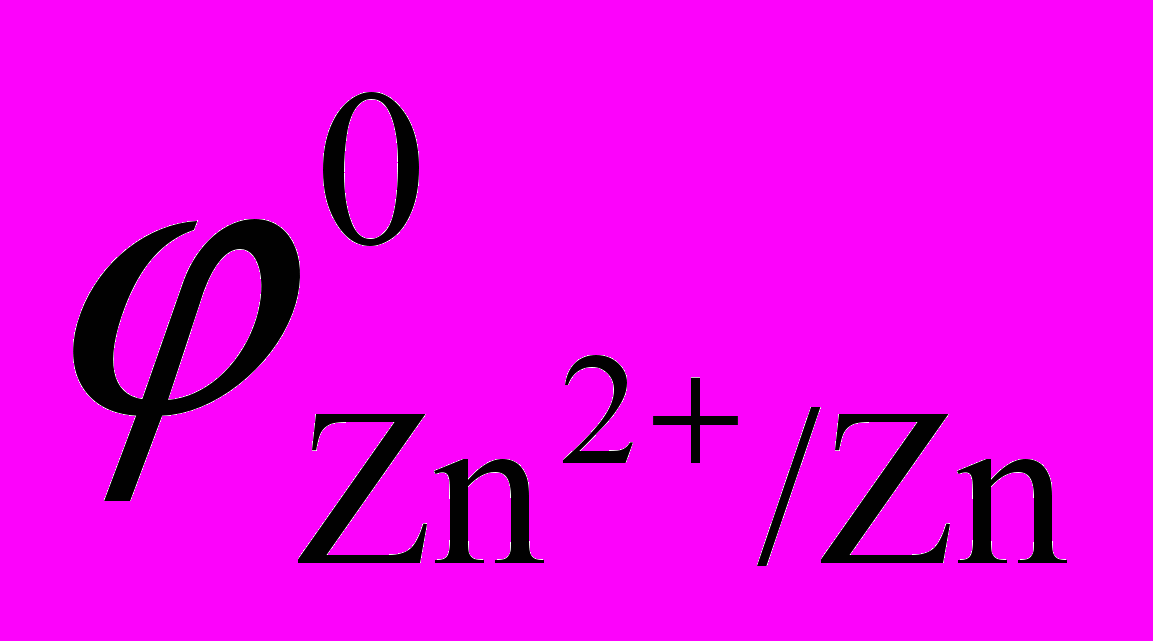 =
= Таблица 5. Результаты эксперимента
| Металлическая пластина | Окраска водного раствора с пластиной | Скорость выделения пузырьков газа | Уравнения коррозионных процессов |
| Стальная | | | |
| Стальная, соединенная с цинковой пластиной | | | |
Выводы: (сравнивают интенсивность синей окраски водного раствора в присутствии индикатора; указывают, какой газ выделяется; объясняют причину различного поведения исследованных металлических пластин; определяют тип коррозионного процесса; указывают, в каком случае осуществляется защита железа от коррозии; объясняют принцип действия протекторной защиты железа)
б) Протекторная защита свинца
Коррозионная среда: водный раствор уксусной кислоты СН3СООН
Индикатор коррозии свинца: KI
Стандартные потенциалы:
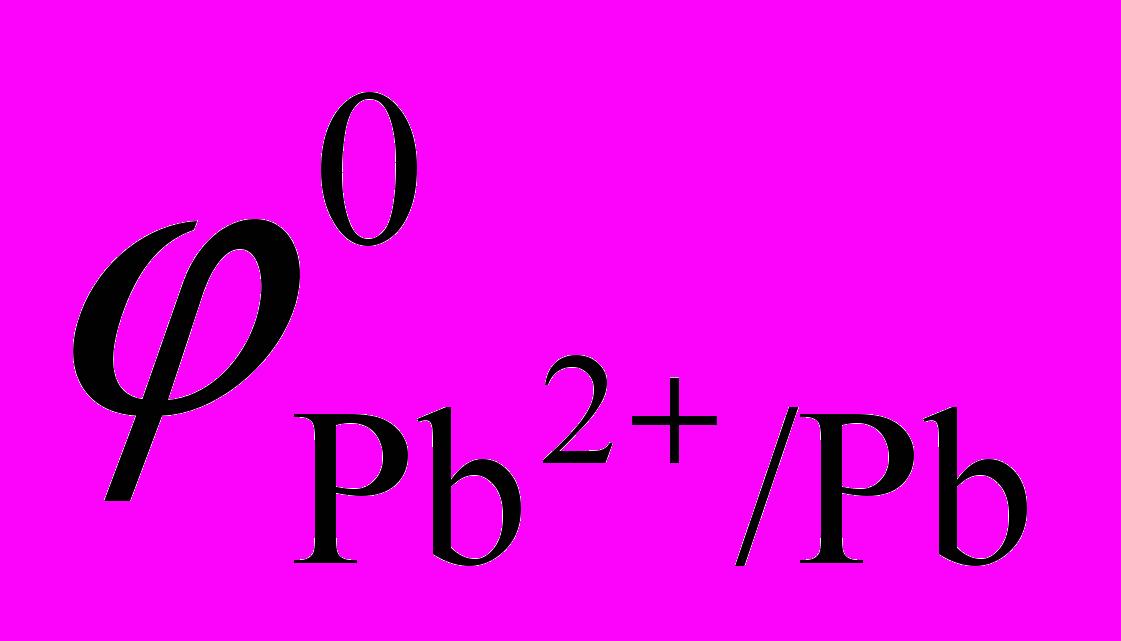 = ;
= ;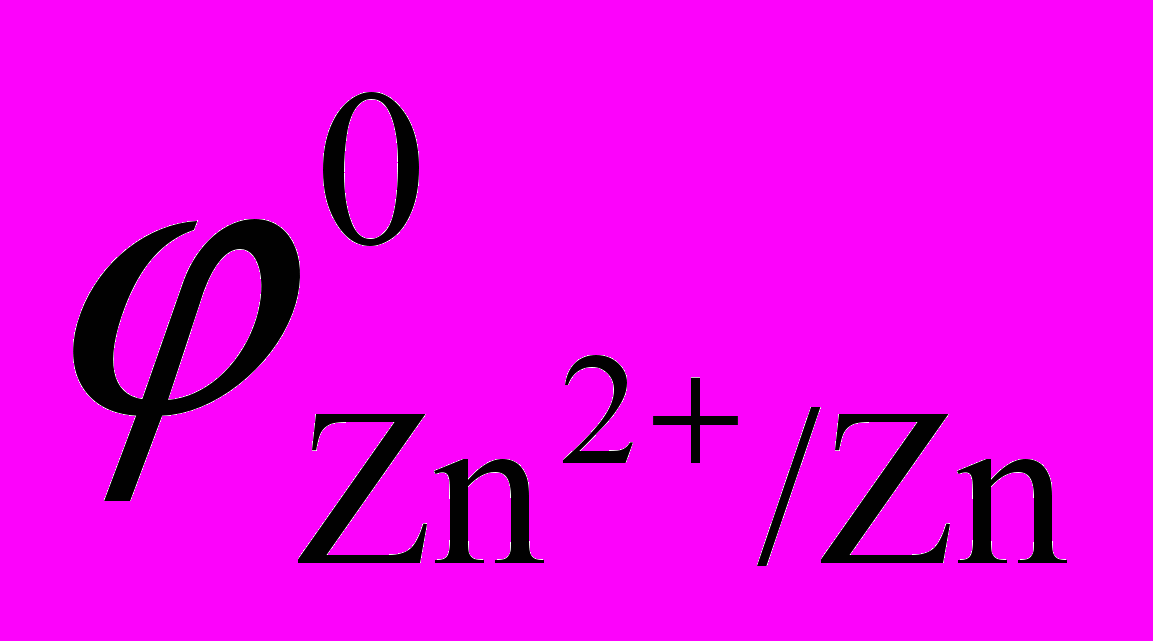 =
= Таблица 6. Результаты эксперимента
| Металлическая пластина | Относительное количество осадка в растворе | Скорость выделения пузырьков газа | Уравнения коррозионных процессов |
| Свинцовая | | | |
| Свинцовая, соединенная с цинковой пластиной | | | |
Выводы: (сравнивают относительное количество осадка в растворе в присутствии индикатора; указывают, какой газ выделяется; объясняют причину различного поведения исследованных металлических пластин; определяют тип коррозионного процесса; указывают, в каком случае осуществляется защита свинца от коррозии; объясняют принцип действия протекторной защиты свинца)
Создатель документа Овчаренко Л.П.
