Программа, методические указания и контрольные задания для студентов ускоренной формы заочного обучения специальности 320700 «Охрана окружающей среды»
| Вид материала | Программа |
СодержаниеВарианты 131 - 150. Варианты контрольных заданий Рекомендуемая литература |
- Рабочая программа, методические указания и контрольные задания для студентов специальности, 707.43kb.
- Рабочая программа методические указания контрольные задания для студентов специальности, 833.92kb.
- Программа, методические указания и контрольные задания для студентов 5 курса заочного, 2134.85kb.
- Программа, методические указания и контрольные задания для студентов 5 курса заочного, 439.54kb.
- Финанс ы методические указания и контрольные задания для студентов заочной формы обучения, 825.1kb.
- Методические указания и контрольные задания по английскому языку орёл 2009, 222.99kb.
- Программа, методические указания и контрольные задания по учебной дисциплине "оценка, 1129.32kb.
- Методические указания и контрольные задания для студентов заочной формы обучения, специальность, 838.97kb.
- Управлением Минобразования России общие методические указания, 378.75kb.
- Процессы и аппараты защиты, 336.4kb.
Варианты 111-130. Дана система, состоящая из парообразного вещества и твердого пористого адсорбента, при температуре Т.
- Постройте изотермы адсорбции и десорбции.
- Определите тип сорбции, возможность гистерезиса адсорбции и капиллярной конденсации.
- Рассчитайте пористость адсорбента по ветви десорбции, в случае ее отсутствия – ветви адсорбции.
- Рассчитайте радиусы пор по уравнению Томсона-Кельвина и постройте интегральную и дифференциальную кривые распределения пор адсорбента по радиусам.
- Определите тип адсорбента по величинам радиусов пор.
Таблица 2.
Задания к вариантам 111-130
| Вариант | ТК | Адсорбент | Адсорбат | Р\Рs | Р 10-2 Па | А, моль\кг | |
| Адсорция | Десорбция | ||||||
| 111 | 293 | Уголь | H2O | - | 5,32 10,0 11,3 12,5 14,7 17,3 20,0 23,3 | 0,5 2,3 4,0 5,0 10,0 16,0 20,0 28,5 | 0,5 2,5 5,0 7,5 15,2 23,0 27,6 28,5 |
| 112 | 293 | Уголь | Бензол С6H6 | - | 19,8 29,9 39,8 59,6 79,7 89,4 99,2 | 4,5 5,4 6,5 10,2 14,4 17,0 20,0 | 4,5 6,0 9,0 13,9 17,5 19,0 20,0 |
| 113 | 293 | Уголь | Н2O | - | 4,65 9,3 14,0 18,7 20,9 23,3 | 0,5 1,5 8,5 20,0 24,0 28,5 | 0,5 1,5 13,5 27,0 28,0 28,5 |
| 114 | 293 | Уголь | CH3OH | | 64,0 76,8 90,0 102,5 114,5 128,0 | 24,0 28,3 31,0 36,0 46,0 55,0 | 24,0 30,0 37,5 44,0 50,0 55,0 |
| 115 | 293 | Уголь | CH3OH | | 12,8 25,6 38,4 52,2 64,0 76,8 90,0 102,0 | 7,5 8,0 8,3 8,6 9,4 10,2 11,4 13,0 | 7,5 8,3 9,0 9,6 10,2 11,0 11,7 13,0 |
| 116 | 293 | Уголь | H2O | | 0,1 0,2 0,4 0,6 0,8 0,9 1,0 | 6,5 9,0 11,5 14,0 22,5 26,5 30,0 | 7,0 10,3 13,5 16,5 25,0 27,6 30,0 |
| 117 | 293 | Уголь | CH3OH | - | 16,0 32,0 64,0 79,0 96,0 110,0 128,0 | 2,5 3,5 4,8 6,3 13,0 19,0 22,5 | 2,5 3,5 4,8 6,5 17,5 20,2 22,5 |
| 118 | 293 | Уголь | H2O | - | 2,93 5,56 11,7 17,5 20,2 23,4 | 1,0 1,4 1,7 2,3 3,0 5,0 | 1,0 1,5 2,0 2,6 3,5 5,0 |
| 119 | 293 | Монтмориллонит | Н2O | - | 2,34 4,68 7,03 9,35 11,7 14,0 16,4 21,0 23,0 | 4,0 6,0 7,3 8,3 9,0 9,5 10,0 12,6 17,0 | 4,0 6,0 7,3 8,3 9,0 11,0 11,6 14,0 17,0 |
| 120 | 353 | Цеолит | H2O | | 1,33 2,66 5,32 6,65 9,30 13,30 17,30 | 7,0 7,7 8,34 8,63 8,90 9,12 9,33 | |
| 121 | 298 | Цеолит | C2H6 | | 50,0 100,0 150,0 200,0 300,0 500,0 | 2,0 2,37 2,53 2,63 2,77 2,87 | - |
| 122 | 293 | Уголь | CH3CI | | 0,0013 0,0051 0,0130 0,033 0,167 0,373 0,956 3,198 | 1,13 1,69 2,25 2,82 3,94 4,50 5,25 5,77 | - |
| 123 | 293 | Силикагель | CH3OH | - | 16,0 32,0 64,0 79,0 96,0 110,0 128,0 | 2,5 3,5 4,8 6,3 13,0 19,0 22,5 | 2,5 3,5 4,8 6,5 17,5 21,2 22,5 |
| 124 | 323 | Уголь | C6H6 | - | 0,0004 0,0030 0,0187 0,1470 0,495 1,029 2,725 7,214 | 0,41 0,68 1,36 2,38 3,26 3,80 4,61 5,09 | |
| 125 | 293 | Уголь | H2O | 0,1 0,2 0,4 0,6 0,8 0,9 1,0 | - | 6,5 9,0 11,5 14,0 22,5 26,5 30,0 | 7,0 10,3 13,5 16,5 25,0 27,6 30,0 |
| 126 | 293 | Уголь | H2O | 0,1 0,2 0.3 0,5 0,7 0,9 1,0 | | 3,75 5,30 6,20 8,75 10,4 12,5 13,2 | 5,70 7,00 7,90 10,0 11,50 13,00 13,20 |
| 127 | 293 | Пшеничный глеадин | H2O | 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 | | 1,75 3,22 3,60 4,67 5,55 6,70 6,90 9,18 | 2,66 3,78 4,90 6,16 6,95 7,70 8,45 9,22 |
| 128 | 293 | Силикагель | CH3OH | 0,2 0,4 0,6 0,8 0,9 1,0 | - | 0,8 1,3 1,6 2,2 4,0 38,7 | 0,8 1,3 1,7 3,0 37,0 38,7 |
| 129 | 293 | Сажа канальная | C6H6 | 0,1 0,2 0,3 0,4 0,5 0,7 | - | 0,4 0,59 0,65 0,70 0,85 1,35 | - |
| 130 | 293 | Сажа | CH3OH | 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 | - | 1,75 2,15 2,42 2,66 2,80 3,20 3,50 3,80 | - |
Таблица 3.
Некоторые физические свойства адсорбатов
| Адсорбат | Т, К | V 10-3 м3\кмоль | РS 10-2 Па | 103 Дж/м2 |
| Н2О С6H6 С6H6 СН3ОH С2Н6 СН3СI | 293 293 323 293 298 64,0 | 18,0 89,0 92,0 40,6 64,0 80,7 | 23,4 99,3 354,8 128,0 37000,0 239,9 | 72,5 28,9 24,88 22,6 19,9 27,14 |
Варианты 131 - 150. Для полного обессоливания методом ионообменной адсорбции V м3 природной или разбавленной сточной воды последовательно пропускают через колонки с m1 кг катионита в Н-форме и с m2 кг анионита в ОН-форме. Динамические обменные емкости катионита равны:
А
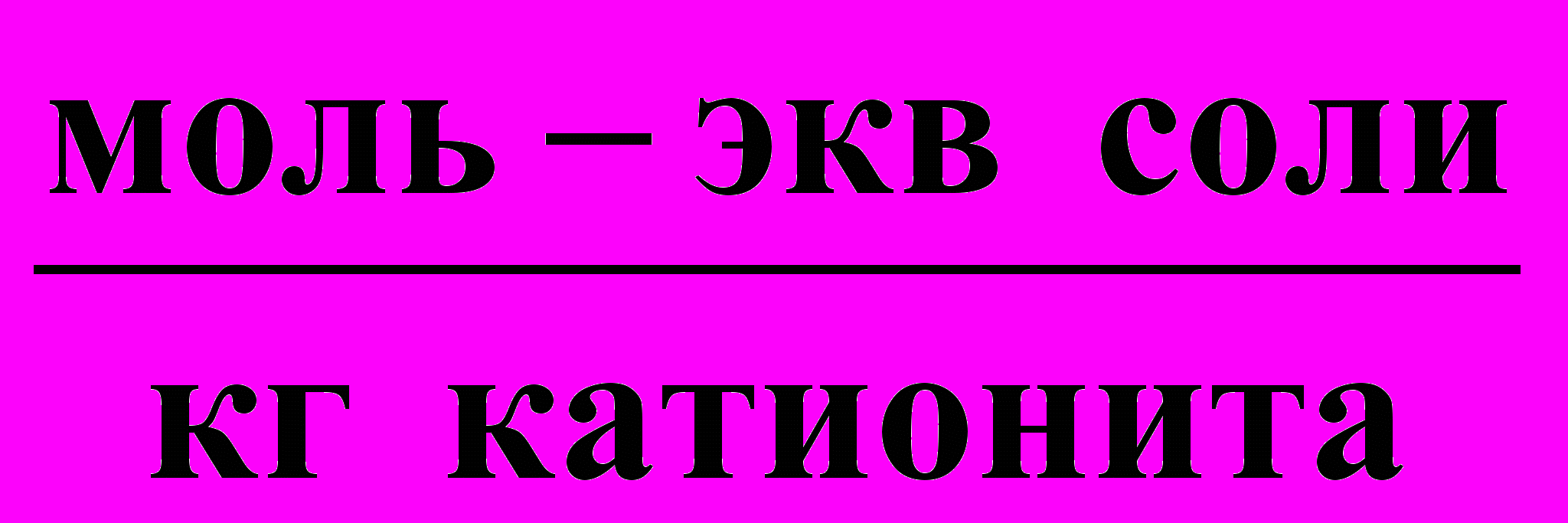 ; В
; В 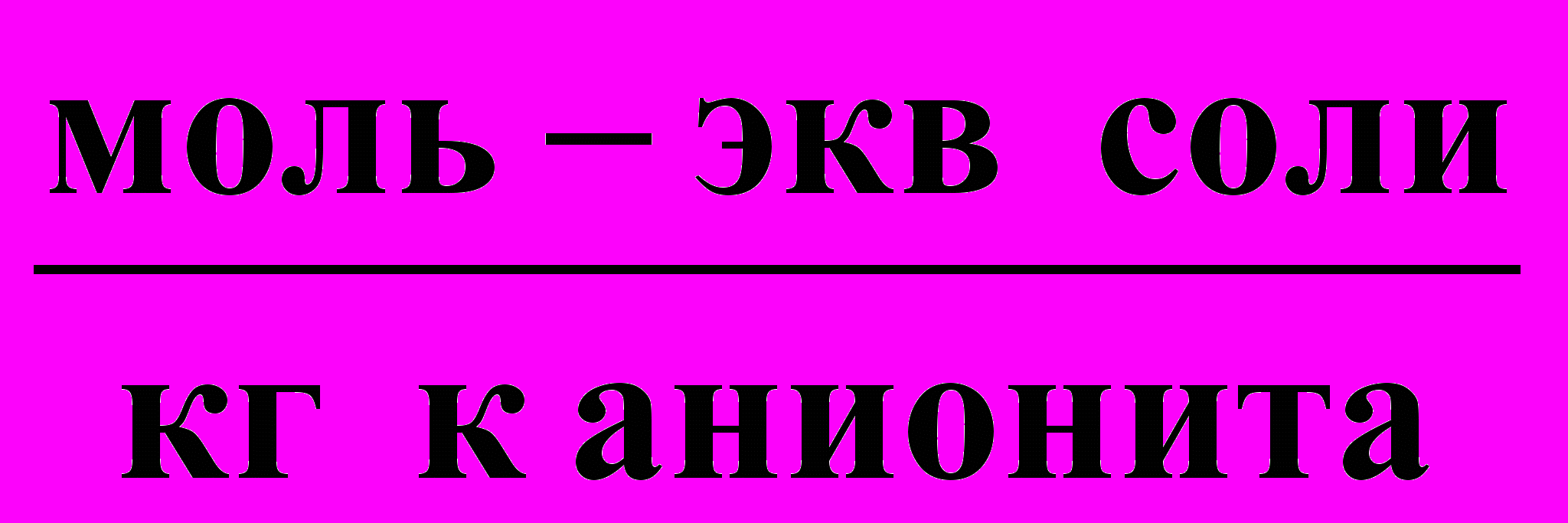 .
.Охарактеризуйте процесс ионообменной адсорбции из воды на ионитах (варианты заданий приведены в табл. 5).
- Напишите уравнения ионообменных реакций, протекающих на катионите и анионите с участием ионов каждой соли.
- Определите, в какой последовательности будут адсорбироваться ионы на катионите и анионите. Расположив их в ряд по уменьшению адсорбируемости.
- Пересчитайте концентрацию солей в водном растворе, выраженную в г/л, в молярную концентрацию эквивалентов (моль экв/л) и определите суммарную концентрацию солей в (моль экв/л).
- рассчитайте искомые величины х, указанные в варианте задания.
- Предложите методы регенерации отработанных катионитов и анионитов и напишите уравнения соответствующих ионообменных реакций.
Таблица 4
Задания к вариантам 131 – 150.
| Вариант | m1, кг | m 2, кг | А, 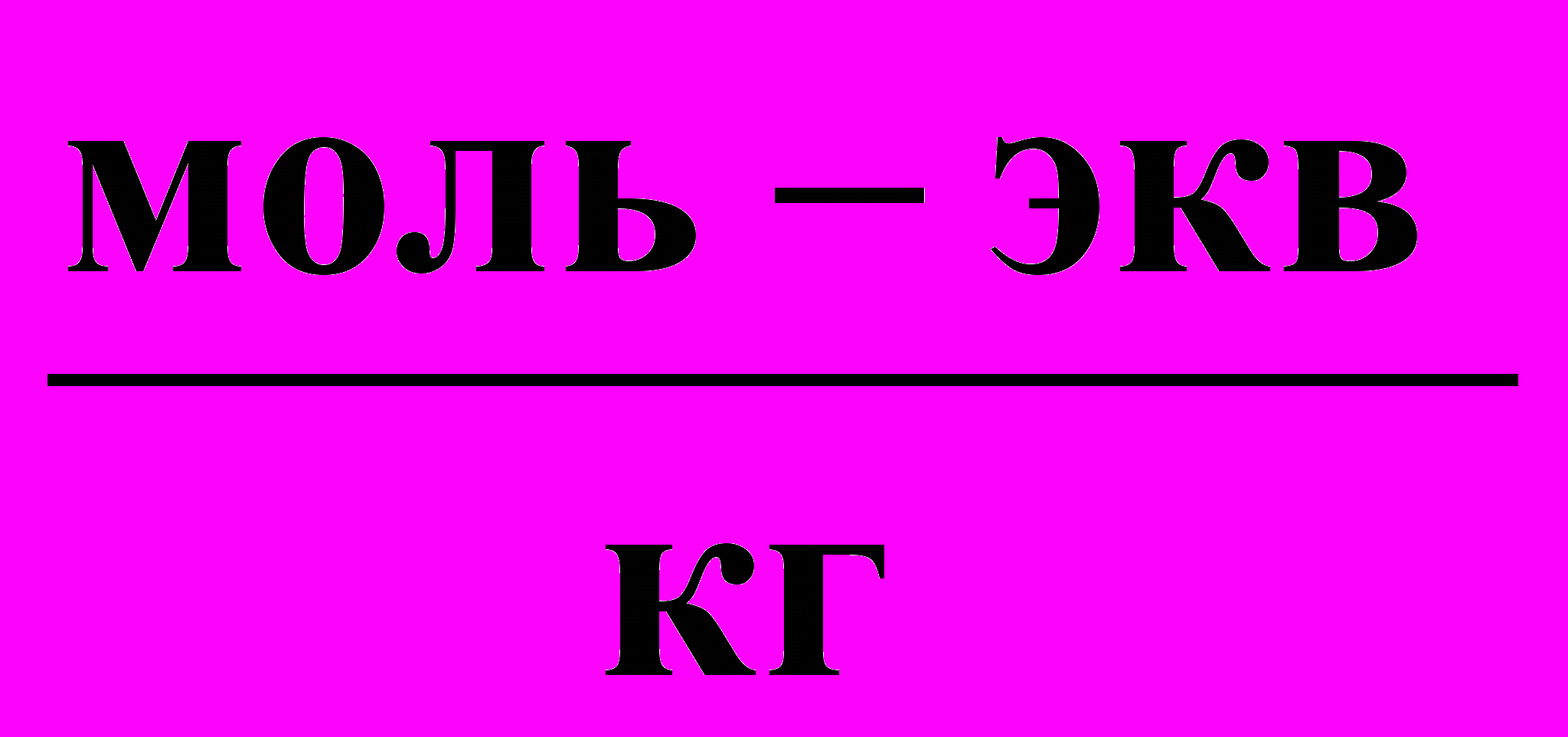 | В, 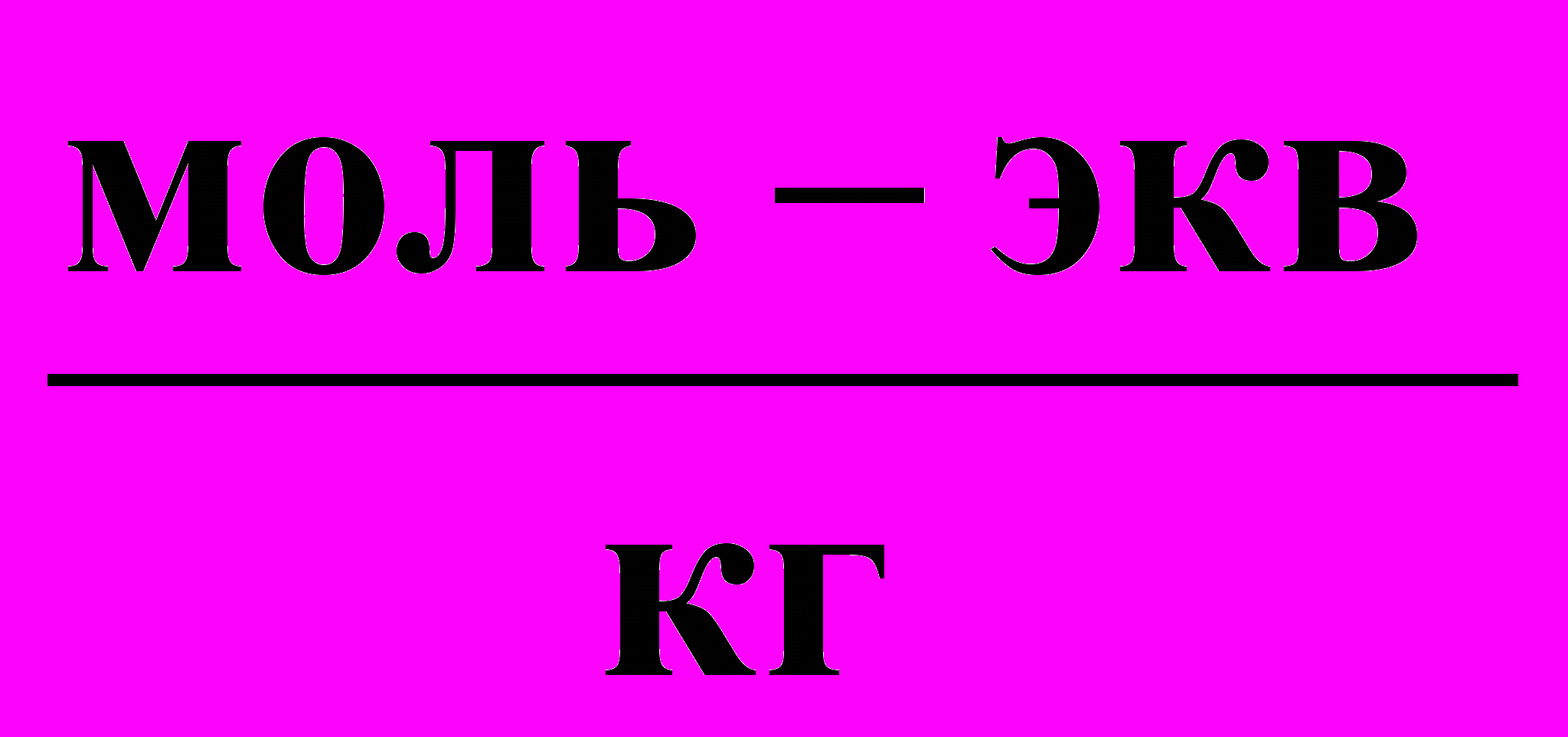 | V, м3 | Солевой состав водного раствора | |
| Формула соли | С, г/л | ||||||
| 1 | х | х | 4,2 | 3,5 | 100 | NaCl MgSO4 Ca(HCO3)2 FeCl3 | 0,025 0,04 0,012 0,006 |
| 2 | 1 | 1 | 4,8 | 4,0 | х | MgCl2 NaCl MgSO4 Al(NO3)3 | 0,031 0,031 0,023 0,018 |
| 3 | х | х | 4,0 | 3,8 | 50 | MgCl2 H2[ZnCl4] H2[CoCl4] Na2SO4 | 0,012 0,021 0,030 0,025 |
| 4 | 1,5 | 2 | 4,3 | 3,9 | х | AlCl3 Sn(NO3)2 ZnCl2 Na2SO4 | 0,020 0,012 0,037 0,025 |
| 5 | х | х | 4,2 | 4,7 | 150 | CdCl2 MgCl2 KCl FeCl3 | 0,015 0,02 0,03 0,018 |
| 6 | 1 | 1,5 | 3,5 | 3,8 | х | NaCl MgCl2 CaSO4 AlCl3 | 0,025 0,03 0,01 0,021 |
| 7 | х | х | 4,0 | 4,2 | 80 | AgNO3 Hg(NO3)2 Pb(NO3)2 Fe(NO3)3 | 0,041 0,033 0,028 0,011 |
| 8 | 2 | 2,5 | 4,5 | 3,8 | х | CuSO4 NaCl MgSO4 Fe2(SO4)3 | 0,015 0,022 0,013 0,032 |
| 9 | х | х | 4,0 | 4,2 | 120 | Pb(NO3)2 AgNO3 Hg(NO3)2 Al(NO3)3 | 0,01 0,04 0,021 0,012 |
| 10 | 2,0 | 2,0 | 3,9 | 4,0 | х | NaCl MgCl2 MgSO4 AlCl3 | 0,022 0,04 0,021 0,018 |
| 11 | х | х | 3,5 | 4,2 | 65 | SnCl2 CdCl2 FeCl3 NaNO3 | 0,014 0,01 0,021 0,014 |
| 12 | 1,5 | 1,5 | 3,9 | 4,1 | х | KCl Ni(HCO3)2 MgCl2 Al(NO3)3 | 0,02 0,012 0,031 0,017 |
| 13 | х | х | 4,2 | 4,0 | 110 | NaNO3 MgCl2 Cd(HCO3)2 Hg(NO3)2 | 0,04 0,01 0,015 0,002 |
| 14 | 1,0 | 1,0 | 4,0 | 3,8 | х | CuSO4 MgSO4 NaCl Fe(NO3)3 | 0,012 0,025 0,015 0,012 |
| 15 | х | х | 3,5 | 3,7 | 130 | KCl NiSO4 FeCl3 NaNO3 | 0,02 0,015 0,02 0,009 |
| 16 | 2,5 | 2,5 | 4,1 | 3,9 | х | KNO3 MgSO4 AlCl3 Fe(NO3)3 | 0,03 0,01 0,025 0,009 |
| 17 | х | х | 3,7 | 4,2 | 90 | Ca(HCO3)2 MgCl2 FeCl3 NaNO3 | 0,025 0,015 0,008 0,011 |
| 18 | 1,8 | 1,5 | 4,3 | 3,8 | х | CrCl3 Mg(NO3)2 NiCl2 KCl | 0,008 0,001 0,01 0,02 |
| 19 | х | х | 4,0 | 3,7 | 160 | NaCl Mg(NO3)2 Fe2(SO4)3 CuCl2 | 0,08 0,012 0,005 0,02 |
| 20 | 2,5 | 2,8 | 3,5 | 3,0 | х | Sn(NO3)2 MgSO4 NaCl Al(NO3)3 | 0,011 0,022 0,052 0,018 |
ВАРИАНТЫ КОНТРОЛЬНЫХ ЗАДАНИЙ
Каждый студент выполняет свой вариант контрольных заданий. Вариант задания выдается каждому студенту индивидуально на кафедре.
Варианты контрольных заданий
| Номер варианта | Номера контрольных заданий |
| 1 | 1 8 31 51 71 91 111 131 |
| 2 | 2 9 32 52 72 92 112 132 |
| 3 | 3 10 33 53 73 93 113 133 |
| 4 | 4 11 34 54 74 94 114 134 |
| 5 | 5 12 35 55 75 95 115 135 |
| 6 | 6 13 36 56 76 96 116 136 |
| 7 | 7 17 34 57 77 97 117 137 |
| 8 | 14 18 38 58 78 98 118 138 |
| 9 | 15 19 39 59 79 99 119 139 |
| 10 | 16 23 40 60 80 100 120 140 |
| 11 | 20 24 41 61 81 101 121 141 |
| 12 | 21 25 42 62 82 102 122 142 |
| 13 | 22 27 43 63 83 103 123 143 |
| 14 | 26 29 44 64 84 104 124 144 |
| 15 | 30 28 45 65 85 105 125 145 |
| 16 | 1 11 46 66 86 106 126 146 |
| 17 | 2 12 47 67 87 107 127 147 |
| 18 | 3 13 48 68 88 108 128 148 |
| 19 | 4 17 49 69 89 109 129 149 |
| 20 | 5 18 50 70 90 110 130 150 |
| 21 | 6 19 35 57 79 101 113 134 |
| 22 | 7 23 36 58 80 102 114 135 |
| 23 | 14 24 37 59 89 104 116 137 |
| 24 | 15 25 38 60 83 105 117 138 |
| 25 | 16 27 39 61 84 106 118 139 |
| 26 | 20 29 40 62 85 107 119 140 |
| 27 | 21 28 41 63 86 108 120 141 |
| 28 | 22 8 42 64 87 109 121 142 |
| 29 | 26 9 43 65 88 110 122 143 |
| 30 | 30 10 44 66 89 91 123 144 |
| 31 | 1 11 45 67 90 92 124 145 |
| 32 | 2 12 46 68 71 93 125 146 |
| 33 | 3 13 47 69 72 94 126 147 |
| 34 | 4 17 48 70 73 95 127 148 |
| 35 | 5 18 49 51 74 96 128 149 |
| 36 | 6 19 50 52 75 97 129 150 |
| 37 | 7 23 31 53 76 98 130 131 |
| 38 | 14 24 32 54 77 99 111 132 |
| 39 | 15 25 33 55 78 100 112 133 |
| 40 | 16 27 34 56 79 101 113 134 |
| 41 | 20 29 35 57 80 102 114 135 |
| 42 | 21 28 36 58 81 103 115 136 |
| 43 | 22 8 37 59 82 104 116 137 |
| 44 | 26 9 38 60 83 105 117 138 |
| 45 | 30 10 39 61 84 106 118 139 |
| 46 | 3 11 35 56 77 98 119 140 |
| 47 | 4 12 36 57 58 99 120 141 |
| 48 | 6 17 38 59 80 101 122 143 |
| 49 | 7 18 39 60 81 103 124 145 |
| 50 | 15 23 40 61 83 104 125 146 |
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Фролов Ю.Г.: Курс коллоидной химии (Поверхностные явления и дисперсные системы).: Учебник – М.: Химия, 1982. - 400 с.
- Воюцкий С.С.: Курс коллоидной химии; Учебник – М.: Химия, 1976. – 574 с.
- Сеничева Л.В., Яргаева В.А., Янковец Ж.Н.: Поверхностные явления. Адсорбция.: Учебное пособие – Хабаровск, изд. ХГТУ, 1999. – 108 с.
- Яргаева В.А., Сеничева Л.В.: Дисперсные системы.: Учебное пособие. – Хабаровск: Изд-во Хабар. гос. техн. ун-т, 2003. – 137 с.
- Евстратова К.И., Купина Н.Н., Малахова Е.Е. Физическая и коллоидная химия: Учебник: - М.: ВШ, 1990. – 488 с.
- Поверхностно-активные вещества. Под. ред. А.А. Абрамзона, Г.М. Гаевского: Справочник – Л.: Химия, 1979, - 376 с.
- Рабинович В.А., Хавин З.Я.: Краткий химический справочник – Л.: Химия, 1994 – 432 с.
