Программа, методические указания и контрольные задания для студентов ускоренной формы заочного обучения специальности 320700 «Охрана окружающей среды»
| Вид материала | Программа |
| Контрольные вопросы и задачи Варианты 31-50 |
- Рабочая программа, методические указания и контрольные задания для студентов специальности, 707.43kb.
- Рабочая программа методические указания контрольные задания для студентов специальности, 833.92kb.
- Программа, методические указания и контрольные задания для студентов 5 курса заочного, 2134.85kb.
- Программа, методические указания и контрольные задания для студентов 5 курса заочного, 439.54kb.
- Финанс ы методические указания и контрольные задания для студентов заочной формы обучения, 825.1kb.
- Методические указания и контрольные задания по английскому языку орёл 2009, 222.99kb.
- Программа, методические указания и контрольные задания по учебной дисциплине "оценка, 1129.32kb.
- Методические указания и контрольные задания для студентов заочной формы обучения, специальность, 838.97kb.
- Управлением Минобразования России общие методические указания, 378.75kb.
- Процессы и аппараты защиты, 336.4kb.
Пример 3. Рассчитайте динамическую обменную емкость катионита и анионита, если для полного обессоливания воды методом ионного обмена через колонку с 2 кг катионита и через колонку с 3 кг анионита можно пропустить только 10 м3 воды, содержащей 0,024 г/л MgSO4 и 0,011 г/л FeCl3.
Р е ш е н и е. Уравнения ионообменных реакций имеют вид:
2R-H + MgSO4 = MgR2 + H2SO4 на катионите
3R-H + FeCl3 = MgR3 + 3HCl на катионите
2R-OH + H2SO4 = R2SO4 + H2O на анионите
R-OH + HCl = RCl + H2O на анионите.
В соответствии с закономерностями адсорбции на катионите адсорбируется в первую очередь ион железа, а затем ион магния, на анионите – сульфат-ион, а затем – хлорид-ион. Обмен ионов протекает с эквивалентных количествах, поэтому вначале пересчитываем концентрацию С, выраженную в г/л, в молярную концентрацию эквивалентов Сэк по формуле
Сэк =
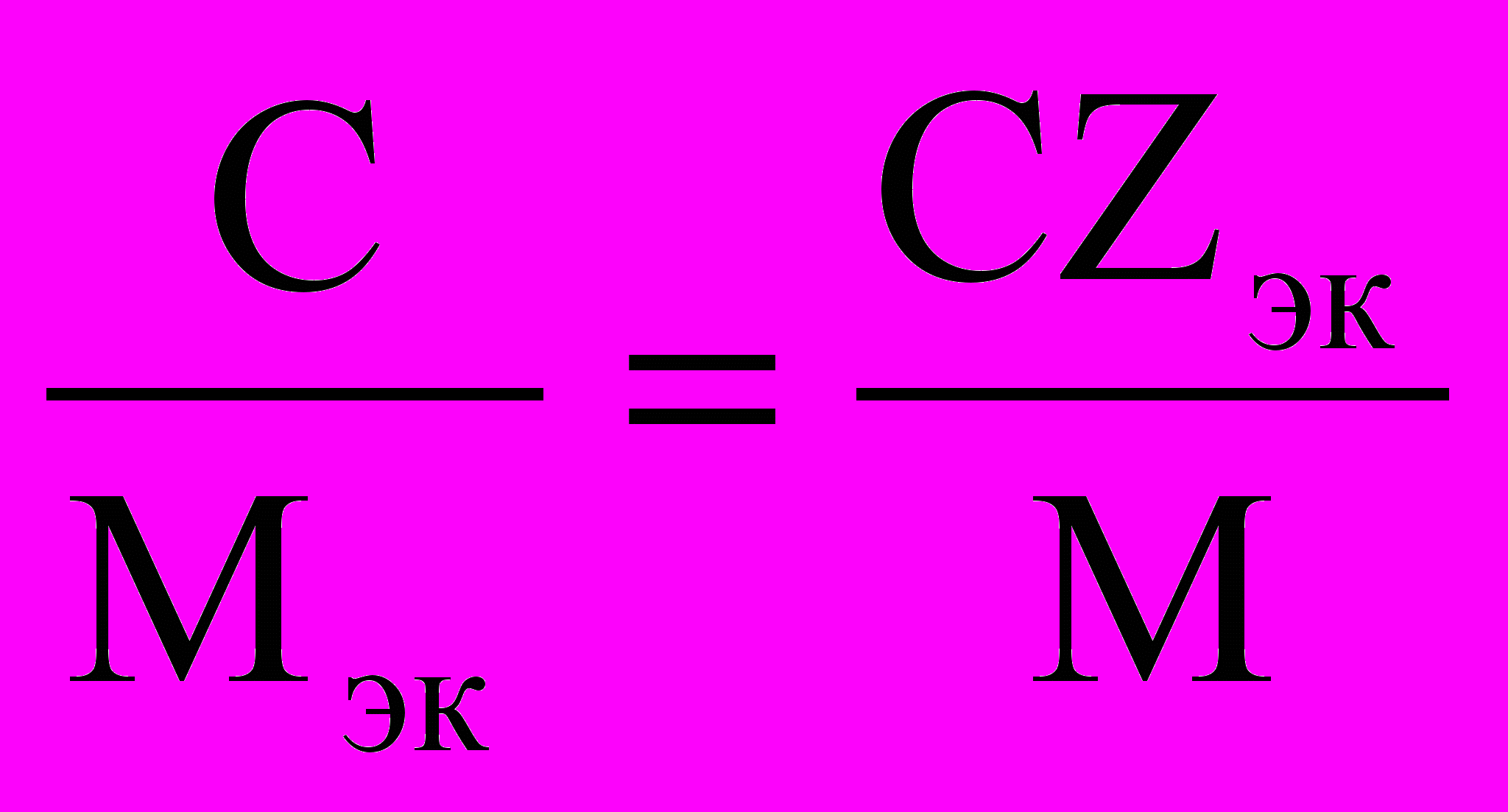 ,
, где Мэк – молярная масса эквивалентов, г/моль;
Zэк – число эквивалентности, равное заряду иона по модулю.
Сэк(MgSO4) =
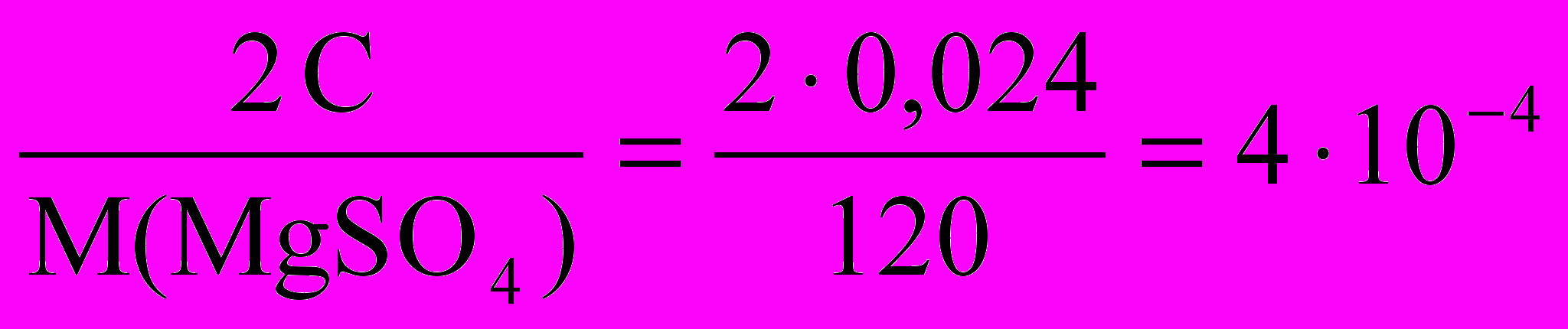 моль/л;
моль/л;Сэк(FeCl3) =
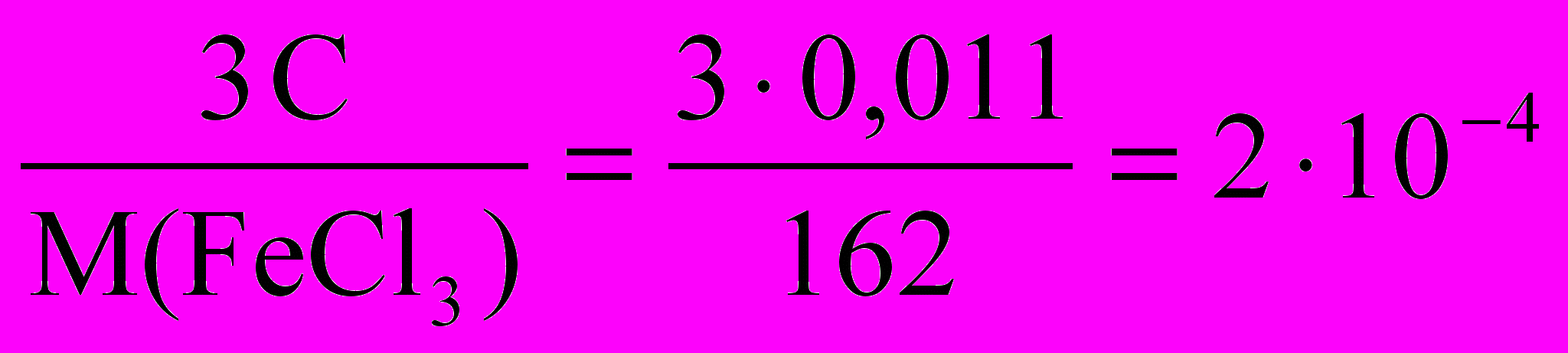 моль/л.
моль/л.По закону эквивалентов
Сэк(MgSO4) = Сэк(Mg2+) = Сэк(SO
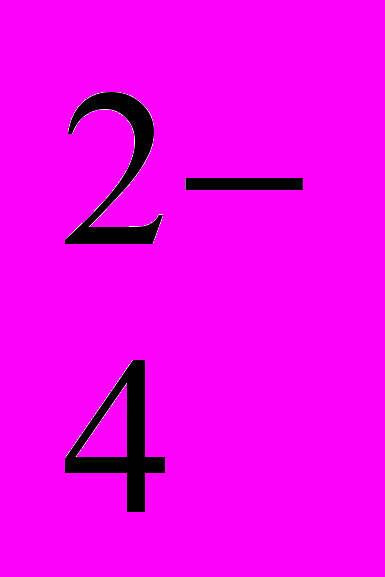 );
);Сэк(FeCl3) = Сэк(Fe3+) = Сэк(Cl–).
Динамическую обменную емкость ионита Q рассчитываем по формуле
Q =
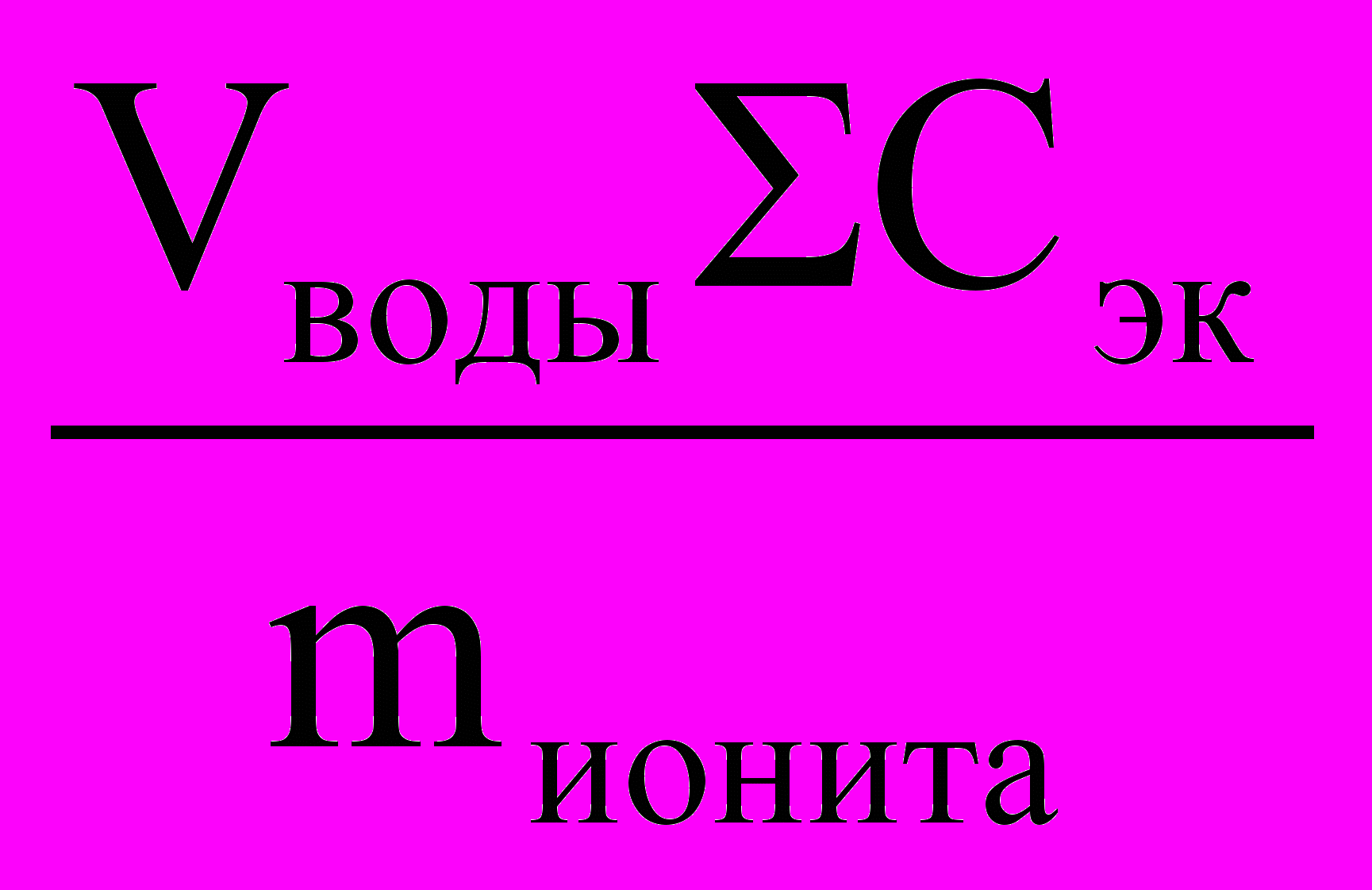 ,
,где Сэк – суммарная молярная концентрация эквивалентов всех катионитов или всех анионитов, моль/л;
Vводы – объем воды, пропускаемой через ионит, л;
Mионита – масса катионита или анионита, кг.
Qкатионита =
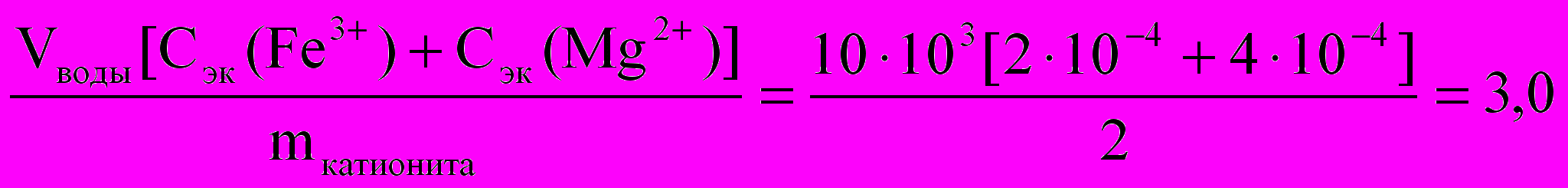 моль/кг;
моль/кг;Qанионита =
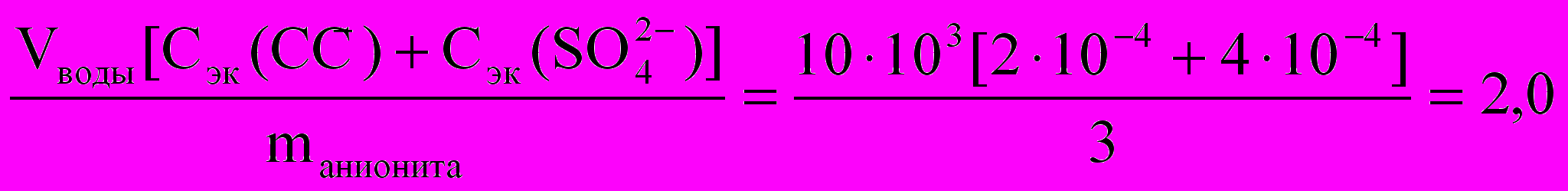 моль/кг.
моль/кг.С целью многократного использования ионитов их можно регенерировать путем проведения ионообменной адсорбции в обратном направлении, т. е. через катионит пропустить раствор кислоты, а через анионит – раствор щелочи.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Какие системы называют дисперcными ? Назовите признаки, характерные для таких систем. Приведите примеры.
2. Назовите условия и методы получения дисперсных систем.
3. Классификация дисперсных систем по степени дисперсности.Определите тип системы по этой классификации: гидрозоль, аэро золь, суспензия, эмульсия.
- По какому признаку дисперсные системы делят на лиофильные и лиофобные? Определите тип систем по этому признаку: гидрозоль серы, гидрозоль Fe(OH)3, раствор высокомолекулярного вещества (ВМВ).
- Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды. Определите тип систем по этой классификации: аэрозоль, гидрозоль, пемза, пена.
- По какому признаку дисперсные системы делят на свободнодисперсные и связнодисперсные? Определите тип систем по этому признаку: золь, гель, студень, раствор высокомолекулярного вещества (ВМВ).
- Что такое мицелла? Напишите формулу мицеллы в гидрозоле AgCl, стабилизированном избытком KСl.
- Перечислите оптические свойства дисперсных систем. Что такое опалесценция?
- Какие молекулярно-кинетические свойства характерны для свободнодисперсных систем? Охарактеризуйте состояние диффузионно-седиментационного равновесия в дисперсной системе.
- Какие электрокинетические свойства проявляют дисперсные системы?
Назовите общие и отличительные признаки электрофореза и потенциала седиментации.
- Какие процессы называют электрофорезом, а какие – электроосмосом?
Перечислите их общие и отличительные признаки. Каково практическое значение этих процессов?
12. Что происходит в дисперсных системах при структурообразовании? Чем гели отличаются от студней?
- Какие свойства дисперсных систем называются структурно-
механическими? Как влияет образование структур на вязкость дисперсных систем?
- Что понимают под агрегативной и кинетической устойчивостями дисперсных систем? Перечислите факторы устойчивости дисперсных систем.
- Чем отличаются растворы высокомолекулярных веществ (ВМВ) от дисперсных систем? Какие процессы называют набуханием ВМВ, а какие – застудневанием?
- Какие вещества являются полиэлектролитами? Как влияют pH на состояние белков в растворе? Что такое pH(ИЭТ)?
- Какие процессы протекают при разрушении дисперсных систем? Что происходит при коагуляции, коалесценции, коацервации, деэмульгировании?
- Электролитная коагуляция. Каковы принципы выбора коагулятора? Что называется порогом коагуляции и коагулирующей способностью коагулятора?
- C позиции теории ДЛФО, ответьте, какую электролитную коагуляцию называют нейтрализационной , а какую – концентрационной? Какие электролиты являются индифферентными а какие –неиндифферентными?
- Дайте классификацию эмульсии. Что такое «обращение фаз эмульсии»?
- Какие системы называют пенами? Какие пути получения стабилизации и разрушения пен имеют практическое значение?
- К какому типу дисперсных систем относится СМОГ? Приведите примеры аэрозолей, используемых человеком.
- Объясните голубой цвет неба днем и желто-красные восходы и закаты на основании основного закона светорассеяния Релея. Как изменяется интенсивность рассеянного света с длиной волны видимого света?
- Почему в устье впадение рек в моря и океаны интенсивно протекают процессы электролитной коагуляции? Какие примеси вод образуют отмели?
- Какое электрокинетическое свойство дисперсных систем проявляется в виде грома и молнии во время грозы? Объясните свой выбор.
- Какова сущность понятии дисперсность и гетерогенность? В каком соотношении находятся дисперсность и размер частиц? Рассчитайте дисперсность, если радиус шарообразных частиц равен 2 10-5м.
- Назовите объекты изучения коллоидной химии. Почему эту науку называют физико-химией дисперсных систем и поверхностных явлений?
- Перечислите основные методы получения лиофобных и лиофильных дисперсных систем. Каковы условия их получения.
- Предложите методы определения размера частиц дисперсной фазы на основе оптических и молекулярно-кинетических свойств дисперсных систем.
- Обоснуйте, можно ли отнести к дисперсным системам атмосферу, почву и поверхностные воды? Какие признаки позволяют считать их дисперсными системами?
Варианты 31-50. Коллоидный раствор (золь) АД получен при смешивании V1мл водного раствора АС с молярной концентрацией эквивалентов С1 и V2 мл водного раствора ВД с молярной концентрацией эквивалентов С2.
- 1. Напишите уравнение реакции получения вещества, образующего золь АД.
2. Рассчитайте, какое из исходных веществ АС или ВД в избытке. Определите
ионный состав раствора и выберите, какой из ионов будет потенциалопределяющим (ПОИ).
3. Напишите формулу мицеллы в гидрозоле АД и назовите все ее составные
части.
- Укажите заряд коллоидной частицы (гранулы) и определите, какой ион (катион или анион) будет ионом-коагулятором.
- Расположите электролиты К2SO4, Nа3PO4, MgСl2, Сd(NO3)2, Аl2(SO4) в порядке увеличения коагулирующей способности иона-коагулятора (или уменьшение порога коагуляции золя).
Таблица 1.
Задания к вариантам 31-50
| Вариант | АД | АС | V1мл | С1, моль\л | ВД | V2, мл | С2 , моль\л |
| 31 | Fe(OH)3 | FeCI3 | 10 | 0,01 | KOH | 15 | 0,010 |
| 32 | Н2SiO3 | HCI | 8 | 0,06 | Na2SiO3 | 12 | 0,015 |
| 33 | ВаSO4 | ВаCI2 | 12 | 0,03 | K2 SO4 | 7 | 0.06 |
| 34 | PbI2 | Pb(NO3)2 | 10 | 0,01 | KI | 12 | 0,01 |
| 35 | ZnS | (NH4)2S | 3 | 0,05 | ZnCI2 | 10 | 0,01 |
| 36 | Hg2SO4 | H2SO4 | 9 | 0,02 | Hg2(NO3)2 | 12 | 0,01 |
| 37 | Ве(ОН)2 | ВеСI2 | 15 | 0,01 | NН4OH | 10 | 0,02 |
| 38 | Аg2CгO4 | К2СгO4 | 7 | 0,03 | АgNO3 | 8 | 0,02 |
| 39 | Cг(ОН)3 | СгСI3 | 10 | 0,01 | NН4OH | 16 | 0,02 |
| 40 | CdS | CdCI2 | 11 | 0,01 | H2S | 5 | 0,02 |
| 41 | РbSO4 | Рb(NO3)2 | 5 | 0,04 | H2SO4 | 6 | 0,03 |
| 42 | ВаF2 | NaF | 9 | 0,02 | ВаСI2 | 8 | 0,02 |
| 43 | Аg2C2 | АgNO3 | 11 | 0,01 | (NH4)2C2O4 | 5 | 0,03 |
| 44 | NiS | Na2S | 8 | 0,02 | NiSO4 | 10 | 0,01 |
| 45 | Mg(OH)2 | NaOH | 12 | 0,02 | MgCI2 | 5 | 0,03 |
| 46 | HgI2 | Hg(NO3)2 | 5 | 0,05 | KI | 10 | 0,03 |
| 47 | Fe3[Fe(CN)6]2 | FeSO4 | 6 | 0,04 | K3[Fe(CN)6]2 | 12 | 0,02 |
| 48 | Вi(OH)3 | NaOH | 7 | 0,03 | Вi(NO3)3 | 9 | 0,01 |
| 49 | Аg4[Fе(CH)6] | Ag NO3 | 10 | 0.02 | К4[Fe(CN)6] | 6 | 0,03 |
| 50 | Аg2SiO3 | Nа2SiO3 | 15 | 0,01 | Ag NO3 | 7 | 0,03 |
51. Определите диаметр частиц аэрозоля, используя результат исследования методом поточной ультрамикроскопии: в объеме 2,210-2 мм3 подсчитано 87 частиц аэрозоля (дыма мартеновской печи). Концентрация аэрозоля 110-4 кг/м3, плотность дисперсной фазы 2 г/см3, форма частиц сферическая.
52. Удельная поверхность сферических частиц гидрозоля кремнезема составляет: 1,1104 м2. Плотность кремнезема 2,7 г/см3, вязкость дисперсионной среды
1103 Пас, температура 293 К. Определите проекцию среднего сдвига частиц золя за время 4 с.
53. По данным Сведберга коэффициент диффузии коллоидных частиц золота в воде при 298 К равен 2,710-7м2/сут. Определите дисперсность частиц гидрозоля золота. Вязкость воды при 298 К равна 8,8410-4 Пас.
54. Определите частичную концентрацию золя Al2O3, исходя из следующих данных: массовая концентрация 0,3 г/л, коэффициент диффузии сферических частиц золя 210-6 м2/сут, плотность Al2O3 4 г/см3, вязкость среды 110-3 Паc, температура 293 К.
55. Используя закономерности светорассеяния в соответствии с теорией Рэлея и ослабление светового потока в соответствии с законом Бугера-Ламберта-Бера, рассчитайте радиус частиц дивинилстирольного латекса, если концентрация латекса 0,2 г/л, длина волны падающего света равна 400 нм, оптическая плотность А равна 0,347 в кювете длиной 5,01 см. Показатель преломления воды равен 1,333, плотность и показатель преломления дисперсной фазы равны 0,945 г/см3 и 1, 653.
56. Удельная поверхность сферических частиц гидрозоля диоксида кремния составляет: 2,1105м2/кг, плотность диоксида кремния 2,7 г/см3, вязкость дисперсионной среды 110-3 Паc, температура 293 К. Определите проекцию среднего сдвига частиц золя за время 6 с.
57. Определите радиус частиц суспензии гуммигута в воде, если среднеквадратич- ный сдвиг
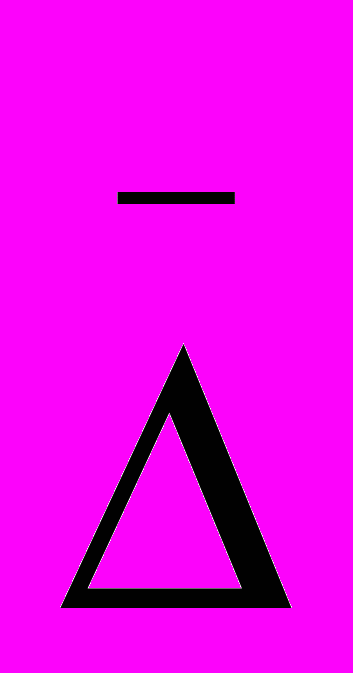 равен 7,09 мкм за время 30 с, температура опыта 290 К, вязкость среды 1,110-3 Пас.
равен 7,09 мкм за время 30 с, температура опыта 290 К, вязкость среды 1,110-3 Пас.58. Рассчитайте, за какое время сферические частицы Al2O3, распределенные в среде с вязкостью 1,510-3 Пас, оседают на высоту 1 см, если удельная поверхность частиц составляет 104 м-1. Плотности дисперсной фазы и дисперсионной среды равны соответственно 4 и 1 г/см3.
59. Определите радиус частиц суспензии коалина в воде, если среднеквадратичный сдвиг
 равен 12 мкм за время 120 с. Температура опыта 293 К, вязкость среды 1,110-3 Пас.
равен 12 мкм за время 120 с. Температура опыта 293 К, вязкость среды 1,110-3 Пас.60. Рассчитайте электрофоретическую скорость передвижения частиц золя трисульфида мышьяка по следующим данным: электрокинетический потенциал частиц – 42,3 мВ, расстояние между электродами 0,4 м, внешняя разность потенциалов 149 В, вязкость среды 1 10-3 Па с, относительная диэлектрическая проницаемость 80,1.
61. Рассчитайте электрокинетический потенциал поверхности частиц бентонитовой глины по результатам электрофореза при следующих условиях: расстояние между электродами 25 см, напряжение 100 В, за 15 мин частицы перемещаются на 6 мм к аноду, относительная диэлектрическая проницаемость среды 78,2 при 298 К, вязкость 8,84 10-4 Па с.
62. Рассчитайте электрокинетический потенциал поверхности кварца по данным полученным при исследовании электроосмотического переноса жидкости через кварцевую мембрану: сила тока 210-3 А, объемная скорость раствора KCl, переносимого через мембрану, 0,02 мл/с, удельная электрическая проводимость раствора 1,210-2 Смм-1, вязкость раствора 110-3 Пас, относительная диэлектрическая проницаемость 80,1.
63. Рассчитайте электрокинетический потенциал частиц кварцевого стекла, если скорость передвижения этих частиц в водном растворе NaCl равна 2,2 мкм/с при постоянной напряженности электрического поля 100 В/м. Вязкость раствора 1,1410-3 Пас, относительная диэлектрическая проницаемость 82, температура 288 К.
64. Рассчитайте электрокинетический потенциал частиц корунда в водном растворе KCl по следующим данным: скорость электроосмоса через корундовую мем- брану 0,02 мл/с , удельная электрическая проводимость раствора 1,210-2 Смм-1, вязкость раствора 110-3 Пас, сила тока при осмосе 1,510-2 А, относительная диэлектрическая проницаемость среды 80,1.
65. Рассчитайте электрокинетический потенциал частиц золя Fe(OH)3 по данным электрофореза: разность потенциалов 170 В, расстояние между электродами 0,45 м, смещение границы золя к катоду составило 12 мм за 30 мин. При температуре опыта, равной 298 К, вязкость дисперсионной (водной) среды 8,9410-4 Пас и относительная диэлектрическая проницаемость среды 78,2.
66. Рассчитайте электрофоретическую скорость частиц глины, если электрокине- тический потенциал частиц 48,8 мВ, разность потенциалов между электродами равна 220 В, а расстояние между ними 44 см, вязкость среды 1 10-3 Пас и от- носительная диэлектрическая проницаемость среды 80,1.
67. Рассчитайте напряженность электрического поля (градиент потенциала), если электрокинетический потенциал частиц золя гидроксида железа равен 52,5 мВ, электрофоретическая скорость частиц 3,7410-4 см/с, вязкость среды
1,00510-3 Пас, а относительная диэлектрическая проницаемость 80,1.
68. Определите электрокинетический потенциал на границе раздела фаз керамический фильтр-водный раствор KCl, если при протекании раствора скорость электроосмоса 0,03 мл/с, удельная электрическая проводимость среды 1,310-2 Смм-1, сила тока при осмосе 210-2 А, вязкость среды 110-3 Пас, относительная диэлектрическая проницаемость 80,1.
69. Рассчитайте величину электрокинетического потенциала на границе кварцевое стекло – водный раствор KCl. Процесс электроосмоса характеризовался следу-ющими данными: сила тока 410-4 А, время перемещения 110-8 м3 раствора составило 12,4 с, удельная электрическая проводимость среды 1,810-2 Смм-1, вязкость среды 110-3 Пас, относительная диэлектрическая проницаемость среды 80,1.
70. Рассчитайте скорость электрофореза коллоидных частиц берлинской лазури в воде, если электрокинетический потенциал составляет 58 мВ, напряженность электрического поля 510-2 В/м, вязкость среды 110-3 Пас, относительная диэлектрическая проницаемость среды 80,1.
71. Перед подачей речной воды в цеха завода ее осветляют: вводят в нее электро- лит коагулятор и образовавшийся ил отстаивают в специальных отстойниках. Рассчитайте, расход Al2(SO4)3 (кг в сутки), если расход воды на предприятии 100000 м3/сут, а порог коагуляции по NaCl равен 288 моль/м3. Считать знак электрических зарядов коллоидных частиц отрицательным.
72. Отработанные растворы производства фотоматериалов содержат коллоидное серебро в виде галогенидов. Рассчитайте расход Al2(SO4)3 в кг на 100 м3 сточных вод, предполагая, что знак электрических зарядов коллоидных частиц положительный. Пороги коагуляции (в ммоль/дм3) для одновалентных ионов – 142; для двухвалентных – 2,43; для трехвалентных – 0,068.
73. Рассчитайте расход 26 % раствора Al2(SO4)3 в м3 ( = 1300 кг/м3) на подготовку 1000 м3 сточных вод к очистке от коллоидных частиц, если знак их электричес- ких зарядов отрицательный. Порог коагуляции рассматриваемого золя по отно- шению к NaCl равен 235 моль/м3.
74. Производственные сточные воды содержат коллоидное серебро в виде галоге- нидов. Рассчитайте расход Al2(SO4)3 на очистку 500 м3 сточных вод, предпола- гая, что знак электрических зарядов коллоидных частиц отрицательный. Поро-ги коагуляции (в моль/м3) для одновалентных ионов 142; для двухвалентных – 2,43; для трехвалентных – 0,068.
75. Речная вода содержит коллоидные частицы органических примесей. Для использования ее в целях завода предварительно проводят коагуляцию, а затем отстаивают в специальных отстойниках для удаления ила. Рассчитайте расход NaCl (кг в сутки), если расход воды на предприятии 300000 м3/сут, а порог коагуляции по NaCl – 52 моль/м3.
76. Для коагуляции 1010-6 м3 золя AgI с отрицательным зарядом частиц требуется 0,4510-6 м3 раствора Ba(NO3)2. Концентрация электролита равна 0,05 кмоль/м3. Найдите порог коагуляции золя под действием Ba(NO3)2.
77. Для осветления речной воды перед подачей ее в цеха завода используют специальные электролиты коагуляторы. Рассчитайте расход Na2SO4 и NaCl кг в сутки для каждого электролита отдельно), если расход воды на заводе составляет 250000 м2/сут, а порог коагуляции по NaCl-52 моль/м3, а по Na2SO4 – 0,68 моль/м3. Укажите знак электрических зарядов взвешенных частиц в речной воде.
78. Рассчитайте, какой объем (см3) раствора электролита 0,01 М K2Cr2O7 нужно добавить к 10 л золя гидроксида алюминия, чтобы вызвать его коагуляцию. Порог коагуляции по данному электролиту – 0,63 ммоль/л.
79. Сточные воды производства фотоматериалов содержат коллоидное серебро в виде иодида серебра. Рассчитайте расход Al2(SO4)3 (кг) на очистку 1000 м3 сточных вод, предполагая, что знак электрических зарядов коллоидных частиц положительный. Пороги коагуляции (в моль/м3) для одновалентных ионов − 140; для двухвалентных – 1,98; для трехвалентных – 0,052.
80. В три колбы налито 50 см3 золя Fe(OH)3, чтобы вызвать коагуляцию золя, пот-ребовалось добавить в первую колбу 5,30 см3 1 М KCl, в другую 31,5 см3
0,01 М Na2SO4, в третью – 18,7 см3 0,01 М Na3PO4. Вычислите пороги коагу- ляции каждого электролита и определите знак заряда частиц золя.
81. Рассчитайте, какой объем (м3) раствора 0,01 М Al2(SO4)3 требуется для коагу- коагуляции 10 м3 золя As2S3. Порог коагуляции равен 9610-6 кмоль/м3.
82. Для очистки сточных вод от коллоидного серебра в виде иодидов используют хлорид железа (II). Рассчитайте расход на 500 м3 сточных вод, предполагая, что знак электрических зарядов коллоидных частиц отрицательный. Пороги коагуляции (в моль/м3) для одновалентных ионов – 120; для двухвалентных – 1,92; для трехвалентных – 0,052.
83. К 5 см3 золя Fe(OH)3 для начала явной коагуляции необходимо добавить один из следующих растворов: 4 см3 1М KCl, 0,5 см3 0,01М K2SO4, 3,9 см3 0,0005 М K4[Fe(CN)6]. Вычислите пороги коагуляции для этих электролитов. Определите, во сколько раз коагулирующая способность K4[Fe(CN)6] выше, чем у K2SO4 и KCl.
84. Для очистки природной воды, используемой в гальваническом производстве, в нее вводят электролит коагулятор и образовавшийся ил отстаивают в специаль- ных отстойниках. Рассчитайте расход Al2(SO4)3 и NaCl (каждого в отдельнос- ти), если расход воды на предприятии составляет 200 000 м3/сут, а пороги коагуляции равны: по NaCl – 52 моль/м3, по Al2(SO4)3 – 0,23 моль/м3. Укажите знак электрических зарядов взвешенных частиц в природной воде.
85. Сточная вода содержит коллоидные частицы Al2S3. Порог коагуляции этого золя по NaCl равен 50,4 моль/м3. Рассчитайте объем 30 % раствора CaCl2 ( = 1280 кг/м3), необходимый, чтобы вызвать коагуляцию в 100 м3 указанного золя, если знак коллоидных частиц положительный.
86. Рассчитайте расход 26 % раствора Al2(SO4)3 в м3 ( = 1300 кг/м3) на подготовку 1000 м3 сточных вод, если знак электрических зарядов коллоидных частиц положительный. Пороги коагуляции для одновалентных ионов − 127 моль/м3, для двухвалентных – 1,85 моль/м3, для трехвалентных – 0,042 моль/м3.
87. В пробе сточных вод объемом 5,010-2 м3 после добавления к ней 2,310-3 м3 26 %-ного раствора NaCl ( = 1200 кг/м3) появляются хлопья. Определите порог коагуляции рассматриваемого золя по отношению к NaCl.
88. Для осветления технической воды в нее вводят электролит-коагулятор и обра-зовавшийся ил отстаивают в специальных отстойниках. Рассчитайте расход Al2(SO4)3 и FeSO4 (кг в сутки), если знак коллоидных частиц отрицательный, отработанная техническая вода составляет 250000 м3/сут, порог коагуляции для двухвалентных ионов равен 0,68 моль/м3, для трехвалентных – 0,012 моль/м3.
89. В сточных водах содержится золь гидроксида алюминия. Рассчитайте порог коагуляции этого золя по NH4Cl, если на коагуляцию частиц из 30 м3 этого золя расходуется 0,33 м3 20 %-ного раствора NH4Cl ( = 1060 кг/м3).
90. Рассчитайте расход 30 %-ного раствора Al2(SO4)3 в м3 ( = 1320 кг/м3) на подго- товку 10000 м3 сточных вод, если знак заряда коллоидных частиц,содержащих- ся в этих сточных водах, является отрицательным. Пороги коагуляции для одновалентных ионов -135 моль/м3, для двухвалентных – 1,89 моль/м3, для трехвалентных – 0,038 моль/м3.
91. Правило Фаянса-Панета. Какой ион в соответствии с этим правилом будет лучше адсорбироваться на известняке из природной воды, содержащей NаСI, MgCI2, СaCI2?
92. Какие явления называются поверхностными? Приведите классификацию поверхностных явлений.
93. Дайте определение полной свободной поверхностной энергии. Как ее рассчитывают? Предложите пути ее снижения .
94. Что понимают под поверхностным натяжением? Какие факторы и как влияют на его величину?
95. Как влияет концентрация раствора на его поверхностное натяжение? Приведите классификацию растворенных веществ по их влиянию на (раствора).
96. Почему адсорбционные слои поверхностно-активных веществ (ПАВ) называют ориентированными? Охарактеризуйте процессы гидрофилизации и гидрофобизации поверхности.
97. Оцените состояние ПАВ в растворе. Какую концентрацию раствора ПАВ называют критической концентрацией мицеллообразования (ККМ)? Каково строение мицелл ПАВ?
- Каковы особенности ионообменной адсорбции? Напишите уравнение процессов устранения кальциевой жесткости методом ионообменной адсорбции и последующей регенерации ионита.
- Какие процессы называются адгезией?
Перечислите основные виды агдезии. Какова роль агдезии в процессах прилипания, склеивания, смачивания?
- Что называется смачиванием? Какие величины характеризуют смачивание?
Перечислите типы твердых поверхностей по их способности смачиваться жидкостью и укажите величины краевых углов смачивания.
- Какой процесс называют флотацией? Перечислите условия флотации. Назовите области использования флотации.
- Что понимают под поверхностной активностью ПАВ? Оцените поверхностную активность С8H17COOH и C6H13COOH на основе правила Дюкло-Траубе. Можно ли рассчитать адсорбцию этих веществ по уравнению Гиббса?
- Что называется солюбилизацией растворов ПАВ? Почему нефтепродукты, по
падающие в природный водоем, концентрируются как на поверхности, так и в объеме воды?
- Дайте определение сорбции. Приведите классификацию сорбционных процессов.
- Дайте определение адсорбции. Приведите классификацию адсорбционных
процессов. Можно ли адсорбцию назвать поверхностным явлением?
- Назовите основные теории адсорбции; приведите соответствующии им
уравнения и типы изотерм адсорбции.
- Как влияет природа адсорбата и адсорбента на величину адсорбции? На основании правила уравнения полярностей Ребиндера определите, на каком адсорбенте: активированном угле или силикагеле, будет лучше адсорбироваться С8H7OH из водного раствора?
- Какие адсорбенты называют ионитами?
Дайте классификацию ионитов. Какие ионы: Fe3+ или Са2+, будут лучше адсорбироваться на катионите?
- Каков механизм ионообменной адсорбции? Напишите уравнения реакций
ионного обмена, протекающие при обессоливании воды, содержащей MgSO4.
- Напишите уравнения процессов обессоливания воды, содержащей CaCI2,
методом ионообменной адсорбции (ионного обмена).
