«Производство серной кислоты контактным способом Урок путешествие «По Солянокислотным островам»
| Вид материала | Урок |
- Производство серной кислоты контактным способом, 40.3kb.
- «Основные закономерности химических реакций. Производство серной кислоты контактным, 28.35kb.
- Урок по химии в 9 классе. Тема: Производство серной кислоты, 45.55kb.
- Сказка «Приключение Серной Кислоты Наглядно-демонстрационные материалы: иллюстрации, 50.15kb.
- Н. Н. учитель химии моу лицея №21 г. Тамбова Михалева И. А. учитель биологии моу лицея, 133.24kb.
- Технология неконцентрированной, 287.45kb.
- Приключение Серной Кислоты (9 класс) Цели урок, 57.17kb.
- Приключение Серной Кислоты (9 класс). Цели урок, 51.52kb.
- Приключение Серной Кислоты (9 класс) Цели урок, 11.91kb.
- Урок по химии в 9 классе на тему: «Алюминий. Его физические и химические свойства., 78.68kb.
- Комплекс уроков по комбинированной системе
Урок I
(урок разбора нового материала)
Тема: Основные положения теории химического строения А.М. Бутлерова. Химическое строение как порядок соединения и взаимного влияния атомов в молекулах. Образование связей в соединениях углерода. Углеродные цепи, кольца. Изомерия.
График – расписание урока
- Ознакомление учащихся с учебной темой и основополагающими знаниями.
- Ознакомление класса с инструкцией по изучению темы.
- Изучение учащимися материала по инструкции. Смысловая группировка материала.
- Объяснение материала учителем и составление конспектов учащимися.
- Закрепление нового материала при помощи практических упражнений (моделирование).
Оборудование урока: Набор для изготовления шаростержневых моделей молекул. Шаростержневые модели бутана, изобутана, циклобутана. Компьютерное оборудование.
Дидактический материал в виде компьютерных слайдов
Инструкция по изучению темы
«Теория строения органических веществ. Изомерия»
- Ознакомьтесь со слайдами по теме и выделите следующие смысловые группы материала:
- А.М. Бутлеров – творец теории химического строения (1861г.);
- химическое строение по А.М. Бутлерову – это последовательность соединения атомов в молекуле, порядок их взаимосвязи и взаимного влияния друг на друга;
- атомы в молекулах соединяются согласно их валентности. Совет. Данное положение отработайте на шаростержневых моделях молекул состава С4Н10. Помните! Углерод в органических соединениях четырехвалентен, водород – одновалентен;
- свойства веществ зависят не только от количества и качества атомов, входящих в состав молекул, но и от последовательности соединения атомов, от их влияния друг на друга. Совет. Для иллюстрации данного положения используйте сведения о температурах кипения бутанов и пентанов;
- вещества, имеющие одинаковый состав молекул, но отличающимися различным строением и поэтому обладающие разными свойствами, называются изомерами. Совет. На модели молекулы С4Н10, которую вы изготовили ранее, изучите данное положение.
- А.М. Бутлеров – творец теории химического строения (1861г.);
Перестройте модель так, чтобы у вас получилась следующая структура:
Н3С―СН―СН3
|
СН3
Убедитесь, что с изменением структуры молекулы изменяются ее свойства.
- Выполните упражнения:
- составьте четыре структурные формулы изомеров вещества состава С4Н9CL, зная, что атом хлора может занимать в углеродной цепи различное положение, а углеродная цепь может быть неразветвленной и разветвленной;
- приведите две структурные формулы вещества состава С4Н8, зная, что углеродный скелет в данных молекулах циклический, а именно:
- составьте четыре структурные формулы изомеров вещества состава С4Н9CL, зная, что атом хлора может занимать в углеродной цепи различное положение, а углеродная цепь может быть неразветвленной и разветвленной;

 | |
| |―С―С― С

 | | и
| | и


 ―С―С― С―С
―С―С― С―С| |
Урок II
(практическое комбинированное семинарское занятие)
Тема: Порядок соединения атомов в молекулы согласно валентности атомов. Типы углеродных цепей. Структурные формулы.
Девиз: Непрекращающиеся процессы изменения, перестройки молекул химических веществ – признаки движения материи.
График – расписание урока
- Запись темы и девиза урока.
- Повторение опорных знаний.
- работа учащихся по дифференцированным программам.
- Контроль знаний учащихся.
Оборудование урока: Набор для изготовления шаростержневых моделей молекул. Шаростержневые модели молекул метана, бутана, изобутана, циклобутана, метилциклопропана. Таблица «Тетраэдрическое расположение связей, образуемых атомами углерода».
Дифференцированные программы урока
Программа «А»
- Изготовьте шаростержневые модели молекул, имеющих следующий состав: а) С4Н8; б) С4Н10; в) С4Н10О. Запишите структурные формулы данных веществ.
Отметьте типы углеродных цепей, присущие молекулам указанного состава. Что происходит со связями между атомами в молекулах при перестройке углеродных цепей? Могут ли происходить данные перестройки без затрат энергии? Свой ответ мотивируйте.
Продемонстрируйте на данном материале возможность молекул перестраиваться, изменяться.
- Решите задачу: установите молекулярную и структурную формулы молекул вещества, если в нем содержится 16,4% углерода, 3,2% водорода, 81,4% йода. Относительная плотность паров данного вещества по водороду равна 78,0.
Программа «В»
- Изготовьте шаростержневые модели молекул, которые имеют следующие структурные формулы:
Н Н Н Н Н Н
| | | | | |
а) Н―С―С―С―С―Н б) Н―С═С―С―Н
| | | | | |
Н Н Н Н Н Н
Н Н


Н Н Н С

 | | |
| | | в) Н―С―С―С―Н г) Н―С―С―Н
| | | | |
Н С Н Н Н

 |
| Н Н Н
Отметьте типы углеродных цепей в данных молекулах. Запишите молекулярные формулы всех веществ и сравните их: а) по числу и виду атомов, входящих в их состав; б) по числу ковалентных связей между атомами углерода; в) по типу углеродного скелета.
Исходя из данных сравнения, сделайте вывод: а) чем отличаются друг от друга изомеры; б) на сколько уменьшается число атомов водорода в молекуле при появлении двойной углерод – углеродной связи?
- Решите задачу: выведите молекулярную формулу вещества, в котором массовая доля углерода составляет 0,8275 (или 82,75%), водорода – 0,1725 (или 17,25%). Относительная плотность вещества по воздуху равна 2. Сколько изомеров имеют этот же состав молекул?
Программа «С»
- Изготовьте шаростержневые модели четырехатомной углеродной цепи: а) неразветвленной; б) разветвленной; в) замкнутой (циклической). Присоедините к свободным валентностям углерода шарики, символизирующие атомы водорода. Запишите молекулярные и структурные формулы веществ, модели молекул которых вы изготовили.
- Ответьте на вопрос: а) что надо учитывать при определении порядка соединения атомов в молекулы; б) какую валентность проявляет углерод в молекулах органических веществ; в) какие типы углеродных цепей вы знаете?
- Решите задачу: массовые доли углерода и водорода в молекуле органического вещества соответственно равны 0,8275 (или 82,75%) и 0,1725 (или 17,25%). Относительная его плотность по водороду равна 29. На основании этих данных выведите молекулярную формулу данного вещества.
Инструктивная карточка. Решение типовой задачи
(компьютерное оборудование)
Необходимо запомнить следующее:
- Вывести молекулярную формулу вещества – это значит установить качественный и количественный состав его молекул.
- Число атомов элемента пропорционально его массе и обратно пропорционально его атомной массе.
Типовая задача: Массовая доля элементов в органическом веществе соответственно равна 0,8182 (или 81,82%) углерода; 0,1818 (или 18,18%) водорода. Относительная его плотность по водороду – 22. Выведите формулу вещества.
Решение.
- Находим относительную молекулярную массу вещества:
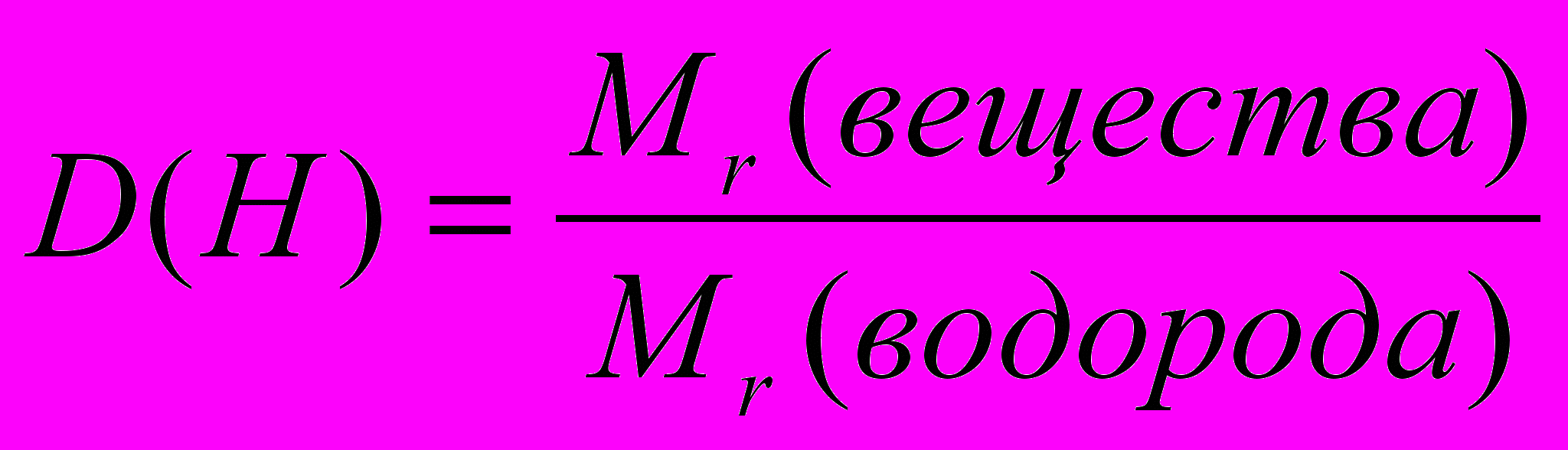
Отсюда
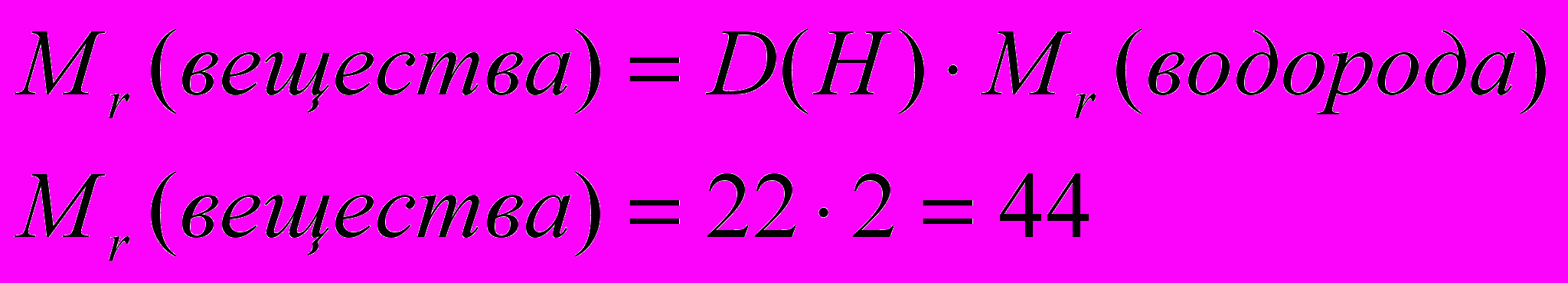
- Находим, сколько массовых частей приходится на углерод:
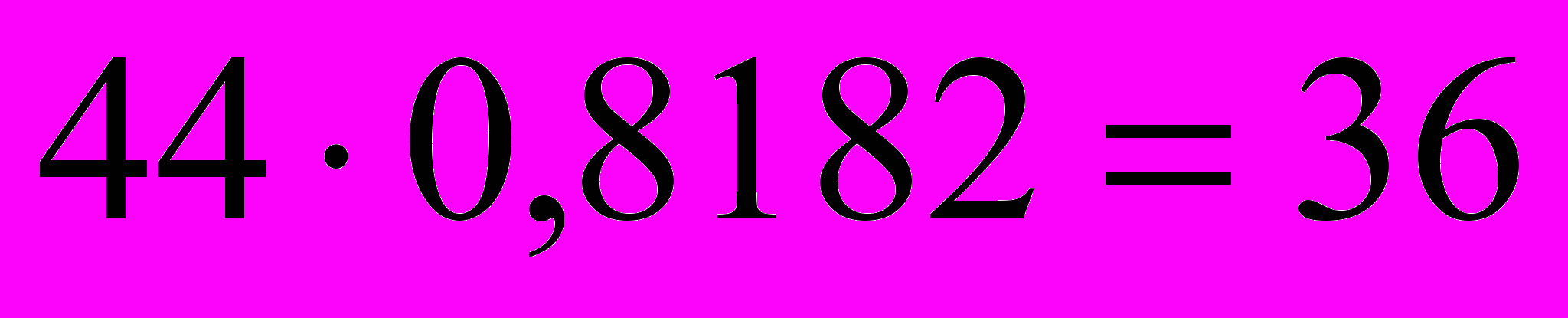
- Находим, сколько массовых частей находится на водород:
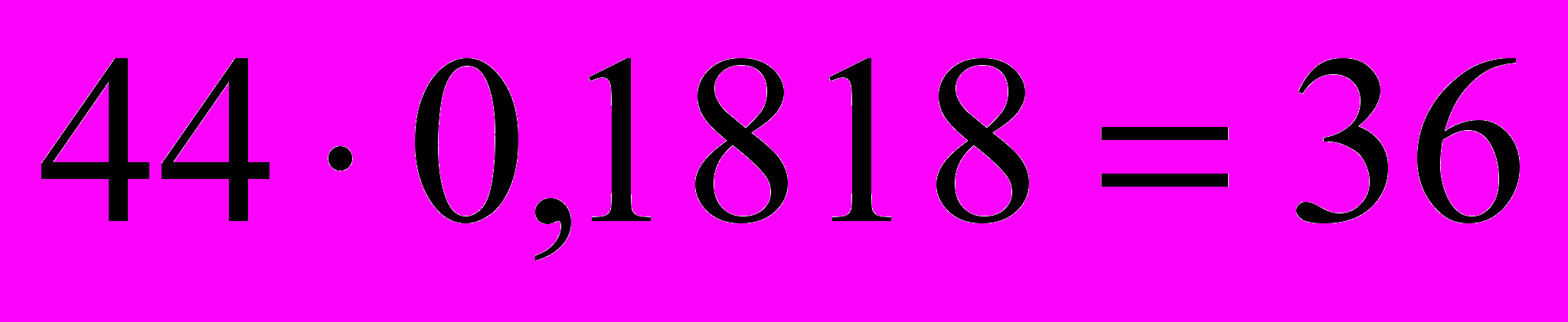
- Находим соотношение атомов в молекуле вещества СхНу:
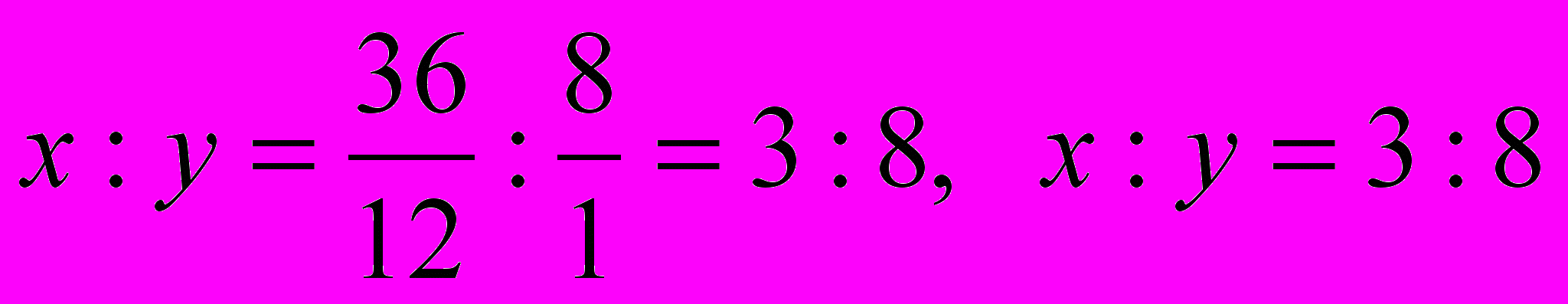
Следовательно, формула органического вещества – С3Н8.
Ответ: Формула органического вещества – С3Н8.
Урок III
(практическое комбинированное семинарское занятие)
Тема: Влияние на свойства веществ порядка соединения атомов в молекулах. Изомерия. Изомерия углеродного скелета. Изомеры.
Девиз: Движение материи – это не только перемена места материального объекта, но и изменение его качества, существующих связей между составными его частями, взаимодействия с окружающей средой.
График – расписание урока
- Запись темы и девиза урока.
- Повторение опорных знаний и разбор ошибок, допущенных учащимися в предыдущей контрольной работе.
- Работа учащихся над дифференцированными программами.
- Контроль знаний
Оборудование урока: Набор для изготовления шаростержневых модулей молекул. Шаростержневые модели молекул бутана, 2-метилпропана, пентана, 2-метилбутана, 2,2-диметилпропана, этилового спирта, этилпропилового эфира. Реактивы: диэтиловый эфир, этиловый спирт, вода. Пробирки со штативом. Таблица «Тетраэдрическое расположение связей, образуемых атомом углерода». Инструктивная карточка «Решение типовой задачи». Компьютерное оборудование.
Дифференцированные программы урока
Программа «А»
- Вам выданы два вещества, которые имеют один и тот же состав – С4Н10О (бутиловый спирт, tкип = 100˚С и диэтиловый эфир, tкип = 34,6˚С). Растворите вещества в воде. Есть ли разница в растворимости этих веществ? запишите их структурные формулы.
Выявите существенный отличительный признак в строении двух данных веществ. Оперируя знаниями о взаимном влиянии атомами в молекулах, электронном строении молекулы воды, объясните, почему исследуемые вещества имеют приблизительно одинаковую растворимость в воде (в 100 г воды растворяется приблизительно 8 г каждого вещества), несмотря на неодинаковое химическое состояние их молекул.
Сравните температуры кипения бутилового спирта диэтилового эфира. Постройте гипотезу, в соответствии с которой можно было бы объяснить тот факт, что первый имеет более высокую температуру кипения, чем второй. На данных примерах выявите следующие признаки движения материи: а) изменение способов связи атомов; б) изменение качества молекул; в) изменение взаимодействия молекул друг с другом.
- Запишите структурные формулы трех возможных изомеров каждого из веществ следующего состава: С5Н12, С5Н12О. Составьте перечень существенных признаков, по которым отличаются изомеры данных веществ.
Выявите причину явления изомерии. На приведенных ранее формулах изомеров докажите, что развитие природы происходит от более простого к более сложному.
- В каком порядке могут соединяться атомы в молекулах вещества, в котором массовые доли углерода, водорода и фтора соответственно равны 0,6316 (или6,16%), 0,1184 (или 11,84%), 0,2500 (или 25%)? Относительная плотность второго вещества по воздуху равна 2,62.
Программы «В»
- Изготовьте шаростержневые модели молекул трех изомеров пентана. Выявите существенные различия в строении углеродного скелета этих веществ, а также в линейных размерах их молекул.
Найдите в справочнике данные о температуре кипения изомеров пентана. Как связаны линейные размеры молекулы с температурой кипения каждого вещества? Как связан порядок соединения атомов в молекулах с линейными размерами молекул?
Является ли приведенное ниже изменении структуры молекулы пентана признаком развития данного материального объекта? Почему?
Н Н Н Н Н Н Н Н
| | | | | | | |
Н―С―С―С―С―Н→Н―С―С――С――С―Н
| | | | | | | |
Н Н Н Н Н Н | Н
Н―С―Н
|
Н
Что называется: а) изомерией; б) изомериями?
- Запишите структурные формулы вещества состава С4Н10О так, чтобы в одном случае атом кислорода образовал две связи с атомами углерода
| | |
(―С―О―С―), а в другом – только одну (―С―О―Н).
| | |
В какой из молекул появляется подвижный атом водорода? (Подвижность атома водорода тем более, чем более полярной связью он соединен с соседними атомами. Связь ―О―Н более полярная, чем
| |
―С―О―С―, потому что в первом случае разница в . | |
электроотрицательности атомов больше, чем во втором).
Какие особенности строения атома углерода и его свойств обусловливают изомерию углеродного скелета?
Сформулируйте основные положения теории строения органических веществ А.М. Бутлерова.
- Решите задачу: газ, пространственное строение которого вам предлагается установить, применяется для производства полиэтилена. Массовые доли углерода и водорода в нем соответственно равны 0,8571 (или 85,71%), 0,1429 (или 14,29%). Относительная плотность вещества по кислороду равна 0,875.
Программа «С»
- Постройте шаростержневые модели молекул бутана и его изомеров. Ознакомьтесь с температурой кипения каждого из веществ, отметьте разницу. Затем там же найдите значение температур кипения трех изомеров пентана (С5Н12). Сопоставляя температуры кипения изомеров пентана с числом разветвлений в их молекулах, определите, в какой зависимости находятся эти два свойства вещества.
- Запишите структурные формулы изомеров пентана. Проследите, чем отличаются между собой молекулы данных веществ. Какие типы углеродного скелета характерны для пентана и изопентана?
Что называется изомерией?
Какие вещества относятся к изомерам?
- Решите задачу: вещество, составляющее основу бензина, содержит углерод и водород, массовые доли которых соответственно равны 0,8421 (или 84,21%), 0,1579 (или 15,79%). Относительная плотность его паров по водороду составляет 57. Используя эти данные, установите молекулярную формулу вещества.
- Урок по модульной технологии «Гидролиз солей»
Цель урока: знакомство с сущностью реакции гидролиза солей, овладение умениями составлять уравнения гидролиза и прогнозировать реакцию на индикатор растворов солей на основании их состава.
Осуществление самообучения с регулированием темпа работы и содержания учебного материала; развитие логического мышления и умения прогнозировать.
Оборудование: на столах учащихся: модульная программа, учебники О.С. Габриеляна 9 класс, таблицы растворимости; инструктивные карточки «Гидролиз солей»: реактивы: в пробирках под №№ - HCI, NaOH, H2O; метиловый оранжевый; K2SO4, Na2CO3 , AICI3 .
Ход урока:
I. 1. Знакомство с темой и формой урока:
- У вас на столах модульная программа, состоящая из учебного
материала по теме с указанием заданий, которые будут выполняться по
ходу урока; рядом с заданием - руководство по осмыслению учебного
содержания и литература, по которой вы будите работать включая
инструктивную карточку.
- Кроме того вам выданы реактивы с помощью которых вы будете
решать экспериментальные задачи по теме урока.
- Работать вы будете самостоятельно, но для более эффективного
усваивания материала мы будем проводить промежуточный контроль
после каждого учебного элемента, тем самым осуществляя принцип
обратной связи.
- Прежде чем вы начнете работать, давайте вспомним правила ТБ при
работе с химическими реактивами:
- работаем с микроколичествами вещества;
- очень аккуратны;
- но если все-таки кислота или щелочь попадет на кожу?
Пока все понятно? Если возникнут трудности по ходу работы,
обращайтесь за помощью к учителю, меня зовут...
2. Учащиеся читают и выполняют задания УЭ - 5.0 и 5.1
Проверка результатов экспериментальной задачи (на доске)
- Как проводили эксперимент? Какой использовали индикатор?
Вы не знали какая кислота налита в пробирке - имеет ли это значение?
Что общего у всех кислот с точки зрения ТЭД? А у щелочей?
(Схема индикаторов)
Есть ли такие ионы в воде? Почему же индикатор не изменил окраски? Вводим понятие «химическая среда». Составление схем на доске
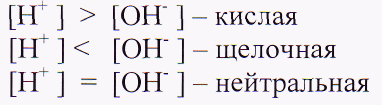
Назвать кислоты, являющиеся сильными электролитами. Они полностью диссоциируют на ионы. Как определить силу оснований?
II. 1 .Что такое соли с точки зрения ТЭД?
Есть ли в них ионы Н+ и ОН", дающие изменения окраски индикаторов?
Индикаторы не должны изменять окраску?
(Региональный компонент)
2
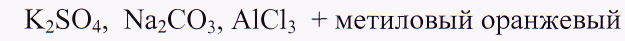 . Экспериментальная задача:
. Экспериментальная задача:3. Как можно получить любую соль?
Что такое реакция нейтрализации?
Напишите уравнение реакции нейтрализации, чтобы продуктом получился сульфат калия.
Какую кислоту и какое основание нужно взять? Проверка уравнения по сумме коэффициентов.
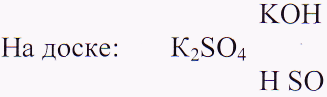
Сделайте аналогичную запись для двух других солей: Рядом с каждым основанием и каждой кислотой в своих записях пометьте силу электролитов.
Обратите внимание: Есть соли, образованные...
III. Учащиеся работают с модулем, УЕ - 5.3
1. Что такое гидролиз? Химическая реакция водой.
Гидролиз
«гидро» - вода, «лизис» - разложение.
Теперь с полным химическим уравнением пробуем представить сам процесс. Гидролиз Na2CO3
- Самостоятельно пишем гидролиз А1С1з (Сверка по таблице)
- Почему в растворе K2SO4 индикатор не изменил окраски?
- Наибольшее значение имеет гидролиз органических веществ: когда из
непищевого сырья (древесины, хлопковой шелухи, соломы, подсолнечной лузги) вырабатывается ряд ценных продуктов: этиловый спирт, дрожжи белковые, глюкоза, скипидар и др. В живых организмах протекает гидролиз белков, полисахаридов и др. органических соединений.
IV. Выходной контроль.
1. Задача: Попадание раствора мыла на слизистую оболочку глаз вызывает ее
раздражение, т.к. в результате гидролиза мыла образуется щелочь. Составить
уравнение реакции, если известно, что оно представляет из себя натриевую
соль органической кислоты, которую можно обозначить RCOONa, зная что
она слабый электролит.
2. Индивидуальные карточки с названиями солей. Написать реакции
гидролиза.
3. Домашнее задание.
ГИДРОЛИЗ СОЛЕЙ
| | Учебный материал с указанием заданий | Руководство по осмыслению учебного содержания | Литература |
| 5.0 | Цели: познакомиться с сущностью реакций гидролиза солей, научиться составлять ионные уравнения химической реакции гидролиза. Освоение данного модуля будет способствовать развитию логического мышления, умения прогнозировать реакцию на индикатор растворов солей на основании их состава. | | |
| 5.1 | Экспериментальная задача: пользуясь имеющимися реактивами, определите в какой из пронумерованных пробирок находится кислота, щелочь, вода. - Сформулируйте ответ на вопрос: что общего с точки зрения ТЭД у кислот? Щелочей? Есть ли в воде ионы Н+ и ОН" ? - Назовите известные вам кислоты, являющиеся сильными электролитами - Как определить силу оснований? | Не забудьте о правилах безопасности при работе с кислотами и щелочами. Попытайтесь найти рациональное решение данной экспериментальной задачи, стараясь использовать как можно меньше времени и реактивов. | Сверьте правильность ответа: О.С.Габриелян 8кл. Табл. №Ю Табл.№11 Таблица растворимости |
| 5.2 | Учитывая, что в растворах солей нет ионов Н и ОН" проверьте химическую среду в растворах, выданных вам солей: А) карбоната натрия Б) хлорида алюминия В)сульфата калия Сверьте визуально результаты проведенного опыта с результатами экспериментальной задачи в модуле 5.1 Какое основание и какую кислоту нужно взять, чтобы получить сульфат калия? Напишите уравнение реакции. Посчитайте сумму коэффициентов в данном уравнении | Любую соль можно получить реакцией между кислотой и основанием. Как называется такая реакция? | |
| 5.3 | Прочитайте определение гидролиза. Вместе с учителем напишите уравнение гидролиза Na2CO3 | Вернитесь к определению гидролиза. Все ли вам понятно в данном определении. | Ю.Э.Ходаков 9 кл. Стр.27 |
| | Пользуясь инструктивной карточкой напишите уравнение гидролиза 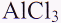 Ответьте на вопрос: почему в растворе K2SO4 ндикатор не изменил окраску? Сформулируйте ответ и запишите его в тетради, начав фразу словами: «Нейтральную среду имеют растворы солей, образованных...» Сделайте аналогичные выводы о растворах солей, имеющих щелочную и кислую среду. Выполните задания, предложенные учителем. | Сверьте результаты с данными в таблице №6. Сверьте ответы с текстом. Подведите итог вашей работы | О.С.Габриелян 11 кл. Стр. 164 О.С.Габриелян 11 кл. Стр.170 |
- Интегрированный урок по теме «Белки»
Цель урока: На основе межпредметной связи обобщение знания о строении и свойствах белков, продолжив формирование материалистического мировоззрения учащихся;
- совершенствование навыков самообразования при систематизации знаний.
Оформление:
«Лаборатория живой клетки - вот идеал органической химии» А.Е Арбузов, «Жизнь - есть способ существования белковых тел» Ф.Энгельс, таблица «Белки», макет вторичной структуры белка, таблица «Пенициллин – C16H18O4 N2, молоко ― С1864Н3021О576 N466 S21, гемоглобин -C3032H4876O872N780SeFe4», формулы аланина и глицина.
Оборудование: на столах учащихся инструкции по выполнению работы, растворы белка, HNO3, CuSO4, спиртовка, держатель, 2 пробирки, нити хлопчатобумажной и шерстяной ткани;
На демонстрационном столе: растворы белка, NaOH, Pb(CH3COO)2, фенолфталеиновая бумажка, вода, спиртовка, держатель, пробирки;
На отдельном лотке - в пробирках под № 1,2,3 - растворы мыла, белка, крахмала, I2, HCI, HNCh.
Ход урока:
I. Тема и форма проведения семинара, связь с оформлением.
Формирование основной проблемы семинара: от чего зависит
многообразие функций белков и их особая роль в жизненных процессах?
Пути решения проблемы (план семинара):
- Строение белка.
- Свойства белка.
- Роль белков в процессах жизнедеятельности организмов.
- Проблема синтеза белка.
II. 1. В ходе беседы с учащимися решаются вопросы:
• Принадлежности белков к какому-либо классу органических веществ;
(азотсодержащие, полимеры)
- Массы и размеров молекул белков;
- Мономеров белков.
- Учащиеся делают сообщения об открытии мономеров белка –аминокислотах, приводят цифры о количестве открытых аминокислот в молекулах белков.
- Учащийся у доски пишет реакцию взаимодействия между двумя аминокислотами - аланином и глицином.
Решаются вопросы: - название продукта (дипептид),
- «ди» (две аминокислоты),
- «пептид» (связь СО -NH — пептидная)
Вывод: белки - полипептиды.
4. Работа с учебником «Химия-10», таблица «Строение некоторых
аминокислот»
- Что общего в строении всех аминокислот? (-NH2 в -положении)
5. Качественный состав белков: наряду с С и Н есть N и S.
Экспериментальное доказательство наличия этих элементов.
Демонстрация 1. Раствор куриного белка + NaOH, выделяется NH3, который обнаруживается по малиновой окраске влажной фенолфталеиновой бумажки.
Демонстрация 2. Раствор белка + NaOH + Pb(CH3COO)2, образуется черный осадок PbS.
III. Структуры белка.
В ходе беседы обсуждается вопрос о том, каким же образом такая длинная молекула белка может поместиться в маленькой клетке живых организмов?
Идет речь о первичной, вторичной, третичной и четвертичной структурах белка; о силе пептидной и водородной связях в сравнении; о примерах белков, существующих в различных структурах.
IV. Химические свойства белков.
- Различная растворимость в воде. Образование коллоидного раствора
куриным белком.
- Гидролиз - в присутствии кислот и щелочей до составляющих аминокислот.
- Амфотерность - за счет концевых групп -NH2h-COOH.
- Качественные (цветные) реакции на белки.
Правила ТБ. Выполнение лабораторного опыта по предложенной инструкции.
Опыт 1. Ксантопротеиновая реакция (на ароматические аминокислоты) Раствор белка + HNO3, появляется желтая окраска раствора.
Опыт 2. Биуретовая реакция (на пептидные связи)
Раствор белка + C11SO4 + NaOH, появляется фиолетовая окраска
5. Денатурация - разрушение структур белка.
V. Роль белков в процессах жизнедеятельности организмов.
По карточкам с названиями белков (гемоглобин, миозин, инсулин, лизин, кератин) рассматриваются функции белков в ходе беседы:
- Транспортная
- Двигательная
- Регуляторная
- Ферментативная (со схемой действия фермента)
- Строительная
- Энергетическая
- Защитная
VI. Проблема синтеза белка. Сообщения учащихся по теме.
Закрепление.
- Лабораторный опыт по решению экспериментальной задачи на
определение шерстяной и хлопчатобумажной нитей.
- Блиц-вопросы по теме.
Итог урока:
Достиг ли семинар цели? Решена ли поставленная проблема?
Выставление оценок.
Домашнее задание.
- Урок – экскурсия по теме «Производство серной кислоты контактным способом
Образовательные задачи: знать химические реакции, лежащие в основе производства H2SO4 и основные рабочие профессии сернокислого производства. Уметь разъяснять значение Н2 SO4 для народного хозяйства.
Оборудование: на демонстрационном столе - пробирки № 1, 2, 3 с растворами НС1, H2SO4, NaOH, фенолфталеин, лакмус, ВаС12, AgNO3; таблица «Производство H2SO4» на каждом ученическом столе, опорные карточки с названиями профессии «инженер-технолог», «лаборант», «аппаратчик», «катализаторщик», «отдел сбыта», «отдел охраны природы», «отдел снабжения».
Ход урока:
1. Из истории производства Н2 SO4 (по схеме)
а) Н2SO4 - основной продукт химической промышленности
(135 млн. т в год в мире)
- 50 % - производство удобрений ( суперфосфаты, аммофосы и др.);
- металлургическая промышленность для травления металлов перед
никелированием, хромированием и т. п.;
- электролит в аккумуляторах;
- получение красителей;
- дубление шкур, выделка кожи;
- приготовление лекарств, взрывчатых веществ, искусственных волокон
и т. д.
б) «Естественные заводы» по производству Н2 SO4 - в пустыне Каракумы
холмы из песка и серы → SO2 → SO3 → Н2 SO4;
в атмосфере SO2 из вулканов и промышленности → Н2SO4 в виде кислых дождей → заболевания лесов, оголение горных склонов, эрозия почвы и смывание плодородных слоев дождями, гибель рыб.
в) Борьба за охрану природы.
2. Экскурсия на сернокислотный завод.
1. Завод построен на основе отходов цветной металлургии. Что используется в качестве сырья других заводах? В качестве сырья используется сера. Составьте уравнения химических реакций, лежащих в основе данного производства.
- Об устройстве и работе аппаратов I стадии производства расскажет
аппаратчик...
- Условия протекания этого процесса уточнит технолог завода...
- Об устройстве и работе аппаратов I u III стадий пр-ва...
- Оптимальные условия этих стадий процесса...
- Какую роль играет катализатор в контактном способе пр-ва H2SO4?
(«катализаторщик»).
- Вопрос «лаборанту»: какие нагревательные приборы используются в
производстве?
- Проведите качественную реакцию на Н2 SO4.
- Распознайте Н2SO4 (3 пробирки с NaOH, HC1, Н2 SO4).
8. Вопрос «отделу сбыта»: в каком виде кислота поступает на склад? Что
такое «олеум»?
9. Как решается на заводе защита окружающей среды?
10.Что делается на заводе по охране здоровья людей?
11.«Экономисту»: задача
Какова масса серной кислоты, которую можно получить из 16 т руды, содержащей 60 % пирита FeS2 ?
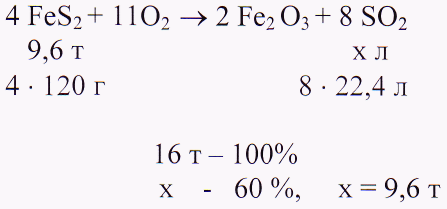
12.«Отделу сбыта»: назовите лекарства, в состав которых входит S (словосочетания сульфо, - зол, - зин): сульфодимезин, этазол, норсульфозол, сульфониламид).
3. Закрепление:
- Какое масло не будет есть ни один человек? (Купоросное 92,5 % Н2 SO4
- Какие профессии сернокислого производства вы знаете?
- Чем занимается «аппаратчик», «технолог», «лаборант»,
«катализаторщик», «отдел сбыта», «отдел снабжения»?
4. Домашнее задание.
Дополнительные вопросы к уроку - экскурсии
I стадия.
- Понятие «кипящий слой».
- Цель такого технологического приема.
- Используется ли тепло экзотермической реакции?
- Какая сила используется в циклоне?
- Что необходимо для работы электрофильтра?
- Как увеличить площадь поверхности соприкосновения веществ в
сушильной башне?
II стадия
- Можно ли было осуществить процесс без теплообменника?
(Рационально ли?)
- Характеристика реакции: обратимая, экзотермическая, каталитическая.
- Для чего нужно охлаждение реагирующей смеси, если мы знаем, что
повышение температуры увеличивает скорость реакций.
- На какой стадии процесса пр-ва Н2 SO4 применяется катализатор?
- Что такое катализатор? Изменяется ли он в процессе реакции?
- Можно ли сместить равновесие обратимой реакции?
- Какой используется катализатор?
III стадия
- На 2-х стадиях пр-ва используется Н2 SO4. На каких?
- Что значит 98% - Н2SО4?
- Урок — путешествие «По Солянокислотным островам»
Цели: Образовательная: расширение кругозора знаний учащихся о соляной кислоте, ее получении, применении и свойствах, как общих со всеми кислотами, так и отличительных от них; формирование умений и навыков практической деятельности.
Развивающая: развитие внимания, памяти, речи, мышления, умений сравнивать, сопоставлять, находить аналогии, воображения, фантазии.
«Химик требуется такой, который в науке собственным искусством прилежно упражнялся».
М. В. Ломоносов
1. Учитель формулирует цели, задачи и форму проведения урока.
Записи ведутся в путевых дневниках.
Химический диктант, как ключ-пропуск в путешествие: 1 вариант составляет ключ из предложений, справедливых для газообразного хлора, 2-й — для газа хлороводорода.
Самопроверка.
2. Остров «Открытий».
Реакция получения НС1, предложенная немецким химиком Иоганном Глаубером из поваренной соли и концентрированной серной кислоты /пишем реакцию в путевых дневниках/.
Открытие Гемфри Дэви о том, что за свойства кислот отвечает Н .
Остров «Знакомств»
Физические свойства соляной кислоты
Остров «Эксперимента»
Правила ТБ: микроколичества вещества, работа с кислотами и щелочами. Заполнение путевых дневников, один учащийся работает на доске:
а) действие на индикатор
б) взаимодействие с металлами /цинк и медь/
в) взаимодействие с оксидом металла
г) взаимодействие с основаниями
д) взаимодействие с солями
Остров «Здоровья»
Роль кислот в человеческом организме. Соляная кислота как активатор фермента пепсиногена, как сильный бактерицид.
Остров «Полезный»
Применение НС1 для растворения окалины и ржавчины, для снятия накипи. Уравнение реакции карбоната кальция и соляной кислоты. Использование НС1 в лабораторной практике.
- Закрепление материала — индивидуальные карточки с дифференцированными заданиями по свойствам НС1.
- Домашнее задание: записи в путевых дневниках.
- Урок - ролевая игра «Аттестация рабочих мест»
по теме «Систематизация и обобщение знаний о сернокислом производстве»
Образовательные задачи: выявить знания учащихся о пр-ве Н2 SO4 , систематизировать и обобщать их в процессе урока - игры «Аттестация рабочих мест».
Оборудование: набор реактивов для группы лаборантов - пробирки с № 1, 2, 3 с растворами НС1, H2SO4 , NaOH, фенолфталеин, лакмус, ВаС12 , AgNO1, таблица «Производство H2SO4 « на каждом столе, карточки с названиями профессий, план характеристики химического производства.
Ход урока:
- Цель и форма урока. Высказывание Г. Лунге, немецкого ученого-
химика.
- Урок-зачет. Фиксированием результатов будет заниматься
аттестационная комиссия. Аттестационные листы.
- Форма работы - групповая. Но зачет должен получить каждый. В план
изучения любого производства входит знакомство с профессиями. На
этом и будет основан наш урок.
Для представителей каждой профессии сернокислотного производства составлены вопросы. Мы познакомились с такими профессиями, функции которых вы будете выполнять. Раздача табличек и вопросов.
3. Время на подготовку - 5 мин.
Раздать: «лаборантам» - лотки с реактивами;
«экономистам» - калькулятор, сборных задач Гольдфарб (таблица концентрации и плотности кислот и оснований при 20 °С);
«отделу сбыта» - испытание серной кислоты в промышленности
- Аттестация будет проходить по плану характеристики хим.
производства.
С чего начинается любое производство?
1. Отделу снабжения:
- Какое сырье используется на Вашем предприятии?
- Как вы понимаете термин «комплексное использование сырья».
Приведите пример.
2. Лаборантам:
- Сколько стадий на Вашем производстве?
- Какие химические реакции протекают на каждой стадии? (3 лаборанта
пишут реакции и характеризуют 1 стадию)
Давайте будем говорить о каждой стадии в отдельности.
3. Инженерам-технологам:
- Перечислите оптимальные условия осуществления 1 стадии.
- Используется ли тепло экзотермической реакции на этой стадии?
4. Аппаратчикам:
- В каких аппаратах получают оксид серы (IV)?
- Какие еще аппараты связаны с 1 стадией?
- Объясните устройство и принцип действия печи для обжига серного
колчедана:
5. Инженерам-технологам:
- Что такое «кипящий слой»? Цель такого технологического приема.
6. Отделу охраны природы:
- Если произойдет выброс полученного оксида серы (IV) в атмосферу, к
каким последствиям это может привести?
Следующая стадия пр-ва - окисление SO2 u SO3
- Лаборантам: - характеристика реакции.
- Аппаратчикам: - характеристика аппаратов.
- Инженерам-технологам: - оптимальные условия.
- Катал изаторщикам:
- Что такое катализатор?
- Применяете ли Вы катализатор на этой стадии пр-ва, какой?
- Изменяется ли он в процессе реакции?
- При характеристике прозвучало слово «обратимая реакция». Можно ли
сместить равновесие обратимой реакции с помощью катализатора?
Переходим к III стадии.
11. Лаборантам:
- Как происходит этот процесс?
- Вы используете воду?
12. Аппаратчикам: - аппараты
- Что делается для увеличения поверхности соприкосновения на этом
этапе производства?
13. Инженерам-технологам:
- В поглотительной башне появился сернокислотный туман. Объясните
причину.
Итак, рассмотрены все стадии. Получили целевой продукт.
14. Экономистам:
- Плотность полученной кислоты при 20°С 1,836 г/см. Определите
концентрацию Н2 SO4.
- Производили расчет необходимого объема оксида серы (VI) для
получения Ют кислоты → сдайте в аттестационную комиссию.
15. Лаборантам:
- Лаборанты должны были подтвердить, что полученный продукт
действительно серная кислота. В 3-х склянках без этикеток находились
3 вещества, с помощью какой реакции вы определили Н2 SO4?
- И еще лаборанты должны были определить содержит ли полученной
Н2SO4 примесь хлорида натрия. Ваши результаты...
16.Отделу сбыта:
- Используете ли вы свой продукт в самом процессе производства?
- Где еще находит применение продукция вашего завода?
17.Отделу охраны природы.
- Как решается на вашем предприятии вопрос охраны природы?
18.Основные технологические приемы данного пр-ва?
Итоги:
Результаты аттестационной комиссии. Оценки будут выставлены на следующем уроке. Аттестацию прошли..., зачет не получили...
- Фрагмент презентации исследовательской работы обучающегося, представленной на республиканской конференции «Шаг в будущее»
- Результаты успеваемости и качества знаний обучающихся, их внеурочной деятельности
Применяемые в работе методы, формы, технологии должны быть направлены на получение желаемого результата, способствовать положительной динамике качества знаний, учебных умений и навыков школьников
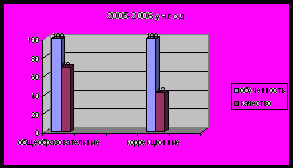
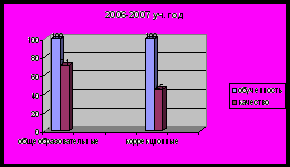
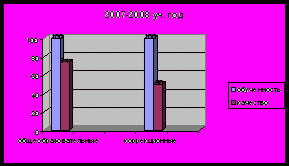
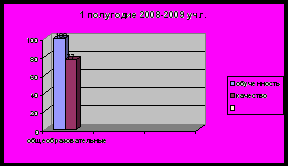
Уровни познавательного интереса обучающихся к предмету
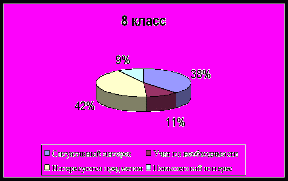
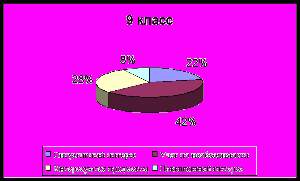
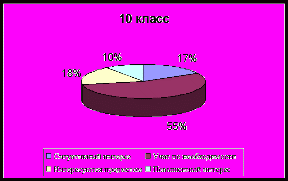
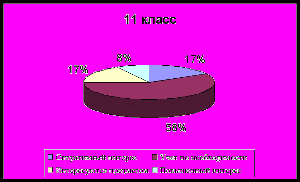
Сформированность личностно – смыслового отношения
учащихся к изучению химии
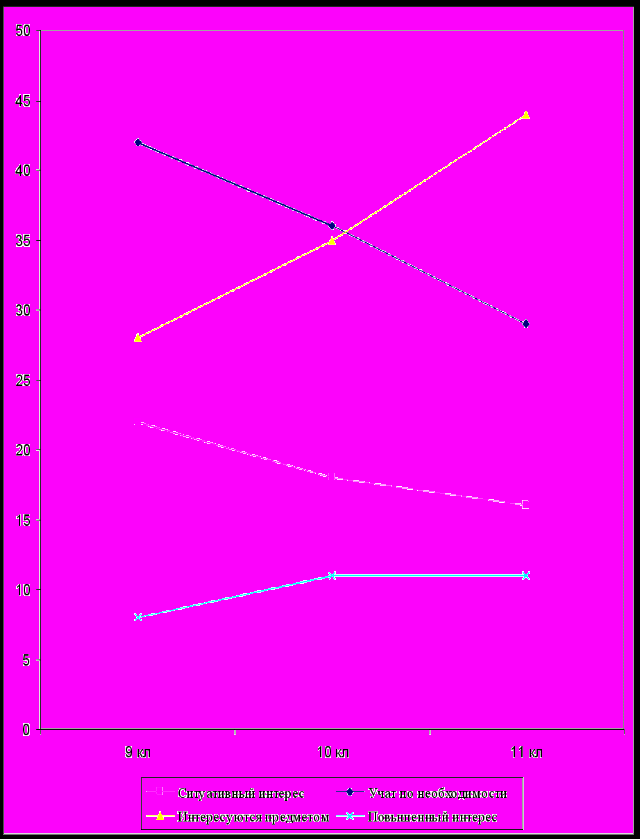
Анализ познавательного интереса учащихся
к изучению химии
| Критерии познавательного интереса | 9 кл., % | 10 кл., % | 11 кл., % |
| 32 | 31 | 31 |
| 32 | 28 | 53 |
| 13 | 10 | 10 |
| 13 | 13 | 8 |
| 4 | 10 | 18 |
| 4 | 3 | 7 |
