Пояснювальна записка
| Вид материала | Документы |
- Реферат курсовий проект: пояснювальна записка сторінок, таблиць, 10.59kb.
- Програми для загальноосвітніх навчальних закладів з українською мовою навчання, 889.57kb.
- Пояснювальна записка, 584.46kb.
- Пояснювальна записка, 1142.65kb.
- Дипломна робота пояснювальна записка, 1244.36kb.
- Пояснювальна записка, 743.42kb.
- Фізична культура пояснювальна записка, 296.81kb.
- Програма зовнішнього незалежного оцінювання з в сесвітньої історії пояснювальна записка, 478.76kb.
- Програма для загальноосвітніх навчальних закладів 7 9 класи пояснювальна записка, 286.52kb.
- Автори програми: д ф. м н., професор чалий о. В., к ф. м н., доцент цехмістер я. В.,, 149.19kb.
План:
1. Інструктаж з виконання роботи.
2. Виконання завдань колоквіуму.
3. Оцінювання роботи.
Питання теоретичної частини завдань
- Титриметрія – сутність методу.
- Поняття «стандартні розчини», їх приготування та стандартизація.
- Характеристика кривих титрування.
- Основи кислотно-основного титрування.
- Види осаджувального титрування, індикатори.
- Стандартні розчини та індикатори комплексонометричного титрування.
- Основні моменти редоксиметрії.
Питання практичної частини
Задачі з тем «Титриметрія», «Побудова кривих титрування» та «Розрахунки в титриметрії».
Задачі для самостійного контролю
Розрахуйте титр: а) 0,21 н. NaOH; б) 0,2 М и 0,12 н. розчинів H2SO4; в) 0,203 н. НС1 за КОН; Відповідь: а) 0,008400; б) 0,01960, 0,005880; в) 0,01139.
- Розрахуйте нормальність розчину: а) КМnО4, якщо його титр 0,0320 г/см3, 0,0066 г/см3 (E =31,61); б) NaOH, якщо наважку титрованої оксалатної кислоти 0,6112 г (Е = 63,04) і на титрування витрачені 52,00 см3 розчину NaOH; в) HCl, якщо на титрування 20,00 см3 0,12 н. NaOH витрачено 26,00 см3 розчину НС1. Відповідь: а) 1,0123 н.; 0,2088 н.; б) 0,1865 н.; в) 0,09231 н.
- Розрахуйте вміст (в %): а) КCl у наважці 0,0842 г, якщо на її титрування витрачено 10,90 см3 0,1020 н. AgNO3; б) Н2SO4, якщо на титрування 10,00 см3 його витрачено 12,10 см3 0,091 н. NaOH; в) КОН, якщо до 10,00 см3 розчину КОН було додано 20,00 см3 0,113 н. HCI і на титрування надлишку НС1 витрачено 8,90 см3 0,12 н. NaOH. Відповідь: а) 98,44%; б) 0,54%; в) 0,67%.
4. Розрахуйте виправкові коефіцієнти для 0,1 н. розчинів: а) оксалатної кислоти, якщо її титр дорівнює 0,00645 г/см3;б) NaOH, якщо на титрування 10,0 см3 розчину NaOH витрачено 12,10 см3 0,091 н. НС1. Відповідь: а) 1,023 до 0,1 н.; б) 1,101 до 0,1 н.
5. Визначите, яка з речовин виявиться в надлишку при взаємодії 100,0 см3 0,2 н. КОН з 50,0 см3 0,25 н. HNO3. Розрахуйте концентрацію отриманого розчину за цій речовині. Відповідь: КОН; 0,05 н.
6. Визначите, яка з речовин залишиться в надлишку при взаємодії 100,0 см3 0,05 н. AgNO3 з 20,00 см3 0,1 н. NaBr. Розрахуйте концентрацію розчину за цій речовині. Відповідь: AgNO3; 0,025 н.
7. Розрахуйте концентрацію розчину речовини, що залишається в надлишку при взаємодії 50,00 см3 0,01 н. CH3COOH з 15,00 см3 0,05 н. NaOH. Відповідь: NaOH; 0,003846 н.
8. Обчисліть масову процентну концентрацію розчину, що одержана розчиненням 50 г речовини в 1,5 дм3 води. Відповідь: 3,33%.
9. Обчисліть молярну концентрацію розчину K2SO4, в 20 см3 якого міститься 1,74 г розчиненої речовини. Відповідь: 0,5 М.
10. Скільки (у см3) 60%-вого розчину H2SO4 (ρ= 1,5 г/см3) треба взяти, щоб приготувати 2 дм3 12%-вого розчину (ρ = 1,08 г/см3)? Відповідь: 288 см3.
11. Обчисліть нормальну концентрацію 10%-вого розчину HNO3, якщо ρ = 1,056 г/см3. Відповідь: 1,68 н.
12. Розрахуйте нормальність розчину КМnО4, якщо на титрування 10,00 см3 0,1012 н. розчину оксалатної кислоти витрачено 12,15 см3 розчину КМnО4. Відповідь: 0,08329 н.
13. Розрахуйте вміст (у г) у розчині безводного натрій оксалату, якщо на титрування 15,00 см3 розчину, відібраних з 200 см3, витрачено 18,75 см3 0,1102 н. КМnО4. Відповідь: 1,8458 г
14. Розрахуйте вміст FeSO4∙7Н2О (в %), якщо наважку його
в 1,3875 г розчинена у воді, об'єм розчину доведений до 100 мл і на титрування 25,00 см3 цього розчину витрачено 17,25 см3 0,05 н. К2Сr2О7. Відповідь: 69,12%.
15. Розрахуйте вміст Н2С2О4∙2Н2О (в %), якщо її наважку в 0,1011 г розчинено у воді й відтитровано 0,1 н. Ce(SO4)2, якого витрачено 12,15 см 3. Відповідь: 75,75%.
16. Наважку 0,1120 г х.ч. К2Сr2О7 оброблено в кислому середовищі розчином KI і відтитровано розчином тіосульфату натрію, якого витрачено 20,15 см3. Обчислите нормальність, титр, поправочний коефіцієнт розчину й
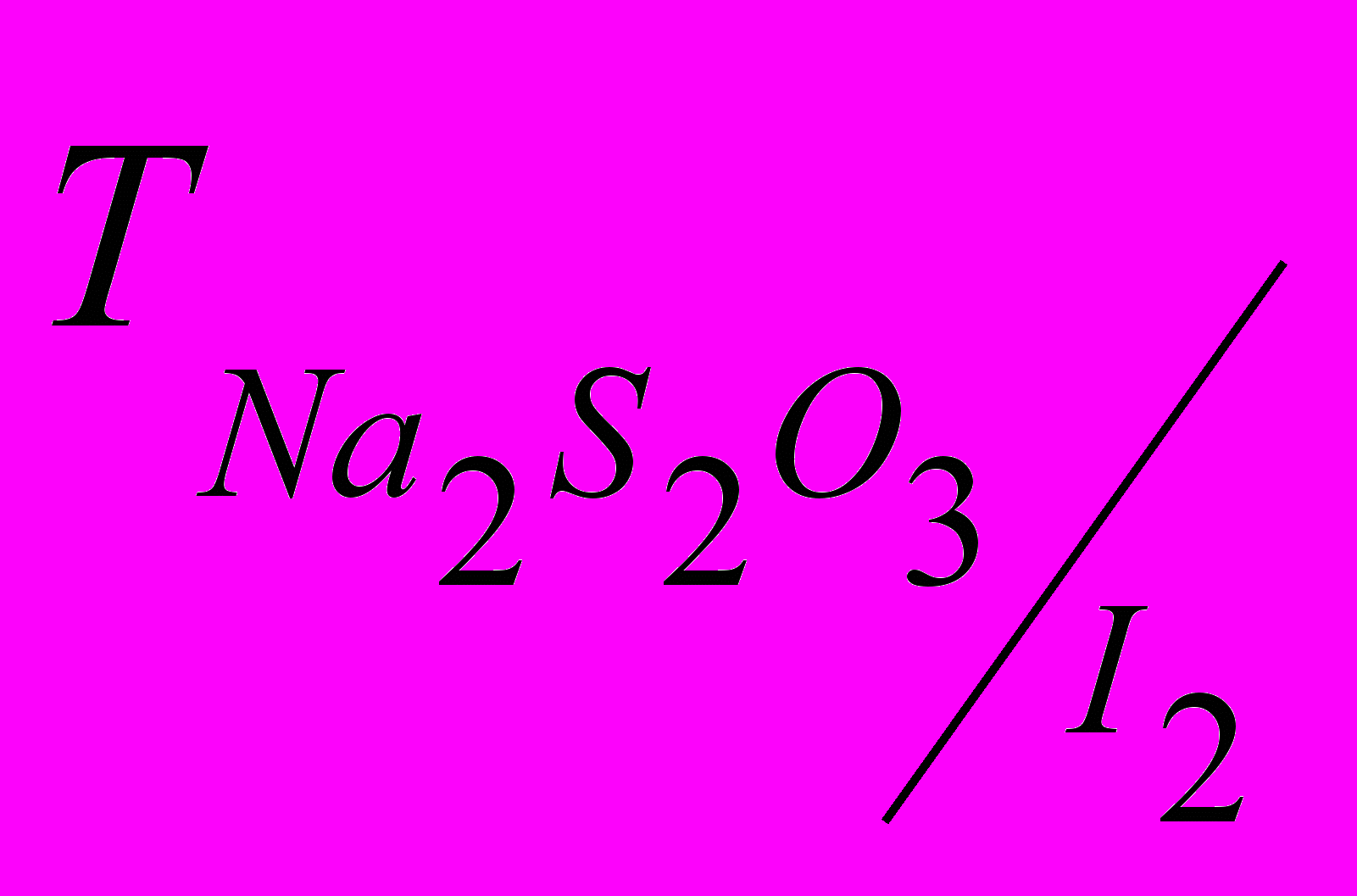 . Відповідь: 0,1134 н.; 0,02814 г/см ; 1,134 до 0,1 н.; 0,01439 г/см3.
. Відповідь: 0,1134 н.; 0,02814 г/см ; 1,134 до 0,1 н.; 0,01439 г/см3.17. Наважка 0,1585 г вапняку розчинена в НС1, оброблена надлишком оксалатної кислоти. Отриманий осад відділений, промитий і розчинений в H2SO4. Останній розчин відтитрований 28,75 см3 розчину КМnО4 з Т = 0,00285 г/см3. Розрахуйте вміст у наважці СаСОз і СаО (в %). Відповідь: 81,8%; 45,81%.
18. На титрування 20,00 см3 розчину (NH4)2C2O4∙H2O витрачено 18,25 см3 розчину КМnО4 з ТKМnO4/Fe = 0,005585 г/см3. Обчислити вміст (NH4)2C2O4∙H2O (у г) у титрованому об'ємі. Відповідь: 0,129 г.
Заняття 22. Електрохімічні методи аналізу. Потенціометрія
План:
- Інструктаж з техніки безпеки
- Ознайомлення з навчальним матеріалом
- Виконання лабораторної роботи
- Розрахунки та оформлення роботи
- Захист роботи
навчальний матеріал
Інструментальні методи аналізу застосовують в аналітичній хімії для ідентифікації речовин по фізичних і фізико-хімічних властивостях, вивчення їхньої будови й кількісного визначення. Останнє проводиться двома шляхами – виміром фізико-хімічних властивостей речовин (прямі інструментальні методи) і встановленням точки еквівалентності по змінах фізико-хімічних властивостей титрованого розчину (інструментальне або фізико-хімічне титрування). Залежно від використаних в аналізі властивостей розрізняють оптичні, електрометричні, хроматографічні й інші методи інструментального аналізу.
Метод заснований на вимірі різниці потенціалів виникаючої між індикаторним і стандартним електродами, опущеними в аналізований розчин. Потенціал індикаторного електрода залежить від концентрації речовини в розчині, від співвідношення концентрацій редокс-пари, їхньої природи, температури й інших факторів. Значення реального рівноважного потенціалу для металевого електрода або для редокс-пар є рівнянням Нернста
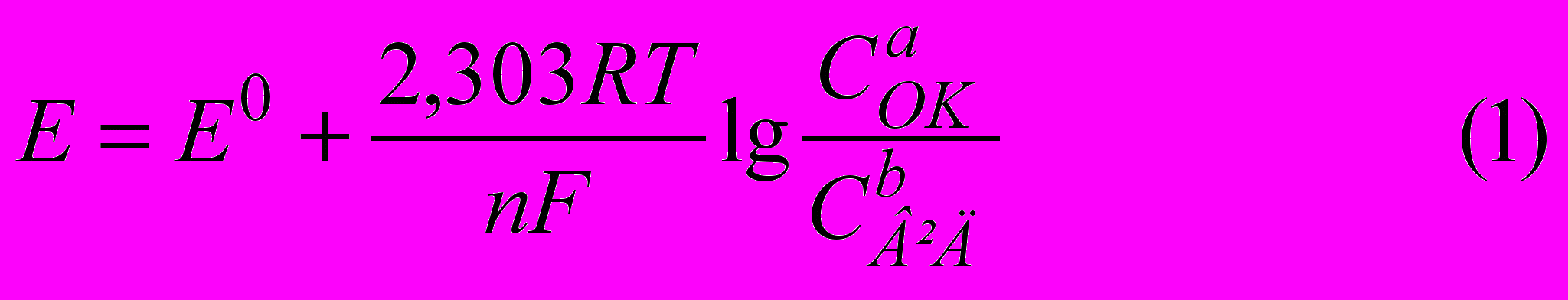
при Т = 273 +25?З = 298 К

де Е° – стандартний потенціал редокс-пари; n – число переданих у ході реакції електронів; СаОК, СbВІД – концентрації окисленої й відновленої форм речовини відповідно в ступенях їх стехіометричних коефіцієнтів; R – універсальна газова постійна; F – постійна Фарадея.
Якщо одна з форм (окислена або відновлена) являє собою тверду або газоподібну фазу, то в рівняння Нернста підставляють концентрації розчинених форм.
Потенціометричні вимірювання проводять за допомогою потенціометрів в осередку типу гальванічного елемента. В осередок, куди поміщають досліджуваний розчин, опускають два електроди - індикаторний і стандартний (електрод порівняння). У якості індикаторного використають скляні, металеві, мембранні електроди. Електродами порівняння служать насичені каломельний або хлорсрібний електроди, що мають постійний потенціал.
Потенціометрія застосовується для кількісного визначення речовин шляхом прямих вимірів потенціалу індикаторного електрода (визначення рН, pNa, pCl і т.д.) і потенціометричним титруванням. При потенціометричному титруванні виникає різка зміна значення потенціалу (стрибок) поблизу крапки еквівалентності (тобто), що зв'язано зі зміною редокс-пар до й після тобто Об'єм титранту в тобто визначають по кривій титрування, що є графічним зображенням процесу й будується в координатах E – V (або рН – V). Тип застосовуваного індикаторного електрода при потенціометричному титруванні залежить від властивостей титриметричної суміші і її взаємодії з електродом. У кислотно-основному титруванні використають скляний електрод, в окислювально-відновному - інертний (платиновий) електрод або електрод, оборотний стосовно одному з іонів, що втримуються в титриметричній суміші; в осаджувальному - срібний електрод; у комплексиметричному - металевий електрод, оборотний до іона металу, який титрується.
Лабораторна робота № 13. Визначення рН розчинів кислот, лугів, солей на іонометрі.
Визначення концентрації водневих іонів по методу прямої потенціометрії проводять зі скляним індикаторним електродом. Електрод порівняння - хлорсрібний електрод. Зміна потенціалу індикаторного електрода (показання гальванометра) пропорційно активній концентрації водневих іонів.
Реактиви й обладнання: NaOH, 0,1 н. розчин; НСІ, 0,1 н. розчин; СН3СООН, 0,1 н. розчин; рН-метр, осередок, скляний і хлорсрібний електроди, сольовий місток; мірні колби місткістю 100 мл; піпетка місткістю 10 мл; колба місткістю 100-150 см.
Виконання роботи. З 10 мл кожного 0,1 н. вихідних розчинів НС1, СН3СООН або NaOH готовлять по 3 розведення в мірній колбі місткістю 100 мл. Кожне наступне розведення проводять із 10 мл попереднього. Приготовлені розчини, починаючи з вихідних, по черзі заливають у склянку, в яку занурюють скляний електрод і сольовий місток. Прилад включають на вимірювання у діапазоні рН 1-14, визначають показання приладу по нижній шкалі рН-метра. Потім перемикають прилад на більш вузький діапазон відповідності з обмірюваним по шкалі грубого відліку через 1-2 хв., коли стрілка приладу прийме стійке положення, знімають відлік по верхній шкалі. Значення рН для даного діапазону знаходять за показаннями приладу на верхній шкалі. Записують показання в одиницях рН, за значенням рН обчислюють активну концентрацію водневих іонів в моль/дм3. Будують графік залежності р) від концентрації кислоти й основи. Встановлюють вплив ступеня дисоціації електроліту і його природи на величину рН. Потім готовлять буферну суміш із одного об'єму 0,1 н. СН3СООН і 0,5 об'єму 0,1 н. NaOH. Вимірюють рН приготовленого буферного розчину й перевіряють його буферну дія, додаючи 1-2 мл 0,1 н. НС1 або NaOH і вимірюючи рН.
Висновок.
Заняття 23. Розв’язування задач з теми «Електрохімічні методи аналізу».
План:
1. Основні формули та стадії розв’язку задач.
2. Розв’язування задач цього типу.
Зразки розв’язування завдань
Приклад 1. Обчислите ДРAgCl при 18°С, якщо реальний електродний потенціал срібного електрода, опущеного в насичений розчин AgCl, дорівнює 0,518 В щодо водневого електрода.
Рішення. Концентрацію Ag+ знаходимо по рівнянню Нернста (1). Якщо E0Ag+/Ag0 = +0,800 У; n = 1; Т = 273 + 18ºЗ = 291 ДО; тоді
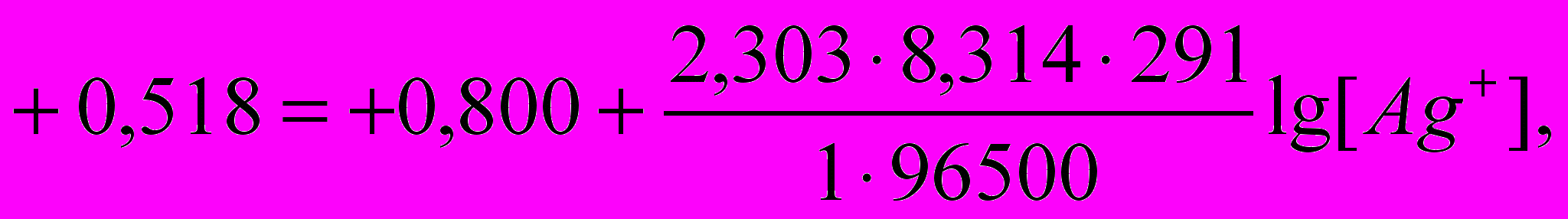
звідси
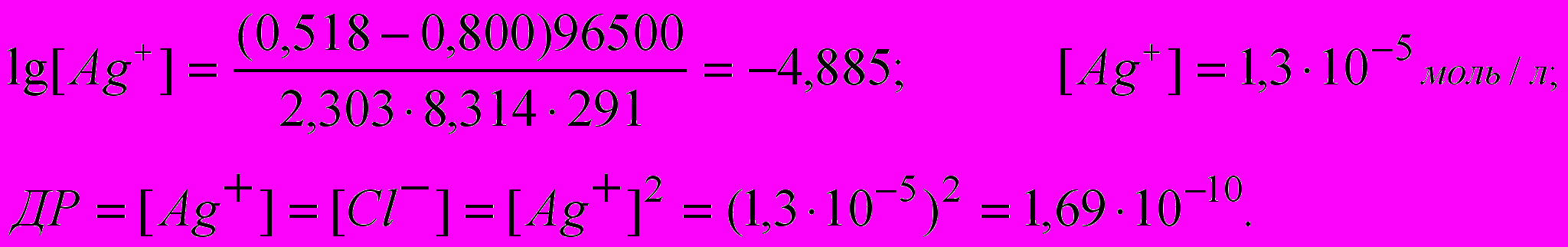
Задачі для самостійного контролю
1. Обчислити потенціал алюмінієвого електрода в розчині з 13,35 г AgCІ3 в 500 мл розчину, при 30° С відносно водневого електрода. Відповідь: 1,656 В.
2. При титруванні 25,0 см розчину СН3СООН 0,0100 н. NаОН були отримані наступні дані:
| VNaOH, мл | 15,00 | 16,00 | 17,00 | 17,50 | 18,00 | 18,50 | 19,00 |
| рH | 5,40 | 5,60 | 5,85 | 6,10 | 6,50 | 9,70 | 10,30 |
Розрахуйте нормальність розчину СН3СООН. Відповідь: 0,074 н.
3. Розрахуйте масу Cu2+ в 100 мл розчину, якщо при полярографу ванні 5 мл розчину висота хвилі становила 41 мм, а після додавання 1,5 мл 2·10-4 М стандартного розчину Купруму(ІІ) висота хвилі зросла до 52 мм. Відповідь: 5, 92·10-4 г.
4. Обчислити концентрацію іонів срібла над осадом при 20° С, якщо потенціал срібного електрода, опущеного в розчин, дорівнює 0,418 В по відношенню до стандартного водневого електрода. Відповідь: 2,63 ∙ 10-7 моль/л.
5. Розрахуйте потенціал скляного електроду в розчині з рН=5,0 по відношенню до хлор срібного електроду. Const скляного електроду дорівнює 0,35 В. Е(AgCl/Ag+)=0,222 В. Відповідь: -0,167 В.
6. Обчислити потенціал кадмієвого електрода в 0,05 н. Cd(NО3)2 відносно стандартного водневого електрода при 25° С. Відповідь: 0,447 В.
7. Побудувати криву потенціометричного титрування та визначити кількість хлоридної кислоти в 100 мл розчину, якщо при титруванні 20 мл розчину її 0,18 н. розчином лугу одержали наступні результати:
Vлугу, мл 10 15 18 19 19,5 19,9 20 20,1 21 21,5
рН 1,45 1,85 2,25 2,6 3,1 3,6 7,0 10,6 11,5 11,6
Відповідь: 0,657 г.
8. При полярографу ванні 25 мл розчину, що містить 3,5·10-4 М солі Купруму, 1,8·10-4 М солі Кадмію та 2,7·10-4 М солі Цинку, висота хвиль склали відповідно 41, 23, 32 мм. Скільки мл 10-2 М стандартних розчинів солей елементів треба додати до комірки, щоб висота хвиль збільшилася в 1,8-2,5 разів? Відповідь: 0,7-1,0; 0,35-0,5; 0,5-0,7 мл відповідно.
9. Скільки грамів аскорбінової кислоти міститься у наважці зразка, якщо її розчинили в 200 мл води, 10 мл змішали з рівним об’ємом 0,1 М розчину калій бромід, який окиснили до брому шляхом пропускання тока силою 70,4 мА в межах 6,51 хв? На один моль кислоти витрачається 1 моль брому. Відповідь: 0,5015 г.
Заняття 24. Молекулярна абсорбційна спектроскопія.
План:
- Інструктаж з техніки безпеки
- Ознайомлення з навчальним матеріалом
- Виконання лабораторної роботи
- Розрахунки та оформлення роботи
- Захист роботи
навчальний матеріал
РЕФРАКТОМЕТРІЯ
Рефрактометрія заснована на вимір кут заломленні світлових промінів при перехід його з одного середовищ у інше. Заломлення світла речовинами характеризують відносним показником заломлення nвідн при n2>n1 для двох середовищ:
nвідн= sin α/sin β= n2/n1.
Показник заломлення даного середовища n1 визначають по граничному кутe заломлення β. При куті падіння α = 90° (sin α = 1) і відомому показнику заломлення другого середовища n2
n1= n2sin β.
Показник заломлення розчину залежить від концентрації речовини. Рефрактометричне визначення проводять методом калібрувальних графіків, по таблицях показників заломлення й рефрактометричному фактору F. В останньому випадку концентрація розчину не повинна перевищувати 20%.
Рефрактометричний фактор F – різницею значень показників заломлення, що відповідає одиниці концентрації розчину речовини. Рефрактометричний фактор і концентрацію розчину по фактору розраховують по формулах:
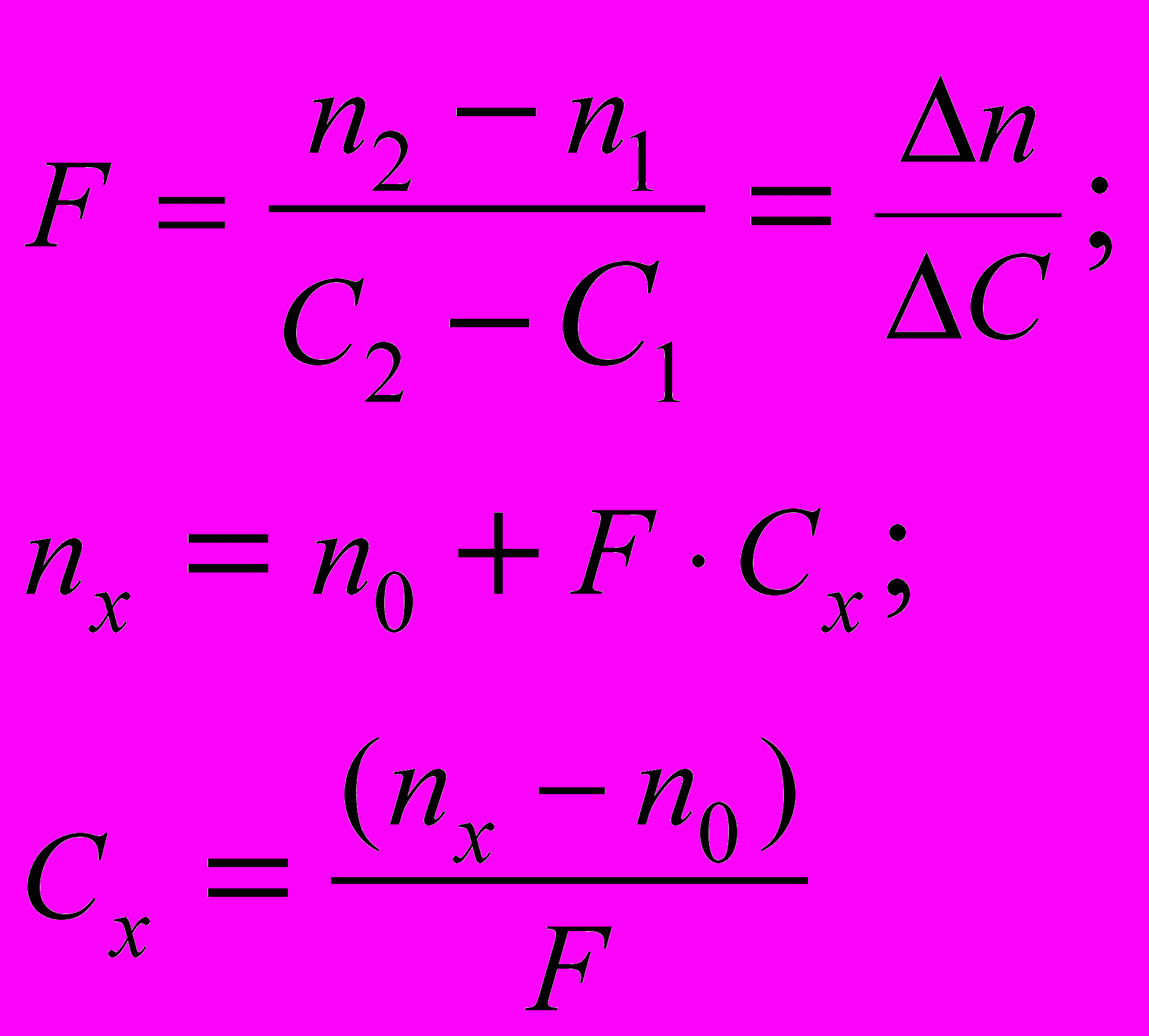
де n2 – показник заломлення розчину з більшою (відомою) концентрацією C2; n1 – показник заломлення розчину з меншою (відомою) концентрацією С1; nX – показник заломлення аналізованого розчину з концентрацією СX; n0 – показник заломлення розчинника.
При рефрактометричних вимірах враховують вплив температури на значення показника заломлення.
ПОЛЯРИМЕТРІЯ
Поляриметрія заснована на вимірюванні кута обертання площини поляризації світлового променя. Речовини, що мають здатність обертати площину поляризації світлового променя, називають оптично активними, до них відносяться сполуки із асиметричною структурою молекули. Речовини можуть обертати площину поляризації вправо «+» або вліво «-». Оптично активні речовини характеризуються величинами питомого і молярного обертань. Кут обертання площини поляризації вимірюють на поляриметрах.
КОЛОРИМЕТРІЯ. ФОТОКОЛОРИМЕТРІЯ. СПЕКТРОФОТОМЕТРІЯ
Колориметричні, фотоколориметричні й спектрофотометричні методи аналізу засновані на вимірі інтенсивності світлового потоку, що пройшов через пофарбований розчин. У колориметрії й фотоколориметрії світловий потік - поліхроматичний, у спектрофотометрії - монохроматичний. Залежність між інтенсивністю забарвлення розчину й вмістом у ньому пофарбованої речовини виражається законом світлопоглинання Бугера-Ламберта-Бера:
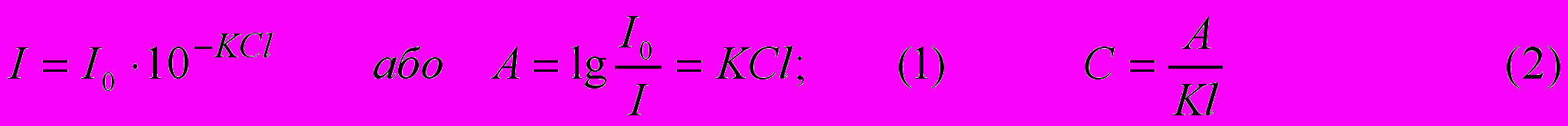 при С = 1 моль/л і ℓ= 1 см K = А, де А – оптичне поглинання розчину; І0 – інтенсивність світла, падаючого на розчин; І – інтенсивність світла, що пройшло через розчин; С – концентрація розчину, моль/л або %, ℓ – товщина шару розчину, см; К – коефіцієнт поглинання, що виражається при С у моль/л через ε – молярне поглинання, а при С у % - через 1 см – питоме поглинання розчину.
при С = 1 моль/л і ℓ= 1 см K = А, де А – оптичне поглинання розчину; І0 – інтенсивність світла, падаючого на розчин; І – інтенсивність світла, що пройшло через розчин; С – концентрація розчину, моль/л або %, ℓ – товщина шару розчину, см; К – коефіцієнт поглинання, що виражається при С у моль/л через ε – молярне поглинання, а при С у % - через 1 см – питоме поглинання розчину.Графічна залежність між оптичним поглинанням і довжиною хвилі світла, що поглинає, називається спектром поглинання. У спектрі поглинання речовин спостерігаються максимуми поглинання, що характеризуються довжиною хвилі λ, молярним поглинанням ε й напівшириною σ. Інтенсивність забарвлення вимірюють неозброєним оком – візуальні або суб'єктивні методи (колориметричні) і за допомогою фотоелементів у спеціальних приладах (фотоколориметрах і спектрофотометрах) – об'єктивні методи (фотоколориметричні й спектрофотометричні).
У спектрофотометрії, використовуючи залежність А = ε∙С∙ℓ або A=E1%1см∙C∙ℓ, можна визначати концентрацію речовини в розчині по обмірюваному на спектрофотометрі оптичному поглинанні. Попередньо визначають молярне ε або питоме E1%1см поглинання за чистою речовиною або знаходять їх у довідникових таблицях. Для зменшення похибки під час визначення поглинання А концентрація розчину та товщина його шару підбираються так, щоб значення А в дослідній спектральній області знаходилося в межах 0,2-0,8.
Лабораторна робота № 14. Визначення Купруму(ІІ) у вигляді амоніакату методом фотоколориметрії.
Реактиви й обладнання: стандартний розчин Купруму, що містить в 1 мл 0,05 мг міді; розведений (1:1) водний розчин амоніаку; мірні колби місткістю 50 мл; піпетка на 10 мл; пальчикові мірні пробірки місткістю 10 мл; фотоколориметр КФК; кювети на 5 см.
Виконання роботи. Роботу починають із побудови калібрувального графіку. У ряд мірних колб на 50 мл наливають 1,0; 3,0; 5,0; 7,0; 8,0 мл стандартного розчину сульфату міді. Розчини в кожній колбі нейтралізують розчином аміаку до появи слабкої каламуті й За результатами вимірів будують графік залежності оптичного поглинання від концентрації міді в (мг/л). Аналізований розчин поміщають у мірну колбу місткістю 50 мл, додають 5 мл надлишку розчину аміаку, доводять водою до мітки й ретельно перемішують. Вимірюють оптичне поглинання розчину у кюветі з ℓ = 5 см. За графіком визначають концентрацію міді в розчині.
Висновок.
Заняття 25. Розв’язування задач з теми «Молекулярна абсорбційна спектроскопія».
План:
1. Основні формули та стадії розв’язку задач.
2. Розв’язування задач цього типу.
1. РОЗРАХУНКИ КОНЦЕНТРАЦІЙ В ІНСТРУМЕНТАЛЬНИХ МЕТОДАХ
Спосіб стандартних розчинів:
Певний об’єм стандартного розчину (з відомою концентрацію) визначуваного компоненту проходе всі стадії методики, що й дослідний зразок. Одержані значення аналітичного сигналу з двох розчинів співвідносяться:
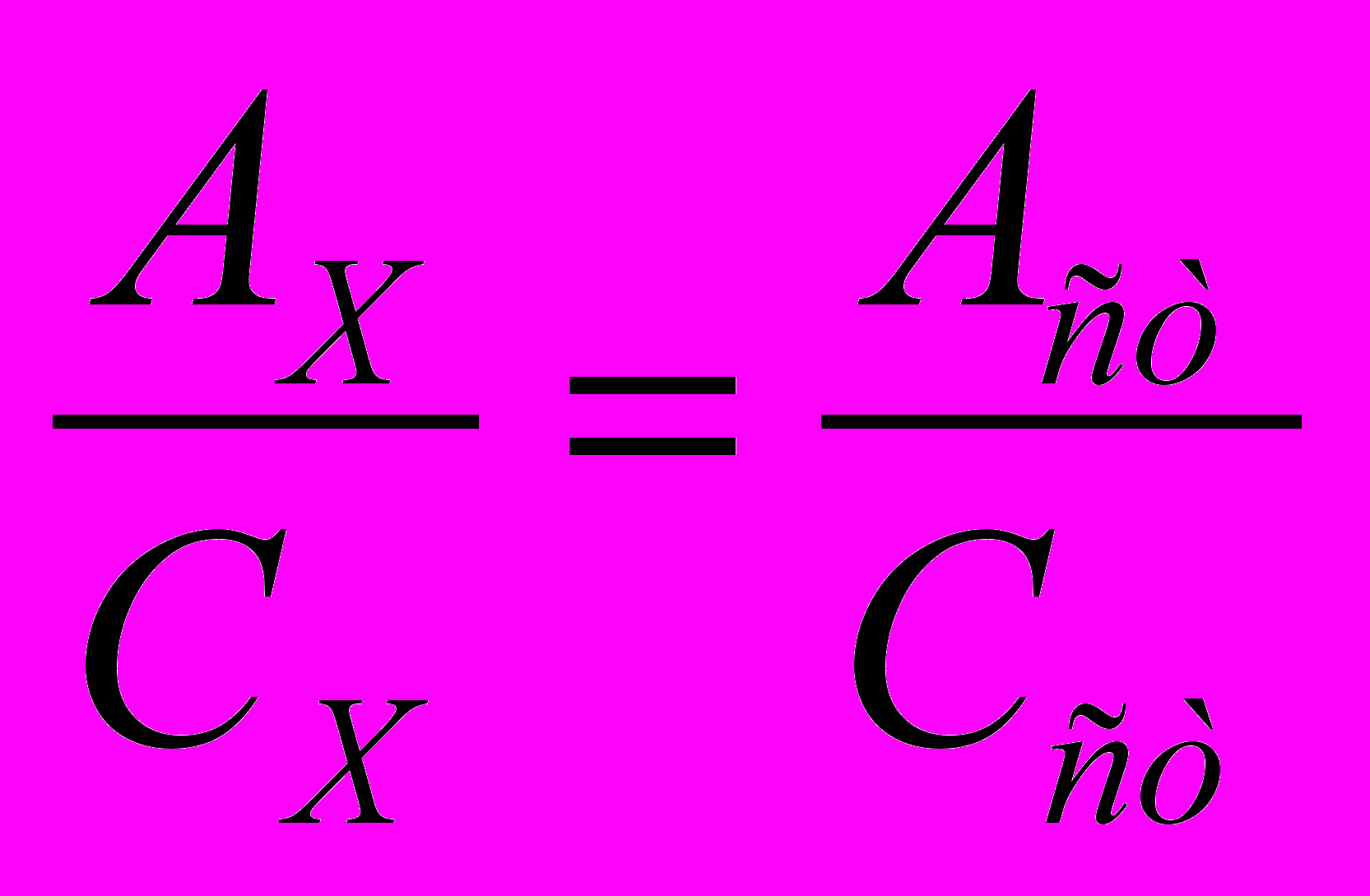 .
.Спосіб калібрувального графіку:
Готується серія розведень стандартного розчину, вимірюють їх аналітичний сигнал та будують графік у координатах залежності параметру від концентрації речовини. Потім зразок аналізують фіксують його силу сигналу та графічно знаходять концентрацію.
А
Ах х
х
Сх С, М
Спосіб добавок:
Беруть два розчини зразка однакового об’єму та аналізують їх паралельно, лише до одного з них додають певний об’єм стандартного розчину. Після аналізу концентрацію розчину зразка розраховують наступним чином:
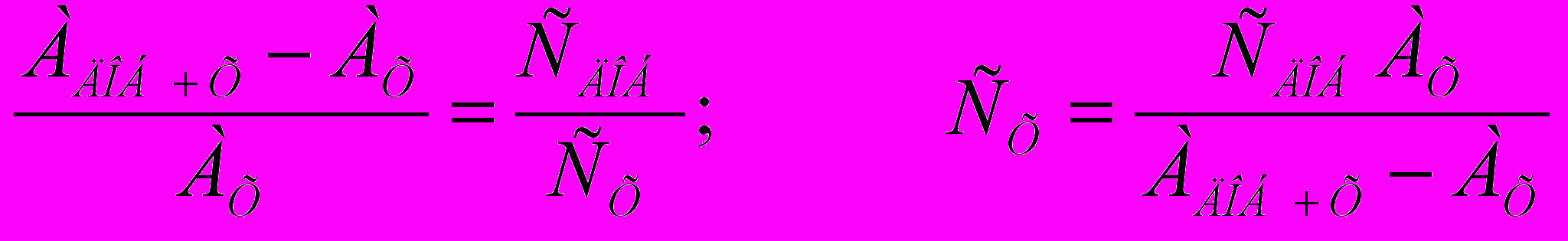
Приклади розв’язування вправ
Приклад 1. До розчину солі міді додали розчин амоніаку й визначили в колориметрі занурення, що однакова інтенсивність забарвлення спостерігається при висоті стовпа аналізованого розчину в 15 і стандартного розчину в 21 поділок шкал. Обчисліть вміст Сu2+ (в %), якщо стандартний розчин 0,05%-вий (0,5 мг/мл). Умови готування аналізованого й стандартного розчинів однакові.
Розв'язання. Розрахунок вмісту здійснюємо по формулі (3):
СХ = 0,05 ∙ 21/15 = 0,07% (0,7 мг/мл).
Приклад 2. При фотоколориметричному визначенні Fe3+ із сульфосаліциловою кислотою зі стандартного розчину зі вмістом заліза 10 мг/мл приготували ряд розведень у мірних колбах місткістю 100 мл, виміряли оптичне поглинання й одержали наступні дані:
VСТ, мл 1,0 2,0 3,0 4,0 5,0 6,0
А
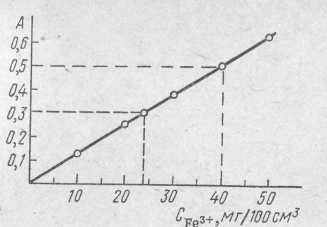 0,12 0,25 0,37 0,50 0,62 0,75
0,12 0,25 0,37 0,50 0,62 0,75Визначте концентрацію заліза у розчинах, якщо їх оптичні густини становлять 0,30, 0,50.
Розв’язання:
Будуємо калібрувальний графік для стандартних розчинів (рис. 1) та знаходимо концентрацію для оптичних Рис. 1. Графік залежності оптичного
густин за графіком. Вона дорівнює 24 поглинання від концентрації
та 40 мг/100мл відповідно.
Задачі для розв’язку
1. Розрахуйте молярне поглинання розчину купрум(ІІ) амоніак ату, якщо оптична густина його, що містить 9,6 мг/дм3 іону Купрум(ІІ), в кюветі з товщиною 2 см дорівнює 0,127. Відповідь: 423,3.
2. Визначте концентрацію Купрум(ІІ) (в моль/дм3 та мг/дм3), якщо оптичне поглинання розчину його амоніачного комплексу в кюветі з ℓ = 2 см складає 0,254, а молярне поглинання 423,3. Відповідь: 3·10-4 М, 19,2 мг/дм3.
3. Визначте концентрацію рутину (в моль/дм3 та мг/дм3), якщо оптичне поглинання аналізованого розчину 0,78, а стандартного – 0,65 при 258 нм (Сст= 6,1·10-5 М, М(рутину)=610 г/моль). Відповідь: 7,32·10-5 М, 44,7 мг/дм3.
4. Оптичне поглинання розчину речовини в кюветі на 3 см дорівнює 0,75. Стандартний розчин, що містить 5 мг/дм3 речовини, має А=0,55 в кюветі на 5 см. Визначте концентрацію розчину (в мг/дм3). Відповідь: 11,36 мг/дм3.
5. Оптичне поглинання розчину забарвленого сполукою Феруму, що містить 1 мг/дм3 Fe3+ в монохроматичному світлі в кюветі на 3 см, дорівнює 0,45. Визначте молярне поглинання катіону Ферум(ІІІ) у цій сполуці. Відповідь: 8400.
6. Визначте вміст Купруму (%) в 10 г зразка, 1 г якого розчинили в мірній колбі на 100 см3. Оптична густина розчину в кюветі на 3 см склала 0,675, а ε= 4,5·104 М. Відповідь: 3,2·10-3%.
7. Оптична густина розчину плюмбум комплексонату, що містить 5 мкг/мл Плюмбуму, дорівнює 0,643 в кюветі на 3 см. Визначте молярне поглинання цієї сполуки. Відповідь: 8,9·103.
8. Значення молярного коефіцієнту поглинання Бісмуту з тіосечовиною (складу 1:3) дорівнює 3,5·104. Яка оптична густина розчину в кюветі на 2 см з вмістом Ві 0,5 мкг/мл. Відповідь: 0,167.
9. При спектрофотометричному визначенні Купруму з діетилдитіокарбамінатом оптична густина розчину, що містить 0,029 мг Купруму в 50 мл органічного розчинника, дорівнює 0,256 в кюветі на 2 см. Визначте молярне поглинання комплексу. Відповідь: 1,4·104.
Заняття 26. Колоквіум № 4.
