Пояснювальна записка
| Вид материала | Документы |
- Реферат курсовий проект: пояснювальна записка сторінок, таблиць, 10.59kb.
- Програми для загальноосвітніх навчальних закладів з українською мовою навчання, 889.57kb.
- Пояснювальна записка, 584.46kb.
- Пояснювальна записка, 1142.65kb.
- Дипломна робота пояснювальна записка, 1244.36kb.
- Пояснювальна записка, 743.42kb.
- Фізична культура пояснювальна записка, 296.81kb.
- Програма зовнішнього незалежного оцінювання з в сесвітньої історії пояснювальна записка, 478.76kb.
- Програма для загальноосвітніх навчальних закладів 7 9 класи пояснювальна записка, 286.52kb.
- Автори програми: д ф. м н., професор чалий о. В., к ф. м н., доцент цехмістер я. В.,, 149.19kb.
План:
- Інструктаж з техніки безпеки
- Ознайомлення з навчальним матеріалом
- Виконання лабораторної роботи
- Розрахунки та оформлення роботи
- Захист роботи
навчальний матеріал
При окиснювально-відновному титруванні змінюється окиснювально-відновний потенціал системи. При повноті зв'язування реагуючих речовин на 99,99% і співвідношенні 1:1 константа рівноваги реакції повинна бути не менш 108. Звідси випливають значення ЕДС реакцій, які можна використати в титриметричному аналізі із зазначеною повнотою перебігу.
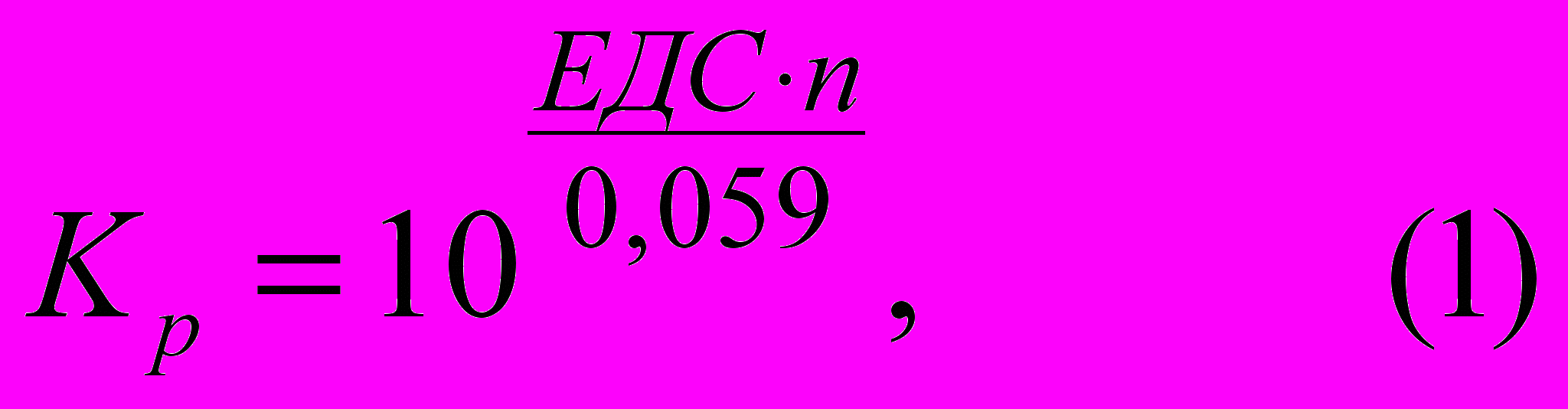
де п – збалансована кількість електронів;
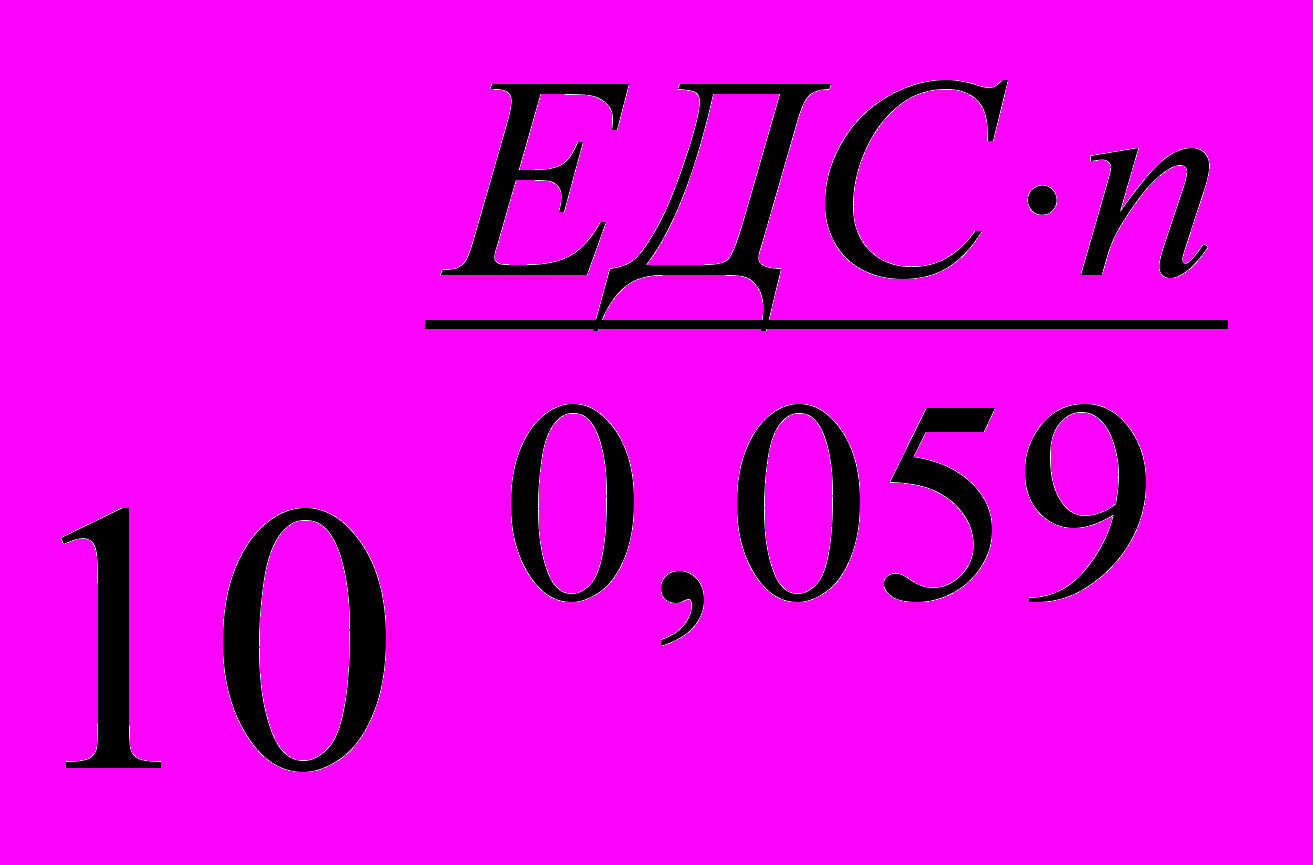 ≥ 108; ЕДС∙n ≥ 8∙0,059 ≥0,472 В; при п = 1 ЕДС = 0,472 В; при п = 2 ЕДС = 0,236 В і т. д.
≥ 108; ЕДС∙n ≥ 8∙0,059 ≥0,472 В; при п = 1 ЕДС = 0,472 В; при п = 2 ЕДС = 0,236 В і т. д.Методи окиснювально-відновного титрування класифікують за типом титранта, наприклад перманганатометричне титрування – титр антом є розчин КМnО4 Стандартними речовинами цих методів є оксалатна кислота і її солі, К2Сr2О7, КВrО3, солі Ce (IV) х.ч., сульфанілова кислота й ін. Використовується пряме, зворотне титрування й титрування замісника.
Аналіз процесу титрування й вибір індикаторів проводять, як і у всіх випадках, на підставі кривих титрування. Криві будують у координатах: Есистеми (в В або мВ) – Vтитрантa, (у см3). Значення Есистеми у кожний момент титрування до й після точки еквівалентності, у т.е. розраховують за формулами (табл. 1)
Таблиця 1
Розрахункові формули для значення Есистеми в окиснювально-відновному титруванні
| Варіант титрування | Титрування | ||
| до т.е. | у т.е. | після т.е. | |
| А – відновник, що титрується В – титрант-окисник | 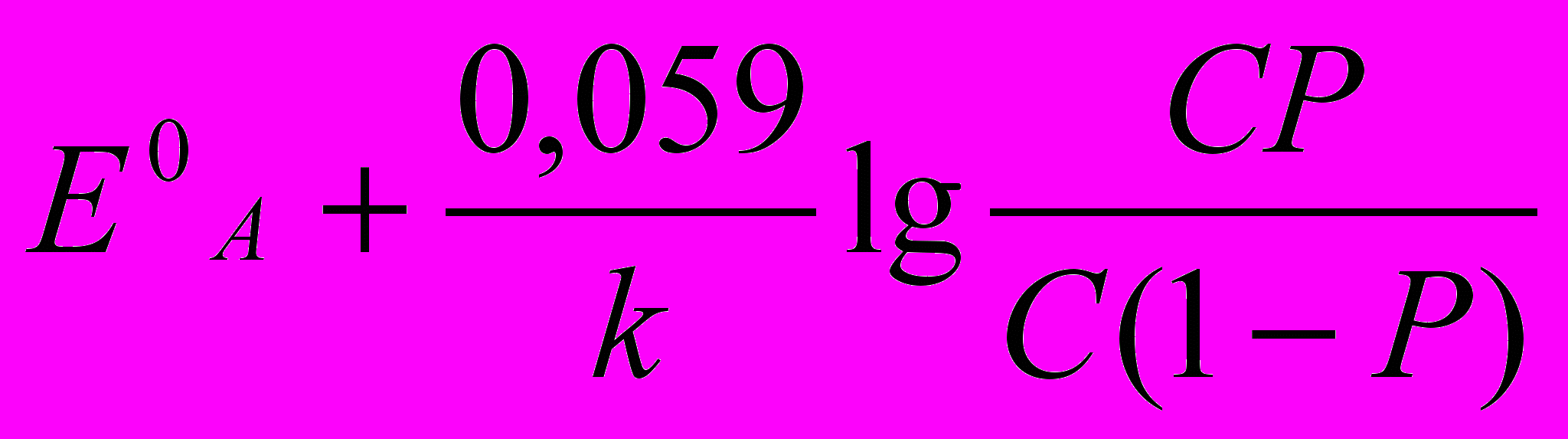 | 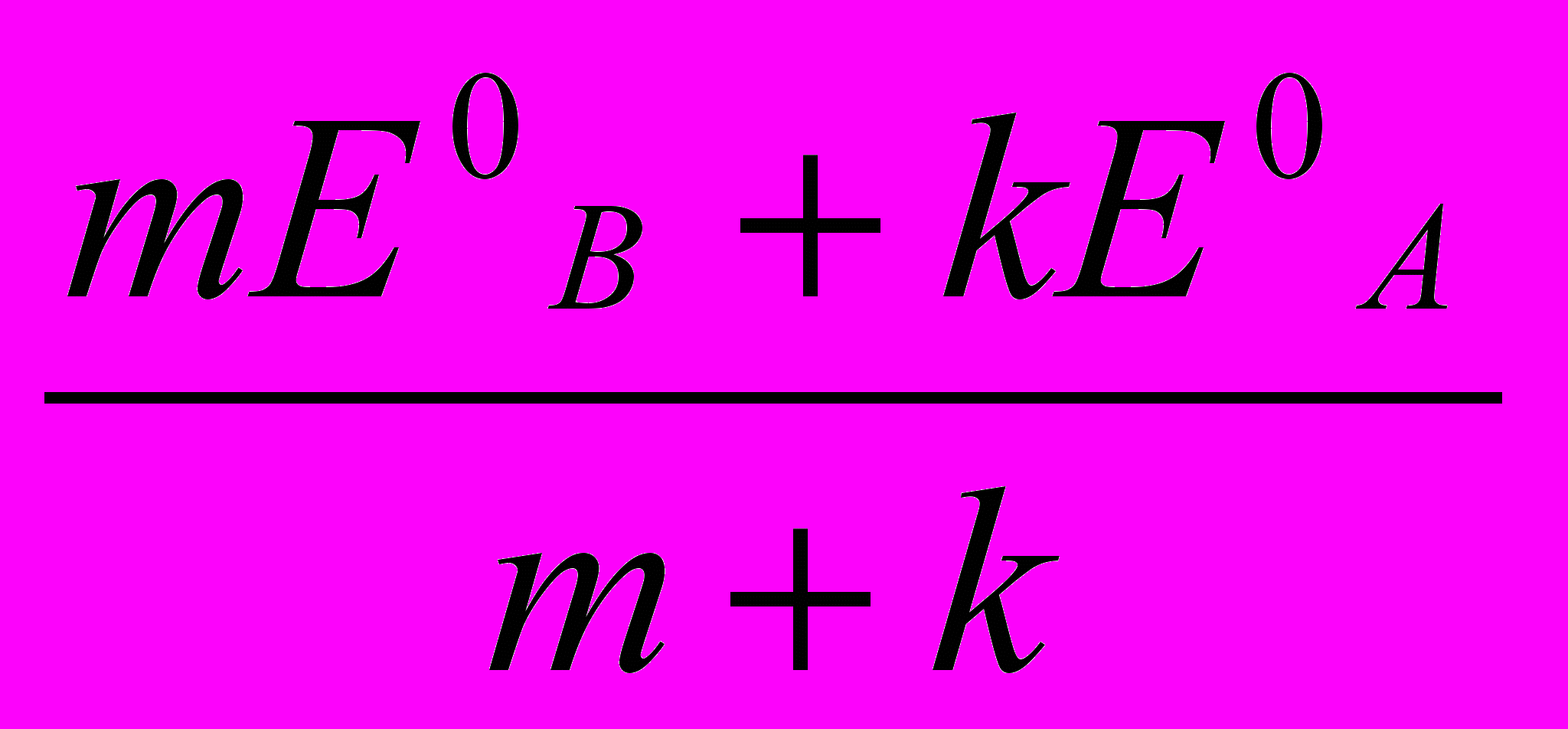 | 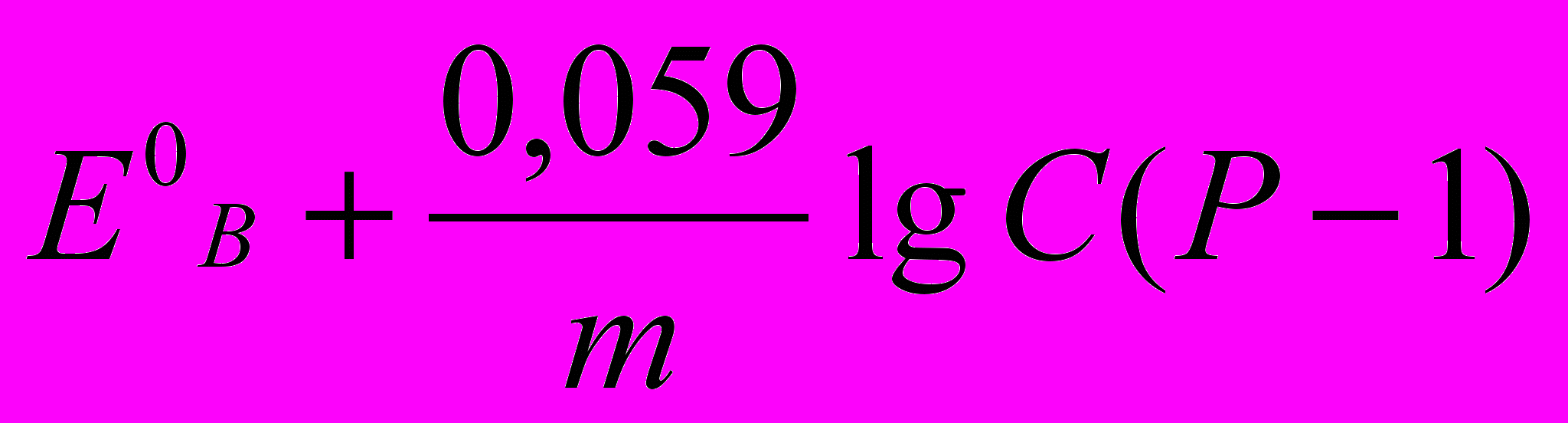 |
| А – окисник, що титрується В – титрант- відновник | 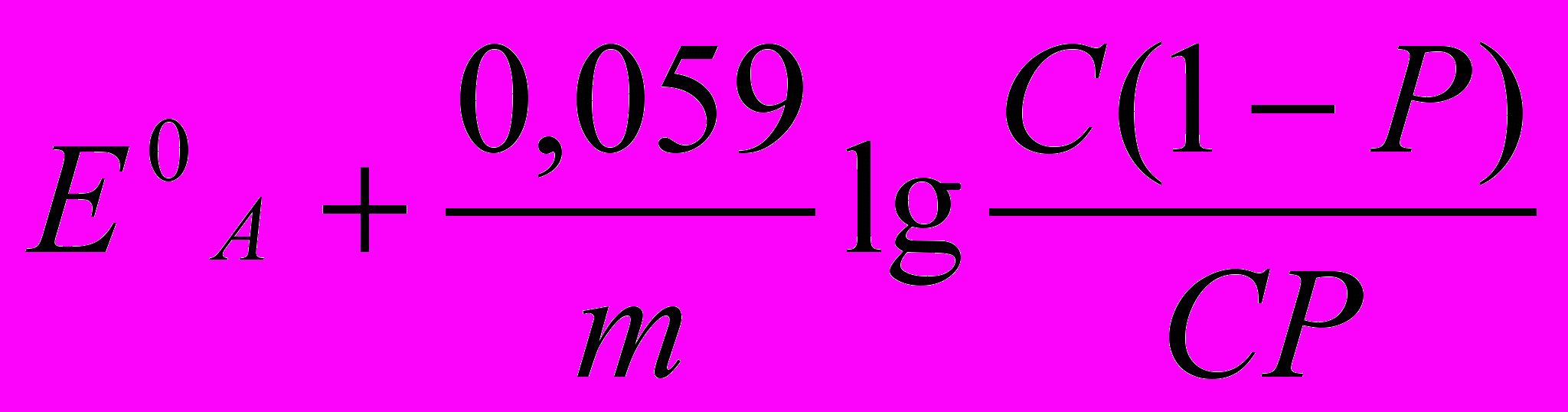 | 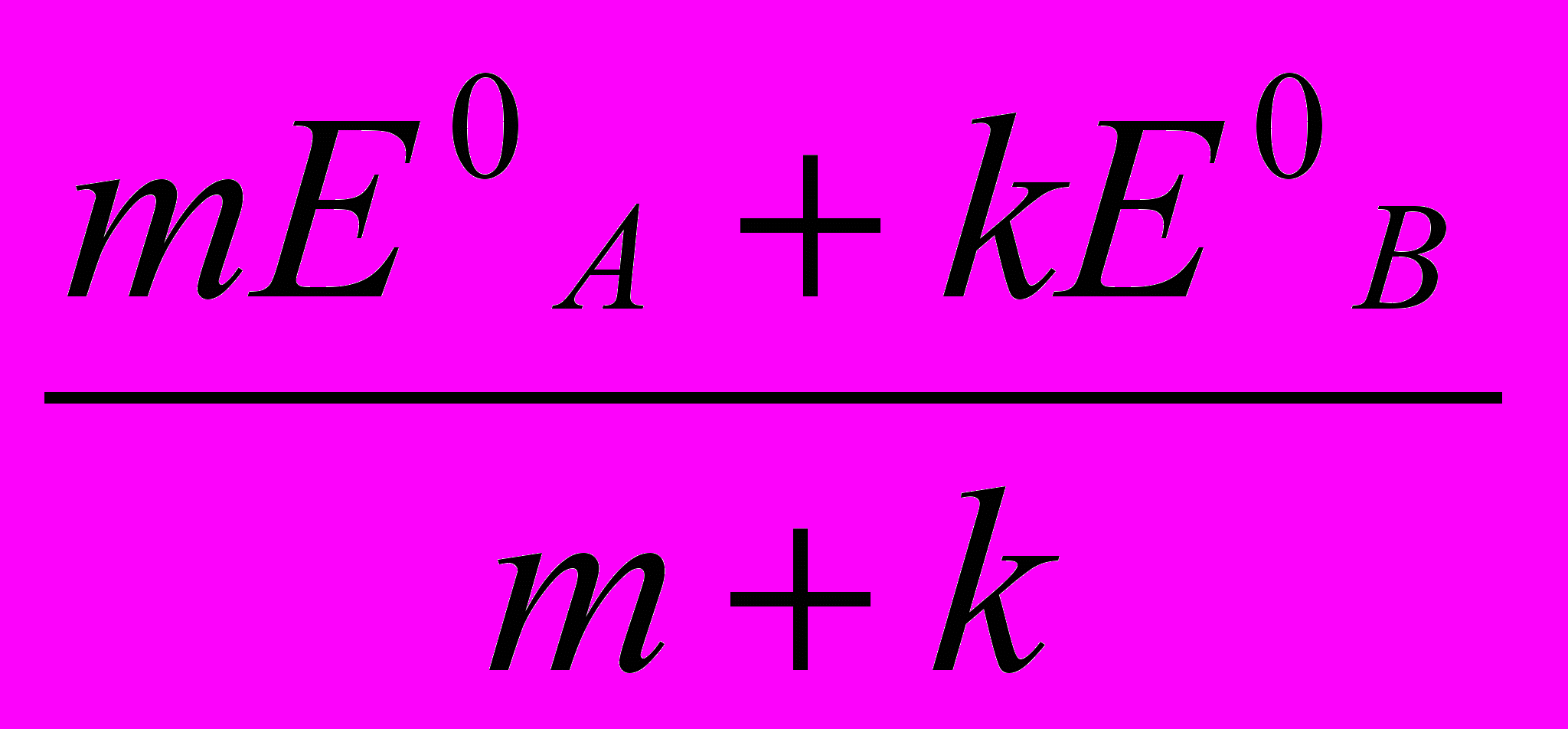 | 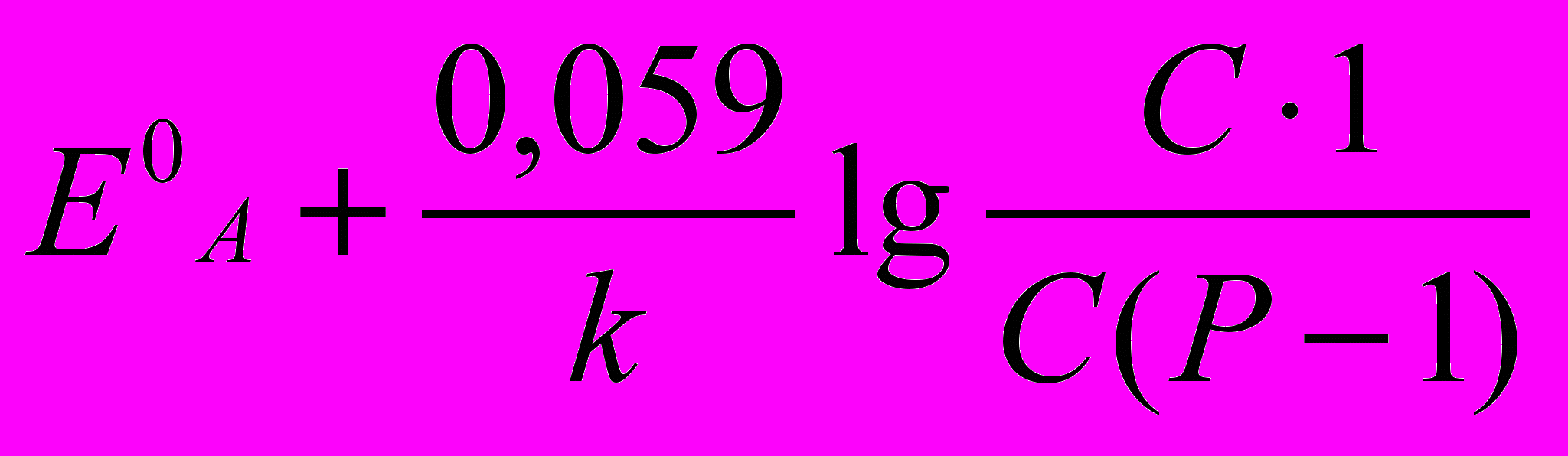 |
На кривій спостерігається стрибок титрування, усередині якого лежить т.е. Вибір індикатора роблять за принципом: індикатор повинен спрацювати поблизу т.е. або в інтервалі стрибка. В окиснювально-відновлювальному титруванні використовують різні типи індикаторів: індикатори-титранти, специфічні, необоротні й окиснювально-відновні.
Перманганатометрія
Для перманганатометричних визначень рекомендується застосовувати 0,05 н. розчин калій перманганату КМnО4. Однак застосування його пов'язане з деякими практичними ускладненнями. Дуже важко одержати калій перманганат в чистому виді. Звичайно він забруднений слідами манган(IV) оксиду. Крім того, дистильована вода звичайно містить сліди речовин, які відновлюють калій перманганат з утворенням манган(IV) оксиду. Розчин, приготовлений відважуванням певної кількості хімічно чистої солі, розчиненням її й розведенням у мірній колбі, не можна вважати титрованим. Титр його можна встановити не раніше, ніж через 7-12 днів після готування розчину. Щоб розчин був досить стійкий і титр його не змінювався, треба видалити з нього МnО2, для чого необхідно пропустити розчин перед його вживанням через фільтр, що не відновлює калій перманганат КМnО4. Присутність манган(IV) оксиду каталітично прискорює саморозклад калій перманганату при стоянні розчину. Кислі розчини КМnО4 не можна зберігати, тому що вони розкладаються швидше нейтральних розчинів.
Треба пам’ятати, що калій перманганат окиснює гуму, коркові пробки, фільтрувальний папір, тому не можна фільтрувати його розчин через паперовий фільтр, а використовувати для цих цілей скляні фільтри або зливати розчин сифоном.
Лабораторна робота № 11. Приготування і установка титру робочого розчину калій перманганату за оксалатною кислотою. Визначення вмісту Феруму(ІІ) в солі Мора.
Реактиви: КМnО4, Н2С2О4∙2Н2О х. ч., H2SO4 – 12,5%-вий та 5%-вий розчини
Розчин КМnО4 застосовують як окислювач у сильнокислому середовищі, при цьому Манган(VII) відновлюється до Мангану(II), Е°МnО4-/Мn2+ = +1,51 В, Е=158,04:5 = 31,61 г/моль. Калій перманганат завжди містить домішки продуктів відновлення МnО2, він також легко змінюється під впливом відновників, амоніаку, органічних речовин, що потрапляють з пилом, і т.п. Тому якийсь час після готування концентрація його розчинів повільно змінюється. При виконанні робіт з методу перманганатометричного титрування готовлять титрант – розчин КМnО4 і стандартизують його за допомогою оксалатної кислоти.
Готування 0,1 н. розчину калій перманганату. Для готування 200 мл 0,1 н. KМnО4 розраховують наважку за формулою (2, заняття 20) і, з огляду на легку відновлюваність реактиву, збільшують її на ~10%. Відважують на технохімічних або аптечних вагах розраховану наважку КМnО4. Тому що кристали калій перманганату розчиняються повільно, частина відміреної води нагрівають до 80-90°С і невеликими порціями доливають при постійному перемішуванні. Потім обережно зливають рідину з склянки у мірну колбу й знову додають до кристалів гарячу воду. По закінченні розчинення й охолодження додають воду, що залишилася, переливають у склянку з темного скла й залишають на 7-8 днів. Після закінчення зазначеного часу розчин фільтрують через скляний фільтр або скляну вату в темну склянку й закривають скляною пробкою. Зберігають у темному місці.
Для більш швидкого готування розчину калій перманганату можна скористатися таким способом: 1,58 г хімічно чистого калій перманганату розчиняють в 1 л води, доводять розчин до кипіння й продовжують нагрівання при температурі, близької до точки кипіння, протягом 1 год. Потім фільтрують розчин через скляний фільтр у чисту склянку. Одержують 0,05 н. розчин. Перевіряють титр. Якщо через якийсь час на дні посудини з'явиться осад манган(IV) оксиду, треба ще раз профільтрувати розчин і знову встановити його титр.
Готування 0,1 н. розчину оксалатної кислоти. Свіжоперекристалізована оксалатна кислота певна її наважка (для приготування 250 мл 0,1 н. розчину) зважується на аналітичних вагах, переноситься в мірну колбу на 250 мл, розчиняють у воді, доводять об’єм розчину до мітки і добре перемішують. Нормальність розраховують за формулою (8 зан.20). Окрім оксалатної кислоти, для встановлення титру й нормальності розчину КМnО4 можна використати натрій оксалат, калій гексаціаноферат(II), калій йодид, ферум(II) сульфат, металічний ферум й ін.
Стандартизація 0,1 н. розчину калій перманганату.
Бюретку із краном заповнюють розчином КМnО4. У колбу для титрування за допомогою піпетки вносять 15,00 мл стандартного розчину оксалатної кислоти, додають 10 мл 12,5%-вого розчину H2SO4 і отриману суміш нагрівають до 70-80°С. Нагрівати розчин до кипіння не можна, тому що при цьому відбувається часткове розкладання оксалатної кислоти до СО2, СО і Н2О. Потім гарячу суміш титрують розчином КМnО4. Спочатку додають 1-2 краплі титранту й очікують, перемішуючи, поки розчин знебарвиться. Наступні порції титранту відновлюються швидше. Кінець титрування визначають за незникаючому рожевому забарвленню, що з'являється при додаванні зайвої краплі розчину КМnО4. Розраховують нормальність розчину КМnО4 за формулою (5 заняття 20).
Перманганатометричним титруванням також можна визначати залізо в солі Мору, металічне залізо, нітрити, солі Кальцію, Мангану(II) і ін.
Визначення вмісту Ферум(II) у солі Мору
Проводять титрування солі Ферум(II) калій перманганатом. Розчин підкисляють сульфатною кислотою й титрують до кінцевої точки. Ферум(II) окиснюється до Ферум(Ш):
10FeSO4 + 2KMnО4 + 8H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Знаючи нормальність розчину КМnО4 і витрачений об'єм його, легко розрахувати кількість заліза в досліджуваному розчині. Як приклад розглянемо визначення іона Fe2+ у солі Мору, що має сполука (NH4)2SO4 ∙ FeSO4 ∙ 6Н2О.
Хід визначення
У мірну колбу на 250 мл беруть певну кількість розчину солі Мору, доводять об'єм колби до мітки дистильованою водою й ретельно перемішують.
Відміряють піпеткою 25,00 мл розчину, переносять у конічну колбу для титрування, додають 10-15 мл 2 н. розчину сульфатної кислоти й титрують її робочим розчином калій перманганату. Титрування проводять на холоді, тому що при нагріванні іон Fe2+ окиснюється киснем повітря до іона Fe3+. Додавання перманганату припиняють після того, як розчин прийме блідо-малинове забарвлення, що не зникає протягом 1-2 хв. Титрування повторюють кілька разів, беруть середнє значення й розраховують кількість грамів заліза в аналізованому розчині.
Розраховують титр калій перманганату по залізу, тобто довідуються, скільки грамів іона Fe2+ може окиснити калій перманганат, що міститься в 1 мл даного розчину. Припустимо, що титрування проводилося 0,05081 н. розчином КМnО4, тоді
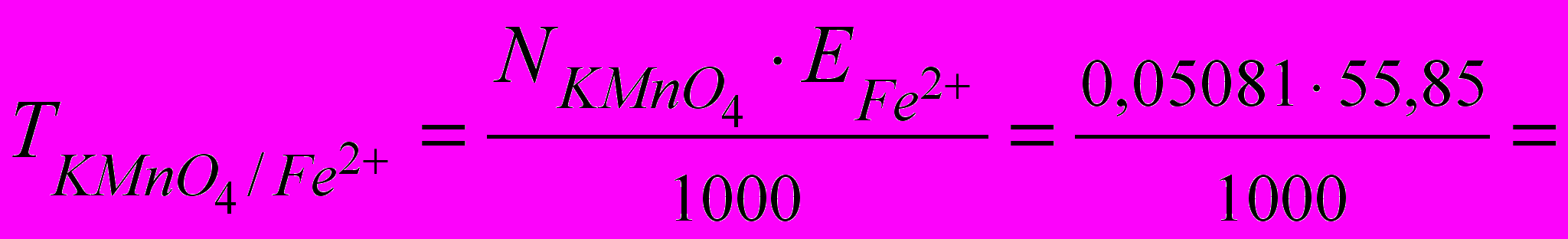 0,002838 (г/мл)
0,002838 (г/мл)Грам-еквівалент заліза дорівнює 55,85 г. Якщо на титрування 25 мл досліджуваного розчину витрачено в середньому 23,80 мл розчину КМnО4, то кількість заліза в 250 мл буде становити:
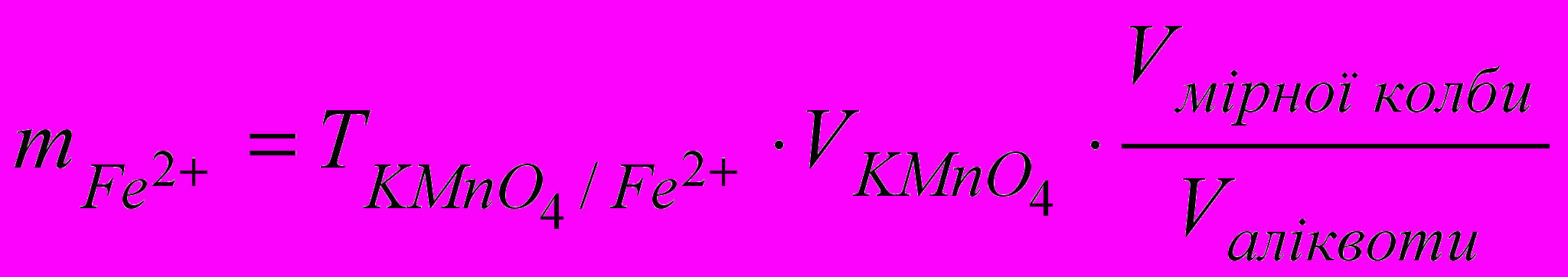 = 0,002838∙23,80∙10 = 0,6754 (г)
= 0,002838∙23,80∙10 = 0,6754 (г)Висновки
Заняття 18. Розв’язування задач з теми «Побудова кривих титрування».
План:
1. Основні формули та стадії розв’язку задач.
2. Розв’язування задач цього типу.
Задачі для самостійного контролю
Розрахуйте, побудуйте й проаналізуйте криву титрування а) титрант – 0,1 н. К2Сr2О7, титрована речовина – 100 мл 0,1н. FeSО4, середовище – 1 М H2SO4; б) титрант – 0,1 н. Ce(SO4)2, титрована речовина – 0,1 н. FeSO4, середовище – 1 М H2SO4; в) титрант – 0,1 н. Na2S2О3, титрована речовина 0,1 н. І2; г) титрант – 0,1 н. КМnО4, титрована речовина 0,1 н. розчин оксалатної кислоти, середовище – 1 М H2SO4.
- Побудуйте криву титрування 0,200М розчину хлоридної кислоти 0,100 М розчином натрій гідроксиду.
- Розрахуйте, побудуйте криву титрування розчину слабкої основи розчином НCl тієї ж концентрації. Розрахунок [H+] та рН зробити для точок 0, 10, 50, 90, 99,9, 100, 100,1, 101% доданого титр анту. Вкажіть межі стрибка титрування та рН середовища у точці еквівалентності.
- Побудуйте криву титрування 100 см3 0,1 н. NН3 0,1 н. розчином НCl.
- Розрахуйте, побудуйте криву титрування 0,15 н. розчину НCl 0,15 н. NaОН; 0,1 н. СН3СООН 0,1 н. NaОН.
- Розрахуйте, побудуйте криву титрування 0,1 М розчину Н3РО4 0,1 н. NaОН.
- Розрахуйте, побудуйте криву титрування 100 см3 0,1 н. розчину NaCl 0,1 н. розчином AgNO3. Виділити стрибок титрування.
- Розрахуйте, побудуйте криві титрування, використовуючи титр ант 0,1 н. розчин AgNO3 для наступних випадків (об’єм 50 см3): а) 0,1 н. KBr, б) 0,1 н. NaI, в) 0,01 н. CaCl2.
- Розрахуйте, побудуйте криву титрування 0,1 н. розчином Hg2(NO3)2 наступних речовин: 0,1 н. NaCl (100 см3), 0,1 н. KSCN (100 cм3), 0,1 н. KI (100 cм3). Виділити стрибки титрування.
- Розрахуйте, побудуйте криву титрування 100 см3 0,1 н. розчину H2SO4 0,1 н. розчином BaCl2. Визначте стрибок титрування.
- Побудуйте криву зміни потенціалів при осадженні Ag2CrО4 з 1 н. AgNO3 1 н. розчином K2Cr2О4, якщо ДР = 9,0 ∙ 10-12, а первісний об'єм розчину AgNO3 100 мл.
- Побудуйте криву титрування 100 мл 0,1 н. FeSO4 0,1 н. розчином К2Сr2О7.
Заняття 19. Комплексонометричне титрування.
План:
- Інструктаж з техніки безпеки
- Ознайомлення з навчальним матеріалом
- Виконання лабораторної роботи
- Розрахунки та оформлення роботи
- Захист роботи
навчальний матеріал
Комплексонометричне титрування засноване на утворенні комплексних сполук металіонів з неорганічними й органічними лігандами. Найбільше поширення одержали меркуриметричне й комплексонометричне титрування. У меркуриметричному титруванні титрантом є розчин Hg(NO3)2, що утворює із галогенідами міцні комплекси типу [HgHal4]. Стандартними речовинами є КС1, NaCl, а індикатором – дифенілкарбазон, що утворює із надлишком титранта комплекс [НgДфк] синього кольору. У комплексонометрії використовують спеціальні реагенти – комплексони – похідні α-амінополікарбонових кислот. Найчастіше в якості титранта застосовують комплексон III – динатрієву сіль етилендіамінтетраоцтової кислоти Na2H2Y – ЕДТА (торговельна назва – трилон Б), а як стандарт – MgSO4 ∙ 7Н2О, солі цинку або х.ч. СаСО3. Повнота протікання реакції комплексоутворення ЕДТА з іонами металів визначається значенням Кр = β > 108 або lg β > 8. На повноту протікання реакції комплексоутворення сильно впливають побічні реакції – протонування ліганду Y4- і комплексоутворювання металіону з іншими лігандами, що втримуються в розчині.
У комплексонометрії використовують декілька методів титрування: пряме й зворотне титрування, алкаліметричне титрування й титрування замісника.
- Пряме титрування використовується, коли відомий індикатор із чітким переходом забарвлення в кінцевій точці. Так, наприклад, катіони магнію, барію, стронцію, кальцію, цинку й ін. можуть бути визначені трилоном Б у присутності індикатора мурексиду. Із цією метою аналізований розчин розбавляють дистильованою водою до мітки, ретельно перемішують. Титрування проводять у лужному середовищі (рН = 10), використовуючи амоніачну буферну суміш.
- Зворотне титрування проводять у тому випадку, коли для визначуваного катіону металу невідомий індикатор із чітким переходом забарвлення в еквівалентній точці. У цьому випадку надлишок комплексону відтитровується розчином солі магнію, цинку або іншої солі.
До аналізованого розчину додають відомий об'єм (надлишок) стандартного розчину трилону Б, розчин нагрівають для завершення реакції й після охолодження відтитровують надлишок трилону Б розчином солі магнію. Еквівалентну точку визначають індикатором на іони магнію. Цим способом широко користуються при визначенні стронцію й галію, а також у тих випадках, коли внаслідок гідролізу обумовлений катіон не може бути затриманий у розчині при рН титрування.
Алкаліметричне титрування також можливо використовувати, тому що при взаємодії трилона Б з обумовленими катіонами виділяється еквівалентна кількість іонів водню:
Ме2+ + [H2Тr]2- → [МеТr]2- + 2Н+
Іони гідрогену, що виділилися, титрують розчином лугу в присутності фенолфталеїну.
Титрування замісника засноване на здатності іонів магнію утворювати із трилоном Б менш стійкий комплекс, чим інші катіони. Тому, якщо змішати магнієвий комплекс із катіонами обумовленого металу (наприклад кальцію), відбудеться зміщення рівноваги вправо:
Na2[MgTr] + Са2+ ↔ Na2[CaTr] + Mg2+
Іони Mg2+, що виділилися, відтитровують трилоном Б у присутності хромогену чорного.
Лабораторна робота № 12. Приготування робочого розчину трилону Б та установка його титру за Бісмутом. Визначення загальної твердості води.
Реактиви: ЕДТА (комплексон III); титрований розчин солі Бісмут(ІІІ); амоніачний буферний розчин (рН 9-10); кислотний хромовий темно-синій; мурексид; 2 н. H2SО4; 2 н. NH3; 1 н. NaOH.
Приготування розчину ЕДТА. Наважку для готування 250 см3 0,1 н. (0,05 М) розчину ЕДТА розраховують за формулою (2 зан.20), вважаючи, що еквівалентна маса дорівнює половині молярної маси (186,12 г/моль). Наважку зважують на аптечних вагах, пересипають у мірну колбу місткістю 250 см3, розчиняють у невеликому об'ємі води, потім доводять водою до мітки, добре перемішують і переливають у склянку.
Стандартизація розчину ЕДТА. У колбу для титрування поміщають 15,00 см3 титрованого розчину солі Бісмуту(ІІІ), додають 5 см3 амоніачного буферного розчину, 50 мл води, ~0,03 г індикатора кислотного хром темно-синього і титрують розчином ЕДТА до переходу червоного забарвлення в синьо-фіолетове. Розраховують нормальність і поправочний коефіцієнт розчину ЕДТА за формулами (5, 6 зан.20).
Визначення загальної твердості води.
Твердість води виражається числом міліграм-еквівалентів кальцію й магнію в 1 л води. Індикатором служить звичайно хромоген чорний. Аналізовану воду підлужують до рН = 10, додаючи амоніачну буферну суміш, і титрують розчином трилону Б:
Са2+ + HІnd2- → CaІnd- + H+
винно-червоний
Mg2+ + Hind2- → MgInd- + H+
винно-червоний
Кнест комплексів Са2+ і Mg2+ із трилоном Б набагато менші, ніж відповідні константи нестійкості для комплексів з індикаторами, тому останні руйнуються.
Поява синього забарвлення розчину вкаже на закінчення реакції. Загальну твердість води обчислюють по формулі:
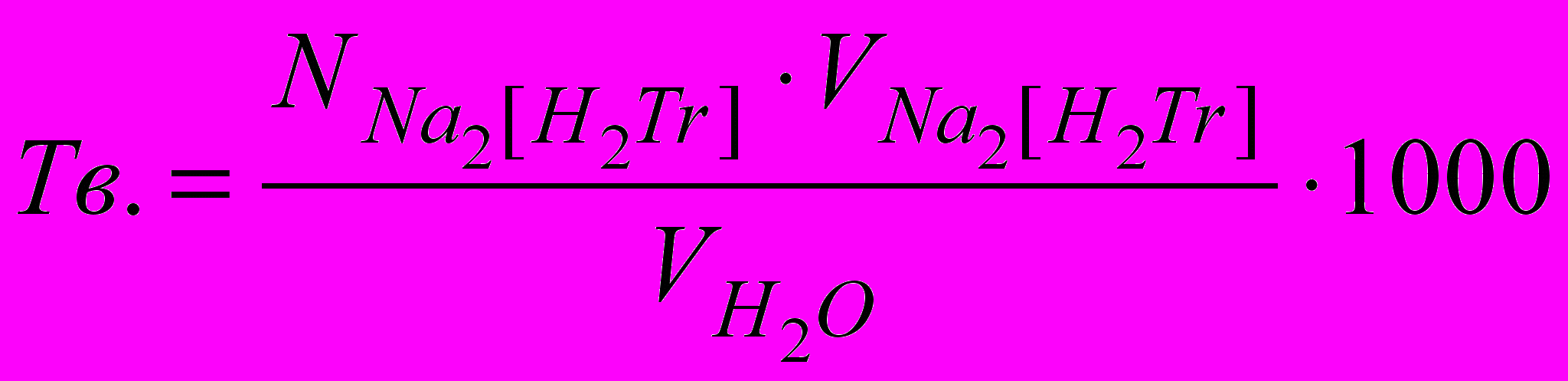 '
'де N(Na2[H2Tr]) – нормальність розчину трилона Б, V(Na2[H2Tr]) – об'єм робочого розчину трилону Б, витраченого на титрування (у мл), V(H2O) – об'єм аналізованої води, узятої для титрування (мл).
Хід аналізу.
Відбирають піпеткою 25,00 мл дослідної води, переносять у колбу для титрування місткістю 200-250 мл, додають 25,00 мл дистильованої води й потім 5 мл амоніачного буферного розчину. В отриману суміш вносять 0,03 г кислотного хром темно-синього й повільно, добре перемішуючи, титрують стандартизованим розчином ЕДТА до переходу червоного забарвлення розчину в синьо-фіолетову. Загальну твердість води (у мекв/л і в градусах) розраховують по формулі:
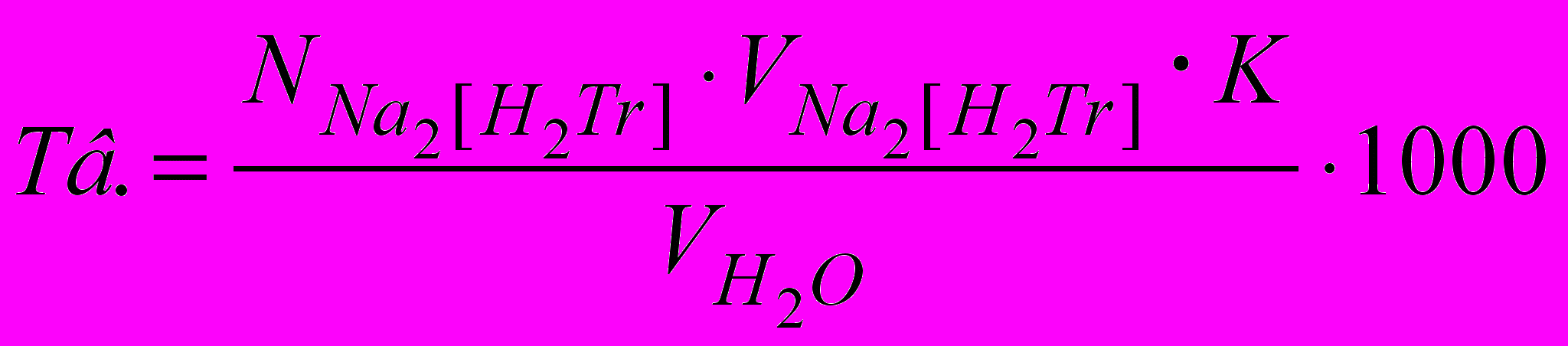
Висновки.
Заняття 20. Розв’язування задач з теми «Розрахунки в титриметрії».
План:
- Основні формули та стадії розв’язку задач.
2. Розв’язування задач цього типу.
1. Розрахунки в титриметричному аналізі
В титриметричному аналізі використовують розчини, концентрації яких виражені у вигляді молярності, нормальності, титру, титру за визначуваною речовиною, виправкового коефіцієнту. Результати аналізу представляють у вигляді вмісту речовини в грамах або у відсотках. Для виконання титриметрического аналізу необхідні розчини визначуваної речовини (А), титранту (В) і інші. Наважка а х.ч. речовини (у г) для готування певного об'єму V розчину із заданою нормальністю розраховують за формулою
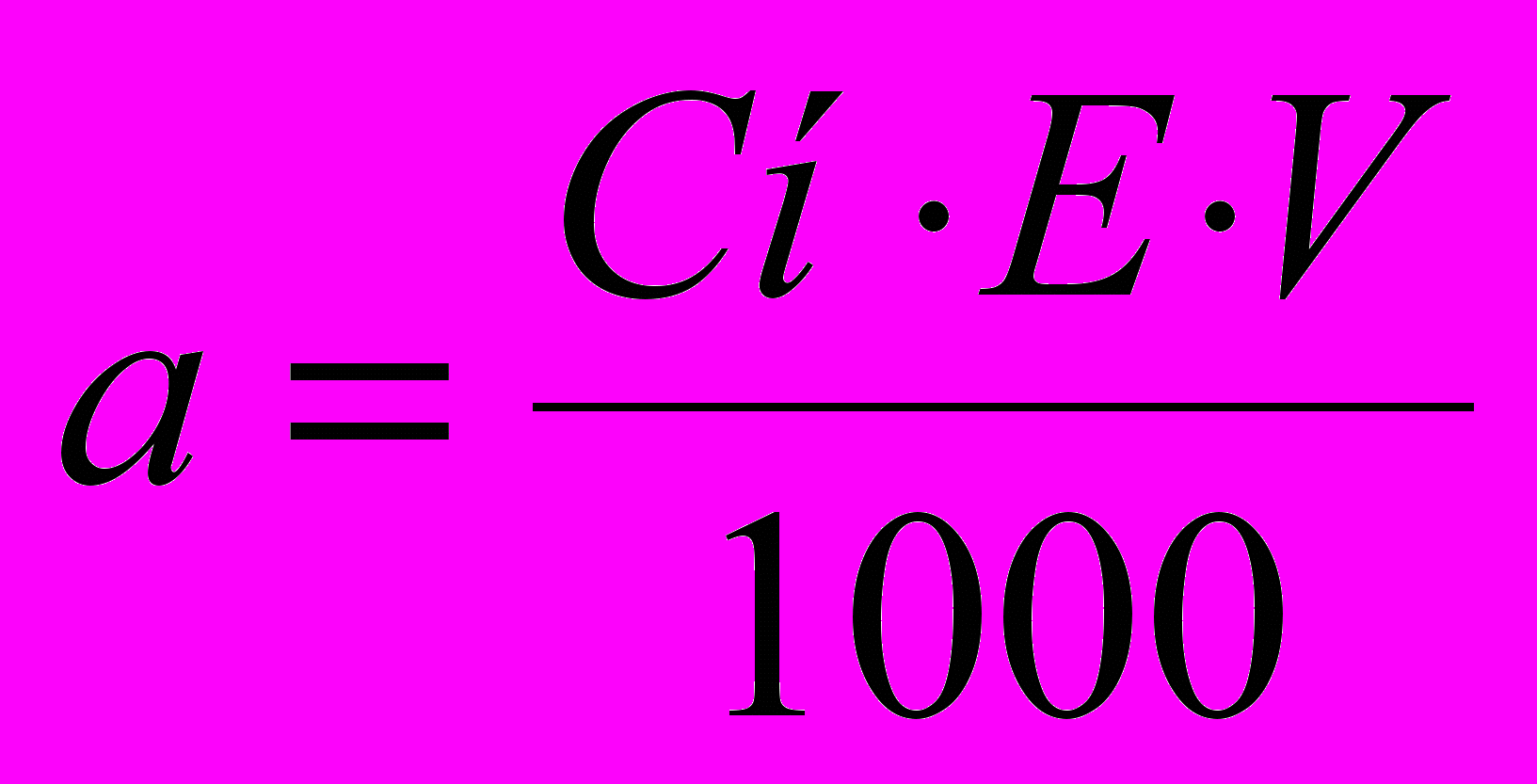 (2)
(2)Якщо речовина забруднена й містить приблизно ω% основного компоненту, то наважка розраховується за формулі
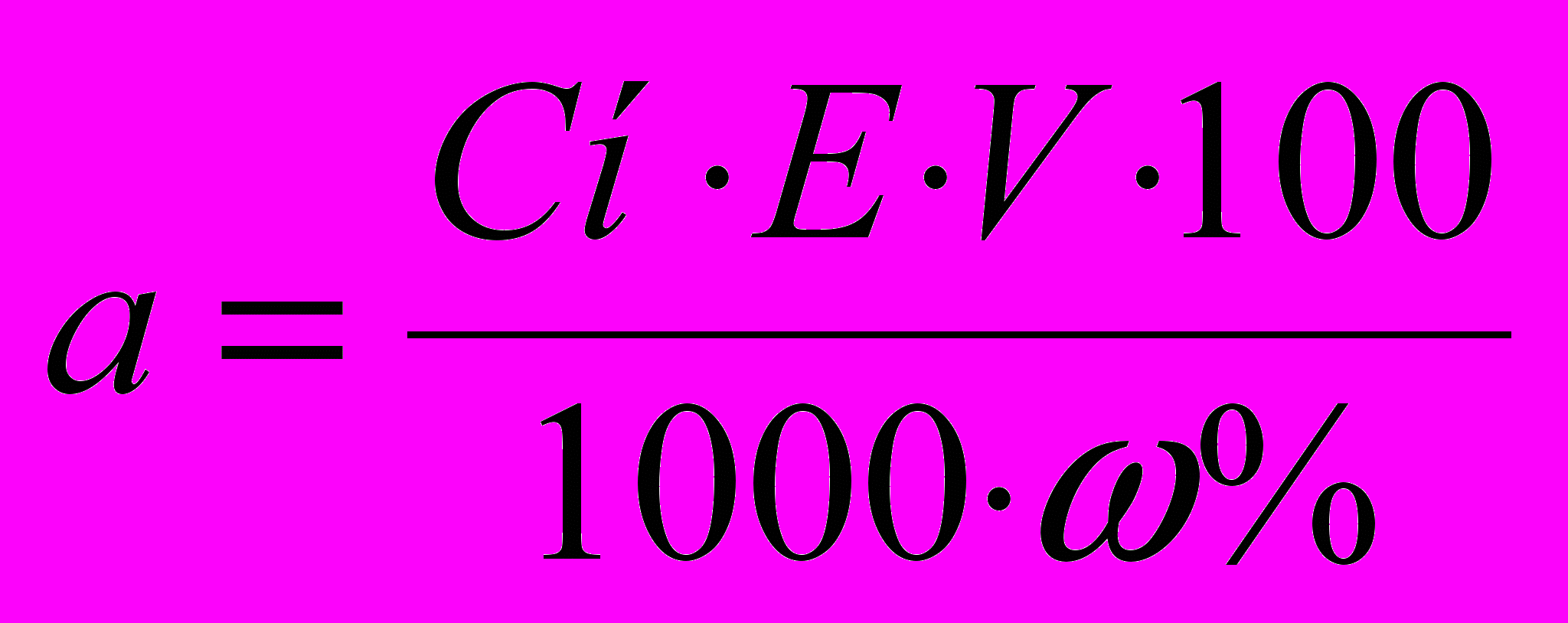 (3)
(3)При використанні ж рідких речовин з відомою щільністю (ρ) і приблизним процентним вмістом наважку (у мл ) V розраховують за формулою
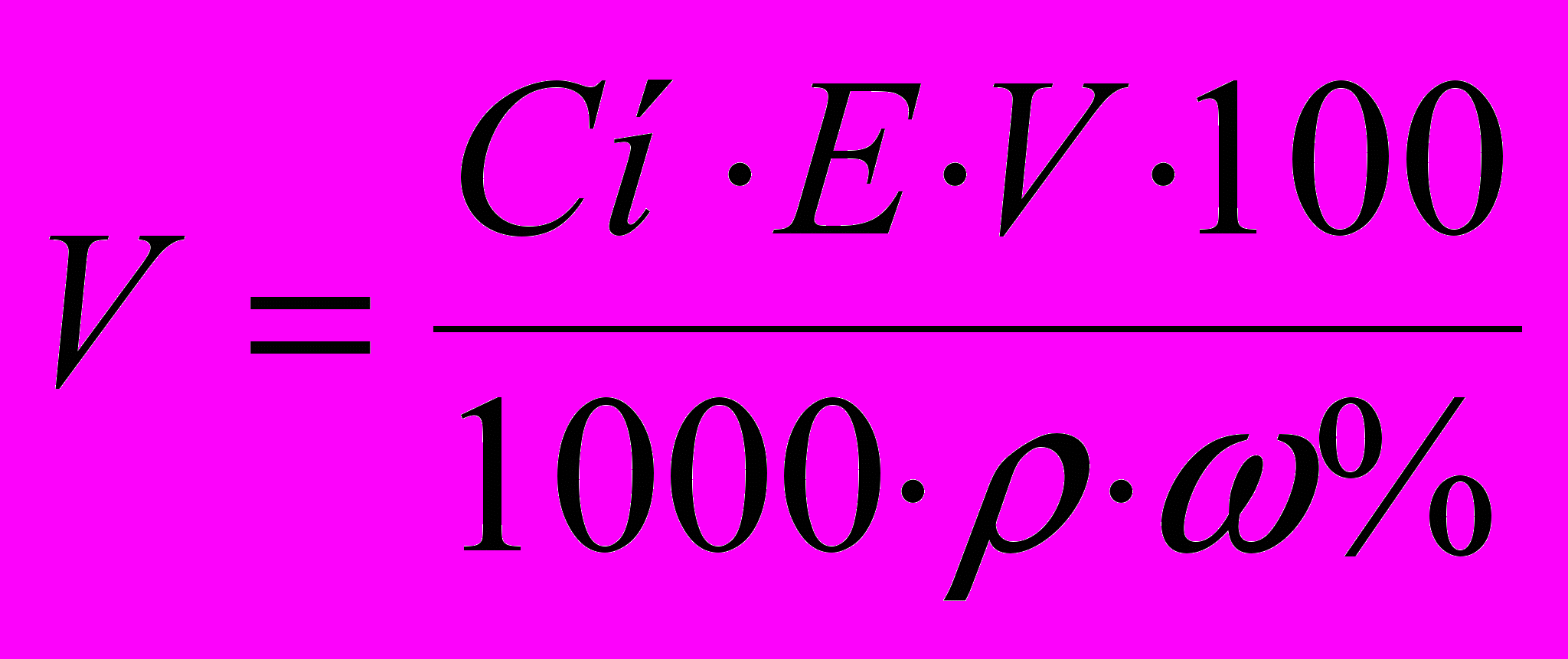 (4)
(4)У титриметрическом аналізі використовуються реакції, що протікають у стехіометричних відношеннях, до яких застосується закон еквівалентів, тому в точці еквівалентності
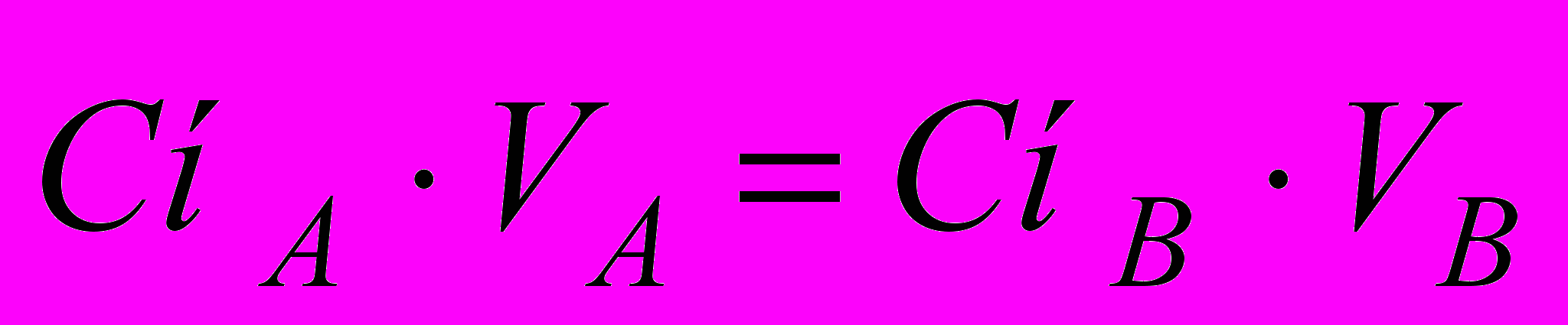 (5)
(5)За формулою (5) розраховують нормальність титранту, якщо відома нормальність титрованого розчину й навпаки, а також молярність (як величину, кратну нормальності). Знаючи істинну нормальність, розраховують виправковий коефіцієнт К до нормальності теоретичної:
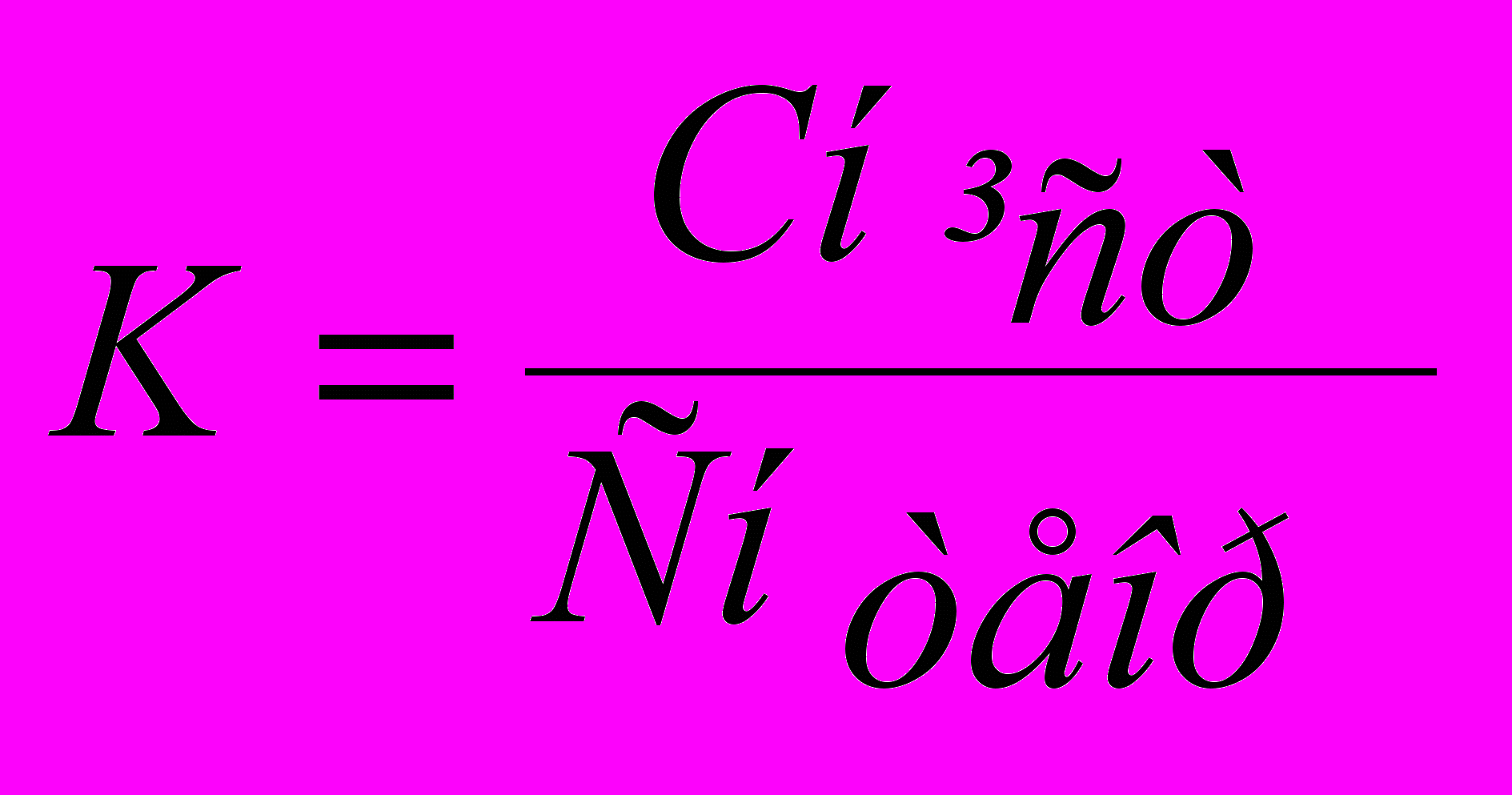 (6)
(6)Титр розчину Т – вміст речовини (у г) в 1 мл розчину розраховують за формулами:
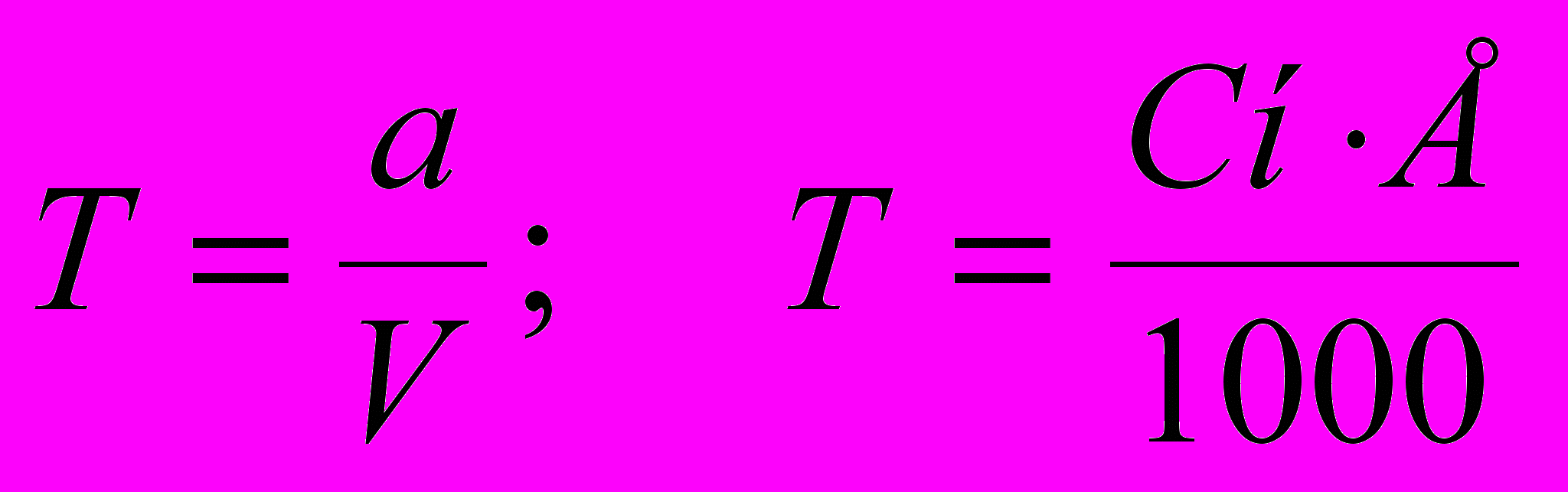 (7)
(7)Застосовуючи формули (7), можна розрахувати Сн розчину, якщо знати наважку речовини (у г) у певному об'ємі розчину:
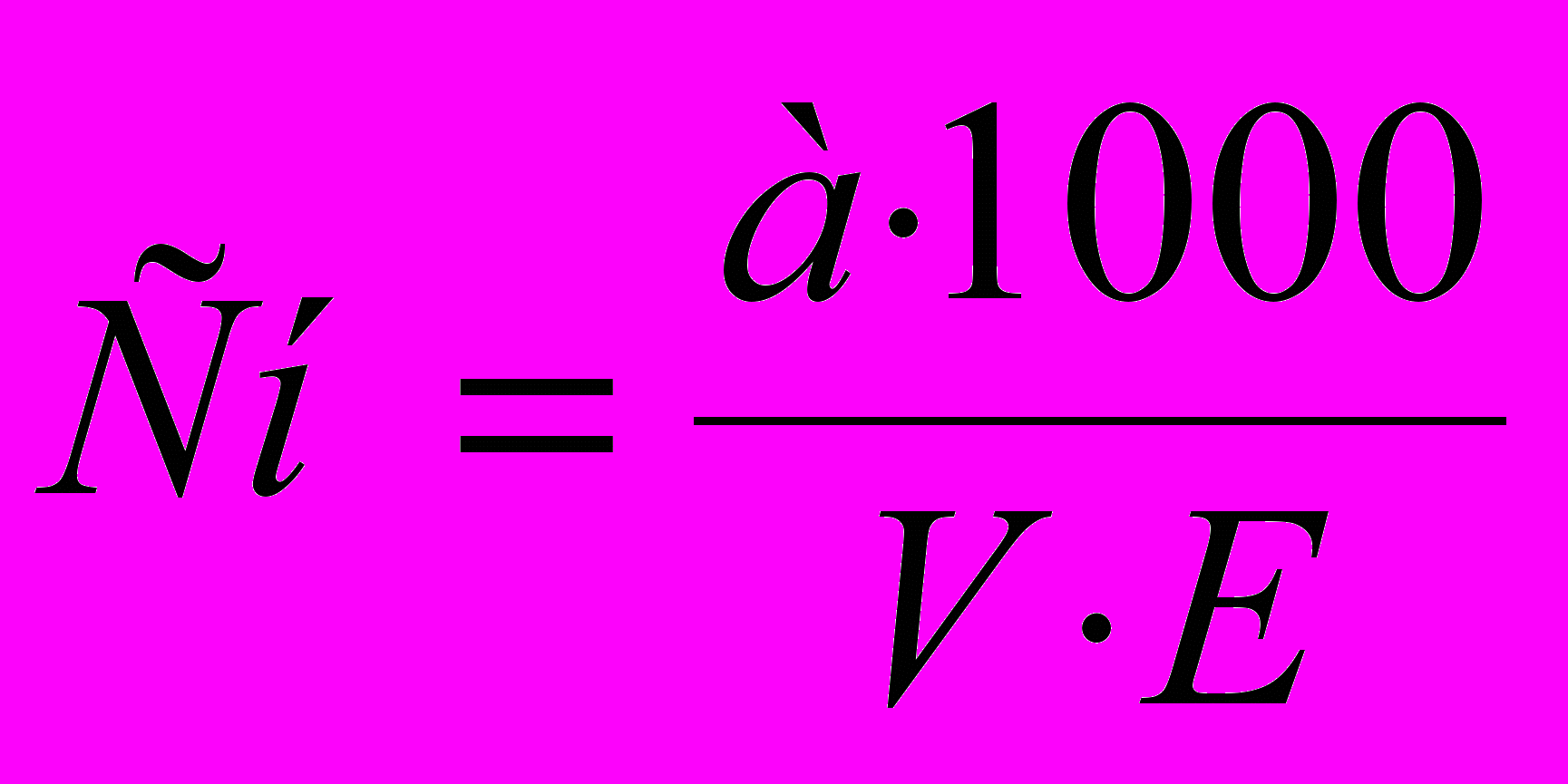 (8)
(8)Титр за визначуваною речовиною або титр відповідності – вміст визначуваної речовини А (у г), еквівалентне числу грамів в 1 см3 титранту В:
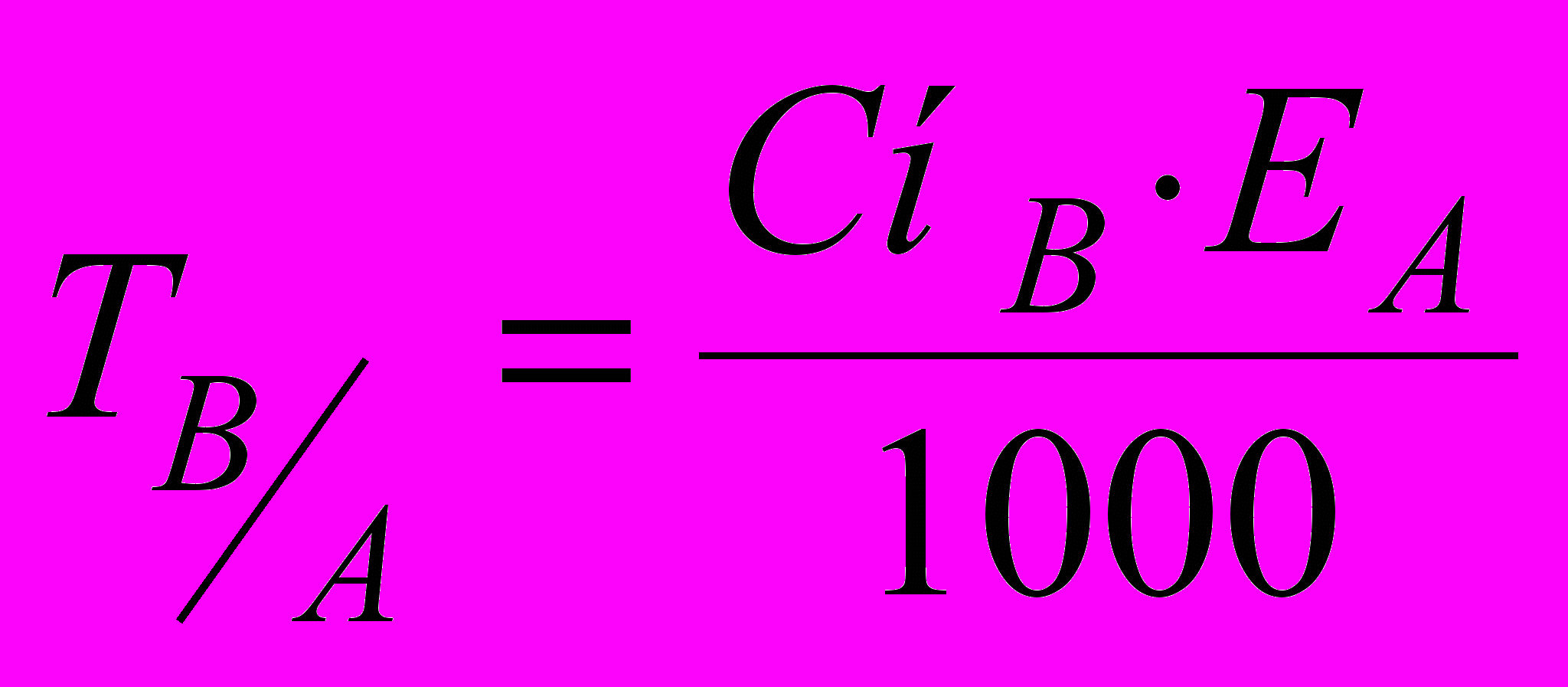 (9)
(9)При розрахунку концентрації визначуваної речовини або титранту в процесі титрування до або після точки еквівалентності (т.е.) використовують формулу
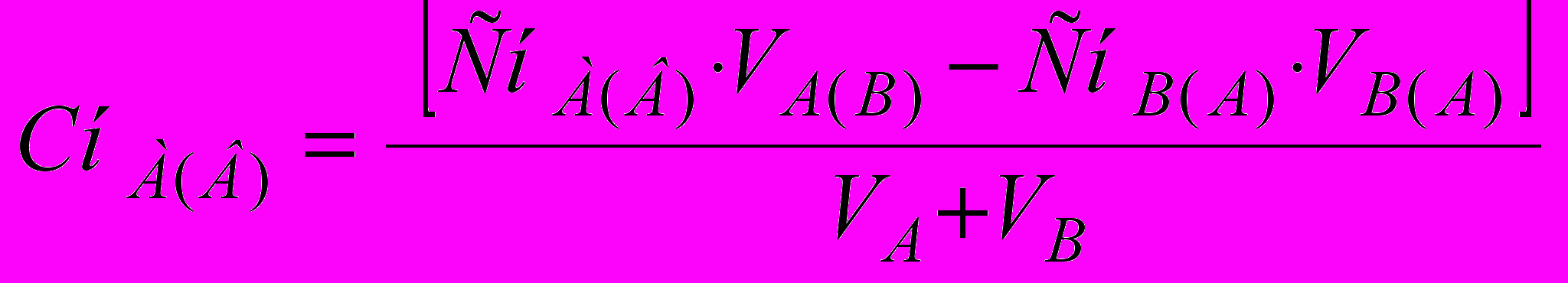 (10)
(10)До т.е. – у надлишку визначувана речовин а, після т.е. – титрант. Розрахунок вмісту речовин залежить від прийому титрування, способу визначення й концентрації титранту. Нижче наведені формули розрахунку вмісту визначуваної речовини (mA) у грамах (11-1,2) і у відсотках (11-3,4) прямим титруванням (або титруванням заступника) при використанні нормальної концентрації титранту способом окремих наважок (11-1,3) і способом піпетування (11-2,4):
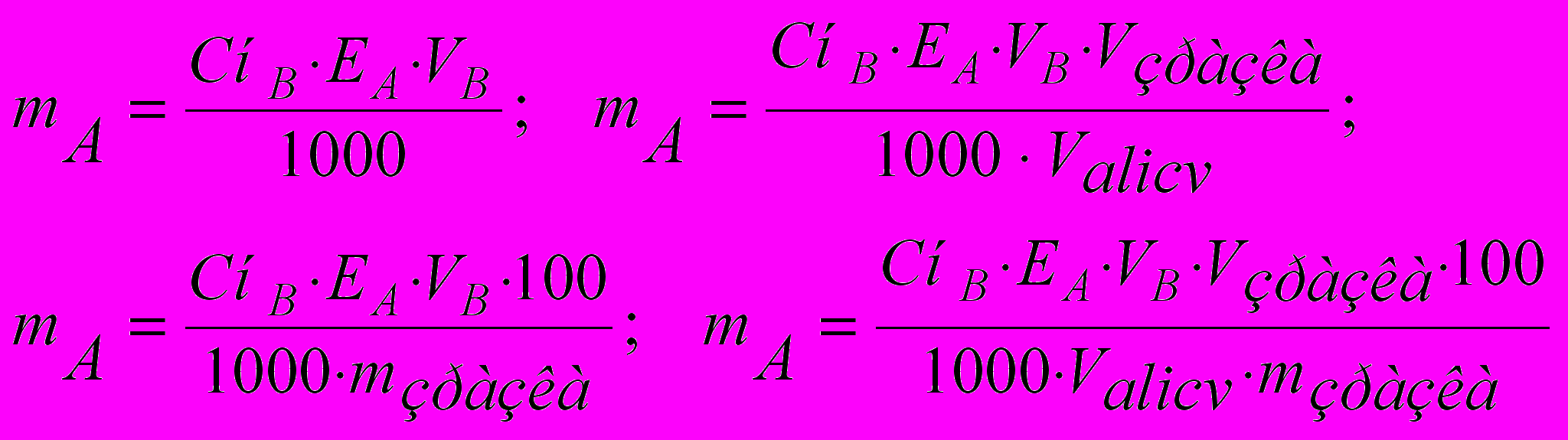 (11)
(11)де Vзразка – об'єм розчину визначуваної речовини; Valicv – аліквотний об'єм розчину визначуваної речовини, необхідний для одноразового титрування.
Як видно, при переході від формули для способу окремих наважок до формули для способу піпетування вводиться співмножник Vзразка/Valicv, а при розрахунку процентного вмісту – співмножник 100/mзразка. При застосуванні тих же прийомів і способів, але з урахуванням титру за визначуваній речовині формули розрахунку мають вигляд:
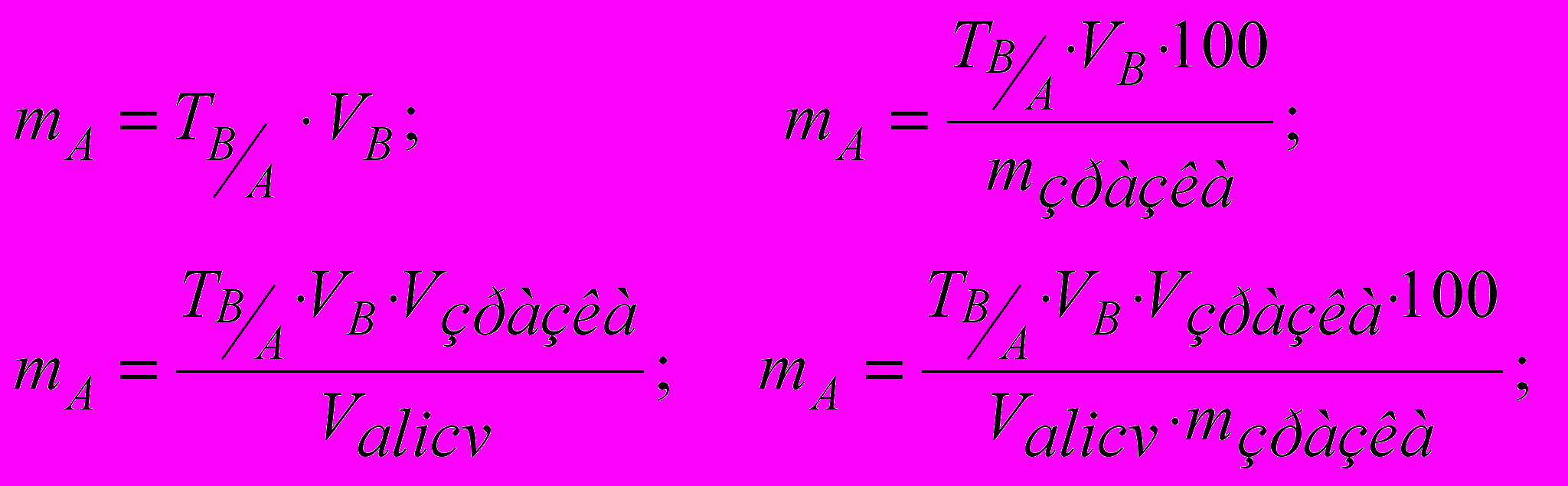 (12)
(12)Дуже часто розрахунок вмісту проводять за титрі за визначуваній речовині до певної теоретичної нормальності титранту. Тоді необхідно знати виправковий коефіцієнт титранту до відповідної теоретичної нормальності й розрахунок проводити по формулах:
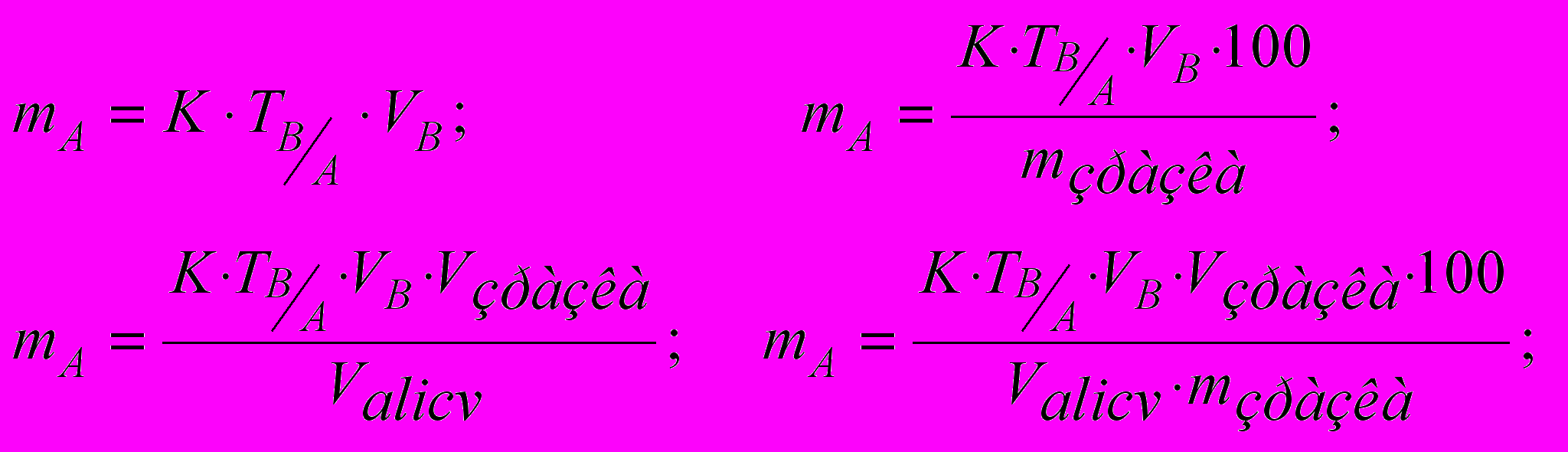 (13)
(13)При зворотному титруванні застосовують два титранту, нормальності й об'єми яких N', N'' і V', V” відповідно. Формула розрахунку вмісту в грамах способом окремих навішень
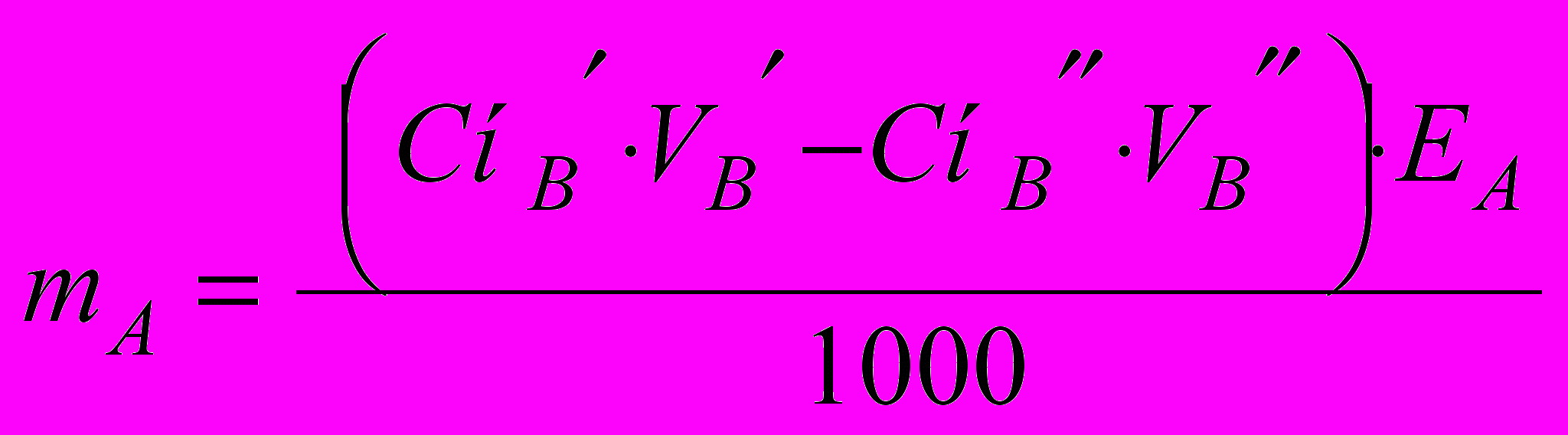 (14)
(14)При розрахунку процентного вмісту використають множник 100/mзразка, а при способі піпетування – множник Vзразка/Valicv.
Приклад 1. На титрування 21,50 см3 розчину H2SO4 витрачено 20,00 см3 0,1 н. NaOH. Розрахуйте титр і нормальність розчину H2SO4.
Рішення. Оскільки відомі об'єми аналізованого розчину, титранту, а також концентрація титранту, то розрахунок концентрації H2SO4 проводимо з використанням формули (5):
Сн(кислоти) = 20,00 ∙ 0,1/21,50 = 0,09302
За формулою (7-2) розраховуємо титр розчину H2SO4, з огляду на еквівалентну масу H2SO4 (49,04 г/моль):
ТА = 0,09302 ∙ 49,04/1000 = 0,004562 г/см3
Приклад 2. При стандартизації розчину НСl на титрування 0,09535 г натрій тетраборату (Е = 190,7) витрачено 25,00 см3 цього розчину. Розрахуйте титр і нормальність НСl.
Рішення. Як видно, стандартизація проводиться способом окремих наважок. Використовуючи формули (11-1, 7-2), розраховуємо нормальність і титр:
СнНС1 = 0,09535 • 1000/(25 • 190,7) = 0,020;
ТHCl = 0,02 • 36,46/1000 = = 0,0007292 г/см3.
Приклад 3. Наважку сплаву заліза 1,5722 г розчинено в мірній колбі місткістю 200 см3. На титрування 20,00 см3 цього розчину витрачено 21,50 см3 розчину КМnО4 з титром за Fe TКMnO4 /Fe = 0,00298 г/см3. Розрахуйте вміст заліза в сплаві (в%).
Рішення. Тому що відомо титр розчину КМnО4 за Fe й визначення проводиться способом піпетування, то розрахунок проводимо за формулою (12-4):
mА = 0,00298 • 21,50 ∙ 200 • 100/(20,00 • 1,5722) = 40,75%.
Приклад 4. Розрахуйте виправковий коефіцієнт приблизно 0,1 н. AgNO3, якщо на титрування 0,09850 г NaCl витрачено 16,50 см3 цього розчину.
Рішення. Еквівалентна маса NaCl дорівнює молярній масі (58,44 г/моль). Нормальність розчину AgNO3 розраховуємо, використовуючи формулу (11-1):
СнAgNO3 = mNaCll000/(VAgNO3ENaCl) = 0,0985 • 1000/(16,50∙58,44) = 0,1022.
Виправковий коефіцієнт (див. формулу 6) дорівнює: К = 0,1022/0,1 = 1,022.
2. Задачі для розв’язку
1. Знайти концентрацію розчину NaCl за наступними даними: а) на титрування 23,65 мл його витрачено 25,63 мл розчину AgNO3; б) на титрування 15,88 мл AgNO3 витрачено 25,63 мл розчину НCl; в) на титрування 29,22 мл НCl витрачено 27,58 мл розчину КОН; г) на титрування 18,13 мл КОН витрачено 19,21 мл розчину Н2С2О3; д) на титрування 34,56 мл Н2С2О3 витрачено 32,47 мл 0,1000 н. розчину КMnO4. Відповідь: 0,1079 М.
2. Якою повинна бути наважка безводної соди, щоб на титрування витратилося 20-25 мл 0,5 н. розчину кислоти при титруванні з метиловим оранжевим. Відповідь: 0,53-0,0,66 г.
3. Розрахуйте виправкові коефіцієнти для 0,1 н. розчину HCI, якщо на титрування 0,0532 г Na2CO3 витрачено 10,30 см3 розчину НС1. Відповідь: 0,9745 до 0,1 н.
4. Розрахуйте наважку сталі, що містить біля 10% Ніколу, щоб при комплексонометричному визначенні його, після відокремлення за допомогою реактиву Чугаєва, витратилося не більше 20 мл 0,05 М розчину комплексону ІІІ. Відповідь: 0,5871 г.
5. Наважка вапняку 1,000 г після розчинення та видалення полуторних оксидів доведена до 200 мл. В 100 мл цього розчину було осаджено Кальцій у вигляді оксалату, після розчинення якого на окиснення витрачено 37,4 мл 0,1512 н. розчину перманганату. Розрахуйте вміст кальцій карбонату (у %) у вапняку. Відповідь: 56,55%.
6. На титрування 20 мл гідроген сульфідної води витрачено 43,66 мл розчину йоду з Т=0,005816. Яка концентрація гідроген сульфіду у воді? Відповідь: 0,100 н.
7. До осаду K2Na[Co(NO2)6], одержаного з наважки, рівної 0,2452 г, додано 25 мл 0,1025 н. розчину перманганату; після нагрівання додано в надлишку 25 мл 0,1000 н. розчин Н2С2О3. Надлишок оксалатної кислоти від титрований 15,5 мл перманганату. Розрахуйте вміси Калію у %. Відповідь: 4,79%.
8. Визначте вміст (%) натрій карбонату, якщо наважка зразка дорівнює 0,2458 г. Після розчинення її до розчину додано 20 мл 0,0450 М розчину магній сульфат, надлишок останнього від титрований 15 мл розчину комплексону ІІІ. 1,0 мл солі еквівалентний 1,25 мл комплексону. Відповідь: 15,52%.
Заняття 21. Колоквіум № 3.
