Пояснювальна записка
| Вид материала | Документы |
- Реферат курсовий проект: пояснювальна записка сторінок, таблиць, 10.59kb.
- Програми для загальноосвітніх навчальних закладів з українською мовою навчання, 889.57kb.
- Пояснювальна записка, 584.46kb.
- Пояснювальна записка, 1142.65kb.
- Дипломна робота пояснювальна записка, 1244.36kb.
- Пояснювальна записка, 743.42kb.
- Фізична культура пояснювальна записка, 296.81kb.
- Програма зовнішнього незалежного оцінювання з в сесвітньої історії пояснювальна записка, 478.76kb.
- Програма для загальноосвітніх навчальних закладів 7 9 класи пояснювальна записка, 286.52kb.
- Автори програми: д ф. м н., професор чалий о. В., к ф. м н., доцент цехмістер я. В.,, 149.19kb.
План:
Інструктаж з техніки безпеки
- Ознайомлення з навчальним матеріалом
- Виконання лабораторної роботи
- Розрахунки та оформлення роботи
- Захист роботи
навчальний матеріал
Гравіметричний аналіз заснований на точному вимірюванні маси визначуваної речовини, одержаного в хімічно чистому стані, або речовини, в яку переводиться визначувана речовина з точно відомим постійним складом. У гравіметричному аналізі використають як хімічні реакції, так і фізичні процеси – відгонку, висушування й ін., а тому розрізняють методи відокремлення, відгонки, осадження. Найбільш часто використовують методи осадження, під час яких визначувана речовина переводиться в осад при взаємодії з реактивом, осад висушують, прожарюють і зважують. Для аналізу методами осадження придатні реакції з утворенням осадів поганорозчинних електролітів із ДР < 10-8 (склад 1:1), ДР < 10-12 (склад 1:2), ДР < 10-20 (склад 2:3) і т.д. При виконанні гравіметричного аналізу проводять ряд аналітичних операцій: відбір середньої проби, розрахунок і зважування наважки, переведення наважки в розчин, осадження (одержання осадженої форми визначуваної речовини), фільтрування, промивання, висушування, прожарювання з метою одержання гравіметричної форми й зважування її. Для проведення аналізу в оптимальних умовах попередньо виконують розрахунок наважок (у г, см3) аналізованої речовини й осаджувача, числа промивань осаду, роблять вибір осаджувача й промивної рідини. Гравіметричний аналіз можна виконати способами окремих наважок і піпетування. У першому випадку наважку, необхідну для одиничного визначення, розчиняють у певному об'ємі розчинника й проводять осадження. У другому - наважку розчиняють у мірній колбі, а для аналізу відбирають аліквотну частину.
Відбір проби. Попередньо відбирають генеральну пробу, що зменшують до розмірів лабораторної, наприклад, квартуванням до одержання близько 25 г проби. Із цього однорідного матеріалу беруть наважку для аналізу.
Розрахунок наважки визначуваної й аналізованої речовини. Для розрахунку наважки необхідно знати зразковий вміст визначуваної речовини в досліджуваній пробі, а також форму одержуваного осаду (кристалічну або аморфну) і очікувану масу гравіметричної форми визначуваної речовини. Для кристалічних осадів очікувана маса гравіметричної форми повинна бути приблизно 0,5 г, для аморфних— 0,1 г.
Розчинення наважки. Наважки переводять у розчин залежно від здатності речовини розчинятися у воді, кислотах, лугах, органічних розчинниках і т.д., а також на холоду або при нагріванні.
Розрахунок наважки осаджувача. Розрахунок проводять із врахуванням наважки визначуваної речовини, агрегатного стану осаджувача (В) і рівняння реакції їхньої взаємодії.
Осадження поганорозчинних електролітів. Поганорозчинні електроліти залежно від природи можуть утворювати як кристалічні (крупно- або дрібнокристалічні), так і аморфні (пухкі, щільні) осади. Найбільш зручні для цілей аналізу крупнокристалічні й щільні аморфні опади, тому що вони краще фільтруються, промиваються й менше співосаджують домішки. Процес осадження проводять, дотримуючись умови одержання чистих великих кристалів або щільних аморфних осадів. Кристалічні осади одержують із розведених (0,1 н.) гарячих (70-80 °С) розчинів аналізованих речовин і осаджувачів. Розчин осаджувача додають повільно по краплинах при безперервному перемішуванні. Крім осаджувача іноді використовують допоміжні речовини, що також сприяють утворенню крупних кристалів. Для укрупнення частинок осаду проводять так зване «дозрівання»: осад разом з розчином над ним витримують певний час на водяній бані або в сушильній шафі при 60-70°С та періодичному перемішуванні. Після дозрівання проводять фільтрування й промивання осаду.
Аморфні осади одержують із концентрованих (~0,5 – 1 н.) гарячих (70-80 °С) розчинів. Осаджувач додають швидко, а за ним, для зменшення співосадження домішок осадом, певний об'єм гарячої дистильованої води. Після цього негайно фільтрують і промивають осад.
Вибір осаджувача. Вибір проводять за значенням розчинності, утворенням зручної для аналізу форми осаду й його летючості при прожарюванні. Так, для осадження гідроксидів використовують не NaOH, а розчин NH3, а для осадження Ва2+-іонів – сульфатну кислоту, а не фосфатну й т.д.
В
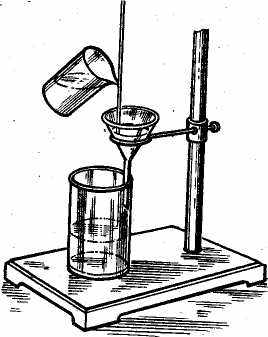
Рис.1 Фільтрування через воронку з паперовим фільтром
ибір промивної рідини. В якості промивної рідини найчастіше використовують дистильовану воду з додаванням різних речовин, що знижують розчинність осаду або перешкоджають його пептизації (наприклад, NH4NO3, HC1 і т.д.) і летких при прожарюванні. Іноді використовують теплу дистильовану воду без добавок.
Фільтрування й промивання осадів. Для фільтрування застосовують беззольні фільтри, які майже не мають залишку після спалювання. Звичайно їхня маса настільки мала, що нею можна знехтувати. Беззольні фільтри готовлять із фільтрувального паперу промиванням НС1 і HF для видалення мінеральних речовин. Для фільтрування аморфних осадів застосовують менш щільні фільтри (пачка фільтрів оперезана червоною паперовою стрічкою); для крупнокристалічних осадів – більше щільні (фільтри з білою стрічкою); дрібнозернистих осадів (BaSО4, СаСгО4) – щільні фільтри із синьою стрічкою. Розмір фільтра вибирають таким, щоб осад займав не більше половини об'єму згорнутого фільтра, а сам фільтр був нижче краю лійки на 0,5 – 1 см. Воронку з фільтром поміщають у кільце штатива, підставивши під неї чисту склянку так, щоб скошений кінець трубки торкався стінки склянки (мал. 1). Рідину на фільтр зливають по скляній паличці, що застосовувалася раніше для перемішування в процесі осадження.
Паличку виймають зі склянки й тримають у вертикальному положенні над лійкою. Нижній кінець палички повинен близько підходити до щільної частини фільтра, не торкаючись його. У праву руку беруть склянку з рідиною й, торкаючись носиком склянки до палички, обережно зливають рідину на фільтр, наповнюючи 2/3 його об’єму. Паличку щоразу опускають у склянку й чекають, поки вся рідина не відфільтрується, і знову наливають рідину на фільтр. Після перенесення на фільтр всієї рідини над осадом проводять промивання осаду декантацією. Для цього до осаду доливають невеликий об'єм промивної рідини, перемішують, дають осаду осісти й зливають рідину по паличці на фільтр. Так повторюють 4-5 разів. Після декантації осад кількісно переносять на фільтр. Осад каламутять з 5-10 см3 промивної рідини й відразу по паличці переносять на фільтр. Так повторюють кілька разів. Частинки осаду, що пристали до стінок склянки, змивають струменем промивної рідини із промивалки, а потім протирають всю внутрішню поверхню склянки маленькими шматочками беззольного фільтра за допомогою скляної палички з гумовим наконечником. Шматочки паперу поміщають на фільтр. Склянку й паличку обполіскують промивною рідиною, зливаючи її в воронку з осадом. Потім проводять промивання осаду на фільтрі до повного видалення домішок.
Висушування, озолення й прожарювання осаду. Осад після промивання висушують при 100° С у сушильній шафі, накривши воронку з осадом аркушем паперу, що проколюють у декількох місцях скляною паличкою з гострим кінцем. Після висушування фільтр виймають із лійки, загортають, як показано на мал. 2, поміщають у тигель із установленою масою й проводять озолення. Тигель із осадом поміщають у порцеляновий трикутник над пальником, полум'я якої зменшують так, щоб папір фільтра не горів, а жеврів. Після озолення осад прожарюють у муфельній печі при певній температурі (звичайно 700— 1000° С) до постійної маси.
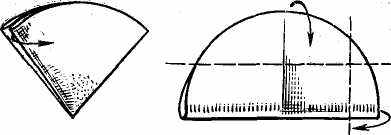
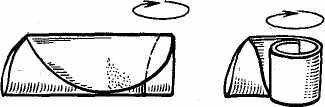
Рис. 2 Завертання фільтру з осадом

Рис. 3 Робота з ексикатором
Розрахунок вмісту визначуваної речовини. Прожарений осад охолоджують в ексикаторі (рис. 3) і зважують.
Лабораторна робота 9. Визначення кристалізаційної води в барій хлориді.
У висушеному й зваженому на аналітичних вагах бюксі відважують 1,5 г кристалічного барій хлориду на технохімічних вагах, уточнюють на аналітичних вагах і поміщають в сушильну шафу, ставлячи кришку бюкса на ребро. Висушування проводять при 120° протягом 1,5-2 годин, потім бюкс переносять в ексикатор і після охолодження (через 30 хв.) зважують, закривши його кришкою. Висушування наважки барій хлориду повторюють протягом 1 год. при тій же температурі, після чого бюкс знову охолоджують і зважують. Висушування вважають закінченим, якщо результати другого зважування відрізняються не більше, ніж на 0,0005 г (0,01-0,05%). Якщо результати зважування різко відрізняються, висушування повторюють. Вміст кристалізаційної води (в %) розраховують за формулою:
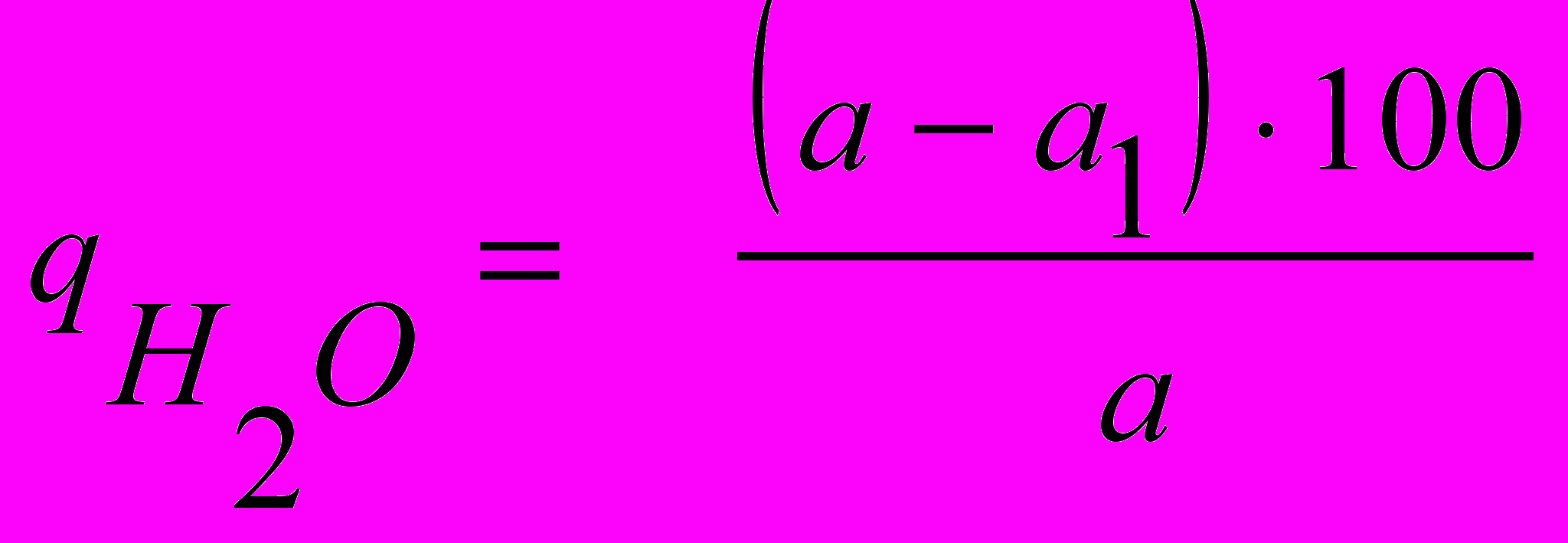 ,
,де а – наважка до висушування, г; а1 - наважка після висушування, г.
Висновок.
Заняття 12-13. Розв’язування задач з теми «Гравіметрія».
План:
1. Основні формули та стадії розв’язку задач.
2. Розв’язування задач цього типу.
1. Наважку сухого визначуваної речовини аА за умови, що вона х.ч. (хімічно чиста), для одиничного визначення розраховують за формулою (у г)
аА = 0,5∙F;
аА = 0,1∙F,
де 0,5 – очікувана маса гравіметричної форми у випадку кристалічних, а 0,1 – аморфних осадів; F – аналітичний (гравіметричний) фактор або множник є відношенням добутків молярних мас визначуваної речовини і її гравіметричної форми на стехіометричні коефіцієнти:
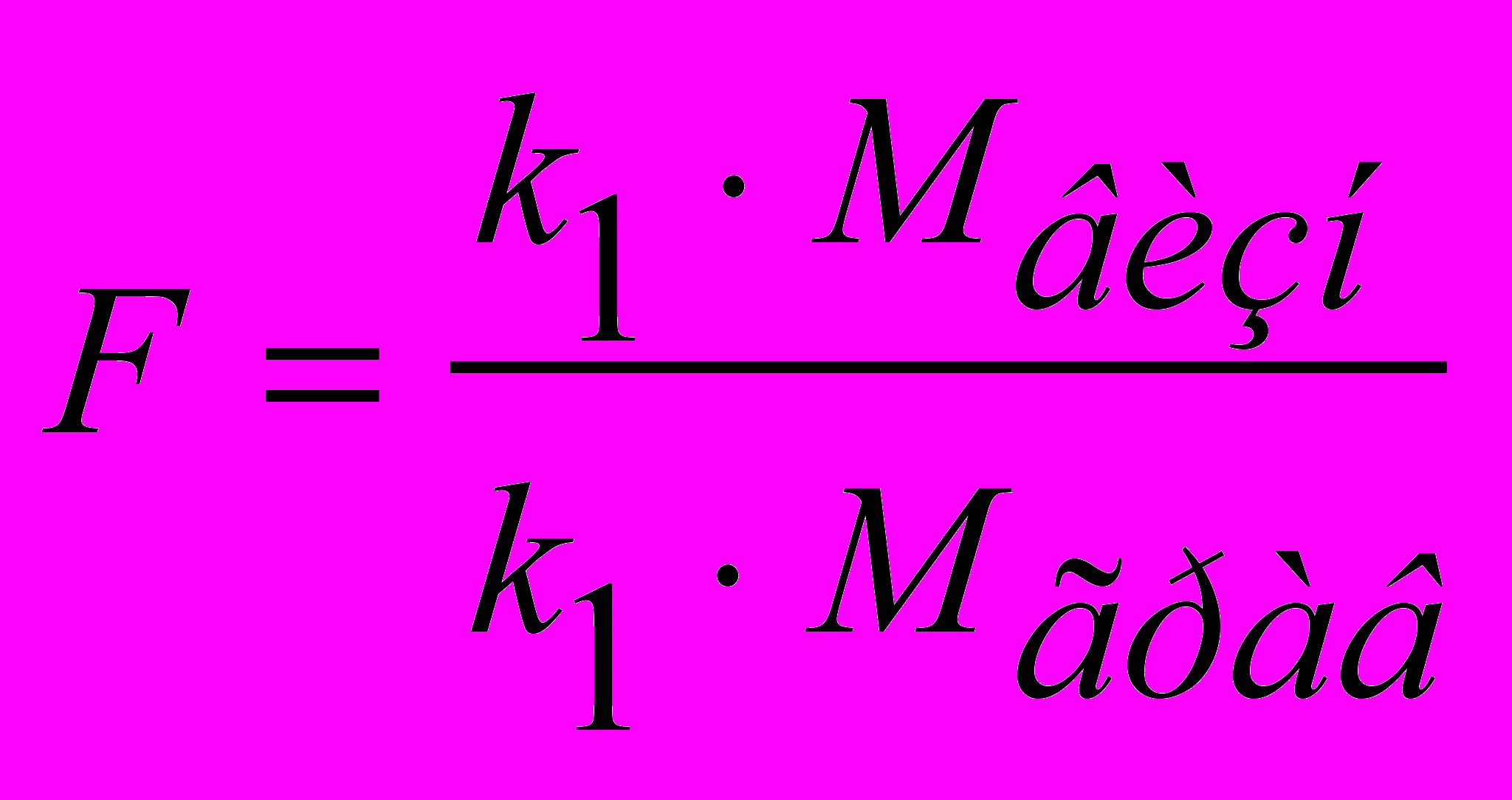 , (1)
, (1)Значення F або обчислюють, або беруть із довідкових таблиць. Якщо аналізована речовина крім визначуваної містить ще які-небудь інші, то наважку аналізованої речовини розраховують за формулою:
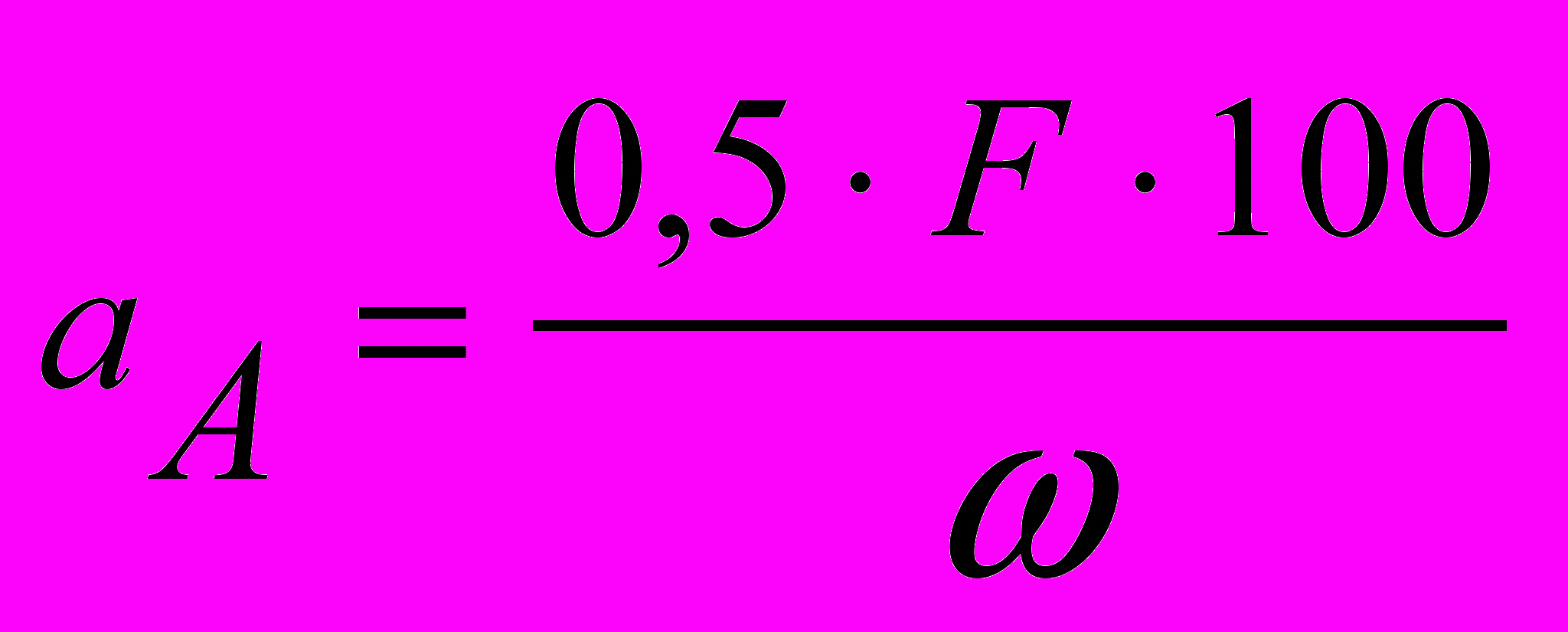 (для кристалічних осадів),
(для кристалічних осадів),та
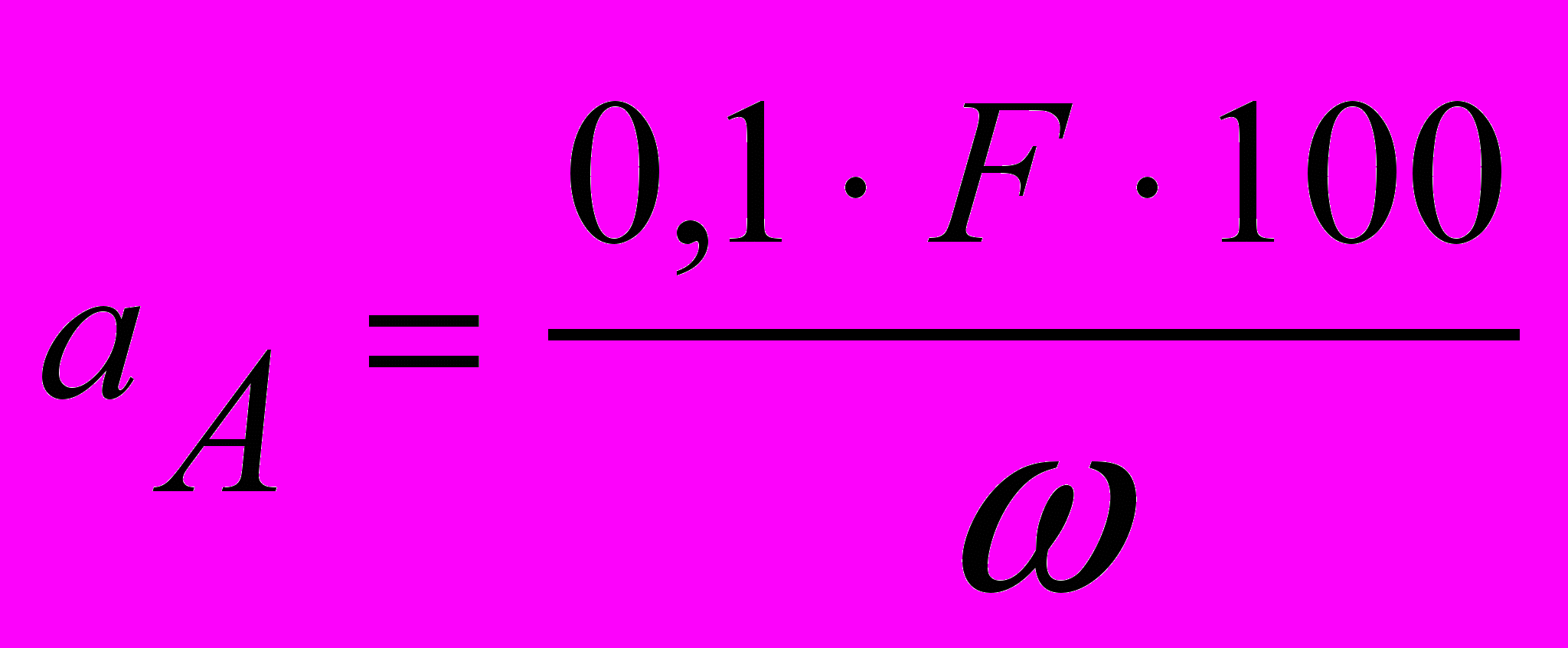 (для аморфних осадів), (2)
(для аморфних осадів), (2)де С – приблизний вміст визначуваної речовини в аналізованій, %.
Якщо аналізована речовина – рідина, тоді розрахунок її необхідного об'єму (у см3) проводять за формулою
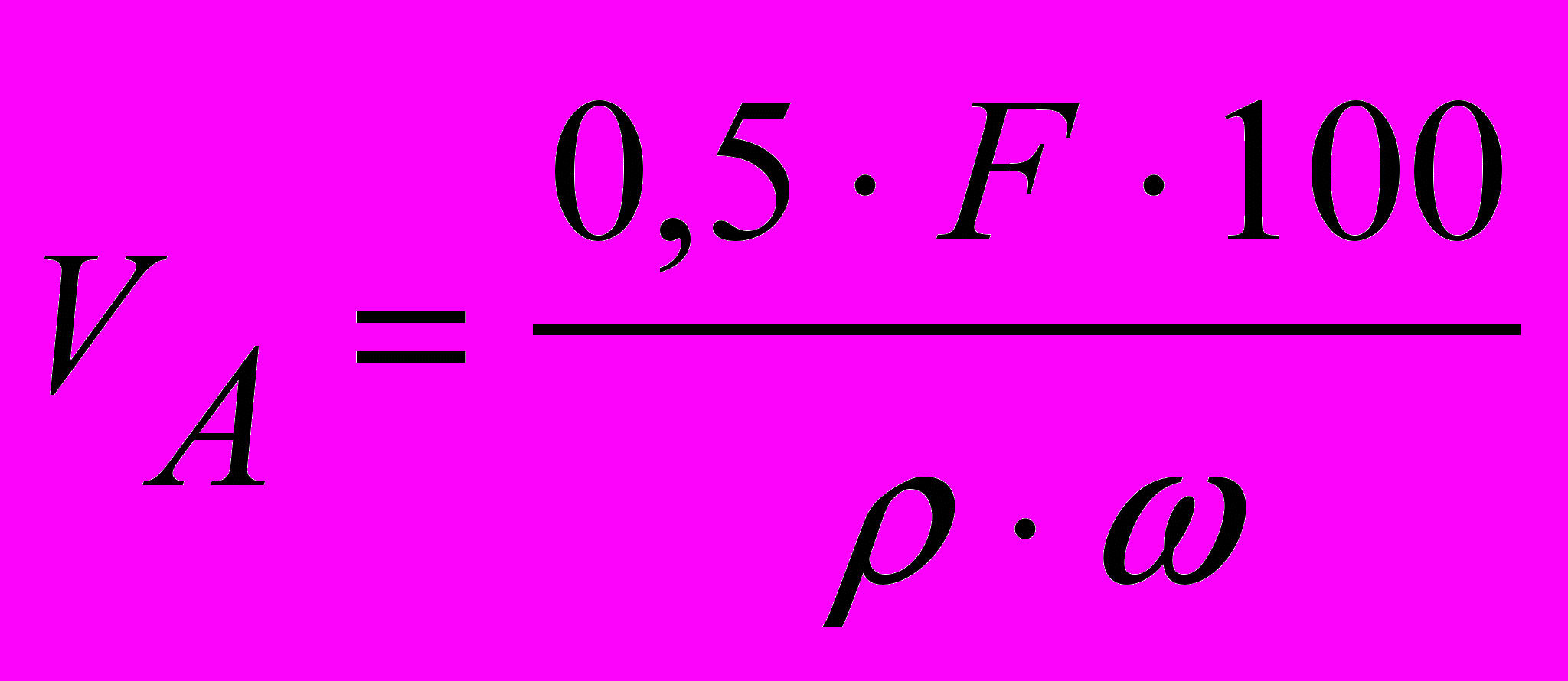 (для кристалічних осадів),
(для кристалічних осадів),та (3)
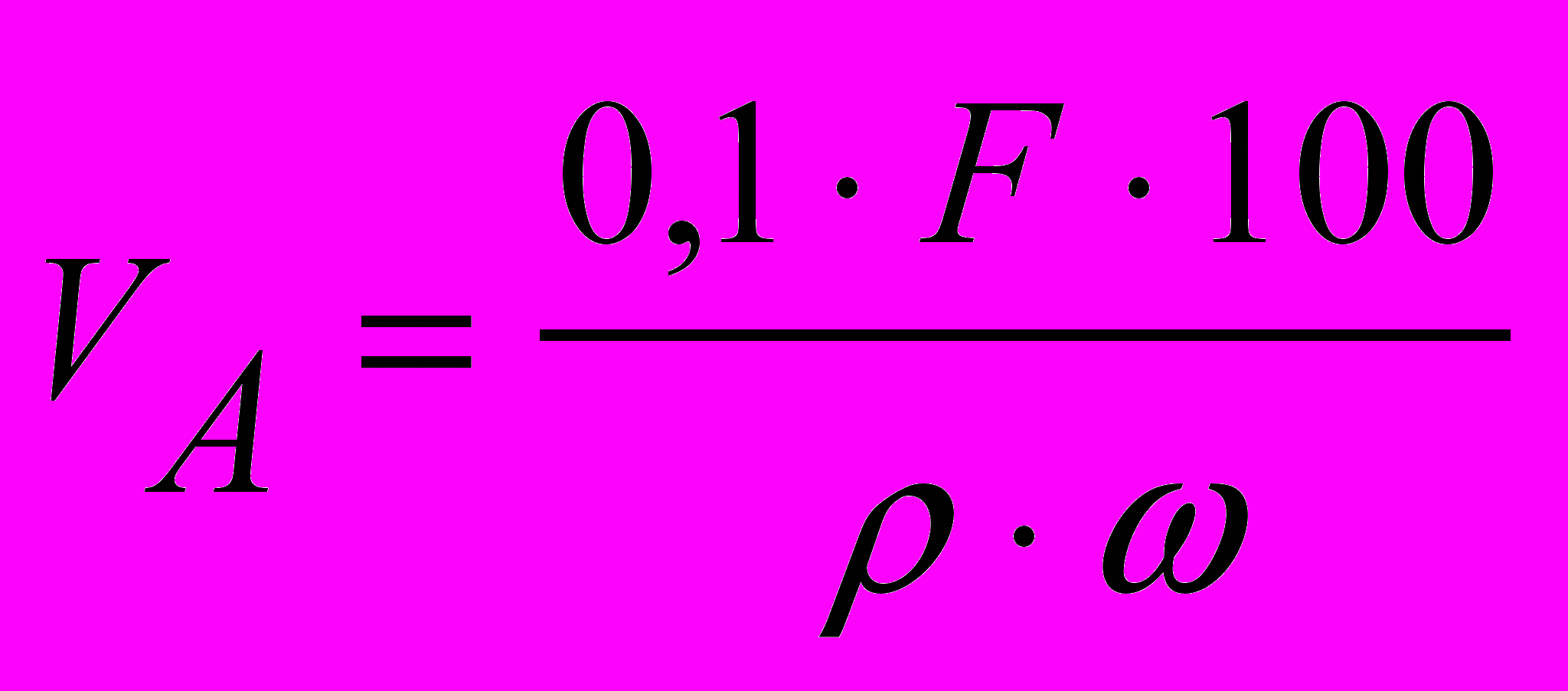 (для аморфних осадів),
(для аморфних осадів),де ρ – густина; С – приблизний вміст визначуваної речовини в аналізованому, %.
Наважку сухого осаджувача аВ розраховують (у г) за формулою:
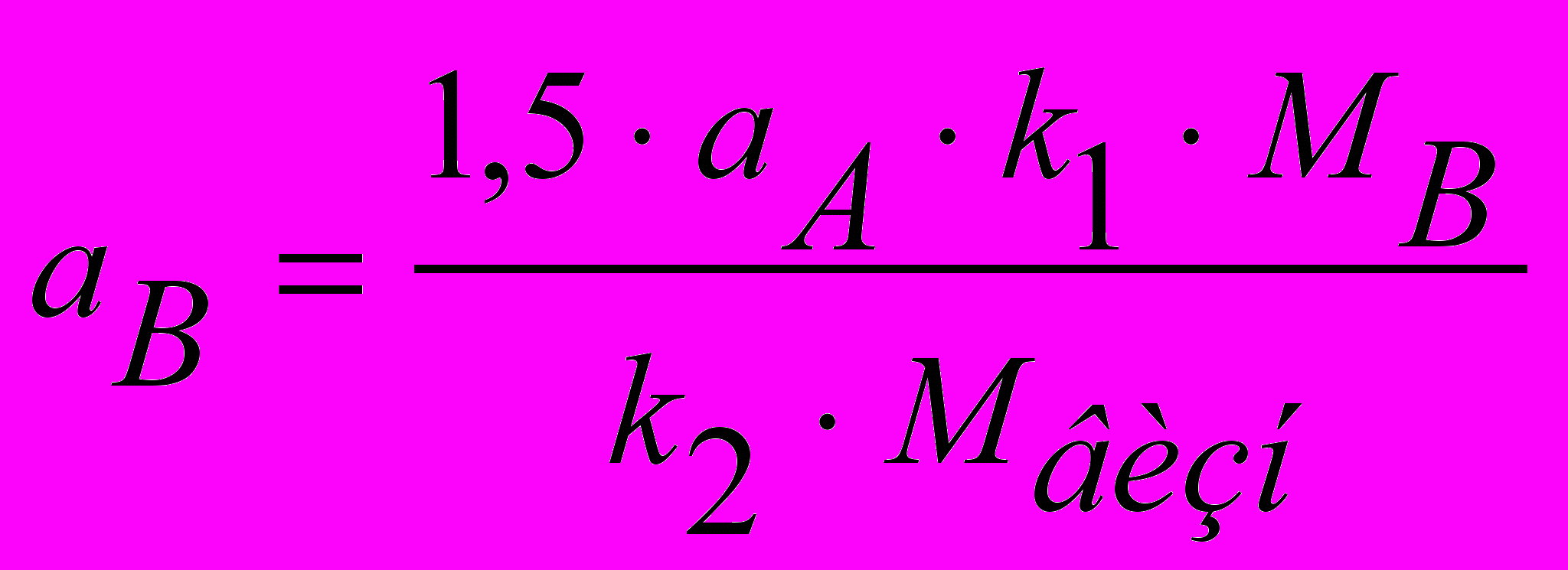 , (4)
, (4)де 1,5 - коефіцієнт, що визначає надлишок осаджувача.
Якщо осаджувач – рідина, тоді об'єм її (у см3) розраховують за формулою:
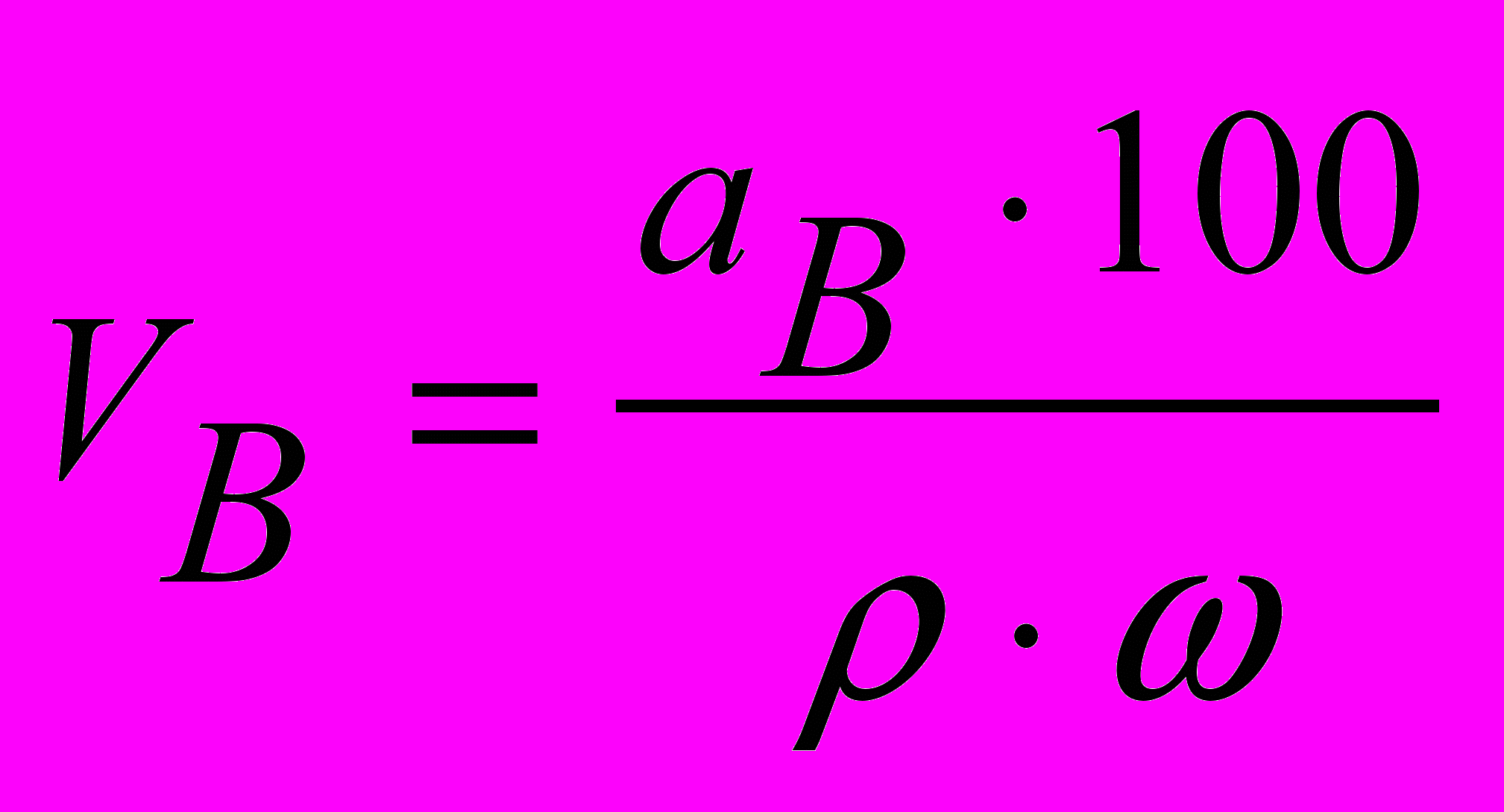 , (5)
, (5)де ω – концентрація осаджувача, %.
Розрахунок концентрації домішок, числа промивань і затрачуваний об'єм промивної рідини (V0) проводять за формулами:
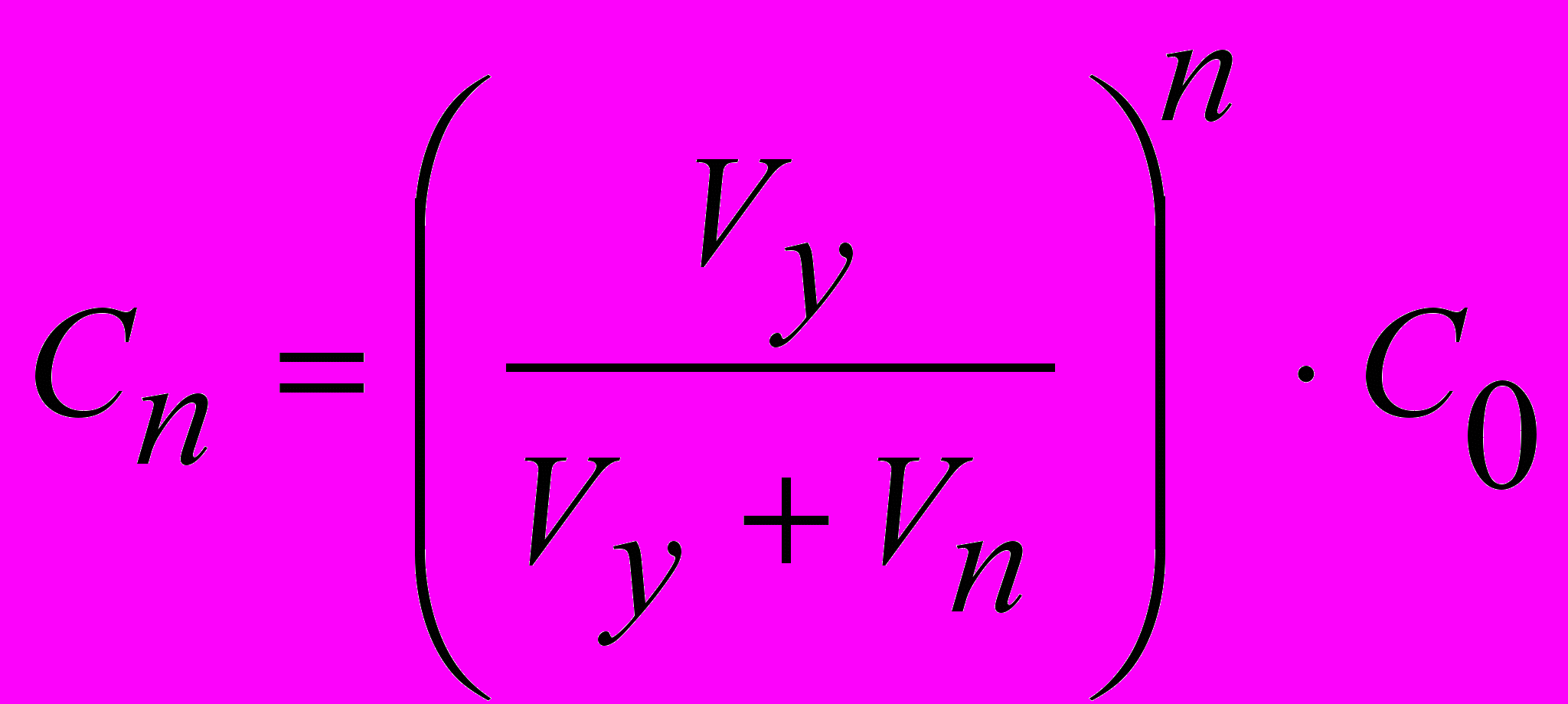 , (6)
, (6)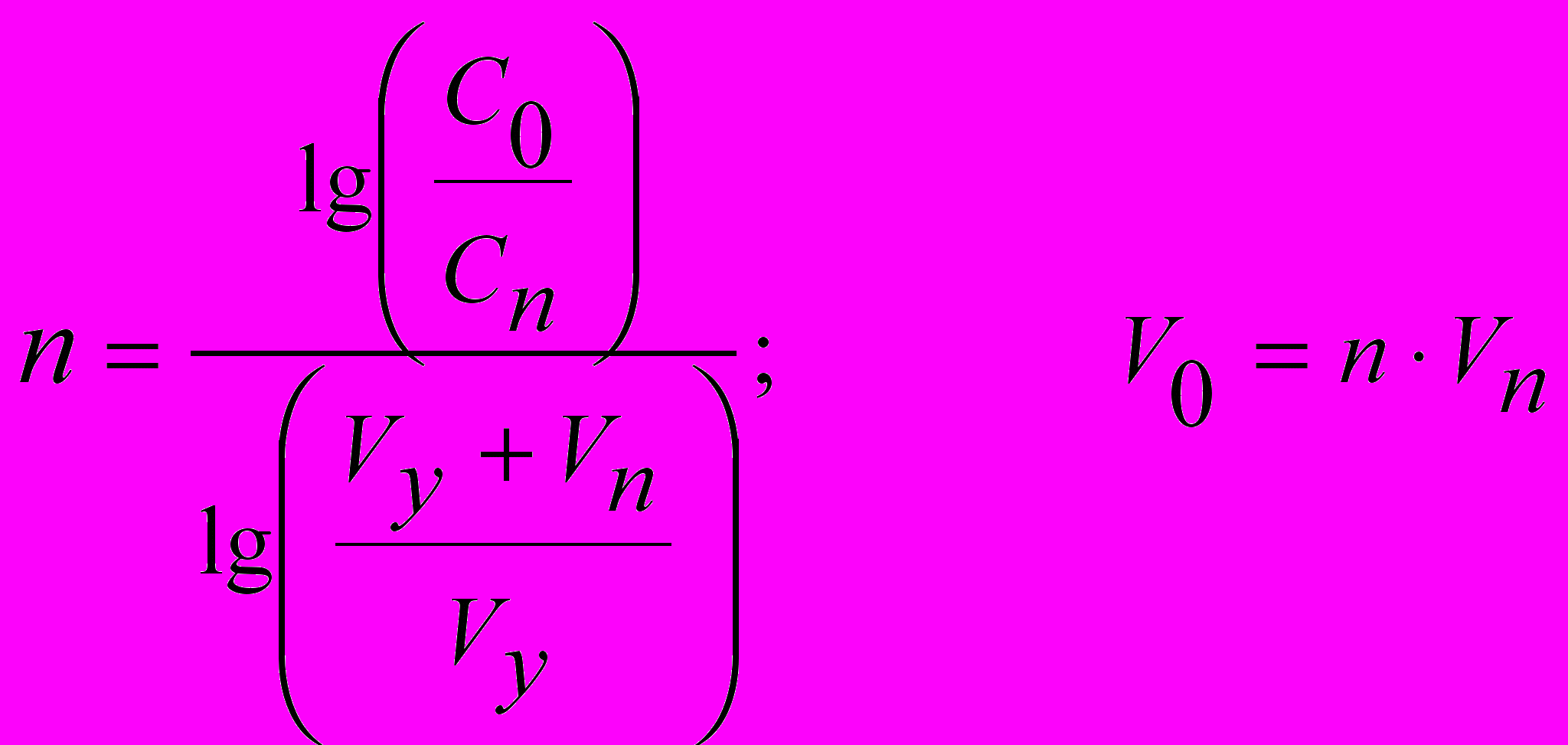 , (7)
, (7)де C0, Cn – концентрація домішок до й після промивання; Vy – об'єм рідини, що втримується осадом; Vn – об'єм однієї порції промивної рідини; n – число промивань.
Вміст визначуваної речовини (у г чи %) розраховують за формулами:
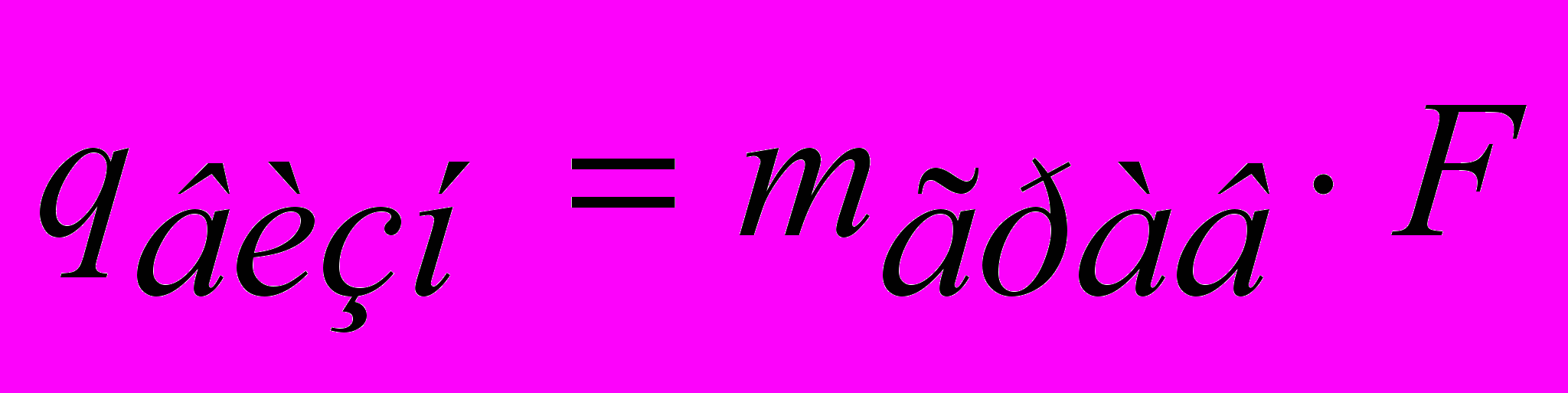 , (8)
, (8)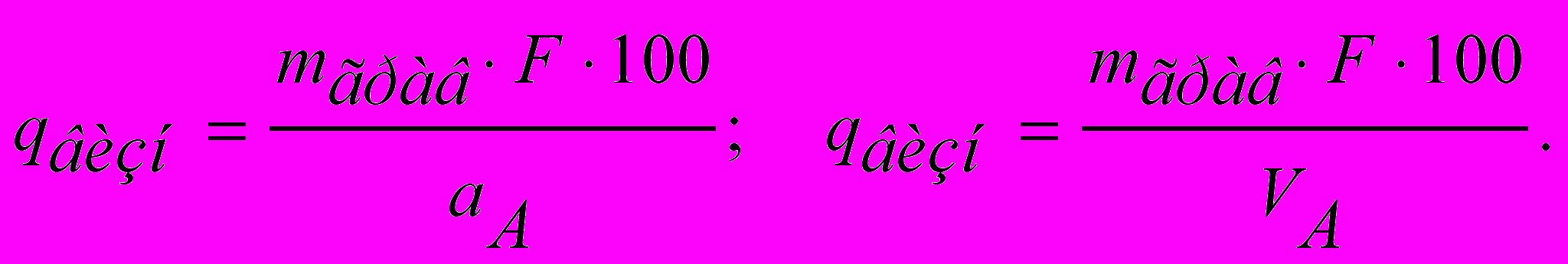 (9)
(9)2.
Задачі для розв’язку
1. Розрахуйте гравіметричні фактори при визначенні компоненту В2О3 у вигляді гравіметричної форми – К[BF4]. Відповідь: 0,2765.
2. Які наважки суперфосфату треба взяти для визначення Кальцію з наступними зважуваннями у вигляді кальцій сульфату і Фосфору у вигляді магній й амоній фосфату з прожарюванням до пірофосфату?
3. Чи можна гравіметрично визначити Силіцій у сталі? (його вміст у сталях не перевищує 0,1%). Відповідь: ні.
4. Розрахуйте мінімальну наважку барій хлориду, що містить 10% Ва, для визначення Барію у вигляді BaSO4. Відповідь: 0,59 г.
5. Яку наважку сплаву, що містить біля 65% Плюмбуму, треба взяти для визначення в ньому Плюмбуму у вигляді PbSO4? Відповідь: 0,105 г.
6. Скільки 8,4%-вого розчину сульфатної кислоти треба взяти для осадження Барію з 0,4859 г дигідрату барій хлориду? Відповідь: 2,3 мл.
7. Зважено барій сульфат, а визначають Барій. Розрахуйте аналітичний множник. Відповідь: 0,5884.
8. Двократне визначення тетрабутилгідроперекису у присутності тетрабутилпербензолу в шести пробах дало наступні результати:
9,45 16,3 53,4 31,35 8,00 5,12
9,20 16,8 53,95 30,62 7,63 5,42
Розрахуйте середню квадратичну помилку аналізу декількох проб з різним вмістом визначуваного компоненту. Відповідь: 0,33.
9. При визначенні константи рівноваги реакції комплексоутворення Цирконій(IV) з піридилазонафтолом у кислому середовищі одержані наступні значення: 2,09; 2,02; 2,09; 2,13; 2,21; 2,31. Розрахуйте довірчий інтервал середнього значення параметру хімічної реакції (для Р=0,95). Відповідь: lgK=2,14±0,11.
10. Який об’єм 10,56%-вого розчину сульфатної кислоти треба додати до 200 мл розчину солі Барій, щоб в ньому могло залишитися не більше 0,00001 г барій сульфату? Відповідь: 0,09 мл.
11. Розрахуйте відсотковий вміст Магнію в доломіті, якщо наважка його 0,5000 г. В результаті аналізі одержано 0,2856 г магній дифосфату. Відповідь: 43,26%.
12. Розрахуйте відсотковий вміст Мангану у сплаві, якщо для аналізу було взято наважку 10,1800 г. Після розчинення сплаву розчин доведено до мітки 250 мл. Манган визначено з 50 мл цього розчину та в результаті одержано 0,1628 г манган дифосфату. Відповідь: 3,09%.
13. Розрахуйте відсотковий вміст Алюмінію в технічному алюміній сульфаті Al2(SO4)3·18H2O, якщо наважка його 1,0925 г. В результаті аналізу одержано 0,1289 г алюміній оксиду. Відповідь: 6,24%.
14. Розрахуйте наважку речовини, що містить Ферум, щоб маса одержаного ферум оксиду, помножена на 50, чисельно дорівнювала відсотку Феруму у вихідній речовині. Відповідь: 1,3988 г.
15. При аналізі магній карбонату було визначено 17,39% Магнію та 39,13% кристалізаційної води. Скільки % Магнію в абсолютно сухому зразку? Відповідь: 28,57%.
16. Скільки разів необхідно промити водою порціями по 10 мл осад барій сульфату, одержаного з 0,025 М розчину барій хлориду осадженням 100%-вим надлишком сульфатної кислоти, щоб концентрація домішок, що залишаються в осаді, не перевищувала 7,5·10-5М? (об’єм води, що залишився в осаді, нехай дорівнює 1 мл). Відповідь: 5.
17. Скільки грамів плюмбум сульфату буде втрачено при промиванні 200 мл: а) води; б) 0,001 М розчину сульфатної кислоти?
18. Який вміст Феруму в руді, якщо з наважки 0,7020 г одержано 0,4344 г Fe2O3?
19. Втрата Кальцію за рахунок розчинності при гравіметричному визначенні у вигляді кальцій оксалату 1,2 мг. Чому дорівнює відносна похибка визначення Кальцію у вапняку із вмістом 51,5% СаО, якщо маса проби, що взята для аналізу, становила 0,5500 г? Відповідь: 0,59%.
Заняття 14. Колоквіум № 2.
План:
1. Інструктаж з виконання роботи.
2. Виконання завдань колоквіуму.
3. Оцінювання роботи.
Питання теоретичної частини завдань
Поняття хімічного аналітичного сигналу, його вимірювання.
- Похибки хімічного аналізу, види похибок, їх причини.
- Особливості відбору проб газоподібних, рідких та твердих зразків. Методи усереднення проб.
- Підготовка проби до аналізу.
- Способи підвищення чутливості реакцій.
- Гравіметричний метод, його основи.
- Поняття фактору перерахунку.
Питання практичної частини
Задачі з теми «Гравіметрія» приблизно наступного змісту.
1. Розрахуйте наважку солі. FeCl3, що містить близько 30% Fe, необхідну для аналізу на вміст Феруму методом осадження за допомогою розчину амоніаку. Відповідь: 0,233 г.
2. Яку наважку сплаву, що містить близько 70% Плюмбуму, треба взяти для визначення в ній Плюмбуму у вигляді PbSO4? Відповідь: 0,488 г сплаву.
3. Скільки треба взяти 5%-вого розчину амоніаку (у см3) з урахуванням 50%-вого надлишку для осадження алюміній гідроксиду з розчину, що містить 0,9865 г KAl(SO4)2∙12Н2О в 1 дм3? Відповідь: 3,26 см3.
4. Скільки (у см3) 0,2 н. H2SO4 необхідно для осадження Барію з 0,5210 г ВаСl2∙2Н2О? Відповідь: 21,3 см3 без надлишку; 32 см3 з надлишком в 50%.
5. Який об'єм 0,5 н. Н2С2О4∙2Н2О треба для осадження кальцію з 0,3289 г Ca(NO3)2∙6Н2О? Відповідь: 5,6 см3 без надлишку; 8,4 см3 з надлишком в 50%.
6. Скільки разів необхідно промити осад речовини порціями промивної рідини по 5 см3, щоб зменшити число домішок в 50 разів, якщо осад утримує близько 2,3 см3 її? Відповідь: 3-4 рази.
7. У скільки разів зменшиться вміст домішок в осаді після промивання його трьома порціями промивної рідини по 10 см3, якщо осадом утримується близько 3 см3 її? Відповідь: в 83 рази.
8. Скільки грамів барій сульфату можна одержати з 25 см3 розчину, що містить 50 г KAl(SO4)2∙12Н2О в 1 дм3? Відповідь: 1,23 г.
9. Скільки Хлору (у %) міститься в дослідній речовині, якщо з 0,5425 останньої отримано 0,6237 г AgCl? Відповідь: 28,4%
10. Розрахуйте вміст Барію (в %) у зразку, якщо з 0,4694 г його отримано 0,2794 г BaSO4. Відповідь: 35,8%.
11. Обчисліть вміст (в %) гігроскопічної вологи в NaCl, якщо наважка зразка 0,6416 г після висушування зменшилися до 0,4930 г. Відповідь: вологість 23,2%.
12. Для визначення вологи наважку рослинної сировини в 3,00 г висушували до постійної маси. Маса висушеної сировини дорівнює 2,610 г. Обчисліть вміст вологи (в %) у сировині. Відповідь: 13,0%.
Заняття 15. Хімічний посуд у титриметрії. Приготування розчинів. Кислотно-основне титрування.
План:
- Інструктаж з техніки безпеки
- Ознайомлення з навчальним матеріалом
- Виконання лабораторної роботи
- Розрахунки та оформлення роботи
- Захист роботи
навчальний матеріал
Титриметричний метод використовують для аналізу середніх та великих вмістів речовин (>1%). За концентрацією та об’ємом розчину реагенту обчислюють вміст визначуваної речовини. Помилка визначення при цьому не перевищує 0,2%.
Титрування – процес поступового контрольованого приливания розчину з точно відомою концентрацією до певного об'єму іншого розчину. Титрант (стандартний або робочий розчин) – розчин, що доливають, позначають звичайно буквою В. Титрований розчин – розчин, до якого доливають титрант. Титрований розчин звичайно поміщають у колбу для титрування, а титрант – у бюретку. Титриметрична система – суміш речовин, що утворилася при взаємодії титранту й титрованої речовини. Точка еквівалентності (т.е.) – момент титрування, коли число еквівалентів титранту дорівнює числу еквівалентів визначуваної речовини. Індикатори – речовини або прилади, застосовувані для встановлення точки еквівалентності.
Робота з вимірювальним посудом. Точні об'єми розчинів у титриметрическом аналізі відмірюють за допомогою вимірювального посуду – мірних колб, піпеток, бюреток. Вимірювальний посуд піддають перевірці на місткість.
Перевірка місткості мірних колб. Колба ретельно миється, висушується й зважується на технохімічних вагах. Потім колбу заповнюють водою до мітки таким чином, щоб нижній край меніска рідини перебував на рівні мітки. Верхня частина горлечка колби зсередини ретельно протирається смужкою фільтрувального паперу для видалення зайвих крапель води. Після цього колбу з водою знову зважують. За різницею знаходять масу води, а вимірявши, її температуру, визначають густину і обчислюють істинну місткість колби. Для приведення об'єму води до об'єму, займаному нею при 20°С (тиск 1013 гПа), використовують значення густини.
Наприклад, маса води в мірній колбі місткістю 500 мл виявилася рівної 498,930 г, температура води 17ºС, ρ води при 17°С 0,99765 г/см3. Істинну місткість колби розраховують за формулою
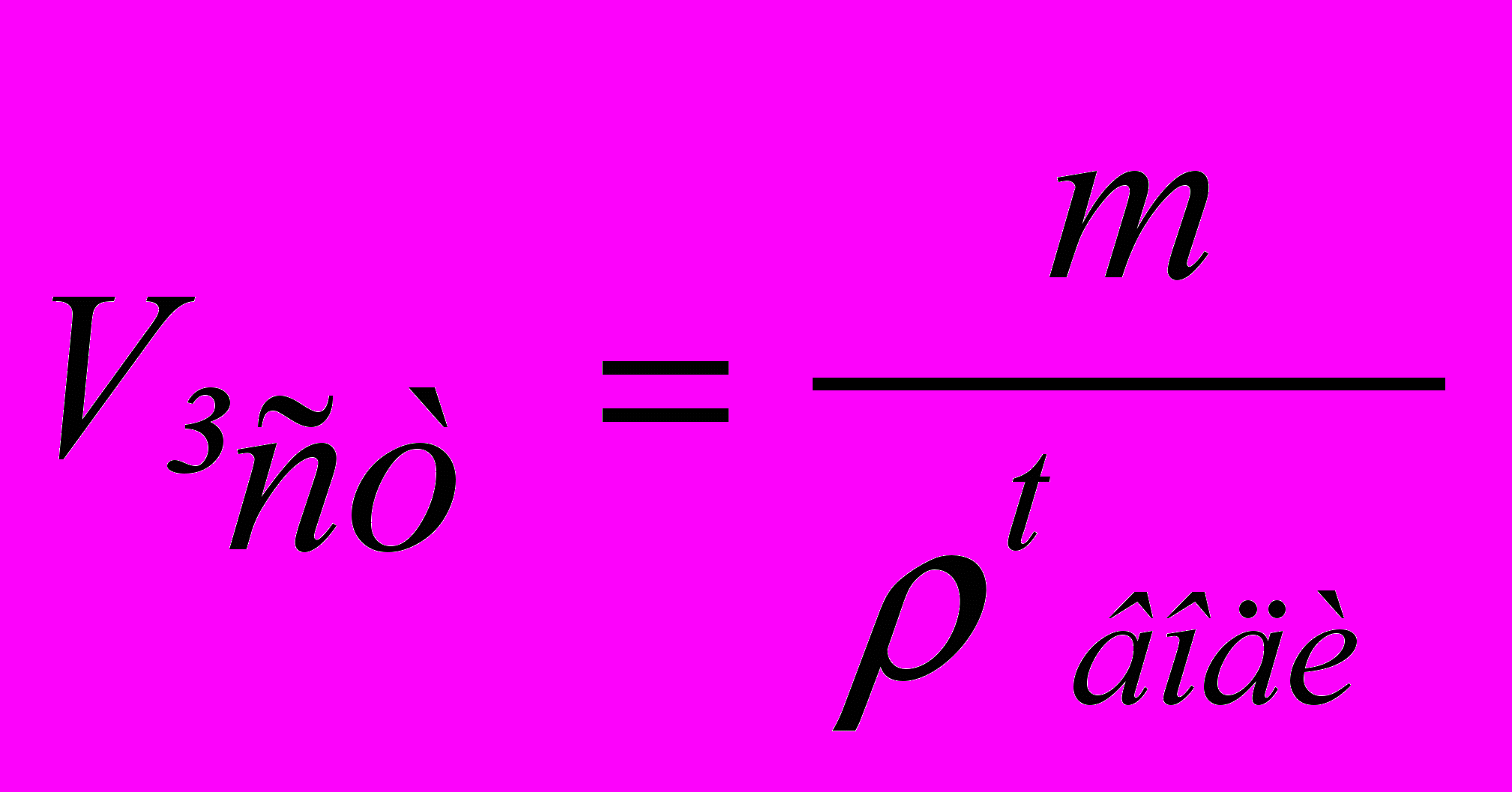 , (1)
, (1)де т – маса води в об'ємі колби, г; ρtводи – густина води за даної температури, г/см3.
Отже, Vіст = 498,930/0,99765 = 500,10 см3.
Заповнення бюреток розчином. Бюретку заповнюють зверху так, щоб у гумовій трубці не залишалося пухирців повітря. Для цього кінчик бюретки піднімають і злегка відкривають затиск. Якщо рідина йде рівним струменем, без пухирців повітря, бюретка заповнена правильно. Якщо склянка з розчином з'єднана з нижньою частиною бюретки скляною трубкою, то розчин подають знизу за допомогою крана, регулюючи подачу рідини в бюретку. Перед початком титрування бюретку встановлюють строго вертикально й заповнюють її титрантом до нуля. Для цього необхідно, щоб рівень меніска рідини ввігнутою частиною збігався з нульовим розподілом (нульовий розподіл повинен перебуває на рівні очей).
Перевірка місткості бюреток. Щоб перевірити точність бюретки, відмірюють і зважують на технохімічних вагах (тричі) різні об'єми води (5, 10, 15 см3 і т.д.) і за густиною розраховують істинні місткості кожної ділянки. При розрахунках беруть середнє арифметичне трьох зважувань. Істинну місткість знаходять по формулі (1). Наприклад, для ρ = 0,99717 г/см3 при 20°С:
Номінальна місткість бюретки V, см3 5 10 15 20 25
Маса води т, г 4,98 9,94 14,92 19,92 24,98
Істинна місткість бюретки Vіст, см3 5,00 9,97 14,96 19,98 25,05
Н
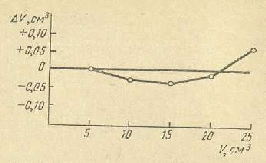
Рис. 1 Крива виправлень місткості бюретки
а підставі отриманих даних креслять криву виправлень місткості бюретки (рис. 1). При більших відхиленнях ∆V від номінальної місткості користуватися даним посудом не можна.
Відмірювання розчинів піпеткою. Щоб відміряти розчин, піпетку беруть великим і середнім пальцями, занурюють нижній кінець піпетки в розчин і засмоктують розчин за допомогою гумової груші трохи вище мітки.
Знімають грушу, отвір злегка закривають пальцем, і, «тримаючи» мітку піпетки на рівні очей, обережно зливають надлишок розчину так, щоб меніск рідини ввігнутою частиною збігався з міткою. Після цього отвір піпетки затискають і переносять її в іншу посудину. Верхню частину піпетки відкривають і дають рідини спокійно витекти. Після того як рідина з піпетки стече, останні краплі зливають, торкаючись стінки посудини, у який виливають рідину. У такому стані піпетку залишають на 10 с. Потім піпетку виймають, не звертаючи уваги на рідину, що у ній залишилася. Видувати або видавлювати рідина з піпетки не треба.
Перевірка місткості піпеток. Піпетки бувають градуйовані й не градуйовані. Градуюють піпетки на виливання. При калібруванні піпеткою відмірюють об'єм води в сухий зважений бюкс із кришкою, що зважують на технохімічних вагах. Операцію повторюють кілька разів. Розбіжність між двома зважуваннями не повинне перевищувати ±0,005 г. Об'єм піпетки знаходять за відношенням середньої маси води до її густини при даній температурі.
Правила титрування. При титруванні з бюреток дотримуються наступних правил. Місце, де проводиться титрування, повинне бути добре підготовлене й освітлено. На підставку штатива з бюреткою варто покласти аркуш білого паперу. Бюретка закріплюється паралельно стрижню штатива. Титрують малими порціями – по краплинам, на одне титрування витрачають 5–8 хв. Відкривають затиск бюретки лівою рукою, а колбу для титрування тримають у правій, постійно перемішуючи її вміст обертовими рухами. Після витікання розчину відлік поділок на бюретці роблять через 20–30 с, щоб дати можливість стекти рідини, яка залишилася на стінках бюретки. Відлік знімають по нижньому (безбарвні розчини) або по верхньому (забарвлені розчини) краю меніска. Меніск повинен перебувати на рівні очей. Якщо край меніска точно не збігається з поділкою бюретки, то рахують соті частки кубічних сантиметрів з точністю до 0,02–0,03 см3. Для одержання достовірних результатів повторюють титрування не менш трьох разів, завершивши його в один робочий день. Кожне повторне титрування починають із нульового відліку бюретки. Об'єм розчину, взятий для титрування, повинен становити 15–20 см3, приблизно такий же об'єм титранту повинен витрачатися на титрування. При використанні мікробюреток об'єми розчинів можуть бути зменшені. Об'єм титранту, витрачений на взаємодію з визначуваною речовиною, обчислюють за різницею між загальним об'ємом титранту й половиною об'єму краплі даної бюретки.
КИСЛОТНО-ОСНОВНЕ ТИТРУВАННЯ
Кислотно-основне титрування – це титриметричний метод аналізу, заснований на взаємодії кислот і основ. Розрізняють ацидіметричне (титрант – кислота) і алкаліметричне (титрант – основа) титрування. Згідно протолітичної теорії кислотними властивостями володіють кислоти НА, кислі солі МНА, солі основ ВНА; основними – основи В, аніони кислот А-, основні солі МОНА. Можливість застосування кислотно-основного титрування для аналізу насамперед визначається константою рівноваги кислотно-основної реакції, значення якої, якщо стехіометричні коефіцієнти при кислоті й основі рівні 1 (при С = 1 моль/дм3), повинне бути > 1∙108 (рК < - 8) при перетворенні речовин на 99,99%:
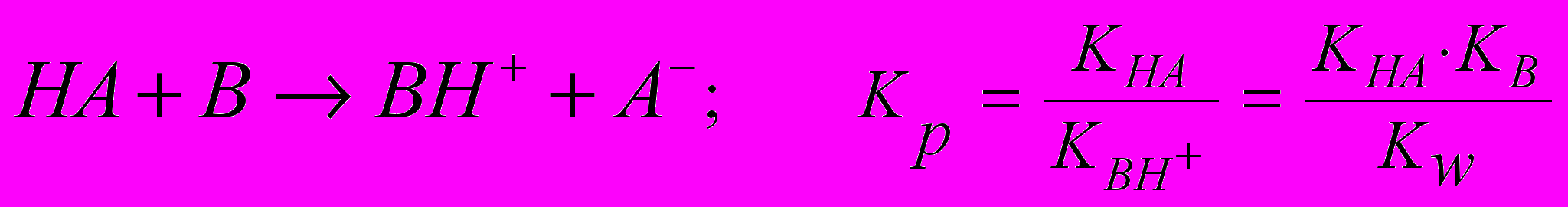
Якщо концентрація реагуючих кислоти й основи менше 1 моль/дм3, то можливість титрування визначають, з огляду на рівень титрування (А), що впливає на стрибок титрування. Орієнтовні висновки про величину стрибка при цьому можна зробити, помноживши Кр на рівень титрування:
К'р = КРА.
Аналіз сумішей кислот або основ можна здійснити, якщо їхні константи іонізації відрізняються на 4 порядки й більше, тобто відношення констант повинне бути > 104, а ∆рК > 4. Титрантами методу кислотно-основного титрування є в ацидиметрії 1; 0,5; 0,1; 0,01 н. розчини НСl і H2SO4, в алкаліметрії 1; 0,5; 0,1; 0,01 н. розчини NaOH або КOН [рідко Ва(ОН)2]. Для стандартизації титрантів застосовують Na2B4O7 ∙ 10Н2О; Н2С2О4 • 2Н2О і ін. Для визначення точки еквівалентності використають кислотно-основні індикатори – фенолфталеїн, метилоранж, метиловий червоний і ін. Індикатори характеризуються показником титрування рТ і інтервалом переходу (ІП) індикатора: рТ = рКінд;
(ІП) = рТ ± 1.
Можливість кислотно-основного титрування й застосовність індикатора визначають за кривими титрування, які будують у координатах рН – об'єм титранта. рН знаходять за формулами, що використовують для розрахунку рН у розчинах кислот і основ, буферних розчинах, розчинах гідролізованих солей, вводячи в ці формули частку відтитрованості: Р = CBVВ/CAVA; рТ індикатора повинен перебувати в межах стрибка титрування.
Лабораторна робота № 10. Приготування робочого розчину хлоридної кислоти за натрій тетраборатом.
Реактиви: концентрований розчин НС1, Na2B4O7 ∙ 10Н2О x. ч, метилоранж і фенолфталеїн, 0,1%-ві розчини.
Готування 0,1 н. НС1. Розведений розчин НС1 готують із більш міцного, вимірявши попередньо ареометром густину ρ його й визначивши по довідкових таблицях процентну концентрацію С%. Об'єм цього розчину V, необхідний для приготування 250 см3 0,1 н. НС1, розраховують за формулі (2). Еквівалентна маса НС1 дорівнює молярній масі. У мірний циліндр із пробкою відмірюють концентрований розчин НС1 більше розрахованого на 0,2–0,4 см3, розбавляють дистильованою водою до 250 см3 і добре перемішують, закривши циліндр пробкою. Приготовлений розчин переносять у чисту склянку для зберігання й наклеюють етикетку.
Готування стандартного розчину тетрабората натрію. Тетраборат натрію повинен бути свіжоперекристалізованим і відповідати формулі Na2B4O7 ∙ 10Н2О. Для готування 0,1 н. Na2B4O7 ∙ 10Н2О, з огляду на об'єм наявної мірної колби, розраховують наважку за формулі (2). Еквівалент тетрабората натрію визначають за рівнянню реакції взаємодії Na2B4O7 з кислотою НС1.
Наважку, трохи більшу розрахованої, зважують на аптечних вагах, переносять у бюкс (або на годинне скло), уточнюють на аналітичних вагах і висипають у чисту мірну колбу через суху лійку. Бюкс або стекло із залишками речовини знову зважують і за різницею знаходять масу тетрабората натрію, внесену в колбу. Результат зважування на аналітичних вагах заносять у зошит за формою*:
Маса бюкса (скла) з тетраборатом натрію _______
Маса бюкса (скла) із залишками тетрабората натрію _______
Маса тетрабората натрію _______
Гарячою водою із промивалки (тетраборат натрію погано розчиняється в холодній воді) ретельно змивають залишки речовини з лійки в колбу, обмивають лійку водою й виймають її з колби. Перемішуючи плавними круговими рухами, повністю розчиняють тетраборат натрію, вливаючи в колбу нові порції води, але не більше 2/з місткості її. Розчин прохолоджують до кімнатної температури й доливають до мітки водою так, щоб нижній край меніска відносився до мітки. Зайві краплі води вище мітки на внутрішній поверхні шейки колби знімають смужкою фільтрувального паперу й закривають колбу пробкою.
Розчин ретельно перемішують, перевертаючи колбу кілька разів, і переливають у склянку для зберігання. Нормальність приготовленого розчину розраховують за формулою (8) до четвертої значущої цифри.
Стандартизація розчину кислоти. Стандартизація проводиться способом піпетування. Приготовленим розчином кислоти НС1 заповнюють чисту бюретку і встановлюють рівень розчину на нульовій оцінці (по нижньому меніску). У колбу для титрування вносять за допомогою піпетки 15,00 см3 розчину натрій тетраборату (дотримуючи правила переносу розчинів піпеткою), додають 1-2 краплі розчину метилоранжу й титрують із бюретки розчином кислоти до переходу жовтого забарвлення в жовтогаряче. Титрування проводять із дотриманням правил техніки титрування не менш 3-4 разів до одержання відтворюваних результатів: різниця між об'ємами титранту не повинна перевищувати 0,05 см3. Розраховують середній об'єм і обчислюють нормальність розчину кислоти за формулі (5). Розчин з точно відомою концентрацією вважається стандартним.
Висновки.
Заняття 16. Розв’язування задач з теми «Титриметрія».
План:
1. Основні формули та стадії розв’язку задач.
2. Розв’язування задач цього типу.
1. РОЗРАХУНКИ КОНЦЕНТРАЦІЇ РОЗЧИНІВ
Концентрація розчину показує вміст речовини у вигляді маси, об'єму або кількості в одиниці маси або об'єму розчину або розчинника. Тому розрізняють масові й об'ємні концентрації. В аналітичній хімії використають і перші, і другі. Процентна концентрація за масою (%) показує вміст розчиненої речовини (у г, кг) в 100 г (кг) розчину й розраховується за формулою
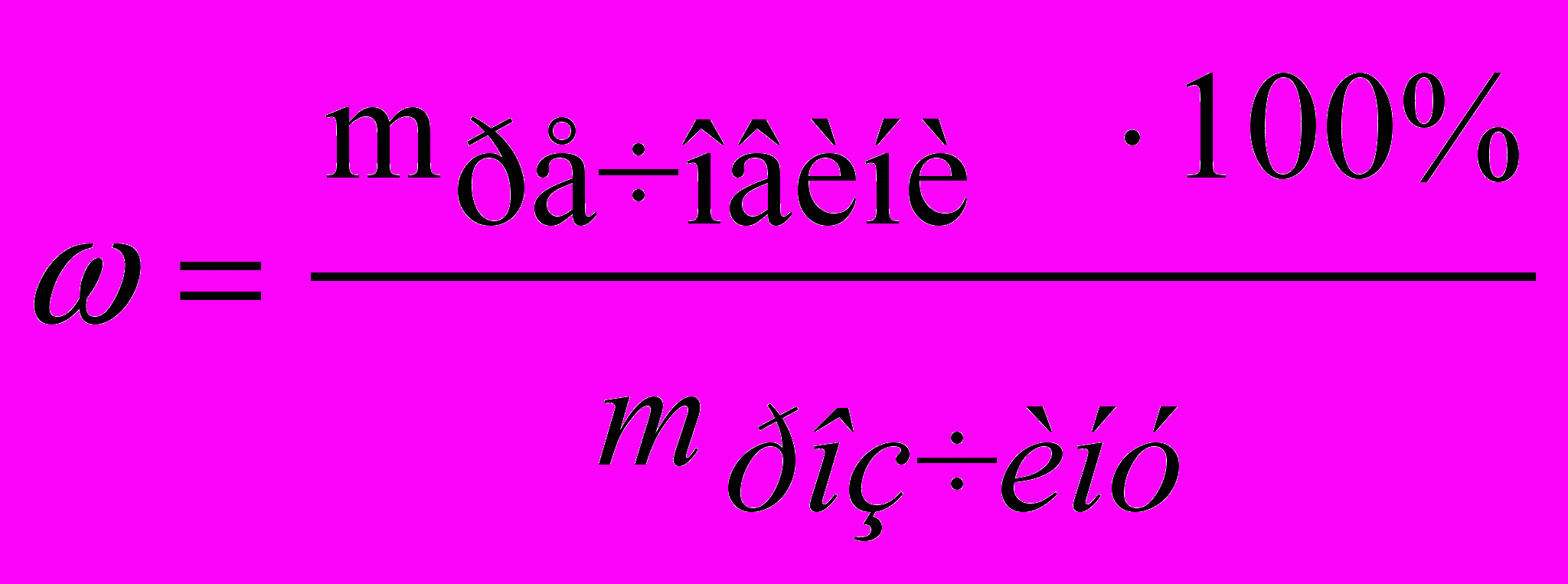 , (1)
, (1)де трозчину – маса розчину, у якому міститься маса речовини тречовини.
Процентна концентрація за об'ємом показує вміст речовини (у см3, дм3) в 100 см3 (дм3) розчину:
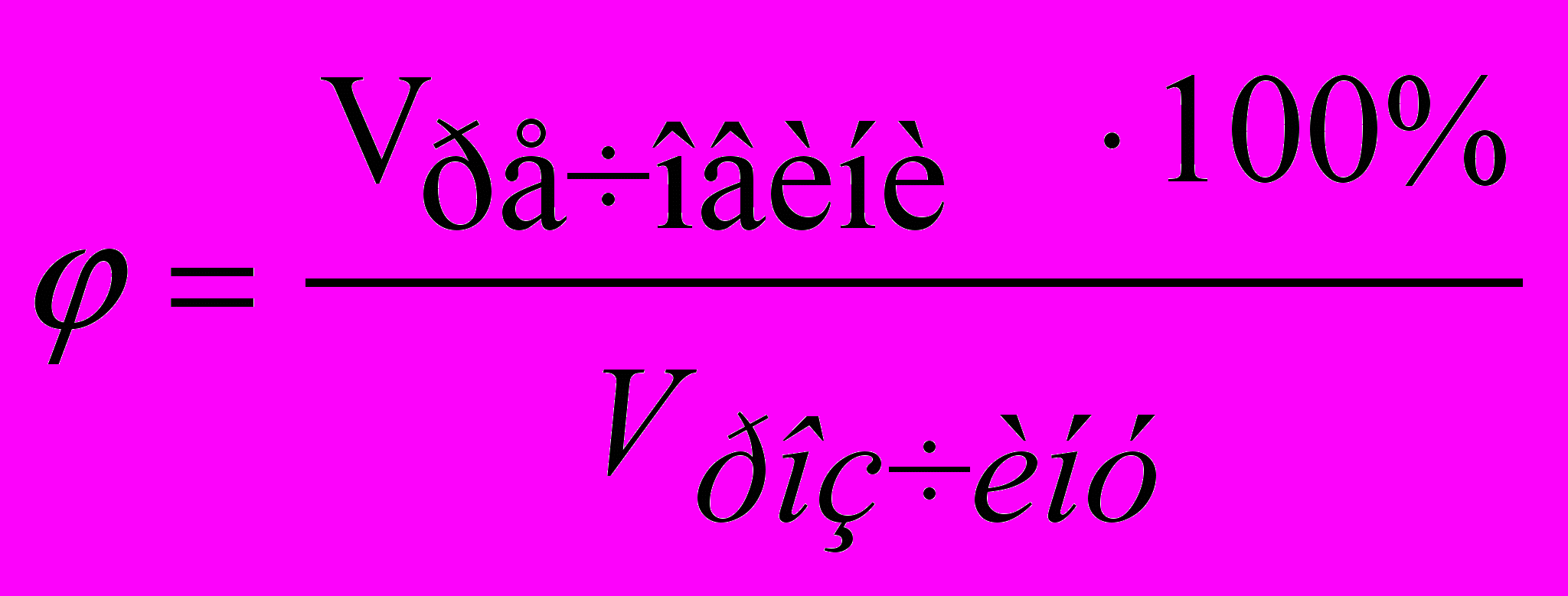 , (2)
, (2)де Vрозчину – об’єм розчину, у якому міститься об’єм речовини Vречовини.
Масооб’ємна процентна концентрація показує вміст речовини (у г, кг) в 100 см3 (дм3) розчину:
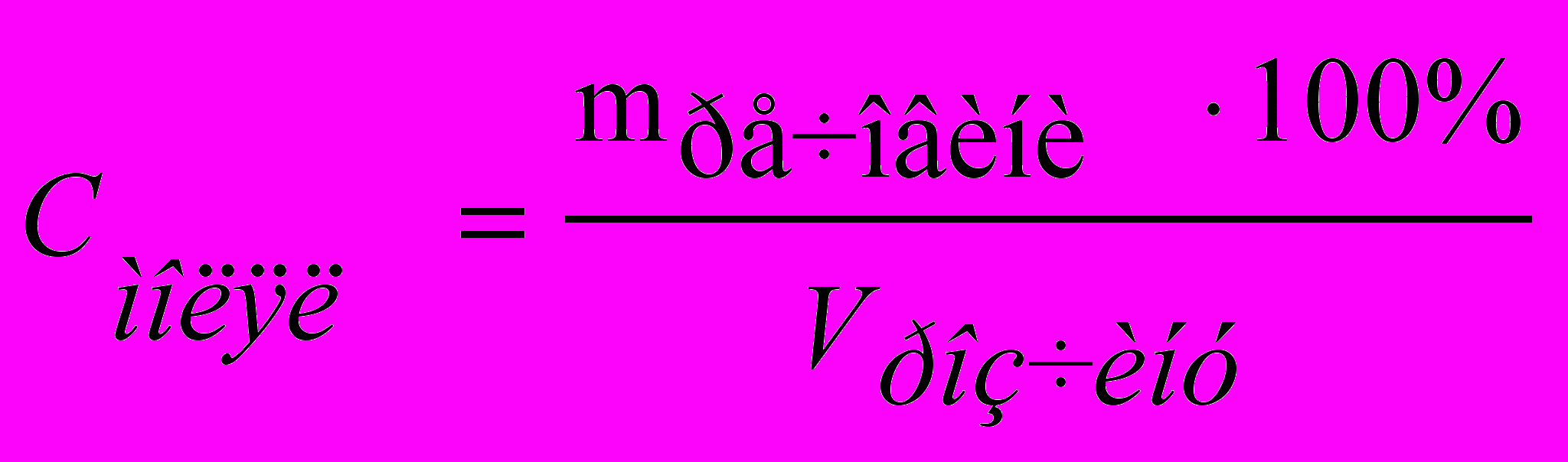 , (3)
, (3)де Vpозчину – об'єм розчину, що містить масу речовини тречовини.
Знаючи масу розчину, можна розрахувати його об'єм та, навпаки, за об'ємом розчину розрахувати його масу:
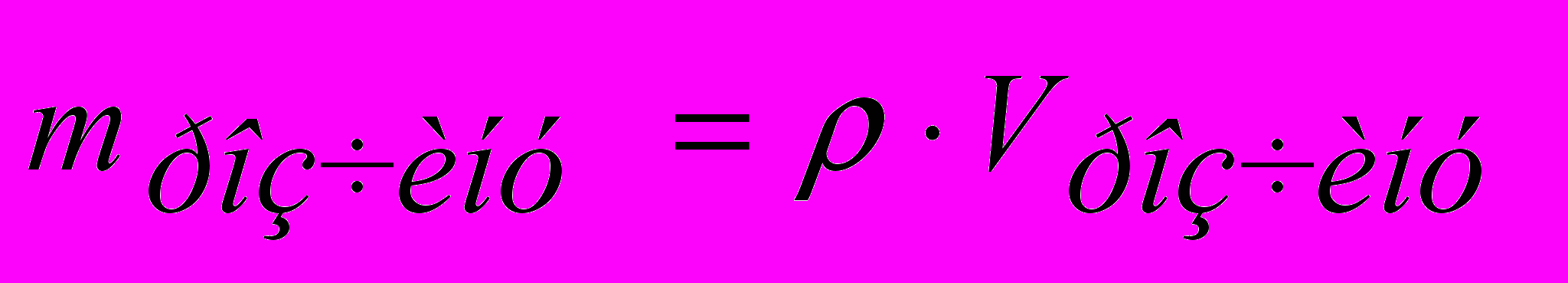 , (4)
, (4)де ρ – густина розчину (г/см3, кг/дм3), отже, можна перейти від одного способу вираження процентної концентрації до іншого.
Молярна концентрація (М) – число молів розчиненої речовини в 1 дм3 розчину:
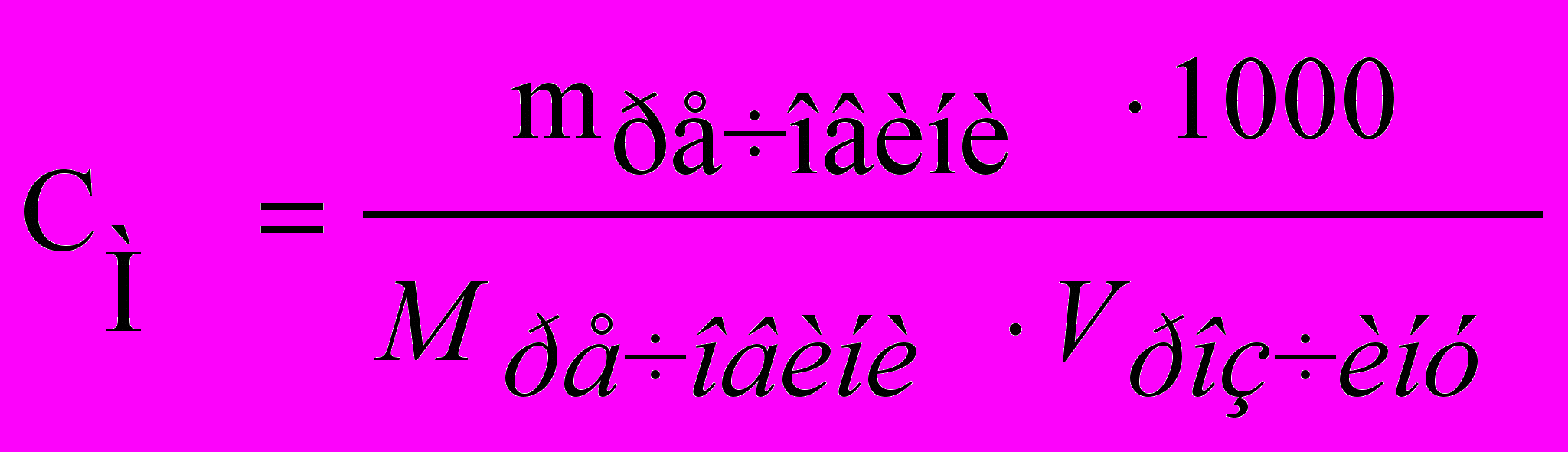 , (5)
, (5)де Мречовини – молярна маса речовини, г/моль.
Нормальна концентрація – число молей еквівалентів розчиненої речовини в 1 дм3 розчину:
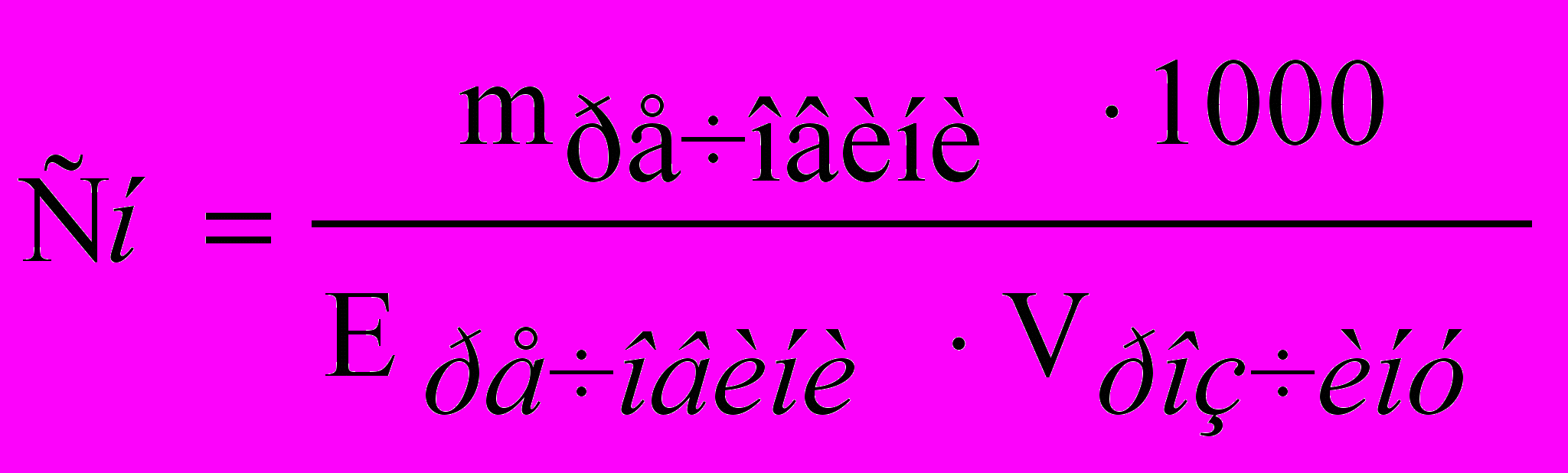 , (6)
, (6)де Еречовини – еквівалентна маса речовини, г-екв/моль.
Еквівалентна маса речовини на відміну від молярної величина змінна, залежить від типу реакції й взаємодіючих речовин. В одних випадках еквівалентна маса дорівнює молярній, в інших – становить частину її й може бути більше. Так, при взаємодії H2SO4 з NaOH еквівалент H2SO4 дорівнює 1 моль, якщо утвориться NaHSO4 і 1/2 моль при утворенні Na2SO4. У реакції ж окиснення-відновлення, коли утвориться S2--іон, еквівалент H2SO4 дорівнює 1/8 моль її. Знаючи нормальність розчину, можна розрахувати молярність і навпаки:
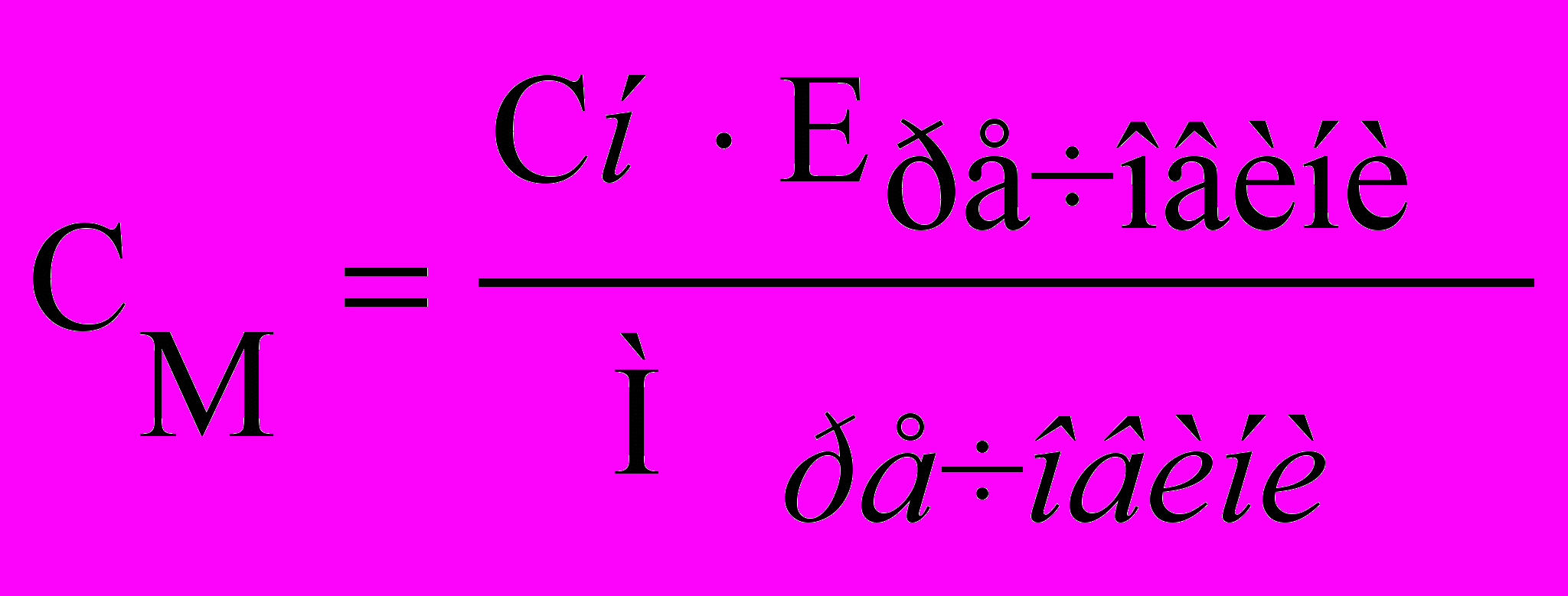 , (7)
, (7)При розведенні розчинів концентрація їх зменшується в стільки разів, у скільки об'єм кінцевого розчину більше первісного. Для приготування розчину певної концентрації (Сс) змішанням розчинів різної концентрації (С1, С2) використовують діагональну схему («зірочку»)
С
 1 Сс – С2
1 Сс – С2 Сс
СсС

 2 С1 – Сс
2 С1 – Ссде (Сс – С2) і (С1 – Сс) – маси розчинів з концентрацією С1 і С2 відповідно, які необхідні для одержання розчину з концентрацією Сс масою (Сс – С2) + (С1 – Сс).
2. Задачі для розв’язку
1. Визначити молярні маси речовин еквівалента кислотних гідроксидів та органічних кислот у таких реакціях:
K2CO3 + 2 HNO3 = 2 KNO3 + H2CO3
2 NaOH + H2SO4 = Na2SO4 + H2O.
2. В якому масовому співвідношенні треба змішати два розчини NaNO3 з масовими частками розчиненої речовини NaNO3 40,00% і 10,00%, щоб одержати розчин з масовою часткою NaNO3 20,00%? Відповідь: 1:2.
3. Визначити масову частку (%) речовини KCl у насиченому при 20ºС розчині калій хлориду, якщо коефіцієнт розчинності KCl за цієї температури дорівнює 0,34. Відповідь: 25,37%.
4. Визначити масову частку речовини NaОН у розчині, який утворюється при розчиненні динатрій оксиду масою 24,8 г у розчині масою 350,4 г з масовою часткою NaОН 8,00%. Відповідь: 16,0%.
5. Яку масу ВаCl2·2Н2О необхідно взяти для приготування розчину об’ємом 0,5 дм3 з масовою часткою речовини ВаCl2 10,00% і густиною 1,090 г/см3? Відповідь: 63,93 г.
6. Як можна одержати розчин сульфатної кислоти з масовою часткою речовини дигідроген тетраоксосульфату 8% з розчину сульфатної кислоти з масовою часткою речовини 40,0%? Відповідь: 1:4.
7. Яка молярна концентрація речовини барій дихлориду у розчині з масовою часткою речовини 10% і густиною 1,090 г/см3? Яка молярна концентрація речовини еквівалента барій дихлориду у цьому ж розчині? Відповідь: 0,5235 моль/дм3, 1,0470 моль/дм3.
8. До якого об’єму треба розбавити водою розчин сульфатної кислоти об’ємом 1,25 дм3, щоб зменшити його молярну концентрацію речовини еквівалента від 0,8 до 0,25 моль/дм3 (fекв.=1/2). Відповідь: 4 дм3.
9. Скільки мілілітрів соляної кислоти густиною 1,12 г/см3 треба взяти для приготування 10 л 0,01 н. розчину? Відповідь: 13,66 мл.
10. Скільки води треба додати до 2750 мл розчину КОН з титром 0,01066, щоб 1 мл одержаного розчину відповідав 0,01% Фосфору при наважці 1 г? Відповідь: 4282,6 мл.
11. Розрахуйте еквівалентні маси окиснювачів і відновників, зазначених у задачі 1. Відповідь: а) 49,03 і 151,9 г/моль; б) 333,24 і 151,9 г/моль; в) 248,18 і 126,9 г/моль; г) 31,6 і 63,03 г/моль.
12. Розрахуйте наважку К2Сr2О7 для готування 250 см3 0,1 н. розчину, що буде використаний в окиснювально-відновлювальному титруванні. Відповідь: 1,22 г.
13. Розрахуйте наважку сухого FeSO4∙7Н2О для готування 100 см3 0,05 н. розчину, що буде використаний, в окиснювально-відновлювальному титруванні. Відповідь: 1,390 г.
14. До 20 мл 0,12 М розчину натрій гідроксиду додано 5,2 мл 0,24 М розчину хлоридної кислоти. Розрахуйте рН розчину. Відповідь: 12,66.
15. До 50 мл 0,1 н. розчину бутиламіну (С4Н9NН2, К=4·10-4) додано 20 мл 0,25 М розчин НCl. Розрахуйте рН розчину та рекомендуйте індикатор для титрування. Відповідь: 5,88.
Заняття 17. Окисно-відновне титрування. Перманганатометрія.
