Растворимый Fas при онкологических заболеваниях 14. 00. 14. онкология 03. 00. 04. биохимия
| Вид материала | Автореферат |
- Ы оказания медицинской помощи населению при онкологических заболеваниях в онкорадиологических, 709.69kb.
- В. С. Волков // Воен мед журн. 2007. N c. 20-22, 50.8kb.
- Медико-социальная экспертиза при онкологических заболеваниях жкт, 230.28kb.
- Программа научно-практической конференции с международным участием, 302.14kb.
- Й Порядок регулирует вопросы оказания медицинской помощи населению при онкологических, 887.62kb.
- Питание при заболеваниях желудочно-кишечного тракта, 1773.01kb.
- Темы рефератов для поступления в аспирантуру по научной специальности 06. 02. 01 -диагностика, 17.74kb.
- Лечебно диагностическая программа При заболеваниях органов дыхания, 58.77kb.
- Проблемы гипоксии при заболеваниях сердечно-сосудистой системы. Применение препарата, 483.23kb.
- Сестринский процесс при заболеваниях, 1192.49kb.
Задачи исследования:
1. Охарактеризовать разработанный нами сэндвич-ИФА для количественного определения sFas в сыворотке крови человека – оценить предел детекции тест-системы и воспроизводимость результатов анализа. Дать иммунохимическую характеристику моноклональных антител (МА), на основе которых разработан сэндвич-ИФА.
2. С помощью пептидного фагового дисплея определить структуру эпитопов для МА к полноразмерному Fas человека, на основе которых разработан сэндвич-ИФА, с целью выявления спектра изоформ sFas, которые должна детектировать разработанная тест-система.
3. Определить концентрацию sFas в сыворотке крови онкологических больных с наиболее часто выявляемыми опухолями (новообразования молочной железы, яичников, эндометрия, костей, толстой кишки, надпочечников и щитовидной железы) и провести анализ показателей sFas в зависимости от основных клинических, морфологических и некоторых биохимических критериев опухолевых процессов и определить его значение в прогнозе заболеваний.
4. Изучить корреляцию показателей sFas в сыворотке крови онкологических больных с показателями наиболее важных патогенетических факторов: активатора процесса неоангиогенеза в опухоли – VEGF, провоспалительного цитокина, ингибитора Fas-зависимого апоптоза – IL-6, уровня содержания рецепторов эстрогенов в опухоли при раке молочной железы, общей активности щелочной фосфатазы в сыворотке крови при новообразованиях костей, уровня содержания активатора плазминогена (uPA) в ткани опухолей щитовидной железы.
Научная новизна. Разработана и охарактеризована оригинальная отечественная тест-система для количественного определения растворимого Fas в сыворотке крови человека, не уступающая аналогичным тест-системам, описанным в литературе.
С помощью разработанной тест-системы впервые на большом клиническом материале определена концентрация и проведен анализ показателей растворимого Fas в сыворотке крови больных новообразованиями различного морфогенеза и локализации в сравнении с соответствующими показателями практически здоровых людей. Впервые определены связь sFas с основными клиническими, морфологическими и некоторыми биохимическими характеристиками опухолевых процессов и его значение в прогнозе заболевания при раке яичников, раке тела матки, раке коры надпочечников и остеогенной саркоме, а также предиктивное значение sFas в оценке эффективности неоадъювантной лучевой терапии при колоректальном раке.
Практическая значимость исследования состоит в разработке оригинальной отечественной иммуноферментной тест-системы для количественного определения растворимого Fas в сыворотке крови человека, а также в установлении значения этого белка как фактора прогноза при раке яичников, раке тела матки, раке коры надпочечников и остеогенной саркоме, а также его предиктивного значения в оценке эффективности неоадъювантной лучевой терапии при раке толстой кишки.
Основные положения, выносимые на защиту:
- Разработанная тест-система на основе МА SA-7 и SA-8 может применяться для количественного определения sFas в сыворотке и плазме крови человека и других биологических жидкостях. Присутствие sFasL и других компонентов сыворотки крови не влияет на результаты количественного определения sFas. Разработанная нами тест-система должна детектировать основную изоформу sFas - FasExo6Del и три минорных изоформы sFas -FasExo4Del, FasExo4,6Del и FasExo4,7Del.
- Концентрация и частота выявления sFas в сыворотке крови больных новообразованиями различного морфогенеза и локализации достоверно превышают соответствующие показатели практически здоровых людей.
- Показатели sFas в сыворотке крови связаны с основными клиническими характеристиками заболевания (стадия опухолевого процесса, размер опухолевого узла, степень дифференцировки опухоли и характер ее роста) при раке яичников, раке тела матки, раке толстой кишки и адренокортикальном раке.
- Показатели sFas достоверно не различаются при злокачественных и доброкачественных новообразованиях молочной железы, костей, яичников и надпочечников, тогда как рак щитовидной железы характеризуется более высокими показателями sFas в сыворотке крови, чем доброкачественные и гиперпластические процессы щитовидной железы. Одновременно высокие уровни sFas, VEGF и IL-6 в сыворотке крови характерны для злокачественных новообразований.
- Высокий уровень sFas в сыворотке крови является неблагоприятным фактором прогноза для больных остеогенной саркомой, раком яичников, раком тела матки и адренокортикальным раком.
- Высокая концентрация sFas в сыворотке крови является неблагоприятным предиктивным фактором эффективности применения неоадъювантной лучевой терапии при колоректальном раке в пожилом возрасте.
Апробация работы:
Материалы диссертации доложены на научно-практическом симпозиуме «Клиническая лаборатория на пороге XXI века: синтез традиций и новаций», (Москва, 12-14 октября 1999 года); на VII Российском Национальном Конгрессе «Человек и лекарство» (Москва, 10-14 апреля 2000 года); на 2-ом съезде онкологов стран СНГ (Киев, 23-26 мая 2000 года); на 7th Biennial Meeting of the International Gynecological Cancer Society (Rome, Italy, September 26-30, 1999); на XI Российском Национальном Конгрессе «Человек и лекарство» (Москва, 19-23 апреля 2004 года); на Конгрессе «Национальные дни лабораторной медицины России-2004» (Москва 20-22 октября 2004г.); на Российской научно-практической конференции «Современное состояние и перспективы развития экспериментальной и клинической онкологии» (Томск, 24-25 июня 2004 г.); на XII Российском Национальном Конгрессе «Человек и лекарство» (Москва, 18-22 апреля 2005 г.); на I Всероссийской научно-практической конференции патологоанатомов «Актуальные вопросы патологической анатомии» (Орел, 31 мая-2 июня 2005 г.); на X Российском онкологическом конгрессе (Москва, 21-23 ноября 2006 г.); на XIII Российском Национальном Конгрессе «Человек и лекарство» (Москва, 3-7 апреля 2006 г.). Диссертационная работа апробирована на совместной научной конференции лаборатории клинической биохимии, лаборатории клинической иммунологии, х/о опухолей молочной железы, х/о проктологии, х/о диагностики опухолей НИИ КО, лаборатории молекулярной эндокринологии НИИ канцерогенеза ГУ РОНЦ им. Н.Н.Блохина РАМН; кафедры онкологии и кафедры клинической биохимии и лабораторной диагностики ФПДО МГМСУ; лаборатории нейрохимии ФИБХ РАН 14 октября 2008 г.
Полученные результаты используются в практике лаборатории клинической биохимии НИИ клинической онкологии ГУ РОНЦ им. Н.Н.Блохина РАМН и в учебном процессе на кафедре клинической биохимии и лабораторной диагностики ФПДО ГОУ ВПО «Московский государственный медико-стоматологический университет Росздрава».
Публикации. По материалам диссертации опубликовано 41 работа в отечественных и зарубежных журналах.
Структура и объем диссертации. Диссертация состоит из введения, обзора литературы, экспериментальной части, включающей описание материалов и методов и 8 глав результатов собственных исследований; заключения, выводов, списка цитируемой литературы. Общий объем диссертации 272 страниц машинописного текста. Список литературы включает 84 отечественных и 448 зарубежных авторов. Диссертация иллюстрирована 67 таблицами и 26 рисунками.
Материалы и методы исследования
Общая характеристика обследованных больных
В настоящее исследование были включены 1061 первичных больных злокачественными и доброкачественными новообразованиями различного гистогенеза и локализации, из них 861 женщины и 200 мужчин, в возрасте от 14 до 80 лет. В общей группе пациентов были больные новообразованиями молочной железы (141), костей (99), яичников (347), тела матки (111), толстой кишки (113), щитовидной железы (141) и коры надпочечников (109).
Группу контроля составили 457 практически здоровых людей, 332 женщины и 125 мужчин, в возрасте от 17 до 76 лет.
Диагнозы всем больным были установлены впервые на основании результатов клинических исследований и подтверждены данными гистологического исследования, определение концентрации sFas в сыворотке крови проводили до начала специфического лечения.
Больных классифицировали по стадиям согласно международной классификации по системе TNM (Cancer TNM Classification of Malignant Tumours VI Ed.).
Группу больных новообразованиями молочной железы составили 119 женщин от 28 до 82 лет с первичным РМЖ и 22 пациентки с доброкачественными новообразованиями и фиброзно-кистозной болезнью в возрасте от 33 до 58 лет, которые были обследованы и получали лечение в НИИ клинической онкологии Российского онкологического научного центра им. Н.Н.Блохина РАМН в период с декабря 1999г. по ноябрь 2003г.
Проводили определение концентрации sFas и общей активности щелочной фосфатазы у 99 больного новообразованиями костей (61 мужчина и 38 женщин) в возрасте от 14 до 59 лет. Определение концентрации VEGF проводили только у больных остеогенной саркомой и опухолью Юинга. Новообразования костей были представлены следующими нозологическими единицами: первичная остеогенная саркома (32), вторичная остеогенная саркома (1), паростальная остеогенная саркома (1), периостальная остеогенная саркома (1), первичная хондросаркома (17), вторичная хондросаркома (1), опухоль Юинга (10), злокачественная фиброзная гистиоцитома кости (9), гигантоклеточная опухоль кости (10), плазмоцитома (1), гемангиоэндотелиома (1), гемангиоперицитома (1), хордома (3), липома кости (1), доброкачественная остеобластома (2), хондробластома (3), хондрома (1), костно-хрящевой экзостоз (2), аневризмальная костная киста (2).
В группе больных новообразованиями яичников было 141 больная злокачественными новообразованиями в возрасте от 24 до 80 лет и 206 пациенток с доброкачественными новообразованиями в возрасте от 18 до 69 лет, которые прошли обследование и лечение в ГУ РОНЦ им. Н.Н. Блохина РАМН в период с января 2000 по март 2006 г.г. В группе больных ДОЯ были представлены следующие морфологические варианты опухоли: дермоид (24), киста желтого тела (20), фолликулярная киста (14), цистаденома (56), цистаденофиброма (6), простая киста (4), папиллярная цистаденома (10), опухоль Бреннера (8), пограничная опухоль (18), муцинозная пограничная опухоль (4), эндометриоидная киста (24), муцинозная киста (6), фиброма (8). В общей группе больных РЯ были следующие нозологические единицы: папиллярная цистаденокарцинома (22), серозная цистаденокарцинома (53), эндометриоидная аденокарцинома (27), муцинозная аденокарцинома (26), аденогенный рак (3), серозный рак (10).
В исследование были включены 111 больных раком тела матки (РТМ) в возрасте от 31 до 80 лет. Гистологическое исследование выявило следующие морфологические варианты строения опухолей у больных РТМ: аденокарцинома (102), железисто-плоскоклеточный рак (7), светлоклеточный рак (2). Больные находились в разных стадиях опухолевого процесса, большинство (62.8%) из них было в 1 и 2 стадии.
В исследование были включены 113 больных колоректальным раком, из них 57 мужчин и 56 женщин в возрасте от 35 до 72 лет.
В общую группу больных были включены 141 пациент с различными патологиями щитовидной железы, из них 127 женщин и 14 мужчин, в возрасте от 17 до 73, которые находились на обследовании и лечении в отделении опухолей верхних дыхательно-пищеварительных путей ГУ РОНЦ им. Н.Н. Блохина РАМН г.Москвы за период с декабря 1998 по январь 2002 года. Новообразования щитовидной железы были представлены следующими морфологическими типами опухолей: 1) рак щитовидной железы – 32; 2) аденома щитовидной железы – 16; 3) узловой коллоидный микро-макрофолликулярный зоб с признаками аденоматоза – 20; 4) узловой коллоидный микро-макрофолликулярный зоб без признаков аденоматоза – 48; 5) диффузный токсический зоб с признаками аденоматоза – 9; 6) диффузный токсический зоб без признаков аденоматоза – 14; 7) аутоиммунный тиореоидит Хошимото – 2.
В общей группе пациентов было 109 больных опухолями надпочечников, из них 59 мужчин и 50 женщин, в возрасте от 45 до 75 лет. Гистологическое исследование выявило следующие нозологические единицы: рак коры надпочечника – 32, аденома коры надпочечника – 52, адренокортикальная опухоль с неопределенным потенциалом злокачественности – 6, феохромоцитома – 18 и миелолипома – 1.
Сопутствующая патология выявлена более чем у половины (56%) всех больных новообразованиями. Среди сопутствующих заболеваний были гипертоническая болезнь, хроническая ишемическая болезнь сердца, стенокардия, миома матки, полип матки, мастопатия, хронический гастрит, хронический колит, хронический пиелонефрит, мочекаменная болезнь, сахарный диабет II типа. Сочетание нескольких хронических заболеваний в анамнезе выявлено у 212 (20%) больных.
Лабораторные методы исследования
Определение концентрации sFas в сыворотке крови. МА против Fas SA-8 (IgG1 (); (4.0±0.6)x107 М-1) сорбировали на ИФА-планшеты (“Linbro”) в 0,05 М карбонатном буфере (рН 9.6) в концентрации 5 мкг/мл в течение ночи при 4оС. Для блокирования остаточных свободных центров связывания планшеты инкубировали с 1% раствором БСА в фосфатно-солевом буфере (РВS) (рН 7.2) 1 час при 37оС. Затем в планшеты вносили сыворотки больных и практически здоровых людей, которые хранили при -20оС до анализа. Для построения калибровочного графика в каждый планшет вносили последовательные двукратные разведения полноразмерного рекомбинантного бакуловирусного Fas от 40 нг/мл до 0.1 нг/мл. Планшеты инкубировали 1.5 часа при 37оС. После инкубации планшеты промывали раствором РВS, содержащим 0.1% Tween 20 (“Sigma”) (буфер для отмывки). Процедуру отмывки далее повторяли после каждой стадии теста. После отмывки в планшеты вносили биотинилированные МА против Fas SA-7 (IgG1 (); (5.8±0.7)x108 М-1) в концентрации 10 мкг/мл в буфере для отмывки, содержащем 0.1% БСА и инкубировали 2 часа при 37оС. Затем в планшеты вносили раствор стрептавидин-пероксидазы (“Amersham”) в рабочем разведении в буфере для отмывки. Планшеты инкубировали 1 час при 37оС. В качестве субстрата использовали свежеприготовленный раствор 0.04% орто-фенилендиамина в 50 мМ цитрат-фосфатном буфере (рН 5.0), содержащем 0.03% перекиси водорода. Планшеты инкубировали 15-20 минут при комнатной температуре до развития окраски. Реакцию останавливали 10% серной кислотой, оптическую плотность измеряли при длине волны 492 нм на спектрофотометре MR 700 Microplate Reader (“Dynatech Labs”, США). Концентрацию sFas определяли по калибровочному графику, построенному заново для каждого планшета.
Определение эпитопов, узнаваемых МА SA-7 и SA-8, проводили с помощью библиотеки гептапептидов в варианте фагового дисплея – PH.D. 7ТМ (BioLabs, Cat. #E8100S) по прилагаемой инструкции.
Синтез пептидов проводили твердофазным методом в ручном твердофазном реакторе (Rodionov I.L. и соавт., 1992) с использованием Fmoc-стратегии (Reid G.E. и Simpson R.J., 1992).
Приготовление сыворотки крови пациентов и практически здоровых людей
Кровь у больных и практически здоровых людей забирали натощак из кубитальной вены с 8 до 9 утра. После свертывания крови пробирки центрифугировали при 500g в течение 10 минут, сыворотку аккуратно отбирали, разливали по промаркированным пробиркам и хранили при 20оС до анализа.
Определение концентрации IL-6 в сыворотке крови проводили с помощью иммуноферментного набора «human IL-6» компании “R&D”, США по прилагаемой к набору инструкции производителя.
Определение концентрации VEGF в сыворотке крови проводили с помощью иммуноферментного набора “CytElisatm Human VEGF” компании “Cytimmune Science inс.” (США) по прилагаемой к набору инструкции производителя.
Определение концентрации uPA в гомогенизированной ткани опухоли проводили с помощью иммуноферментного набора реактивов, разработанных в Католическом Университете г. Наймегена в лаборатории проф. Т.Benraad'a (Нидерланды).
Определение рецепторов эстрадиола-17 в экстрактах опухоли молочной железы проводили радиолигандным методом при насыщающих концентрациях лиганда [2,4,6,7-3H]-эстрадиола-17 (“Amersham Int. PLC”, Англия). Неспецифичное связывание определяли при 100-200-кратном молярном избытке диэтилстильбэстрола. Для разделения свободных и связанных с рецептором стероидов пробы после инкубации обрабатывали суспензией активированного угля, покрытого декстраном. Радиоактивность образцов определяли на спектрометре “LS 6500” (“Beckman”, США).
Определение общей активности щелочной фосфатазы в сыворотке крови проводили оптимизированными методами при использовании автоматического анализатора «Hitachi 911».
Статистический анализ результатов исследования
Выбор центральных характеристик исследуемых количественных данных осуществляли после изучения формы их распределения. Оценку различия формы распределения от формы распределения Гаусса проводили по критерию согласия Колмогорова-Смирнова. При логнормальном распределении проводили математическое преобразование значений. Рассчитывали среднее значение показателя и его 95% доверительные границы, ошибку среднего, а также медианы (для логнормальных показателей) и пределы колебания.
Рассчитывали абсолютные и относительные частоты качественных и ординальных признаков. Оценку различий частот проводили непараметрическим критерием χi-2, для малых выборок – точным критерием Фишера. Расчет доверительных интервалов для малых долей проводили с учетом биноминального распределения.
Для выяснения диагностической способности показателей проводили дискриминантный анализ. Рассчитывали точное значение р. При множественных сравнениях значения р определяли с помощью специальных тестов с поправкой на множественность сравнений (test Scheffe). При корреляционном анализе рассчитывали коэффициент корреляции Пирсона, а также значимость его отличия от нуля. Выживаемость рассчитывали по методу Каплана-Майера.
При выборе статистических процедур учитывали методологические требования Международного конгресса по гармонизации GGP “Статистические принципы для клинических исследований” (ICH Guidelines//Good Clin.Pract.J.-1998.-Vol.5, №4.-р.27-37).
Все вычисления проводили с помощью математических пакетов «Статистика» и SPSS.
Результаты собственных исследований
Разработка и характеристика сэндвич-ИФА для количественного определения sFas
в сыворотке крови на основе моноклональных антител
Получение моноклональных антител против человеческого Fas
Для иммунизации брали 8-недельных мышей линии BALB/c, в качестве антигена использовали полноразмерный рекомбинантный бакуловирусный Fas (“Сoultronics”, Франция). Гибридизацию иммунных спленоцитов мыши с клетками мышиной линии NSO/1 проводили по стандартной методике. Отбор положительных гибридом проводили методом непрямого ИФА. Одиночные положительные клоны получали методом лимитирующих разведений.
МА нарабатывали в асцитной жидкости мышей линии BALB/c. Выделение МА из асцитной жидкости осуществляли преципитацией сульфатом аммония и последующей жидкостной хроматографией умеренного давления на колонке MonoQ. Определение типов тяжелых и легких цепей иммуноглобулинов проводили непрямым ИФА с помощью набора для типирования антител (“Amersham”, Великобритания).
Иммунохимическая характеристика полученных антител приведена в таблице 1.
Таблица 1. Иммунохимическая характеристика моноклональных антител кFas
-
Антитело
Тип тяжелой и легкой цепи
Константа аффинности, М-1
SA-1
IgG2a()
(7.8±1.3)x107
SA-2
IgG1()
(4.1±0.3)x107
SA-3
IgG1()
(6.4±0.5)x107
SA-4
IgG1()
(2.1±0.4)x109
SA-5
IgG1()
(3.8±0.3)x107
SA-6
IgG1()
(3.3±0.2)x107
SA-7
IgG1()
(5.8±0.7)x108
SA-8
IgG1()
(4.0±0.6)x107
SA-9
IgG1()
(6.5±0.5)x107
С целью разработки тест-системы для количественного определения растворимого Fas в сыворотке крови были получены конъюгаты МА против Fas с биотином. Были проверены все возможные варианты сэндвич-ИФА, наилучшие результаты определения sFas показала «пара» антител SA-7 и SA-8. МА SA-7 и SA-8 выявляли одну мажорную полосу, соответствующую молекулярному весу полноразмерного Fas в клеточных экстрактах человеческих линий HL-60, MCF 7 и Jurkat, и не взаимодействовали с экстрактом клеток мышиной линии L929 в иммуноблоттинге, что может свидетельствовать о видовой специфичности этих антител.
Проводили определение минимальной концентрации sFas, детектируемой разработанной тест-системой, для этого делали последовательные двукратные разведения полноразмерного Fas от 10 до 0.08 нг/мл. Нижним пределом детекции sFas, определяемым сэндвич-ИФА, считали концентрацию Fas, достоверно превышающую фоновое значение оптической плотности тест-системы плюс три стандартных отклонения. Минимальный предел детекции sFas тест-системы на основе МА SA-7 и SA-8, определенный в 6 независимых экспериментах, составил 0.3 нг/мл (рис. 1).
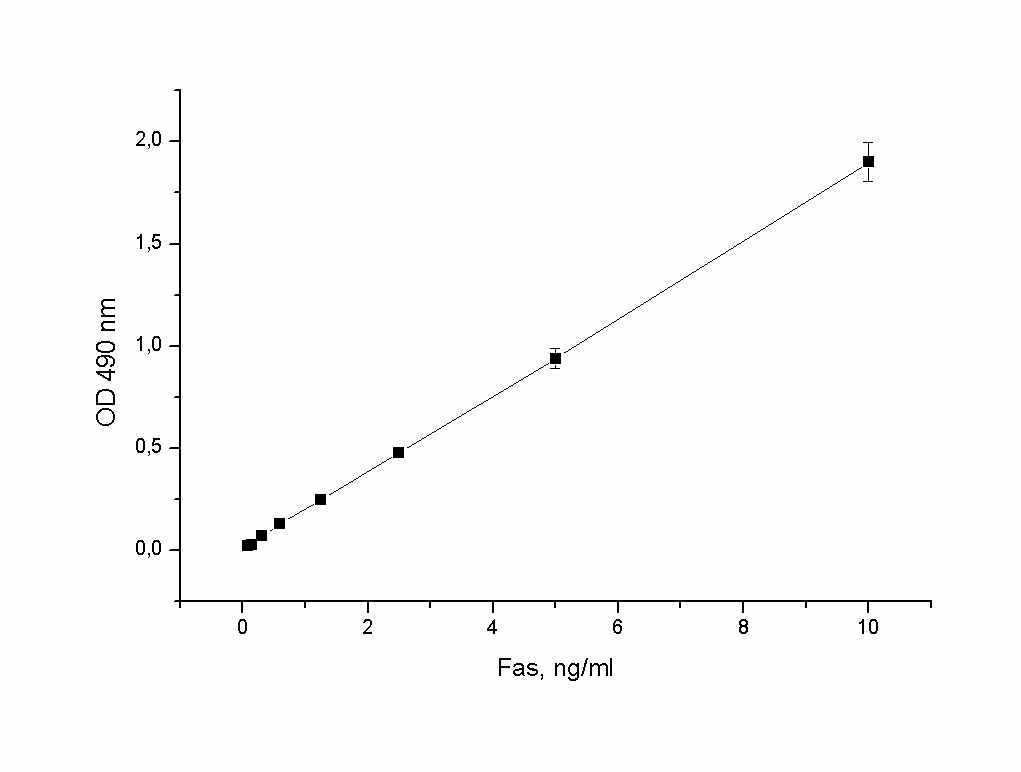
Рис. 1. Калибровочный график для определения концентрации растворимого Fas
В литературе описано несколько тест-систем для определения концентрации sFas в варианте сэндвич-ИФА, нижний предел детекции которых колеблется от 2 нг/мл (Tomokuni A. и соавт., 1997) до 0.1 нг/мл (Seishima M. и соавт., 1996), по данному показателю разработанный сэндвич-ИФА не уступает аналогичным тест-системам.
Показали, что присутствие sFasL в концентрации 10 нг/мл не влияет на результаты количественного определения sFas разработанной нами тест-системой (рис. 2).
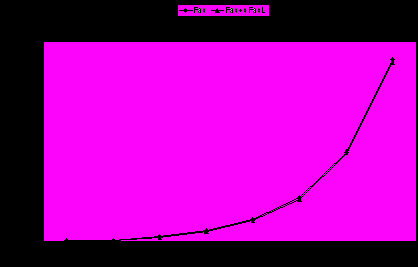
Рис. 2. Определение концентрации sFas в присутствии sFasL
С целью оценки воспроизводимости результатов определения концентрации sFas в сыворотке крови человека с помощью разработанного сэндвич-ИФА проводили определение уровня sFas в 8 различных образцах сыворотки в 6 параллельных повторах для каждого образца в пределах одного ИФА-планшета (intra-assay) и рассчитывали коэффициент вариации. Эксперимент повторяли 3 раза в независимых экспериментах (inter-assay) и рассчитывали коэффициент вариации для данного теста, учитывая результаты 18 определений для каждого образца сыворотки. Результаты проведенных экспериментов представлены в таблицах 2 и 3.
Таблица 2. Результаты определения концентрации sFas в сыворотке крови
в пределах одного ИФА-планшета
| Образец сыворотки | Концентрация sFas, нг/мл | Коэффициент вариации, % |
| 1 | 2.67, 2.75, 2.60, 2.59, 2.73, 2.65 | 2.5 |
| 2 | 5.45, 5.39, 5.55, 5.59, 5.48, 5.62 | 1.6 |
| 3 | 0.76, 0.85, 0.70, 0.81, 0.74, 0.77 | 6.9 |
| 4 | 3.59, 3.48, 3.75, 3.55, 3.67, 3.64 | 2.6 |
| 5 | 8.40, 8.90, 8.65, 8.56, 8.73, 8.57 | 2.0 |
| 6 | 1.78, 1.83, 1.64, 1.75, 1.68, 1.67 | 4.2 |
| 7 | 0.53, 0.64, 0.59, 0.58, 0.61, 0.57 | 6.3 |
| 8 | 3.67, 3.75, 3.53, 3.58, 3.64, 3.52 | 2.5 |
| Средний коэффициент вариации (M±m), % | 3.7±0.7 |
Коэффициент вариации изменялся от 1.6% до 6.9% и в среднем составил 3.7%. Полученные данные свидетельствуют о хорошей воспроизводимости результатов измерения концентрации sFas в данном виде теста (intra-assay). Коэффициент вариации был выше при низкой концентрации sFas в сыворотке крови, что объясняется бóльшим вкладом ошибки метода (разброс значений оптической плотности, краевые эффекты) вблизи значения минимального предела детекции тест-системы.
Таблица 3. Результаты определения уровня sFas в независимых экспериментах
| Образец сыворотки | Эксперимент №1 | Эксперимент №2 | Эксперимент №3 | Коэффициент вариации, % |
| 1 | 2.67 | 2.80 | 2.50 | 5.6 |
| 2 | 5.51 | 5.30 | 5.45 | 2.0 |
| 3 | 0.77 | 0.67 | 0.73 | 6.9 |
| 4 | 3.61 | 3.70 | 3.55 | 2.1 |
| 5 | 8.64 | 8.80 | 8.54 | 1.5 |
| 6 | 1.73 | 1.68 | 1.65 | 2.4 |
| 7 | 0.59 | 0.55 | 0.63 | 6.8 |
| 8 | 3.62 | 3.54 | 3.58 | 1.1 |
| Средний коэффициент вариации (M±m), % | 3.6±0.8 |
Проводили сравнение результатов определения концентрации sFas в сыворотке и плазме крови онкологических пациентов с использованием сэндвич-ИФА на основе МА SA-7 и SA-8.
Таблица 4. Сравнительные результаты определения концентрации sFas в сыворотке и плазме крови онкологических больных в сэндвич-ИФА на основе МА SA-7 и SA-8
| Тип образца | Концентрация sFas, нг/мл | Коэффициент вариации, % | |
| Сыворотка | 4.28 | 4.30±0.06 | 1.3 |
| EDTA-плазма | 4.36 | ||
| Гепарин-плазма | 4.25 |
Из данных таблицы 4 видно, что разработанный нами сэндвич-ИФА дает близкие результаты определения концентрации sFas как в сыворотке, так и в плазме крови человека, при этом метод приготовления плазмы не влияет на результаты определения концентрации.
Определяли, насколько полно разработанный нами сэндвич-ИФА выявляет sFas в сыворотке крови, для этого в сыворотку, в которой первоначально не был выявлен sFas, вносили различные количества Fas и определяли его концентрацию, затем сравнивали определяемый показатель концентрации Fas в сыворотке с ожидаемой величиной. Результаты данных экспериментов отражены в таблице 5.
Таблица 5. Сравнительные результаты выявления привнесенного в сыворотку крови Fas
-
Концентрация добавленного Fas, нг/мл
% выявления добавленного Fas
9.0
86, 98, 93
6.0
88, 105, 99
3.0
87, 118, 113
1.5
102, 112, 95
0.8
105, 95, 98
Средний % выявления Fas
99.6
