В. И. Емельянов Введение. Задачи и методы физико-химического анализа. Диаграммы систем «состав свойство». Независимый компонент. Фаза. Правило фаз. Фазовые переходы. Основные принципы анализа
| Вид материала | Документы |
- Вопросы к экзамену по аналитической химии для студентов химического отделения физико-химического, 46.33kb.
- А. С. Аронин Фаза. Стабильное состояние. Метастабильное состояние. Потеря устойчивости., 47.99kb.
- Учебно-тематический план современные методы физико-химического анализа Цель, 66.45kb.
- Курсовая работа по курсу " Химия и физико химические методы анализа" на тему " Методы, 218.07kb.
- Рабочая программа по дисциплине ен. Ф. 07 «Аналитическая химия и физико-химические, 223.14kb.
- Лекция: Унифицированный язык визуального моделирования Unified Modeling Language (uml):, 182.61kb.
- Контрольная работа По дисциплине физико-химические свойства и методы контроля качества, 77.41kb.
- Программа курса «электрохимические методы анализа», 20.91kb.
- Системный анализ и моделирование, 47.68kb.
- Системный анализ и моделирование, 61.37kb.
 30 а в а1
30 а в а120 КС1ТВ. NaC1
10 Е2
0 А а2 в1 0 А лёд NaC1.2H2O
-15 Е Е1
7% 26% 22,4% 26,4%
Н2О масс.% КС1 Н2О масс.% NaCl
Рис.2. Диаграммы растворимости систем КС1 – H2O и NaC1 - H2O.
Кривая растворимости (рис.2) в системе КС1 – Н2О состоит из 2-х ветвей: ветви 0Е кристаллизации льда и ветви ЕВ кристаллизации КС1. Точка 0 отвечает кристаллизации льда из чистой воды. Кривая АЕ отображает зависимость между температурой и концентрацией соли в растворе, находящейся в равновесии со льдом. Кривая ЕВ отвечает условиям равновесия раствора с безводным КС1. Кривая не доведена до конца, т.к. при 1атм. не существует раствора с большей концентрацией хлорида калия при данной температуре.
Рассмотрим пути кристаллизации отдельных растворов КС1 при охлаждении и изотермическом испарении.
При охлаждении раствора состава а (7% при 30оС) фигуративная точка а будет перемещаться вниз по вертикали до пересечения с кривой кристаллизации льда АЕ. В точке а2 начнётся выделение льда. При дальнейшем охлаждении фигуративная точка а2 будет перемещаться вниз по кривой насыщения до эвтонической точки Е. Отрезок а2Е на ветви кристаллизации льда будет изображать изменение концентрации раствора с изменением (понижением) температуры. В нонвариантной точке Е температура и состав раствора останутся постоянными вплоть до исчезновения последней капли жидкости.
При охлаждении раствора с фигуративной точкой в, она будет перемещаться вниз и в точке пересечения с кривой насыщения хлористого калия в1 начнётся выделение твёрдого КС1. Отрезок в1Е на ветви кристаллизации хлористого калия изображает изменение концентрации раствора с понижением температуры. В точке Е начинается выделение льда на фоне продолжающееся кристаллизации хлористого калия.
При изотермическом испарении раствора состава отвечающего точке а концентрация КС1 будет повышаться и фигуративная точка а будет перемещатся по горизонтали до пересечения с кривой растворимости КС1 в точке а1. В этой точке раствор будет насыщен КС1 и находится в равновесии с кристаллами хлорида калия. Дальнейшее испарение раствора будет сопровождаться выделением всё большего количества КС1. Состав жидкой фазы в этой точке
останется постоянным, равным 26% хлористого калия до полного высыхания раствора KC1.
Кривая растворимости системы NaC1- H2O имеет 3 ветви кристаллизации. АЕ1 – кристаллизация льда; Е1Е2 – кристаллизация NaC1.2H2O; E2B – кристаллизация NaC1.
Н
 а фазовой диаграмме системы Na2SO4 – H2O, (рис.3) показаны фазовые равновесия стабильного Na2SO4. 10H2O и метастабильного кристаллогидрата Na2SO4. 7H2O:
а фазовой диаграмме системы Na2SO4 – H2O, (рис.3) показаны фазовые равновесия стабильного Na2SO4. 10H2O и метастабильного кристаллогидрата Na2SO4. 7H2O:
ТоС
L+ Na2SO4



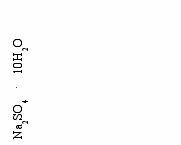 35 - р Na2SO4 . 10H2O+Na2SO4
35 - р Na2SO4 . 10H2O+Na2SO4


 - L р1
- L р1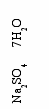 -
-
 - Лёд+ L L+ Na2SO4 . 7H2O
- Лёд+ L L+ Na2SO4 . 7H2O

 0 Е Е1
0 Е Е1 -20 . . лёд+ Na2SO4. 10H2O . .H2O 5 15 25 мол.% 35 45 Na2SO4
Рис. 3. Фазовая диаграмма системы Na2SO4 - H2O
Na2SO4+ 10H2O Na2SO4 . 10H2O
Na2SO4 + 7H2O Na2SO4 . 7H2O
Оба кристаллогидрата термически не устойчивы и при температуре выше 24оС разлагаются:
Na2SO4. 10H2O(кр.) Na2SO4(кр.) + раствор (32,4оС)
Na2SO4. 7H2O(кр) Na2SO4(кр.) + раствор (24оС)
Метастабильный кристаллогидрат Na2SO4. 7H2O может переходить в стабильную форму самопроизвольно.
Na2SO4 . 7H2O(тв.) Na2SO4 . 10H2O + Na2SO4
Получить кристаллогидраты можно кристаллизацией, с последующим фильтрованием, из охлаждённых насыщенных растворов, соответствующих по составу линиям ликвидуса Ер или Е1р1, ограничивающих двухфазные области Na2SO4 10H2O(тв.) + L и Na2SO4 .7H2O(тв.) + L. Из диаграммы видно, что при увеличении температуры выше 32,4о в равновесии с раствором находится безводный сульфат натрия, который можно выделить фильтрованием насыщенных растворов входящих в область их существования.
