В. И. Емельянов Введение. Задачи и методы физико-химического анализа. Диаграммы систем «состав свойство». Независимый компонент. Фаза. Правило фаз. Фазовые переходы. Основные принципы анализа
| Вид материала | Документы |
- Вопросы к экзамену по аналитической химии для студентов химического отделения физико-химического, 46.33kb.
- А. С. Аронин Фаза. Стабильное состояние. Метастабильное состояние. Потеря устойчивости., 47.99kb.
- Учебно-тематический план современные методы физико-химического анализа Цель, 66.45kb.
- Курсовая работа по курсу " Химия и физико химические методы анализа" на тему " Методы, 218.07kb.
- Рабочая программа по дисциплине ен. Ф. 07 «Аналитическая химия и физико-химические, 223.14kb.
- Лекция: Унифицированный язык визуального моделирования Unified Modeling Language (uml):, 182.61kb.
- Контрольная работа По дисциплине физико-химические свойства и методы контроля качества, 77.41kb.
- Программа курса «электрохимические методы анализа», 20.91kb.
- Системный анализ и моделирование, 47.68kb.
- Системный анализ и моделирование, 61.37kb.
 ТА L+
ТА L+ + гетерогенная смесь твёрдых растворов
 A B
A BРис.12. Диаграмма состояния ограниченных твёрдых растворов с перитэктикой
Оно заключается в растворении ранее выпавших кристаллов твёрдого раствора в расплаве определённого состава, в результате чего образуются кристаллы твёрдого раствора : L(p)+ (n)<=> (m).
Превращение в ходе охлаждения происходит в пределах протяжённости перетектической горизонтали рn.
Диаграммы состояния 2-х компонентных систем с образованием
химических соединений. Конгруэнтное и инконгруэнтное плавление.
В случае образования в 2-х компонентной системе А – В химического соединения АХВу, диаграмма ликвидуса состоит из 3-х кривых, соответствующих кристаллизации 3-х фаз: А, АХВу и В. Их расположение на диаграмме зависит от состава химического соединения. Если в равновесной системе, при температуре плавления соединения твёрдая и жидкая фазы имеют одинаковый состав, то такое плавление называется конгруэнтным АХВу(S)<=>xА(L) + yВ(L). Если при плавлении соединение распадается на жидкую и твёрдую фазы, состав которых отличается от состава первоначального соединения, то такое плавление называется инконгруэнтным. В этом случае состав жидкой фазы не совпадает с составом твёрдой фазы, из которой образовалась жидкость.
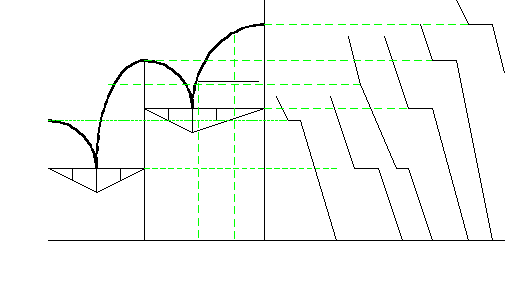
Рассмотрим фазовую диаграмму конгруэнтно плавящегося соединения АхВу. Прибавление компонентов А или В к этому соединению понижает его температуру плавления. Кривая ликвидуса Е1МЕ2 на диаграмме имеет максимум М, отвечающий температуре плавления соединения, рис. 1. Систему с одним конгруэнтно плавящимся соединением можно рассматривать, как состоящую из 2-х двойных диаграмм плавкости с простой эвтектикой, рис.1.
На диаграмме 6 фазовых полей: 1 - жидкая фаза (Ж), 2 – Ж + кристаллы А (кр.А), 3 - Ж + кр. АхВу , 4 – Ж + кр.В, 5 – кр.А + кр.АхВу, 6 – кр.В + кр.АхВу .

 Т 1 f ТВ В
Т 1 f ТВ В М 4 N АхВу
N c f* d
ТА 3 Е2 А Е2
2
Е1 Е1
5 6
время
А АхВу c’ f’ В
Рис.1. Диаграмма плавкости 2-х компонентной системы с образованием химического соединения (конгруэнтное плавление).
Анализируя кривые охлаждения видим: вначале кристаллизуется компонент А, затем эвтектика Е1 и первичное появление новой фазы АхВу. Со стороны компонента В – первичная его кристаллизация, затем эвтектика Е2 и образование новой фазы АхВу. Состав смеси в точке f находят, проводя канноду сd и вертикаль до пересечения с осью составов в точке f1. Различные точки состава на ликвидусе показывают состав смеси при различных температурах.
Относительные количества различных фаз, например, в точке f на конноде сd , «жидкость+ кристаллы В» (поле 4), определяют по правилу рычага. Относительные количества фаз обратно пропорциональны расстоянию, определяющему состав точки по оси составов системы к суммарному составу системы. При данной температуре Тd доля жидкости в точке f определяется соотношением f’В : Bc’; доля твёрдой фазы В – отношением f ‘c’: Вс'. Поскольку доля расплава с понижением температуры уменьшается, соответственно меняется и состав жидкой фазы, увеличивается доля компонента В.
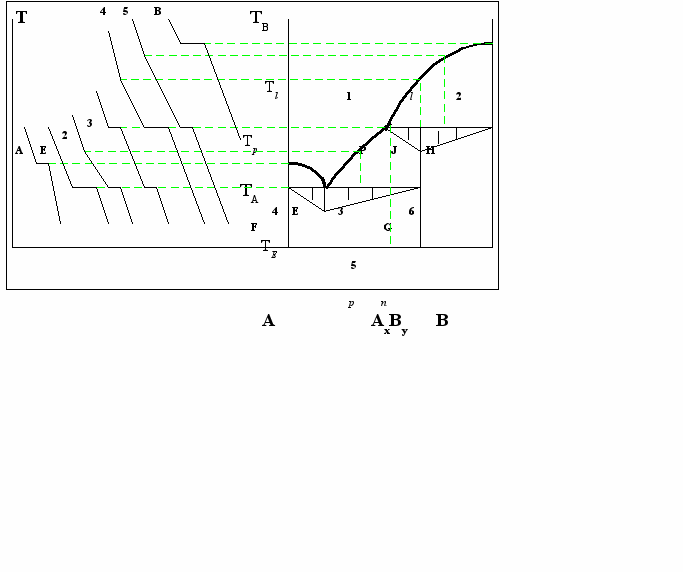
Рис.2.Диаграмма плавкости и кривые охлаждения для различных сплавов 2-х компонентной системы с образованием химического соединения (инконгруэнтное плавление).
Соединение АхВУ на диаграмме, рис.2, плавится инконгруэнтно при ТР. При этом образуется твёрдая фаза другого состава ВН, и жидкая фазы состава р, которая отличается от состава плавящегося вещества: АхВУ <=> BH + LР.
Состав соединения Ах Ву или состав сосуществующих фаз, выражается
точкой J на канноде РН. НJ – количество жидкости; РJ – количество твёрдой фазы. С компонентом А соединение Ах Ву даёт эвтектику Е; соединение выделяется по линии ЕР. Выше линии РН, выделяется компонент В.
Процесс инконгруэнтного плавления называется перетектическим, точка Р – нонвариантная точка т. к. в ней существуют 3 фазы: В, АхВу и жидкая фаза. Она называется перетектической, поскольку этот состав жидкости не может быть получен из определённых количеств твёрдых фаз (компонентов), т.к. состав Р не лежит между В и АхВу в отличии от эвтектического состава.
Фаза АхВу кристаллизуется первой при охлаждении расплавов в интервале температур ТР - РЕ. Состав самого соединения, однако, отделён от поля кристаллизации, что отличает этот случай от систем с конгруэнтно плавящимися соединениями, где состав АхВу лежит внутри области кристаллизации для которой АхВу - первичная фаза.
Рассмотрим процессы, которые протекают при охлаждении жидкости состава n. При достижении точки l начинает кристаллизоваться фаза В. С понижением температуры, образуется больше фазы В, а состав жидкости сдвигается от l к J. При ТР происходит перетектическая реакция Ж+кр.В =>Ж+кр.АхВу. В итоге фаза В превращается в фазу АхВу, а количество жидкости уменьшается. При дальнейшем понижении температуры до ТЕ процесс заканчивается и оставшееся количество жидкости состава Е кристаллизуется в виде смеси АхВу и А. Перетектическая реакция образования при ТР фазы АхВу происходит в этих составах между всем количеством расплава и частью кристаллов В. При дальнейшем охлаждении кр.В и АхВу сосуществуют без изменений.
На диаграмме 6 фазовых полей: 1 - жидкая фаза (Ж), 2 – Ж + кристаллы В (кр.В), 3 - Ж + кр. АхВу , 4 – Ж + кр.А, 5 – кр.А + кр.АхВу, 6 – кр.В + кр. АхВу .
Состав инконгруэнтно плавящего соединения и положение точки р можно установить при помощи треугольника Таммана. Продолжительность перетектической остановки - наибольшая у сплава состава n и равна нулю у сплава состава точки Р и у компонента ВH.
Структура сплавов от F до Е состоит из первичных кристаллов компонента А и эвтектики; от точки Е до точки G – из эвтектики и кристаллов АхВу. Кристаллы компонента А и АхВу будут более крупными на фоне мелкокристаллической эвтектики. Сплавы от точки Р до точки H – состоят из кристаллов компонента В на фоне затвердевшей жидкости. Перетектическая реакция протекает полностью: LP + BH => АхВу.
При образовании инконгруэнтно плавящихся соединений, могут возникать неравновесные процессы. Это связано с медленно протекающими реакциями жидкости с кристаллами (большой плотности), которые быстро осаждаются на дно реакционного сосуда. В некоторых случаях при быстром охлаждении жидкие фазы не успевают кристаллизоваться, что приводит к образованию стекол. Последние по существу представляют собой переохлажденные жидкости.
Равновесие в водно – солевых системах. Двухкомпонентные системы.
Растворимость и взаимодействие твёрдых веществ в жидких растворителях – частный случай диаграмм плавкости, в которых один из компонентов жидкая фаза, которая имеет температуру плавления намного ниже температуры плавления других компонентов. Диаграмма растворимости характеризует состояние равновесия между несколькими фазами, из которых, по меньшей ме-
ре одна является жидкой. Обычно изучение растворимости осуществляют при температурах 0 – 100оС. Изучение растворимости, как и в случае диаграмм плавкости, позволяют выяснить характер взаимодействия компонентов, а так же судить о химическом составе и границах существования фаз при различных условиях.
Одной из главных особенностей двойных систем соль – вода является отсутствие твёрдых растворов на основе льда (исключение NH4F) и твёрдых растворов воды в солях и гидратах. При атмосферном давлении водные растворы солей не расслаиваются на две фазы. Вместе с тем, водные системы усложняются образованием гидратов различного состава, полиморфных и метастабильных состояний.
В равновесных системах соль – вода переменными параметрами являются: концентрация, давление пара над раствором и температура.
Связь между этими параметрами может быть представлена в системе координат в пространстве трёх измерений, где по соответствующим осям откладываются значения концентрации, давления и температуры. Однако, внешнее давление, чаще всего принимается постоянным (1 атм.) и диаграмма принимает плоский вид отражающий связь между температурой (ось абсцисс )и концентрацией (ось ординат). Концентрацию обычно выражают в весовых процентах или в мольных долях.
Диаграммы растворимости систем соль - вода можно представить тремя простейшими видами:
- образование безводной соли;
- образование гидрата конгруэнтно растворимого;
- образование гидрата инконгруэнтно растворимого.
Буквами V, L, S обозначены области существования пара, жидкости и твёрдого вещества. Поле V от поля V+L отделяет кривая кипения. В случае нелетучей соли, эта кривая показывает зависимость температуры кипения от состава раствора. Температура кипения увеличивается с ростом концентрации соли А. Состав пара при этом постоянен, содержит только воду. На диаграмме 1а кривая растворимости состоит из 2-х ветвей. Кривая оЕ соответствует растворимости льда и cЕ – компонента А в указанных условиях.










T
V c V c V c
L L+SA х1* х2* SA L SA L
о
E2 L+
L+Sо L+Sо L+SA L+Sо SA.H2O
E E1 E
Sо + SA Sо + SA.Н2О SA.Н2О+SА Sо + SA.Н2О SА.Н2О+SA
a a1 a2




 oC
oC 1
 00o
00o





 0oC
0oC


 -oC
-oCН2О а А Н2О SA.nH2O А Н2О SA .nH2O А
Рис.1.Диаграммы растворимости двойных водносолевых систем: а – образование безводной соли, в – образование кристаллогидрата конгруэнтно растворимого,
с – образование кристаллогидрата инконгруэнтно растворимого.
Точка Е эвтоника (криогидратная точка) соответствует нонвариантной смеси четырёх фаз: кристаллов соли А, льда, насыщенного раствора соли и пара при постоянном давлении (с=2 – 4 + 2 = 0). Строго говоря, равновесие здесь моновариантно (с=2 – 4 + 3 = 1), но т.к. давление было принято постоянным, то нельзя изменить ни одного из параметров без того, чтобы не исчезла, по крайней мере, одна фаза. Так если повысить температуру системы, то лёд расплавится, а соль растворится. При понижении температуры ниже эвтектической исчезнет жидкая фаза.
Э
 втоника характеризуется координатами: концентрации компонента А, масс.% и конкретной температурой. Если взять раствор с концентрацией соли - а, масс.% , то при охлаждении его фигуративная точка х, передвигаясь параллельно оси температур, попадёт на кривую кристаллизации воды оЕ; в этот момент начнётся выделение льда и фигуративные точки составов растворов равновесных со льдом, будут двигаться по линии оЕ в сторону эвтоники Е с концентрацией соли а1. Если взять фигуративную точку х2 с содержанием соли в растворе а2 > а1 , то в первую очередь будет выделяться соль А и затем, при температуре эвтоники Е, начнётся кристаллизация эвтонического раствора с выделением льда.
втоника характеризуется координатами: концентрации компонента А, масс.% и конкретной температурой. Если взять раствор с концентрацией соли - а, масс.% , то при охлаждении его фигуративная точка х, передвигаясь параллельно оси температур, попадёт на кривую кристаллизации воды оЕ; в этот момент начнётся выделение льда и фигуративные точки составов растворов равновесных со льдом, будут двигаться по линии оЕ в сторону эвтоники Е с концентрацией соли а1. Если взять фигуративную точку х2 с содержанием соли в растворе а2 > а1 , то в первую очередь будет выделяться соль А и затем, при температуре эвтоники Е, начнётся кристаллизация эвтонического раствора с выделением льда. Примером соли, которая не образует кристаллогидрат, является хлорид калия, рис.2.














ТоС ТоС
40 L В L В



