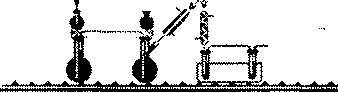Нітратна кислота та її властивості
| Вид материала | Урок |
- Урок вивчення нового матеріалу, 88.8kb.
- Реферат на тему: Азот, азотна кислота, 51.18kb.
- Витамины (от лат vita жизнь), низкомолекулярные органические соединения различной химической, 518.58kb.
- Реферат на тему: Азотная кислота Содержание, 87.78kb.
- Будова й властивості твердих тіл. Кристалічні й аморфні тіла. Анізотропія кристалів., 92.38kb.
- Загальна програма з математики для підготовки до тестування на 2-ий курс радіофізичного, 24kb.
- Програма вступного іспиту до аспірантури за спеціальністю 01. 01. 02 Диференціальні, 57.6kb.
- Курсовая работа " Азотная кислота", 38.26kb.
- Курсовая работа " Азотная кислота", 44.11kb.
- Чиста нитратна кислота hno -безбарвна рідина густиною 1,51 р/см при 42 °С застигаюча, 68.44kb.
Нітратна кислота та її властивості
Мета уроку: на прикладі нітратної кислоти поглибити знання учнів про властивості кислот та їх якісні реакції; вивчити особливі властивості НМО3 та її значення в житті людини.
Обладнання: концентрована нітратна кислота, індикатори, колекції нітратів, мідь, Н2О4; таблиці «Виробництво нітратної кислоти» та «Виробництво амоніаку».
Хід уроку
І. Організаційний момент
Привітання, вступ до теми.
Учитель. Нітроген, ніби давнє божество Янус, має два обличчя: мирне та войовниче. З мирним його застосуванням пов'язаний урожай наших полів, оскільки чверть усього продовольства на нашій планеті здержують лише завдяки хімічним добривам.
Родючі грунти тримаються на трьох елементах — Р, К, N. але сполуки Нітрогену з грунту завжди вимиваються швидше, і тому відновлювати їх теж слід у першу чергу.
Виробництво добрив гальмується дефіцитом енергії. За наявності дешевої енергії стане можливим плазмохімічний спосіб одержання нітратної кислоти прямо з повітря.
Нітратна кислота — головна по цінності сполука Нітрогену. Це і джерело добрив, і сировина для виробництва пороху, вибухових речовин, одержання ряду інших кислот, а також лікарських препаратів тощо. Ось така чудова нітратна кислота.
Наприкінці уроку ми повинні відповісти на питання:
- Чому нітратна кислота — найцінніша сполука Нітрогену?
- Про які нові властивості кислот ми дізналися під час вивчення
нітратної?
Перш ніж ми перейдемо до безпосереднього вивчення властивостей нітратної кислоти, давайте повторимо вивчений раніше матеріал.
II. Актуалізація опорних знань
1. Робота за картками
а) Напишіть чотири рівняння, що описують способи одержання амоніаку.
б) Складіть рівняння реакцій, що характеризують властивості Нітрогену.
в) Напишіть три рівняння реакцій розкладання солей амонію: сульфату, хлориду, карбонату.
г) Амоній гідрогенкарбонат використовується у процесі випікання кондитерських виробів. На якій властивості цієї речовини це грунтується?
2. Задача (на переносній дошці)
Скільки нітратної кислоти (за масою) утворюється при взаємодії 69г нітроген(ІV) оксиду з водою?
З Nо2+ Н20 = 2НNO3+ N0
138 г 126 г
х = 63 (г)
3. Експериментальна частина
(учнівський експеримент)
У трьох пробірках (№ 1, 2, 3) містяться:
- хлоридна кислота;
- сульфатна кислота;
- нітратна кислота.
Визначте за допомогою досліду, яка кислота в якій пробірці міститься.
Розв'язок
З кожної пробірки відлити проби, у кожну капнути ВаС12. Випав осад. Це — сульфатна кислота — Н2SО4.
Ва+2+SО2=ВаSО4
Взяти решту пробірок і додати до кожної розчин АgNО3. Випадає осад АgСl — це хлоридна кислота.
У третій пробірці залишилася НNO3 (за методом виключення).
4. На дошці
а) Здійсніть перетворення: N2 -> NН3 -> N0 -> N02 -> НN03
б) Напишіть на дошці рівняння реакцій, в яку буде вступати нітратна кислота (ґрунтуючись на загальних властивостях кислот).
HNO3=H++NO3-
НNO3+Ме->?
2НN03 + СuO -> Сu(NO3)2+ Н20
 2НNО3+Сu(ОН)2 = Сu(NO3)2+2Н2О
2НNО3+Сu(ОН)2 = Сu(NO3)2+2Н2О2НNО3 +СаС03 = = Са(NO3)2+Н20+СО2
III. Фронтальна бесіда
- Дайте визначення класу кислот
з точки зору теорії електролітичної дисоціації (рівняння).
- Як саме класифікують кислоти:
- одноосновні(приклад);
- двохосновні(приклад);
- трьохосновні(приклад)?
3. Які загальні фізичні властивості
кислот вам відомі та як їх пояснити?
• Кислі (аналіз за допомогою індикатора), розчинні, однаково діють на індикатори.
4. Які хімічні властивості кислот ви знаєте? Назвіть їх.
Взаємодія:
- з металами (продукти);
- з оксидами металів (продукти);
- з гідроксидами (продукти);
- із солями (продукти).
Назвіть умови реакції обміну.
- Назвіть особливості властивостей сульфатної кислоти.
- Назвіть загальні наукові принципи хімічних виробництв на прикладі виробництва сульфатної кислоти та амоніаку.
- Детальніше опишіть процес синтезу амоніаку.
Учитель збирає роботи за картками, перевіряє виконання завдання на дошці, оголошує результати перевірки.
IV. Вивчення нового матеріалу Розповідь учителя
Однією з кислот, що відома з давніх-давен, є нітратна кислота. Про те, хто, де й коли відкрив її, ми вже не дізнаємося ніколи. Уже в XII ст. арабські хіміки знали спосіб її одержання з мідного купоросу, а селітри з додаванням Галунів. У цей спосіб чисту нітратну кислоту одержували протягом восьми століть аж до початку минулого століття. Читаючи опис методу, поданий у традиційній алхімічній формі, майте на увазі, що це було в першій половині XVII ст.
«Спершу слід виготувати із заліза людину з двома довгими носами на голові та з ротом на маківці, який можна відкривати та знову щільно закривати. До кожного носу голови слід приєднати по скляній посудині для збирання парів, що піднімаються з розпеченого шлунка залізної людини».
Учитель записує на дошці: Н25О4 + 2КМО3 = 2НМО3 + К25О4
Які ознаки хімічної реакції бачимо? 4НМО3 — ІІ+4МО, + 2Н20 + О2
Електронна H _O _ N
формула
Виробництво нітратної кислоти
Самостійна робота за підручником (Фельдман Ф. Г, Рудзитис Г. Г. Химия. 9 кл.: Учебник.— М.: Просвещение, 1990; с. 57, рис. 21).
4мн3 + зо2 = 4ж> + бн2о + д
02+4е-»2СГ2|5|20[
Питання (до тексту на с. 58):
- Що відбувається в контактному
апараті? Які необхідні умови?
(Каталізатор)
- Як відбувається поглинання КО2
в башті? У чому подібність до по
глинання сульфатного ангідриду?
Властивості нітратної кислоти
- Фізичні властивості нітратної кис
лоти: рідина, температура кипіння
84 °С, замерзання -- 41,5 °С, має
запах, добре розчиняється.
- Хімічні властивості нітратної
кислоти:
а) дисоціація НМ03 ± Н+ + N0;
б) узаємодія з металами.
Взаємодіє майже зі всіма металами, з багатьма неметалами та органічними сполуками. З металами поводиться по-різному, залежно від активності металу та міцності кислоти. Захоплюючи електрони, Нітроген стає чотири-, три-, два- та однозарядним. Водень при взаємодії з металами ніколи не виділяється. Концентрована нітратна кислота не реагує із залізом, хромом, алюмінієм (пасивний стан), отже, концентровану нітратну кислоту можна зберігати в залізній або алюмінієвій тарі. Але варто лише додати туди води, як починається реакція й не залишається ні кислоти, ані металевої оболонки, в якій вона містилася. А суміш одного об'єму Н1ЧО3 та трьох об'ємів НС1 називається царською горілкою. Вона окиснює практично всі речовини органічного та неорганічного походження. У такий спосіб можна розчинити золото і платину. Датський учений Нільс Бор у 1943 р. під час окупації території Данії німецькими фашистами вимушений був залишити батьківщину і, щоб врятувати Нобелівську медаль, розчинив її у царській горілці, а після повернення за допомогою методу електролізу виділив золото та замовив собі нову медаль.
Нітратна кислота — дуже сильний окисник, що сприяє одержанню маси нових хімічних сполук.
Інформація за таблицею.
Демонстраційний дослід: взаємодія НМО3 з Си.
Си+4НН03=Си(М03)2+2Н20+2Н02Т
Си°-2е--»Си+2 ЗСи+8Ш03=ЗСЬ(ї403)1 + 4Н20+21«)Т
Си°-2е--»Си+2 3 6
Висновок. Поява бурого газу ТЧО2 — якісна ознака нітратної кислоти.
Реакції НМ03:
1) з оксидами металів (використати приклад на дошці):
СІЮ + 2НМО3 = Си (Ж>3 \ + Н2О + =Си+2+Н2О
2) з основами:
2БҐ +Си(ОН)2 = Си+2 +2Н2О
3) із солями слабких кислот:
2Н+ + СаСО3 = Са+2 + Н2О+СО2Т Особливі властивості:
а) розкладання:
№N03 ->2Н20+4М02 +02
б) взаємодія з неактивними метала
ми;
в) ксантопротеїнова реакція (демон
страція).
Висновок. Нітратна кислота — най-сильніший окисник, вона окиснює речовини органічного та неорганічного походження, майже всі метали, багато які з неметалів, що сприяє її широкому застосуванню, одержанню нових речовин: нітросполук, амінів, ароматичних нітросполук, білків, антибіотиків, барвників, інших кислот, у металургії — для травлення, у металокераміці.
Отже, чому ж нітратна кислота — найцінніша нітратна сполука?
V. Закріплення вивченого
матеріалу
При взаємодії розбавленої НН03 з магнієм утворюється нітроген(І) оксид. Напишіть рівняння окисно-відновної реакції.
VI. Підбиття підсумків.
Оцінювання
Сюрприз!
Солі нітратної кислоти — нітрати — також розкладаються з виділенням 02.
Дослід. На аркуші паперу малюється оцінка «12» насиченим розчином натрій нітрату. Підпалюється жевріючою скіпкою. Проявляється оцінка.
Нам за урок — 12.