Курсовая работа " Азотная кислота"
| Вид материала | Курсовая |
СодержаниеСтруктура азотной кислоты Безводная азотная кислота Дымящая азотная кислота Строение кислоты с МВС |
- Курсовая работа " Азотная кислота", 38.26kb.
- Реферат на тему: Азотная кислота Содержание, 87.78kb.
- Окислительные свойства азотной кислоты стр, 77.4kb.
- М. В. Ломоносова кафедра охт курсовой проект, 391.73kb.
- М. В. Ломоносова кафедра «Основы химических технологий» курсовой проект, 280.17kb.
- Разработка урока по химии в 9 классе на тему : «Азотная кислота,строение, свойства,, 38.4kb.
- Урок «Азотная кислота», 12.42kb.
- Курсовая работа Получение лимонной кислоты, 281.79kb.
- Реферат на тему: Азот, азотна кислота, 51.18kb.
- Витамины (от лат vita жизнь), низкомолекулярные органические соединения различной химической, 518.58kb.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ТВЕРСКОЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Факультет ______________________________
Кафедра________________________________
Курсовая работа
“Азотная кислота”
| | Выполнил: | студент Х-Б-Г факультета |
| | Курс: | 1 |
| Проверил: | Группа: | 16(2) |
| «_____»______________2001г. | Фамилия: | Лапшин Сергей |
Тверь - 2001г.
Содержание:
Содержание: 3
Структура азотной кислоты 4
Безводная азотная кислота 4
Дымящая азотная кислота 4
Строение кислоты с МВС 4
Нитроний-ион 5
Список литературы: 8
Структура азотной кислоты
Азотная кислота имеет tпл.=–41,6ºC, tкип=–82,6ºC. Её плотность составляет 1,552 г/см3. С водой смешивается в любых соотношениях, образуя азеотроп (68,4% по массе HNO3 tкип=121,9ºC)
В
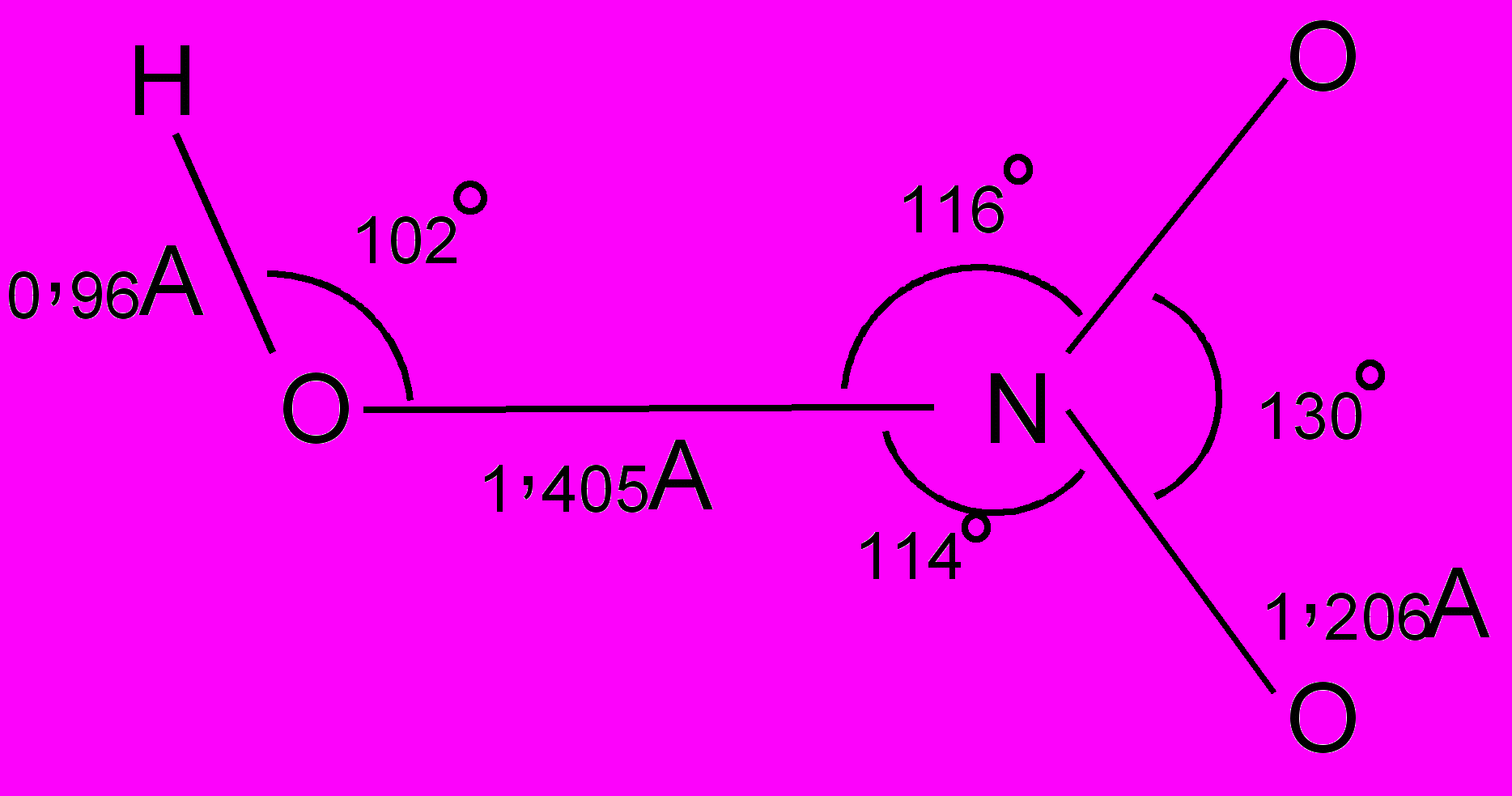
газовой фазе молекула азотной имеет плоское строение. Вращение группы ОН относительно NO2 затруднено. В целом молекулу можно изобразить следующим образом:
Безводная азотная кислота
Азотная кислота, не содержащая воды, является безводной. В ней протекают следующие равновесные процессы:
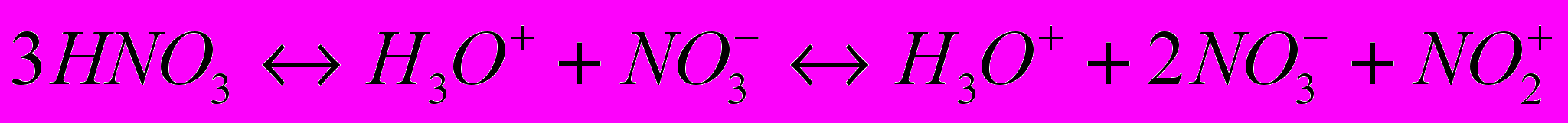
Чистая азотная кислота самоионизированна:
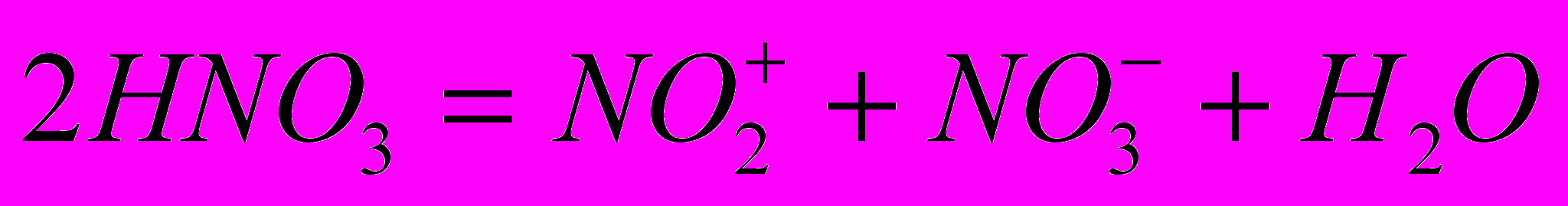 ,
, причем мольная концентрация каждого вида частиц равна 0,51 моль/ л при -10ºC. В твердом состоянии молекула кислоты представляет собой гидроксид нитрония:
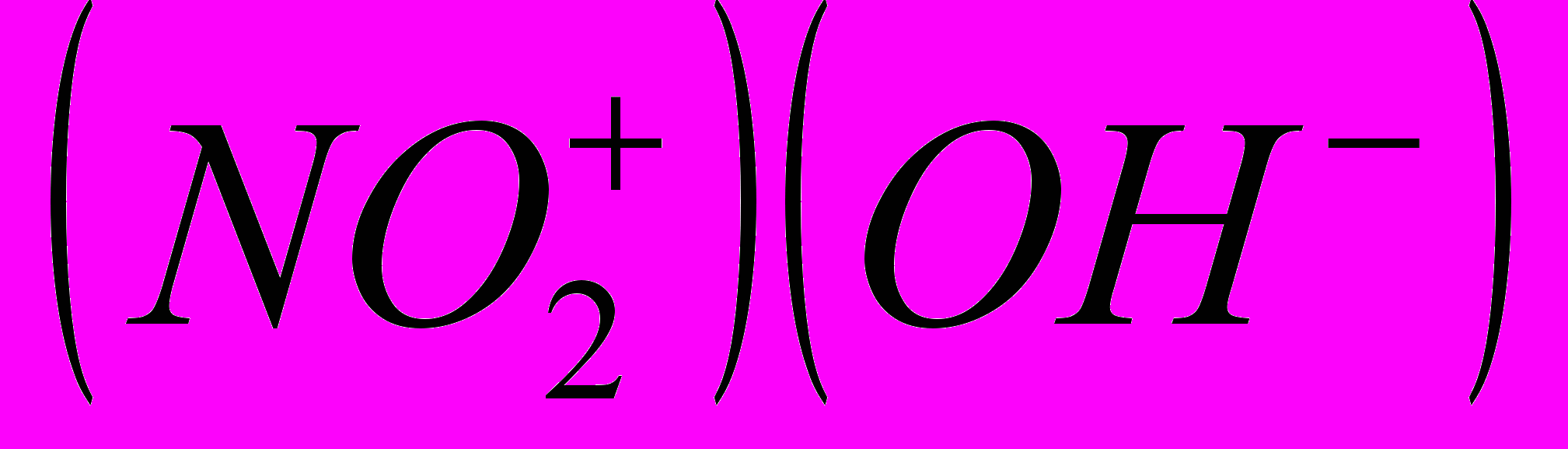 .Интерес представляет собой взаимодействие азотной и серной кислот:
.Интерес представляет собой взаимодействие азотной и серной кислот: .
.Отсюда видно, что азотная кислота амфотерна.
Дымящая азотная кислота
Азотную кислоту с концентрацией 97-99% часто называют дымящей. Дымящая азотная кислота при хранении разлагается:

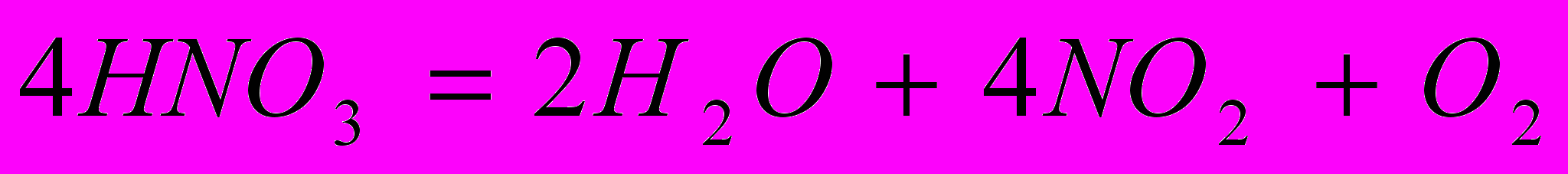
Дымящая азотная кислота - сильный окислитель. Она способна поджечь скипидар и другие органические вещества.
Строение кислоты с МВС
Рассмотрим строение азотной кислоты с позиции метода валентных связей. Для этого посмотрим, какие орбитали принимают участие в образовании молекулы этой кислоты.
Т
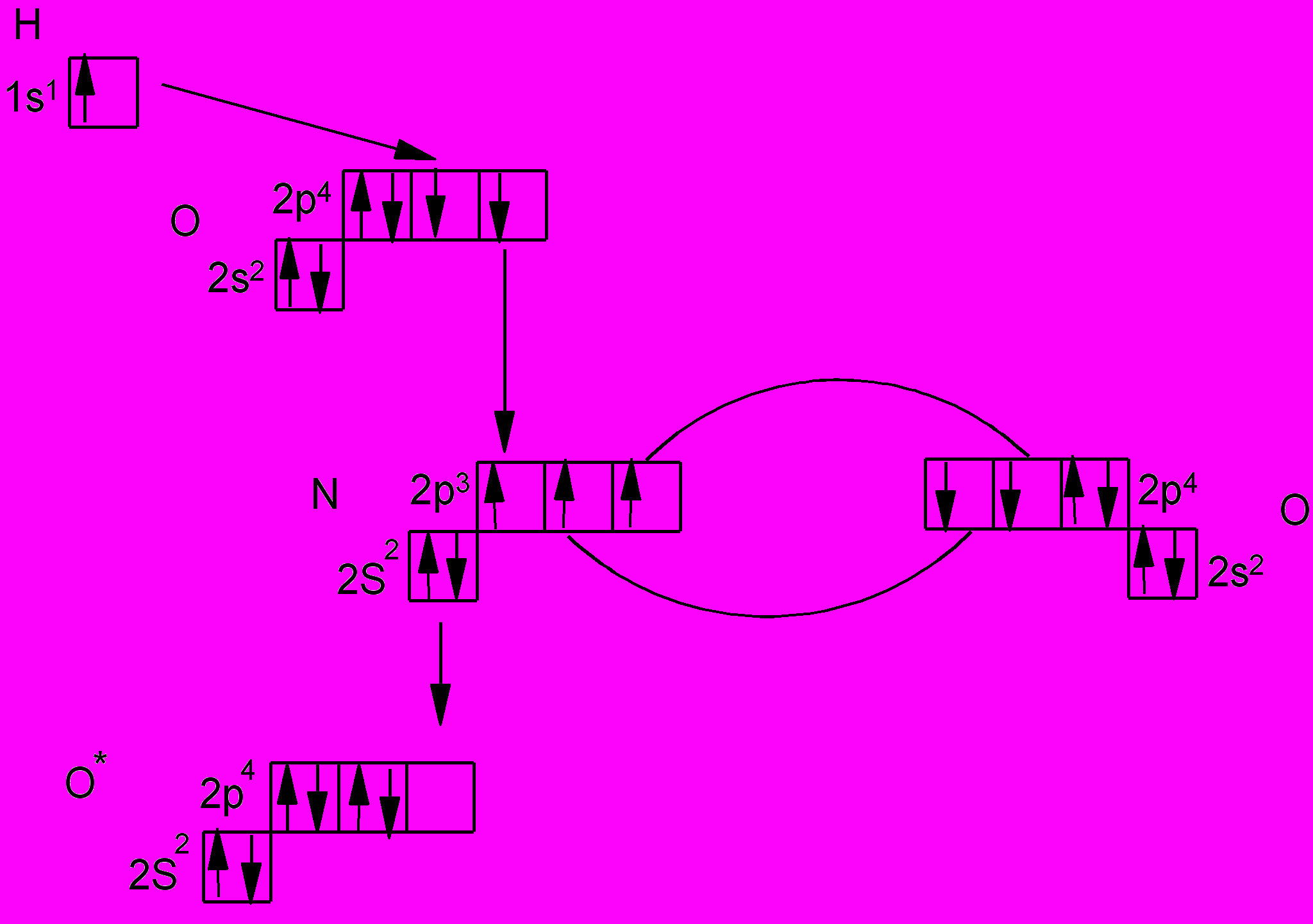
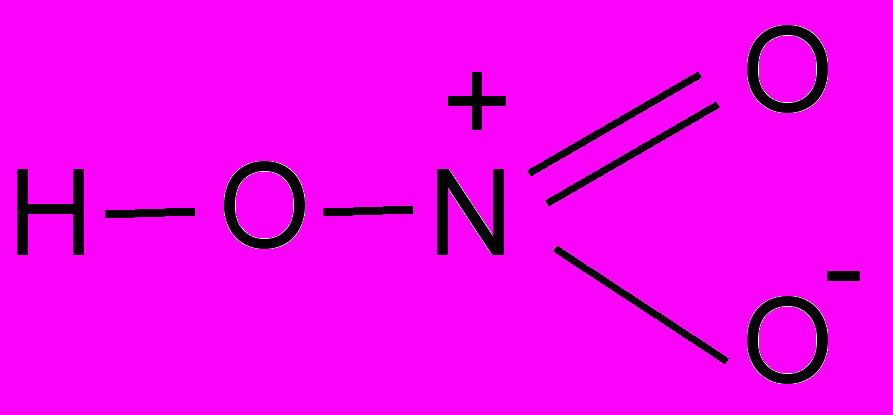
аким образом азотную кислоту можно представить в виде:
О
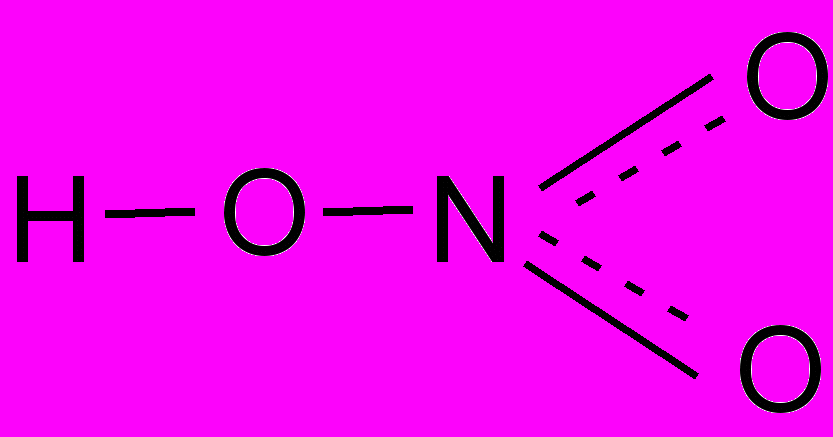
днако современные методы исследования показали, что строение кислоты таково:
Отсюда видно, что молекула азотной кислоты имеет делокализованные связи.
Нитроний-ион
Этот ион
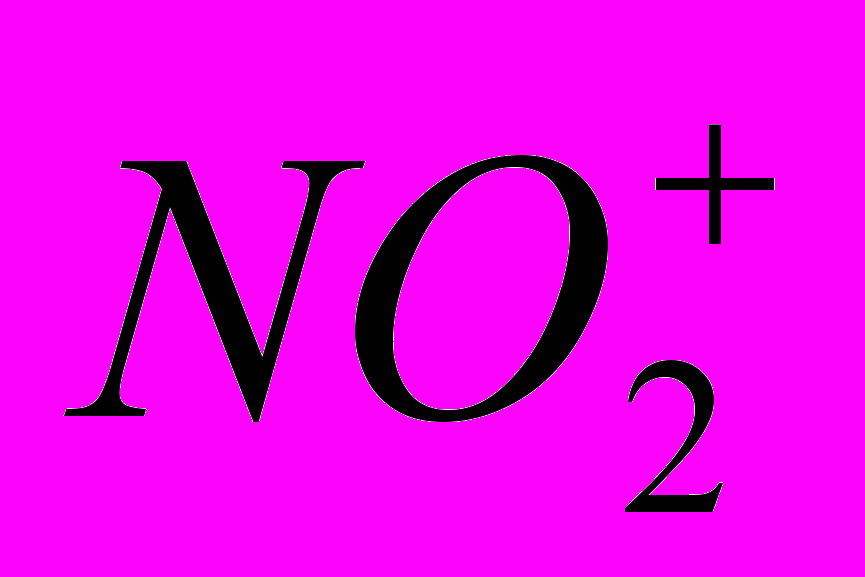 непосредственно возникает не только при ионизации самой азотной кислоты, но и в реакциях нитрования или в растворах окислов азота в этой кислоте и в других сильных кислотах.
непосредственно возникает не только при ионизации самой азотной кислоты, но и в реакциях нитрования или в растворах окислов азота в этой кислоте и в других сильных кислотах.Ранние физические измерения, выполненные известным ученым Ганчем, свидетельствовали об ионизации HNO3 в серной кислоте:
HNO3+2H2SO4=H3NO32++2HSO4-.
Поздние исследования, проведенные Хьюзом, Ингольдом и другими учеными, показали, что предложения Ганча не вполне верно. Так, скорость нитрования бензола возрастает в 1000 раз при переходе от 80%-ных к 90%-ным растворам H2SO4. Подобные кинетические данные по нитрованию в растворах серной кислоты, нитрометана, и ледяной уксусной кислоты были объяснены тем, что атакующей частицей является - ион:



Важность ионизации первого типа подтверждается тем, что добавление ионизированных нитратов к реакционной смеси замедляет реакцию. Процесс нитрования можно представить в виде:
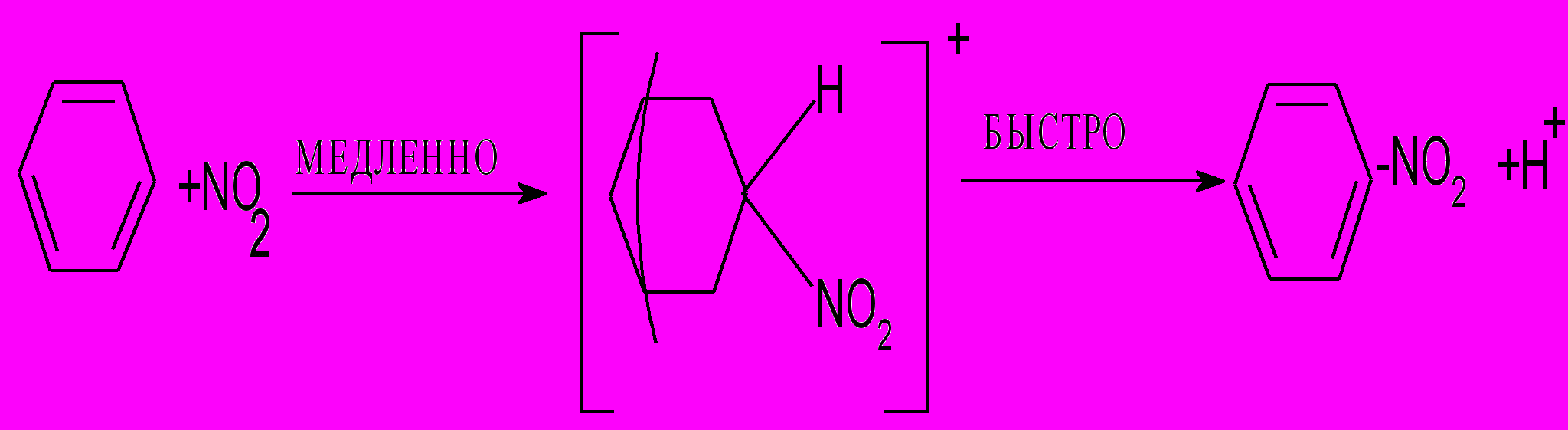
О
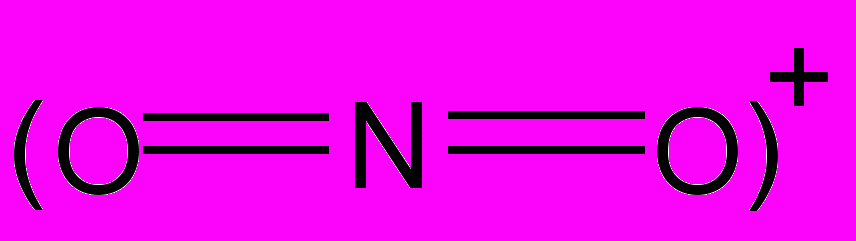
кончательным подтверждением существования ионов нитрония явилось выделением солей нитрония. Соли содержат линейный катион:
Длина связи N-O составляет 110 пм. Выделение солей нитрония происходит следующим образом:
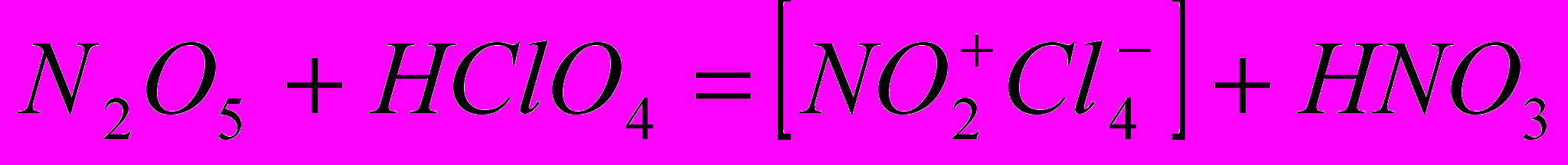 | (1) |
 | (2) |
 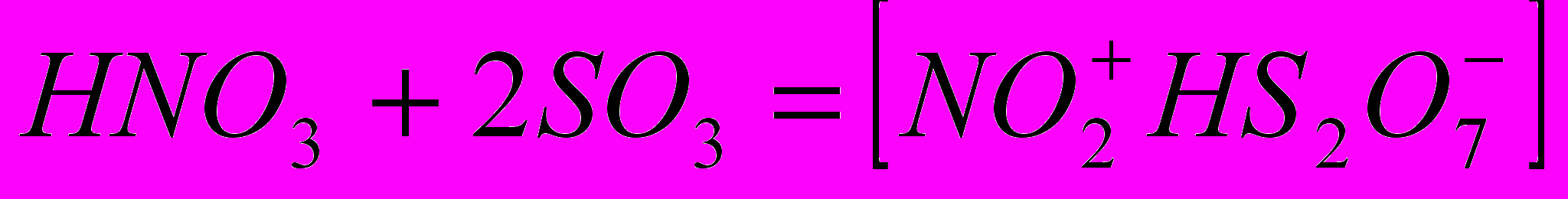 | (3) |
Реакции (1) и (2) представляют собой, в действительности, просто реакции обмена, поскольку N2O5 в твердом состоянии и в растворе безводных кислот существуют в виде ионов
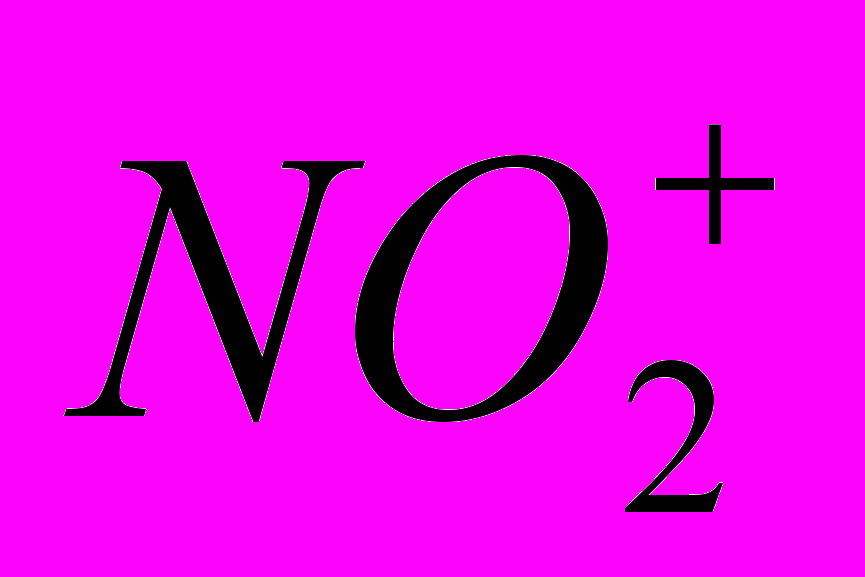 и
и 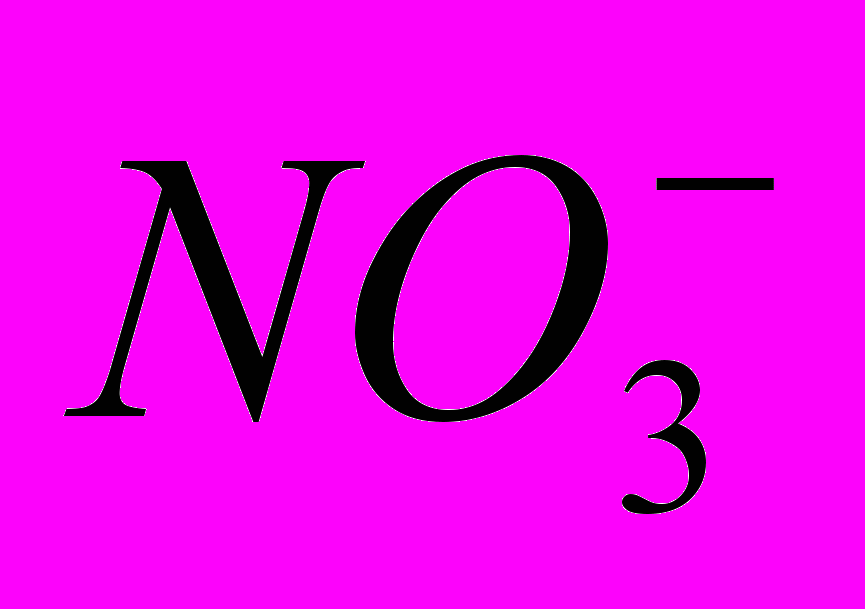 . Реакция (3) представляет собой реакцию ангидрида кислоты
. Реакция (3) представляет собой реакцию ангидрида кислоты 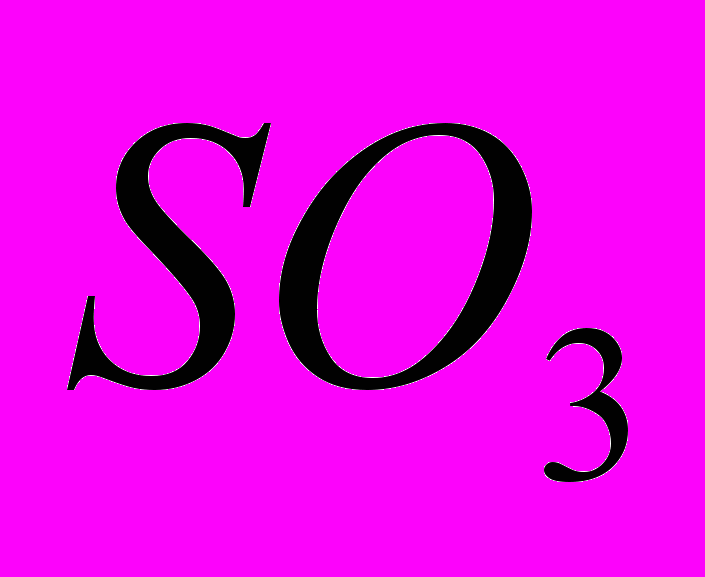 c основанием
c основанием 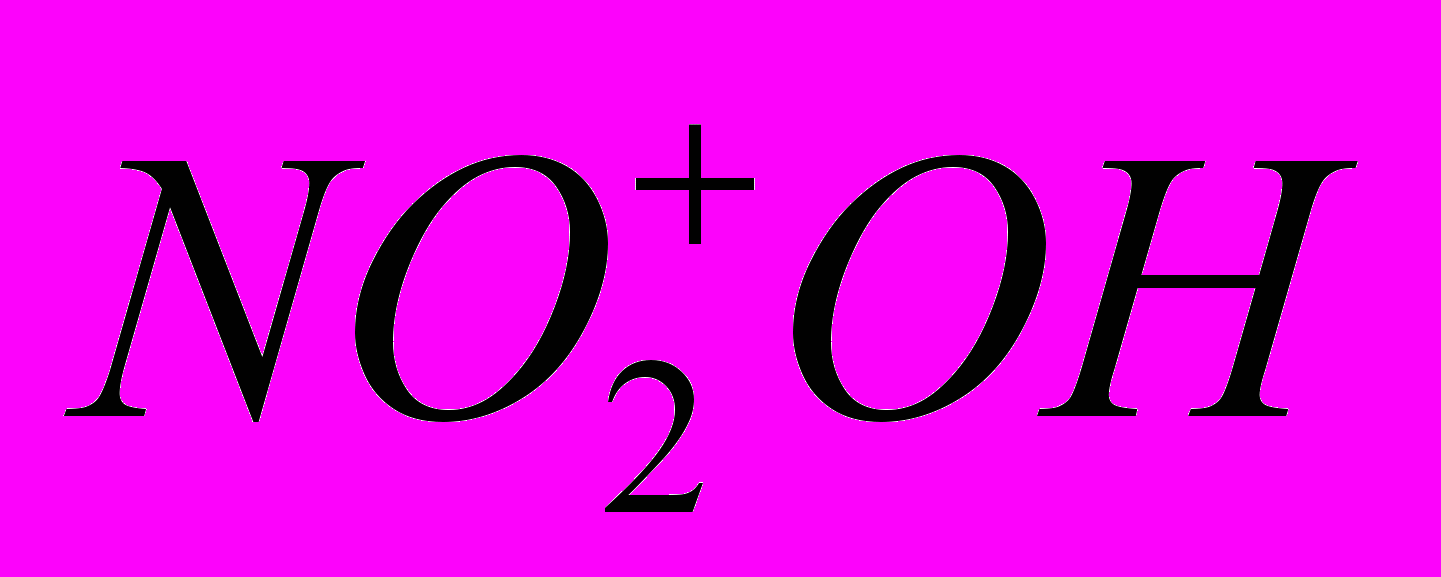 .
.Соли нитрония кристаллические вещества, термодинамически устойчивы, но химически очень активны. Они быстро гидролизуются влагой воздуха; кроме того,
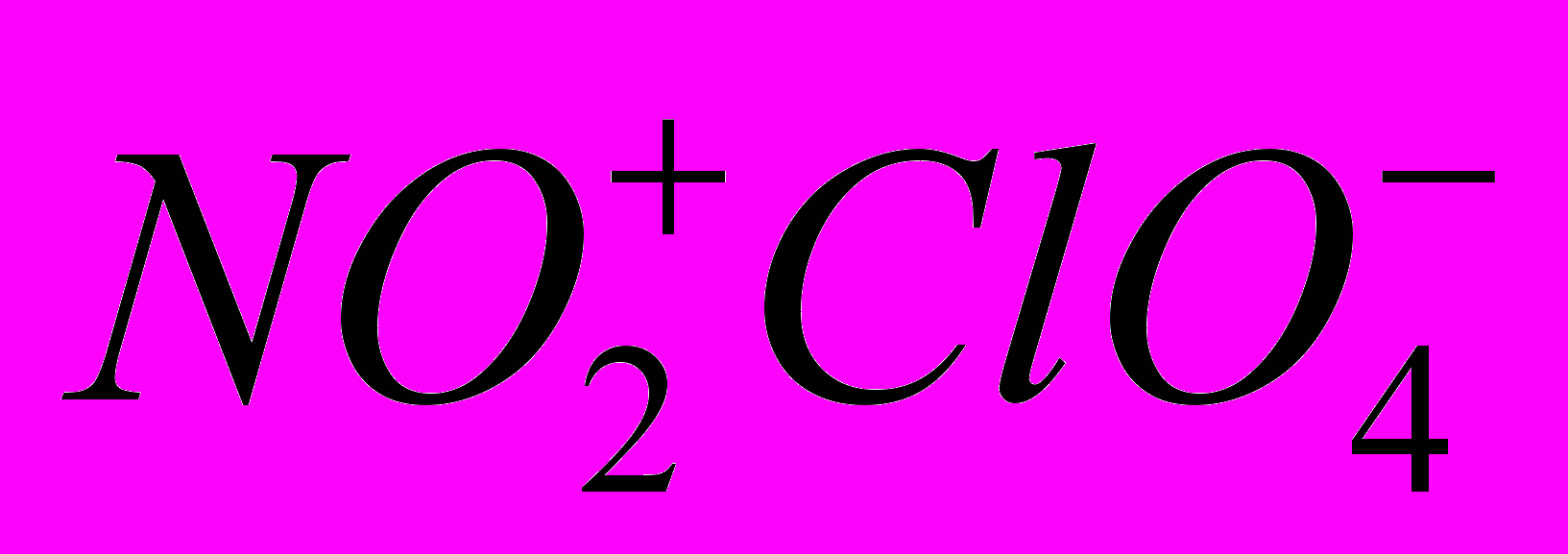 , например, бурно реагирует с органическими веществами, однако в растворе нитробензола его можно использовать для нитрования.
, например, бурно реагирует с органическими веществами, однако в растворе нитробензола его можно использовать для нитрования.Соединения,содержащие нитроний-ион являются промежуточными соединениями при нитровании ароматических веществ.
С
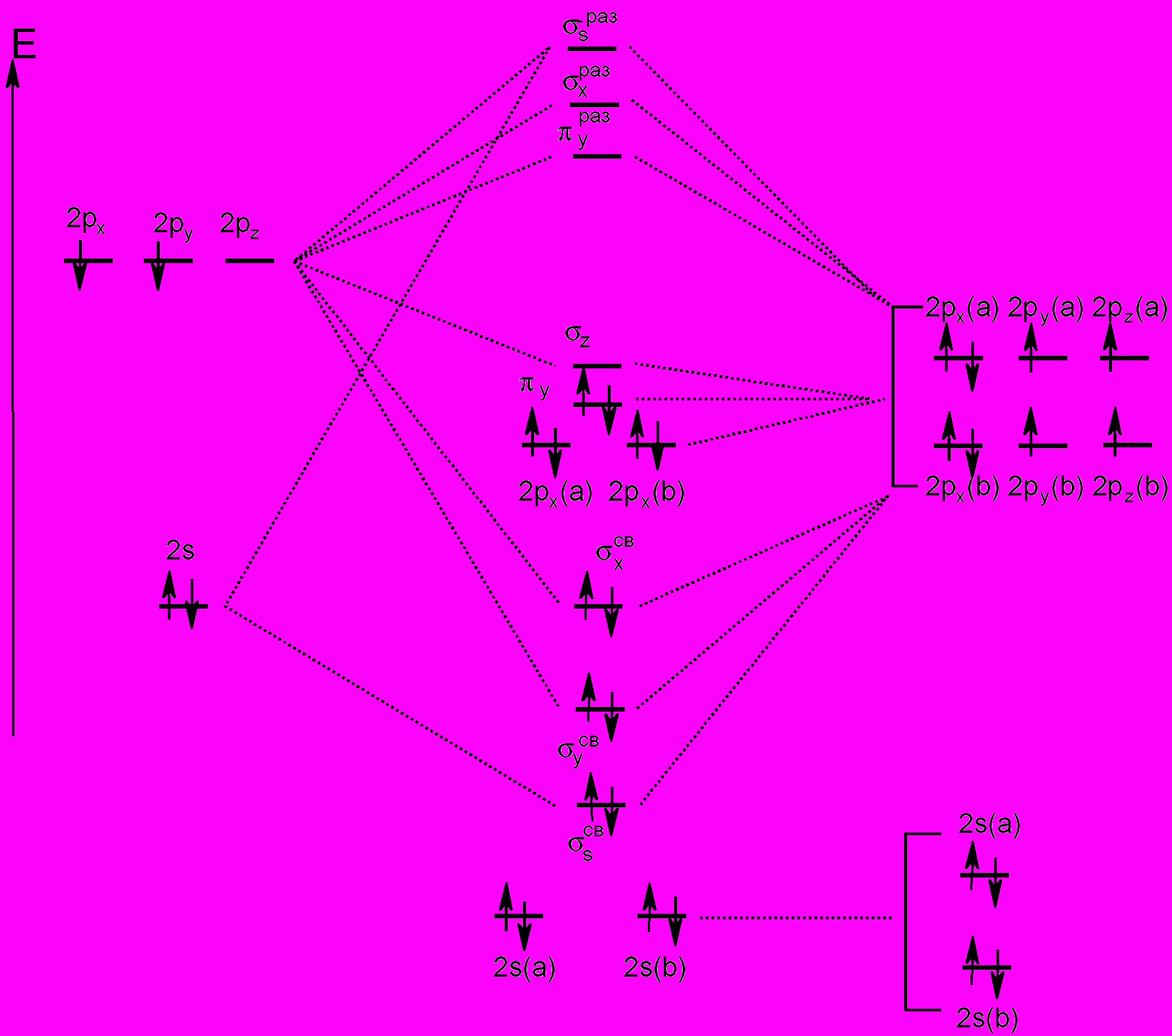
метода молекулярных орбиталей нитроний-ион выглядит так:
Список литературы:
- Ахметов Н.С. Неорганическая химия. М.:Высшая школа 1975.
- Карапетьянц М.Х. Дракин С.И. Общая и неорганическая химия. М.: Химия1994
- Коттон Ф. Уилкинсон Дж. Современная неорганическая химия. том.2. М.: Мир.1969.
- Реми Г. Курс неорганической химии. том 1. М.: Мир.1972.
- Общая химия./Под редакцией Соколовской Е.М. и Гузея Л.С. М.: Московский университет.1989.
- Химический энциклопедический словарь/ редакцией И.Л.Кнунянца. М.: Московская энциклопедия. 1983.
