Роль метаболического и антиоксидантного статуса в возникновении омфалита у новорожденных телят 03. 00. 04 биохимия
| Вид материала | Автореферат |
- Элективный цикл, 36.5kb.
- Фармакокоррекция нитроксидергических процессов, морфобиохимического и иммунологического, 908.84kb.
- Особенности морфологического и гормонально-метаболического статуса спортсменок-борцов, 533.99kb.
- Превентивная программа лечения метаболического синдрома на базе клиники «Слатина», 31.01kb.
- Комплексная оценка функционально-метаболического статуса нейтрофильных гранулоцитов, 307.08kb.
- Программа кандидатского экзамена «Биохимия», 166.06kb.
- Научная программа конференции: Эпидемиология метаболического синдрома. Новое в патогенезе, 40.17kb.
- Клинико-иммунохимическая оценка проницаемости гематоэнцефалического барьера новорожденных, 421.23kb.
- «Гигиеническое воспитание по профилактике и лечению ожирения и метаболического синдрома», 1208.92kb.
- Откорм молодняка крупного рогатого скота мясных пород, 101.86kb.
1 2
* - р<0,05-0,001 по сравнению с показателями у животных в возрасте 30 суток
Как видно из представленных данных, сразу после рождения у телят установлен самый высокий уровень лактата, который через сутки после рождения уменьшался на 11,3% при повышении уровня пировиноградной кислоты на 20,0% и снижении соотношения лактат/пируват на 26,2%. На 3-и сутки после рождения соотношение лактат/пируват снижалось еще более значительно (на 36,1%). Это свидетельствовало о постепенной нормализации окислительных процессов вследствие включения механизмов, способствующих увеличению доставки кислорода к тканям, что закономерно отражалось на снижении содержания лактата на 34,6% через 10 суток до минимальных значений по сравнению с первоначальным уровнем у новорожденных.
К концу первого месяца жизни наблюдалось снижение концентрации лактата более чем в 2 раза и некоторое повышение уровня пирувата относительно уровня, определенного сразу после рождения.
Вследствие гипоксического состояния и наличия респираторно-метаболичес-кого ацидоза у телят в первые дни после рождения возникает относительный избыток акцепторов электронов и возрастает вероятность образования активных форм кислорода (АФК) в результате его неполного восстановления в электронтранспортных цепях. При этом возникают метаболические предпосылки для смещения антиоксидантного баланса в сторону активации процессов свободнорадикального окисления биополимеров (Зинчук В.В., Борисюк М.В., 1999).
До первой выпойки молозива для новорожденных телят характерно довольно высокое содержание в сыворотке крови креатинина (табл.2), которое через сутки уменьшалось на 28,1%, и к концу 3-х суток после рождения снижалось до верхней границы физиологической нормы у взрослых животных данного вида.
Содержание мочевины у новорожденных телят к 10-дневному возрасту достоверно возрастало на 33,8%.
Таблица 2
Возрастные изменения некоторых биохимических показателей крови у телят
Показатели | Возраст телят | ||||
| До выпойки молозива | 1 сутки | 3 суток | 10 суток | 30 суток | |
| Креатинин, мМ/л | 286,830,5 | 206,219,8* | 127,58,1* | 103,48,2* | 86,92,9* |
| Мочевина, мМ/л | 4,40,25 | 4,80,32 | 4,50,34 | 6,80,64* | 3,10,26 |
| -ГТ, мккат/л | 0,600,086 | 6,281,91* | 3,090,56* | 0,740,11* | 0,250,05* |
| ЩФ, мМ/л×час | 4,51,27 | 3,70,36 | 2,70,13* | 2,10,10* | 1,80,74* |
| АлАТ, мМ/л×час | 0,270,032 | 0,330,036 | 0,340,024 | 0,290,016 | 0,290,023 |
| АсАТ, мМ/л×час | 0,770,04 | 1,260,07* | 0,990,03* | 0,980,04* | 1,150,05* |
*- p<0,05-0,001 по сравнению с уровнем до первой выпойки молозива
В месячном возрасте содержание мочевины достоверно снижалось до физиологических пределов у взрослого животного.
При этом не выявлено взаимозависимости уровня мочевины с содержанием креатинина в сыворотке крови, что свидетельствует об отсутствии нарушения фильтрационной функции почек, а изменение этих показателей связано с метаболическими перестройками в организме новорожденных телят в связи с переходом на другой тип питания, интенсификацией азотистого обмена и повышенной нагрузкой на печень (Хочачка П., Сомеро Дж., 1988).
В 13-суточном возрасте имеется коррелятивная взаимосвязь содержания IgG в сыворотке крови новорожденных с уровнем общего белка (r = от 0,60 до 0,65; P<0,02), фракцией -глобулинов (r = от 0,58 до 0,66; P<0,05).
Если до выпойки молозива активность -ГТ в сыворотке крови новорожденных практически отсутствует или является минимальной, то уже после 4-ой выпойки молозива она превышает исходную в десятки раз. В 2-суточном возрасте и далее активность фермента снижается.
Уравнение регрессии, характеризующее зависимость содержания в сыворотке крови новорожденных телят IgG и активность -ГТ в течение первых 3-х суток жизни представлено на рисунке 1.
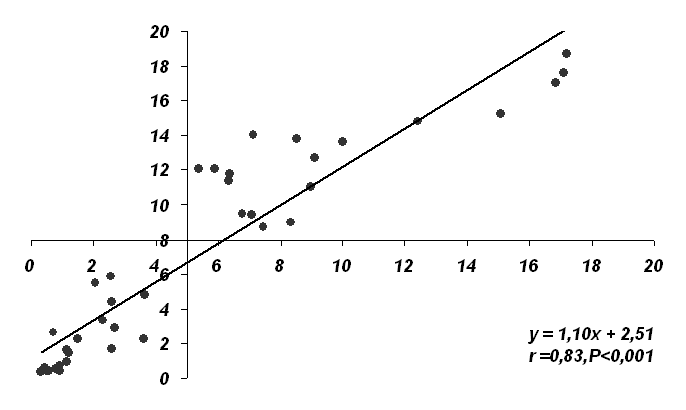 Рис. 1. Взаимосвязь между активностью -ГТ и содержанием IgG в сыворотке крови телят в течение 2-х суток после рождения (по оси абсцисс – активность -ГТ (мккат/л), по оси ординат – содержание IgG (г/л) в сыворотке крови). | Исходя из этого наиболее информативным тестом интенсивности всасывания колостральных иммуногло-булинов у новорожденных телят является определение активности -ГТ в сыворотке крови на 1-2 сутки после рождения. Из представленных данных видно, что у телят с нормальной интенсивностью всасывания колостральных ИГ (содержание IgG в сыворотке крови 8 г/л и более) активность -ГТ в сыворотке крови должна составлять к концу первых суток жизни, при соб-людении оптимальных условий корм- |
ления и содержания новорожденных, 5 и более мккат/л.
Телята, у которых в 12-суточном возрасте активность -ГТ 3 и менее мккат/л должны рассматриваться как имеющие недостаточность пассивного переноса колостральных иммуноглобулинов (< 8 г/л), что является одним из основных факторов риска развития неонатальной патологии.
3.2. Свободнорадикальное окисление липидов и белков у здоровых
новорожденных телят в первый месяц после рождения
Наиболее высокая концентрация первичных и вторичных продуктов ПОЛ отмечена у телят через сутки после рождения (табл.3).
Таблица 3
Концентрация продуктов ПОЛ в крови у телят разного возраста
| Показатели | Возраст животных, сутки | |||
| 1 | 3 | 10 | 30 | |
| ДК, D232/мг липидов | 0,2200,010* | 0,217±0,011* | 0,1790,007 | 0,1600,008 |
| МДА, мкМ/л | 2,240,140* | 2,17±0,125* | 0,950,084* | 0,640,045 |
| ОШ,отн. ед./мл | 0,140,011 | 0,21±0,009* | 0,280,047* | 0,140,036 |
* - р<0,05 по сравнению с показателями у животных в возрасте 30 суток
К 10-суточному возрасту происходило снижение уровня первичных продуктов свободнорадикального окисления в 1,23 и промежуточных – в 2,36 раза, но при этом в 2,0 раза возрастало содержание конечных, наиболее трудно утилизируемых продуктов ПОЛ, которое нормализовалось к месячному возрасту. Это свидетельствует о том, что в течение первых 1-3 суток жизни для новорожденных телят характерно состояние окислительного стресса.
Адаптация новорожденных к новым условиям жизни сопровождается повышением в крови концентрации ключевых эндогенных биоантиоксидантов (рис. 2).
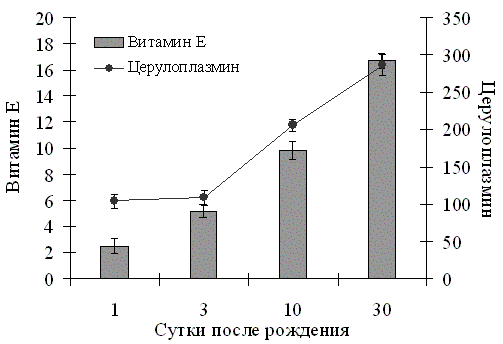 Рис.2. Возрастная динамика основных компонентов неферментативного звена системы АОЗ в сыворотке крови телят. | Концентрация витамина Е в крови телят 10-суточного возраста увеличивалась в 3,9 раза относительно новорожденных и нормализовалась через месяц на уровне, характерном для клини-чески здоровых взрослых животных (Скурихин В.Н., Шабаев С.В., 1996), превышая почти в 7 раза его уровень через сутки после рождения. Телята суточного возраста характеризовались и наиболее низкой ферроксидазной активностью в крови основного внеклеточного антиоксиданта – |
церулоплазмина, которая уже через 10 суток возрастала почти в 2 раза, а 30-суточном возрасте превышала уровень у суточных новорожденных в 2,8 раза.
В ферментативном звене АОС наиболее высокая активность в первые 3-е суток после рождения установлена для супероксиддисмутазы (СОД) (рис.3).
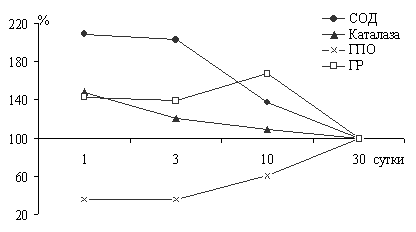 Рис.3. Возрастные изменения активности основных антиоксидантных ферментов в крови телят (в % к уровню в месячном возрасте). | Синхронно с изменением активности СОД происходило изменение активности каталазы, пик которой был характерен для суточных новорожденных телят. Учитывая, что конечный продукт этой реакции (Н2О2) ингибирует СОД по принципу обратной связи (Marklund S.L., 1985; Halliwell B., Gutteridge J.M.C., 1986), то довольно высокая активность каталазы на раннем этапе адаптации может |
служить важным фактором поддержания высокой активности СОД. С этим явлением, вероятно, связано изменение активности и каталазы в более поздние возрастные периоды. Снижение её активности почти на 20% происходило уже на 3-и сутки после рождения и достигала минимальных значений к 30 суткам по сравнению животными суточного возраста. Иная динамика в ранний период постнатального развития отмечена для активности глутатионпероксидазы крови. Адаптация новорожденного происходила на фоне нарастания активности фермента.
В первые трое суток после рождения активность ГПО в крови телят была минимальной, однако через 10 суток она увеличивалась на 76,2%, а в возрасте 30 дней превосходила почти в 3 раза активность у однодневных животных.
У новорожденных телят 13-суточного возраста установлена также и достаточно высокая активность в крови другого фермента глутатионового звена антиоксидантной защиты - глутатионредуктазы (ГР), которая снижалась в 1,48 раза к месячному возрасту. Очевидно, по мере приспособления новорожденных к новым условиям существования в антиоксидантной системе (АОС) осуществляются адаптивные перестройки, связанные с тенденцией к нарастанию мощности неферментативного звена на фоне снижения до уровня у взрослых животных активности ферментативного звена АОС.
Таким образом, в условиях окислительного стресса, развивающегося в неонатальный период, преимущественная функция в защите от супероксидного аниона (O2) в первые дни жизни принадлежит СОД, обладающей большим сродством к радикалу и характеризующейся более высокой константой скорости взаимодействия, чем церулоплазмин. Но по мере увеличения в крови содержания ЦП его роль в детоксикации O2 во внеклеточных жидкостях возрастает на фоне снижения активности супероксиддисмутазы.
Состояние окислительного стресса в начальный период постнатального развития приводит к усилению и окислительной модификации белковых структур. Как видно из представленных данных (рис.4) наибольшая степень окислительной модификации белков сыворотки крови установлена сразу (через 0,5-1,5 часа) после рождения животных. Через 24 часа после рождения уровень окислительной модификации белков снижается на 23,7%.
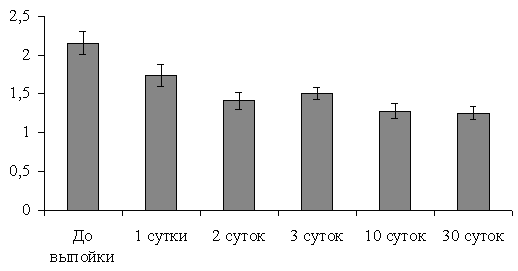 Рис. 4. Возрастная динамика ОМБ сыворотки крови у телят (нМ карбонильных групп / мг белка). | Начиная со 2-х суток жизни, происходит более существенное снижение степени окислительной модификации белков крови. Максимальное падение наблюдается на 10-е сутки жизни (на 68,1% по сравнению с уровнем, определенным в первые часы жизни), в месячном возрасте уровень окислительной модификации белков стабилизируется на уровне взрослых животных (Артемьева С.С., 2006). |
В связи с тем, что в первые сутки жизни у новорожденных в результате развития явлений оксидативного стресса окислительной модификации подвергаются и белки, то это определяет вероятность и окислительной модификации, уже всосавшихся в первые часы жизни колостральных иммуноглобулинов, нарушения их физико-химических и функциональных и, как следствие этого, снижения потенциала противоинфекционной защиты новорожденных.
3.3. Состояние метаболического статуса у заболевших омфалитом
новорожденных телят
Исследования проведены на 25 новорожденных телятах, из которых 15 остались здоровыми, а у 10 развился омфалит. Коров-матерей этих телят, за 1,5 и 1 месяц до отела дважды иммунизировали против колибактериоза (эшерихиоза) сельскохозяйственных животных вакциной «Коливак».
Телятам сразу после рождения пуповину обрабатывали 5% спиртовым раствором йода и помещали в станок по 5-6 животных. После 10-15 суток нахождения телят в профилактории их переводили в телятник, где они содержались от 2 до 5 месяцев. Биохимические исследования крови проводили у всех телят в возрасте 1, 2, 3 и 15 суток после рождения.
Считается, что для формирования адекватного метаболического статуса новорожденного важное значение имеет их обеспеченность микроэлементами (Самохин В.Т., 2003), единственным источником которых для телят в первые дни жизни является молозиво и молоко.
Установлено, что у оставшихся здоровыми телят уровень в крови Cu, Zn, Mn и Fe был выше, чем у заболевших омфалитом (табл. 4).
Таблица 4
Содержание меди, цинка и марганца в крови новорожденных телят
| Элементы | Группа телят | |
| Здоровые (n=15) | Заболевшие (n=10) | |
| Через 1сутки после рождения | ||
| Cu, мкг% | 81,5±4,10 | 70,2±3,67* |
| Zn, мкг% | 299,4±7,03 | 227,5±15,83* |
| Mn, мкг% | 15,6±1,00 | 12,5±0,77* |
| Fe, мг% | 28,8±1,35 | 24,0±1,07* |
| Через 2 суток после рождения | ||
| Cu, мкг% | 85,1±2,81 | 71,8±3,47* |
| Zn, мкг% | 298,5±15,10 | 245,7±8,78* |
| Mn, мкг% | 15,9±1,03 | 13,4±0,54 |
| Fe, мг% | 27,2±1,22 | 23,0±1,31* |
| Через 3 суток после рождения | ||
| Cu, мкг% | 85,3±2,45 | 75,4±2,07* |
| Zn, мкг% | 286,5±14,35 | 222,7±14,66* |
| Mn, мкг% | 15,0±1,06 | 12,6±0,70* |
| Fe, мг% | 23,2±1,47 | 20,6±1,99 |
* - p<0,05-0,001 по сравнению со здоровыми
Так как содержание микроэлементов в крови у новорожденных является результирующим их уровня в крови коровы-матери и в молозиве и имеется высокая прямая взаимосвязь (r = от +0,83 до +0,88, P<0,001) между содержанием микроэлементов в крови и молозиве коров-матерей, то более низкое содержание в крови новорожденных микроэлементов обусловлены различиями в их содержании в крови коров-матерей и в молозиве. Так, в день перед отелом в крови коров, у телят которых развился омфалит, содержание меди было ниже на 11,5%, цинка - на 26,7%, марганца - на 25,4% и более чем в 1,5 раза уровень железа. В молозиве коров-матерей здоровых телят уровень Cu, Zn, Mn и Fe был в течение первых трех дней после отела выше, чем у коров-матерей телят, у которых развился омфалит.
В первые сутки после рождения у оставшихся здоровыми и заболевшими телятами наибольшие различия установлены в активности -ГТ и уровне холестерина в сыворотке крови (табл. 5), которые сохранялись и на 2-е и 3-и сутки после рождения.
Таблица 5
Содержание холестерина и активность -глутамилтрансферазы в сыворотке крови здоровых и заболевших омфалитом телят
| Показатели | Группа телят | |
| Здоровые (n=15) | Заболевшие (n=10) | |
| Через 1сутки после рождения | ||
| Холестерин, мМ/л | 0,53±0,05 | 0,80±0,06* |
| -ГТ, Ед/л | 674,7±69,68 | 185,9±19,36* |
| Через 2 суток после рождения | ||
| Холестерин, мМ/л | 0,86±0,07 | 1,30±0,10* |
| -ГТ, Ед/л | 339,2±153,74 | 180,8±78,96* |
| Через 3 суток после рождения | ||
| Холестерин, мМ/л | 0,82±0,13 | 1,21±0,07* |
| -ГТ, Ед/л | 239,6±102,65 | 97,62±48,16* |
* - p<0,05-0,001 по сравнению со здоровыми
Существенно более низкая активность -ГТ в сыворотке новорожденных телят, заболевших омфалитом, является свидетельством нарушения пассивного транспорта молозивных иммуноглобулинов (Рецкий М.И. с соавт., 2005; Близнецова Г.Н. с соавт., 2007).
Более высокий уровень холестерина в сыворотке крови телят, предрасположенных к развитию омфалита, связан, вероятно, с нарушением структурно-функцио-нального состояния эритроцитарных мембран и выходом в плазму крови холестерина – одного из основных липидных компонентов, обеспечивающего жесткость биомембраны.
Подтверждением этому может служить более высокая сорбционная способность эритроцитов в отношении витального красителя метиленового синего. У здоровых телят она составила в суточном возрасте 46,0 ± 1,22%, а у заболевших – 52,0± 2,17% (p<0,05), в 3-суточном - 43,3 ± 1,66% и 51,8 ± 2,04% (p<0,05) соответственно.
3.4. Свободнорадикальное окисление липидов и белков у
заболевших омфалитом новорожденных телят
Изменение свойств эритроцитарных мембран, по всей видимости, связано с развитием у новорожденных, у которых впоследствии развился омфалит, в первые дни после рождения, явлений оксидативного стресса. На это указывает более высокое содержание у них в крови промежуточного продукта пероксидного окисления липидов – малонового диальдегида (табл. 6).
В суточном возрасте оно было выше, чем у не заболевших телят на 18,5%, в 2-суточном – на 20,3% и в 3-суточном – на 28,2%. При этом, как компенсаторная реакция со стороны системы антиоксидантной защиты, у этих животных в суточном возрасте установлена более высокая активность основных антиоксидантных ферментов – СОД и ГПО.
Таблица 6
Динамика показателей антиоксидантного статуса у новорожденных телят
| Показатели | Группа телят | |
| Здоровые | Заболевшие | |
| Через 1сутки после рождения | ||
| МДА, мкМ/л | 0,81±0,187 | 0,96±0,041* |
| СОД, ед. акт./мг Hb | 0,51±0,039 | 0,72±0,058* |
| Каталаза, мМ Н2О2/лмин | 28,5±1,90 | 29,3±1,06 |
| ГПО, мМ восст. глутатиона/лмин | 7,2±0,13 | 7,8±0,23* |
| ГР, мкМ окисл. глутатиона/лмин | 678,9±8,79 | 631,6±10,53* |
| Через 2 суток после рождения | ||
| МДА, мкМ/л | 0,79±0,050 | 0,95±0,025* |
| СОД, ед. акт./мг Hb | 0,68±0,081 | 0,70±0,040 |
| Каталаза, мМ Н2О2/лмин | 29,2±1,00 | 29,3±2,45 |
| ГПО, мМ восст. глутатиона/лмин | 6,8±0,06 | 7,1±0,06 |
| ГР, мкМ окисл. глутатиона/лмин | 663,4±15,27 | 633,6±21,48 |
| Через 3 суток после рождения | ||
| МДА, мкМ/л | 0,71±0,057 | 0,91±0,010* |
| СОД, ед. акт./мг Hb | 0,72±0,052 | 0,62±0,040 |
| Каталаза, мМ Н2О2/лмин | 27,7±2,58 | 25,9±1,17 |
| ГПО, мМ восст. глутатиона/лмин | 6,5±0,07 | 6,0±0,10 |
| ГР, мкМ окисл. глутатиона/лмин | 592,3±12,91 | 560,7±15,42 |
На 3-и сутки после рождения активность антиоксидантных ферментов у заболевших телят имеет тенденцию к снижению по сравнению с таковой у здоровых.
Это можно считать началом формирования антиоксидантной недостаточности с учетом того, что в организме таких новорожденных снижено экзогенное поступление меди и цинка, содержащихся в активном центре СОД, и железа – в активном центре каталазы.
Об определенной недостаточности глутатионового звена системы АОЗ на 3-и сутки жизни заболевших телят может свидетельствовать и более низкая активность ГПО и глутатионредуктазы.
О более выраженных явлениях оксидативного стресса у телят, у которых развился омфалит, по сравнению со здоровыми животными, свидетельствует и более высокая степень окислительной модификации белков (ОМБ) (рис. 5).
У заболевших телят степень окислительной модификации белков сыворотки крови в течение первых суток жизни на 13,9 - 28,7 % выше, чем у оставшихся здоровыми. И если в период ранней постнатальной адаптации у здоровых животных степень ОМБ динамично снижается, то у заболевших телят она в этот период остается существенно выше. В 15-суточном возрасте степень ОМБ нако в 15-суточном возрасте ично снижается, то у заболевших телят она в этот период практически не изменяется. белка)тепень окМБу здоровых и переболевших омфалитом телят существенно не различается.
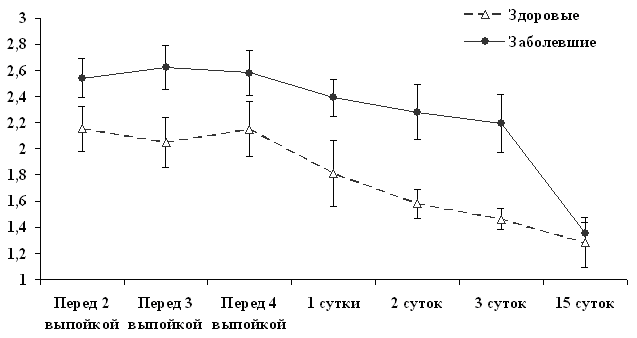 Рис. 5. Динамика окислительной модификации белков сыворотки крови новорожденных телят (нМ карбонильных групп / мг белка) | Более высокая степень окислительной модификации белков, обусловливающая повышение их доступности к действию протеаз, приводит к тому, что у заболевших телят уровень МСМ выше, чем у здоровых в первые сутки жизни на 11,7%, на 2-е сутки – на 13,9% и на 3-и сутки – на 45,6 %, что говорит об уже развившемся явлении эндогенной интоксикации. |
Изменения липидных и белковых структур, вызванные действием свободных радикалов, избыточное образование которых происходит при оксидативном стрессе, приводят к разобщению дыхания и окислительного фосфорилирования, происходящего из-за нарушения работы ферментов цепи тканевого дыхания и переноса электронов. Это влечет за собой системные изменения метаболизма – накопление восстановленных переносчиков в дыхательной цепи, недоокисленных продуктов и дефицит АТФ (Каверин Н.Н., 2005). Поэтому с явлениями респираторно-метаболического ацидоза у новорожденных сопряжено развитие оксидативного стресса в первые часы и дни после рождения.
У телят, заболевших омфалитом, по сравнению со здоровыми, уже в самый начальный период постнатальной адаптации более выражено преобладание процессов анаэробного окисления углеводов над аэробным, что является одной из причин развития у них явления ацидоза, которое не компенсируется даже на 3-и сутки жизни (табл.7).
Таблица 7
Динамика показателей окисления углеводов в крови новорожденных телят
| Показатели | Группы телят | |
| Здоровые (n=15) | Заболевшие (n=10) | |
| Через 1сутки после рождения | ||
| Молочная кислота, мМ/л | 2,92±0,44 | 3,00 ± 0,50 |
| Пировиноградная кислота, мкМ/л | 239,8±11,46 | 195,0 ± 8,00* |
| Лактат/пируват | 12,2±0,24 | 15,4±0,62* |
| Через 2 суток после рождения | ||
| Молочная кислота, мМ/л | 2,03±0,57 | 2,17 ± 0,47 |
| Пировиноградная кислота, мкМ/л | 234,8±20,04 | 150,0 ± 16,00* |
| Лактат/пируват | 8,6±0,31 | 14,5±0,97 |
| Через 3суток после рождения | ||
| Молочная кислота, мМ/л | 2,11±0,41 | 2,08±0,48 |
| Пировиноградная кислота, мкМ/л | 237,2±21,76 | 153,2±17,73* |
| Лактат/пируват | 8,9±0,75 | 13,6±1,02* |
*- р<0,05-0,01 по сравнению со здоровыми
у таких животных через сутки после рождения соотношение лактат/пируват в крови было на 26%, в 2-суточном – на 70,6% и в 3-суточном – на 47% выше, чем у здоровых телят.
3.5. Иммунный статус у заболевших омфалитом новорожденных телят
Более длительное ацидотическое состояние, что является фактором, нарушающим нормальное всасывание молозивных иммуноглобулинов и формирование колострального иммунитета (Рецкий М.И. с соавт., 2005), о чем свидетельствует и более низкая на 1-3 сутки жизни активность -глутамилтрансферазы, отражающая интенсивность пассивного переноса макромолекулярных белков молозива. Это приводит к тому, что концентрация IgG в сыворотке крови в суточном возрасте у заболевших животных составила 2,8 ± 1,36 г/л, что ниже по сравнению с уровнем у здоровых телят в 2,89 раза (табл. 8).
Таблица 8
Возрастная динамика показателей, характеризующих гуморальное звено
иммунитета у здоровых и заболевших омфалитом новорожденных телят
| Показатели | Группы телят | |
| Здоровые (n=15) | Заболевшие (n=10) | |
| Через 1сутки после рождения | ||
| Общий белок, г/л | 72,8±6,21 | 68,3±0,58 |
| -глобулины | 10,1±1,01 | 7,1 ± 1,09* |
| Ig G, г/л | 8,1±1,67 | 2,8±1,36* |
| Через 2 суток после рождения | ||
| Общий белок, г/л | 74,1±5,41 | 65,1±2,68 |
| -глобулины, г/л | 10,6±0,92 | 6,4 ± 1,30* |
| Ig G, г/л | 8,57±1,08 | 3,61±0,65* |
| Через 3 суток после рождения | ||
| Общий белок, г/л | 72,2±5,25 | 62,3±1,70 |
| -глобулины, г/л | 10,2±1,02 | 7,5±0,06* |
| Ig G, г/л | 8,09±1,72 | 4,13±1,10* |
*- р<0,05-0,001 по сравнению со здоровыми
На 2-е сутки после рождения у заболевших телят также установлен более низкий уровень IgG в сыворотке крови в 2,37 раза, чем у здоровых телят. В 3-суточном возрасте у заболевших телят среднее содержание в сыворотке крови IgG было в 1,96 раза меньше, чем у оставшихся здоровыми. Все это свидетельствовало о более низком уровне иммунного статуса у заболевших омфалитом телят.
У заболевших омфалитом телят был также значительно ниже и титр антител против E.coli (рис. 6). Причем у оставшихся здоровыми телят уже после 1-ой выпойки молозива в сыворотке крови обнаруживаются антитела к E.coli, а у заболевших - их нет, хотя у коров-матерей в первой порции молозива титр антител к E. coli составил 1:465,0±101,05 в обеих группах.
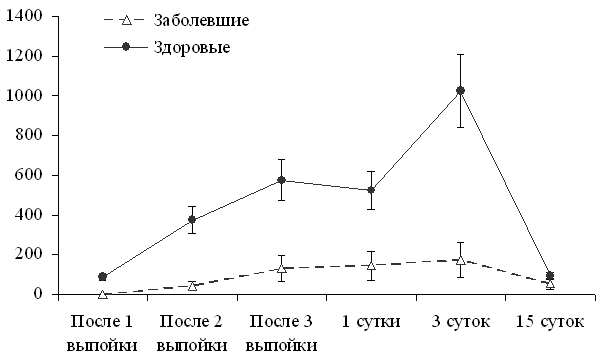 Рис.6. Титр антител против E. coli у оставшихся здоровыми и заболевших омфалитом телят. | На 3-и сутки жизни титр антител к E. coli у заболевших телят был в 5,86 раз ниже, чем у оставшихся здоровыми. Таким образом, телята, предрас-положенные к развитию омфалита, уже в первые сутки жизни, по сравнению с оставшимися здоровыми, в меньшей степени обеспечены основными микроэлементами, у них более выражены явления оксидативного стресса, а характерное для |
них более длительное состояние ацидоза приводит к нарушению всасывания молозивных иммуноглобулинов и формирования колострального иммунитета, что является одной из основных причин развития у новорожденных омфалита, в этиологии которого важная роль принадлежит микробному фактору.
Исходя из этого в схему профилактики омфалита у новорожденных телят, было предложено включить иммунизацию коров против эшерихиоза для повышения уровня противоэшерихиозных колостральных антител. Для снятия явлений оксидативного стресса, нормализация антиоксидантного статуса и улучшения всасывания колостральных иммуноглобулинов телятам сразу после рождения применять препараты с антиоксидантными свойствами.
3.6. Профилактика омфалита у новорожденных телят с использованием
антиоксидантов
В первом опыте объектом исследования были новорожденные телята, родившиеся от коров 2-х групп. В первую (контрольную) группу (n=12) вошли телята, родившиеся от коров контрольной группы, иммунизированных за 1,5 и 1 месяц до отела против колибактериоза (эшерихиоза). Во вторую (опытную) группу (n=12) вошли телята, родившихся от коров, которым иммунизировали в сочетании с введением органического селенсодержащего препарата Селедант. Препарат коровам вводили одновременно с вакцинацией в дозе 20 мкг/кг массы тела.
Телятам, полученным от этих коров, в течение 0,5-1 часа после рождения внутримышечно вводили Селедант в дозе 10 мкг/кг массы тела и 1 мл тривита на животное. Исследования крови у телят проводили через 1, 2, 3 и 15 суток после рождения.
Установлено, что у телят, матерям которых применяли Селедант, и которым в первые сутки после рождения вводили Селедант и Тривит, в крови был статистически достоверно более низкий уровень промежуточного, наиболее токсичного продукта пероксидного окисления липидов – МДА (рис.7).
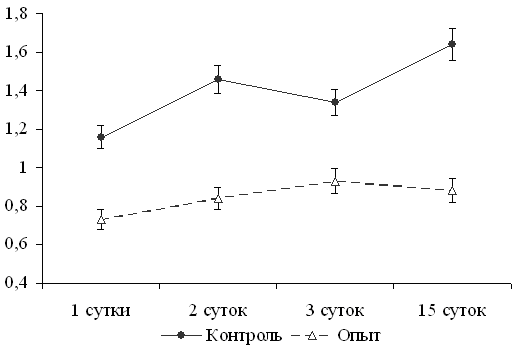 Рис.7. Влияние применения Селеданта коровам совместно с вакцинацией и Селеданта и Тривита телятам в первые сутки жизни на уровень МДА в крови. | Для телят контрольной по сравнению с телятами опытной групп характерно более высокое (на 10,6-15,9%, p<0,05) содержание карбонильных групп в белках сыворотки крови как в первые трое суток после рождения, так и в 2-недельном возрасте (рис. 8). Это свидетельствует о том, что наряду с нормализацией интенсивности пероксидного окисления липидов при-менение препаратов способствовало снижению и окислительной модификации сывороточных белков у телят в первые дни жизни. |
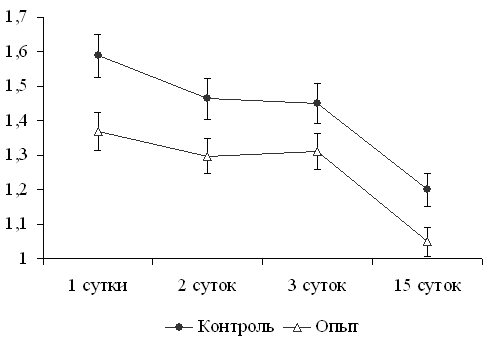 Рис.8. Влияние применения Селеданта и Тривита на ОМБ в крови новорожденных телят (нм карбонильных групп / мг белка. | Применение препаратов оказало влияние на состояние ферментативного звена антиоксидантной системы (АОС) у телят, матерей которых вакцинировали в сочетании с Селедантом, и которым в первые сутки жизни применяли Селедант и Тривит. Наиболее существенные отличия между телятами контрольной и опытной групп установлены на 2-й и, особенно, на 3-й дни жизни (табл. 9). |
Таблица 9
Влияние Селеданта и Тривита на состояние ферментативного звена
антиоксидантной системы у новорожденных телят
| Группы животных | ГПО | ГР | Каталаза |
| Возраст 1 сутки | |||
| Контроль | 3,3±0,17 | 417,4±27,11 | 35,8±1,03 |
| Селедант+Тривит | 3,8±0,17* | 439,3±22,24 | 38,6±1,11 |
| Возраст 2 суток | |||
| Контроль | 4,2±0,33 | 400,4±39,67 | 33,9±1,04 |
| Селедант+Тривит | 4,9±0,35* | 446,6±26,17 | 38,9±1,40* |
| Возраст 3 суток | |||
| Контроль | 5,0±0,21 | 327,1±22,87 | 33,6±1,22 |
| Селедант+Тривит | 6,0±0,19* | 436,6±23,42* | 38,0±1,23* |
| Возраст 15 суток | |||
| Контроль | 6,3±0,21 | 464,9±22,27 | 30,5±2,22 |
| Селедант+Тривит | 7,2±0,20* | 477,9±23,42 | 33,6±2,23 |
*- р<0,05 по сравнению с контролем
Поддержание достаточно высокого антиокислительного потенциала и менее выраженное состояние окислительного стресса характерного в первые дни жизни у телят этой опытной группы, способствовало более адекватному формированию колострального иммунитета. Это подтверждается и более высоким (в 1,5 - 2 раза) содержанием в сыворотке крови IgG в течение первой недели жизни (табл. 10), когда наиболее высока вероятность развития омфалита.
Таблица 10
Некоторые показатели иммунного статуса телят при применении
Селеданта и Тривита
| Показатели | Возраст телят | ||
| 1 сутки | 2 сутки | 7 сутки | |
| Контроль | |||
| Общий белок, г/л | 55,9±1,72 | 56,1±1,16 | 59,3±3,19 |
| Активность -ГТ, Е/л | 155,2±72,13 | 255,3±36,0 | 62,2±10,86 |
| Ig G, г/л | 4,0±0,66 | 5,2±0,90 | 5,8±0,17 |
| Опыт (Селедант+Тривит) | |||
| Общий белок, г/л | 57,6±1,28 | 65,1±1,14* | 61,5±0,87 |
| Активность -ГТ, Е/л | 727,9±70,6* | 689,4±36,3 | 75,1±18,7 |
| IgG, г/л | 8,1±1,35* | 8,8±1,20* | 8,4±1,03* |
*- р<0,05 по сравнению с контролем
Таким образом, применение телятам сразу после рождения Селеданта и Тривита, способствует снижению проявлений оксидативного стресса, нормализации антиоксидантного статуса и становлению более высокого иммунного статуса первые дни жизни.
Об эффективности профилактики омфалита путем нормализации метаболического и, в частности, антиоксидантного статуса можно судить по результатам более широкой апробации метода профилактики омфалита, проведенной во втором опыте на 106 телятах (табл. 11).
Таблица 11
Эффективность применения Селеданта и Тривита
для профилактики омфалита новорожденных телят
| Показатели | Группы телят | |
| Опыт (Селедант+Тривит) | Контроль | |
| Количество телят, гол.(%) | 84 (100) | 22 (100) |
| Из них заболело омфалитом, гол.(%) | 7 (8,3) | 5 (22,7) |
| Начало, сут. | 2,340,22 | 2,25±0,25 |
| Длительность, сут. | 5,01,05 | 6,5±0,64 |
| Тяжесть течения омфалита: | | |
| - легкое, гол.(%) | 7 (100) | 3 (60) |
| - умеренно-тяжелое, гол.(%) | - | 1 (20) |
| - тяжелое, гол.(%) | - | 1 (20) |
Из представленных данных следует, что включение в схему профилактики омфалита антиоксидантного препарата селедант и витаминов А, Д3 и Е в форме Тривита способствует снижению заболеваемости новорожденных телят омфалитом в 2,73 раза, а если телята и заболевают, то болезнь протекает в более легкой форме и менее длительно. У телят опытной группы среднесуточный прирост массы тела в первые 10 суток жизни составил 226,0±38,4 г, а у телят контрольной группы – 175,5±14,6 г.
ВЫВОДЫ
1. Ранний постнатальный период развития клинически здоровых телят сопровождается явлениями окислительного стресса, которые выражаются в: повышенном содержании в крови новорожденных в 1-3 сутки жизни первичных (диеновые конъюгаты) и вторичных (МДА) продуктов пероксидного окисления липидов соответственно до 0,220-0,217 D232/мг липидов и 2,24-2,17 мкМ/л или на 37,5-36,6% и в 3,50-3,39 раза по сравнению с телятами месячного возраста.
В первые сутки после рождения у телят повышена степень окислительной модификации белков крови. Через 0,5 -1,5 часа после рождения уровень карбонильных групп в белках превышает уровень, характерный для телят в возрасте 24 часов в 1,24, а в возрасте 30 суток - в 1,72 раза.
2. Преимущественное значение в защите организма от активных форм кислорода в течение первых 3-х суток жизни принадлежит ферментативному комплексу супероксиддисмутаза - каталаза. Активность СОД и каталазы в этот период соответственно выше в 1,52 и 1,35 раза, чем на 10-е сутки после рождения. К этому времени в системе антиоксидантной защиты организма новорожденного начинает приобретать значение и глутатионовое звено ферментативной системы антиоксидантной защиты, о чем свидетельствует повышение к 10-суточному возрасту активности глутатионпероксидазы на 76,2%, глутатионредуктазы - на 17,3 % и повышенный (на 19,8 %) расход восстановленного глутатиона.
3. По мере приспособления новорожденных к новым условиям существования и питания материнским молоком в системе антиоксидантной защиты нарастает мощность неферментативного звена. Концентрация витамина Е в крови телят 10-суточного возраста превышает его уровень через сутки после рождения в 3,9 раза, а в месячном - в 6,7 раза. Ферроксидазная активность в крови основного внеклеточного антиоксиданта – церулоплазмина, через 10 суток после рождения возрастала почти в 2 раза, а в месячном возрасте превышала уровень у суточных телят в 2,8 раза.
4. У телят, заболевших омфалитом, по сравнению с оставшимися здоровыми, после рождения более выражено преобладание процессов анаэробного окисления углеводов над аэробным, и у заболевших животных состояние ацидоза не компенсируется даже на 3-и сутки жизни. Это сопровождается более сильным проявлением оксидативного стресса, о чем свидетельствует повышенное на 18,5-28,2 % содержание в крови малонового диальдегида и на 13,9-28,7 % - степень окислительной модификации белков. Кроме этого на 3-и сутки жизни у таких телят начинает развиваться недостаточность ферментативного звена системы антиоксидантной защиты.
5. Выраженное состояние оксидативного стресса и длительный ацидоз у заболевших омфалитом новорожденных телят является факторами, нарушающими всасывание молозивных иммуноглобулинов и формирование колострального иммунитета. У таких животных концентрация IgG в сыворотке крови в суточном возрасте ниже по сравнению со здоровыми телятами в 2,89, в 2-суточном – в 2,37, в 3-суточном - в 1,96 раза. На 3-и сутки жизни у заболевших телят титр антител к E. coli в 5,86 раз ниже, чем у здоровых.
6. Имеется высокая прямая взаимосвязь (r = от +0,83 до +0,88, P<0,001) между содержанием микроэлементов в крови и молозиве коров-матерей. В день перед отелом в крови коров, у телят которых развился омфалит, содержание меди ниже на 11,5%, цинка - на 26,7%, марганца - на 25,4% и более чем в 1,5 раза уровень железа. В результате этого в первые сутки после рождения у впоследствии заболевших телят ниже содержание в крови меди - на 11,4, цинка - на 17,3, марганца - на 13,5, железа - на 20,0%. Эта же тенденция сохраняется и в течение 2-х и 3-х суток жизни новорожденных.
7. Применение телятам через 0,5-1 час после рождения Селеданта и Тривита способствует повышению их антиоксидантного статуса, что проявляется в снижении интенсивности пероксидного окисления липидов, окислительной модификации сывороточных белков и усилении активности ферментативного звена системы антиоксидантной защиты.
8. Повышение антиоксидантного потенциала телят путем применения им сразу после рождения Селеданта в дозе 10 мкг/кг массы тела и 1 мл на голову Тривита способствует формированию более выраженного колострального иммунитета, что подтверждается более высоким (>8 г/л) уровнем IgG в сыворотке крови в 1-2 сутки жизни и снижению в 2,7 раза заболеваемости омфалитом.
ПРАКТИЧЕСКИЕ ПРЕДЛОЖЕНИЯ
Для нормализации антиоксидантного статуса и профилактики омфалита у новорожденных телят рекомендуется совместно с иммунизацией коров-матерей против эшерихиоза за 1,5 и 1 месяц до отела применять Селедант в дозе 20 мкг/кг массы тела, а телятам, полученным от этих коров, в течение 0,5-1 часа после рождения внутримышечно однократно вводить Селедант в дозе 10 мкг/кг массы тела и 1 мл тривита на животное.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Филатов Н.В. Состояние окислительного метаболизма и иммунный статус у здоровых и заболевших омфалитом новорожденных телят / Н.В. Филатов, А.И. Золотарев, Ю.Н. Масьянов, М.И. Рецкий //Актуальные проблемы ветеринарии в современных условиях: матер. Междунар. научно-практ. конф. - Краснодар, 2006.- С. 423-427.
2. Золотарев А.И. Коррекция биохимического статуса у телят при профилактике омфалита /А.И. Золотарев, Г.Г. Чусова, Н.В. Филатов // Актуальные проблемы патологии и морфологии животных: матер. Междунар. научно-практ. конф., посвящ. 100-летию со дня рождения проф. А.А.Авророва.- Воронеж, 2006.- С.С. 445-447.
3. Каверин Н.Н. Влияние селекора на параметры биохемилюминесценции плазмы крови телят / Н.Н. Каверин, Н.В. Филатов, Г.Н. Близнецова // В кн. Селекор. Биологическое действие.- М.: MAGERIC, 2006.- С. 141-147.
4. Артемьева С.С. Влияние селекора на окислительную модификацию белков у новорожденных телят / С.С.Артемьева, Г.Н. Близнецова, Н.В. Филатов // Актуальные проблемы патологии, фармакологии и терапии: матер. 1-ой Междунар. научно-практ. конф. молодых ученых, Воронеж, 2006.- С. 10-15.
5. Филатов Н.В. Динамика показателей углеводного обмена у здоровых и заболевших омфалитом новорожденных телят / Н.В. Филатов, А.И. Золотарев // Актуальные проблемы патологии, фармакологии и терапии: матер. 1-ой Междунар. научно-практ. конф. молодых ученых, Воронеж, 2006.- С. 114-116.
6. Филатов Н.В. Динамика изменения белковых фракций и иммуноглобулинов у здоровых и заболевших омфалитом новорожденных телят / Н.В. Филатов, А.И. Золотарев, Ю.Н. Масьянов //Актуальные проблемы патологии, фармакологии и терапии: матер. 1-ой Междунар. научно-практ. конф. молодых ученых.- Воронеж, 2006.- С. 117-120.
*7. Рецкий М.И. Окислительная модификация белков у телят в период постнатальной адаптации под влиянием селенсодержащего препарата Селекор / М.И. Рецкий, С.С.Артемьева, Н.В.Филатов, И.В. Доломатова // Сельскохозяйственная биология. Серия Биология животных, 2006, №6.- С. 98-100.
8. Методические рекомендации по диагностике, терапии и профилактике нарушений обмена веществ у продуктивных животных / М.И. Рецкий, А.Г. Шахов, В.И. Шушлебин, А.М. Самотин, В.Д. Мисайлов, Г.Г. Чусова, А.И. Золотарев, Д.В. Дегтярев, Т.Г. Ермолова, Н.В. Филатов и др. // В кн. Новые методы исследований по проблемам ветеринарной медицины». Ч.III. «Методы исследований по проблемам незаразной патологии у продуктивных животных. – М.: РАСХН, 2007.- С. 5-109.
9. Близнецова Г.Н. Влияние селеданта на окислительную модификацию белков и формирование колострального иммунитета у новорожденных телят / Г.Н. Близнецова, Н.В. Филатов, С.С. Артемьева, Ю.Н. Масьянов // Матер. 1-го съезда ветеринарных фармакологов России, Воронеж, 2007.- С. 131-136.
10. Каверин Н.Н. Влияние Селеданта на антиоксидантный статус новорожденных телят / Н.Н. Каверин, Н.В. Филатов, А.И. Золотарев, Д.В. Дегтярев // Матер. 1-го съезда ветеринарных фармакологов России, Воронеж, 2007.- С. 334-340.
*11. Рецкий М.И. Роль метаболического статуса в развитии омфалита у новорожденных телят / М.И. Рецкий, А.Г. Шахов, Н.В. Филатов, А.И. Золотарев, Г.Н. Близнецова, Ю.Н. Масьянов, Т.Г. Ермолова // Доклады Россельхозакадемии, 2007, №4. - С. 50-53.
12. Филатов Н.В. Состояние микроэлементного обмена у здоровых и заболевших омфалитом новорожденных телят/ Н.В. Филатов, В.И. Шушлебин // В сб. Актуальные вопросы ветеринарной медицины. Т.2 - Екатеринбург: Изд-во УрГСХА, 2007.- С.155-157.
13. Способ профилактики омфалита у новорожденных телят: пат. 2301060 Рос. Федерация:МПК А61К 31/245, 31/7036, 39/08 /А.И. Золотарёв, А.Г. Шахов, М.И. Рецкий, Г.Н. Близнецова, Н.В. Филатов; заявитель и патентообладатель ГНУ ВНИВИПФиТ.- 2006105366/13; заявл. 20.02.2006; опубл. 20.06.2007, Бюлл. №17- 7 с.
*- работы (7, 11) опубликованы в изданиях, рекомендованных ВАК РФ.
