«Гигиеническое воспитание по профилактике и лечению ожирения и метаболического синдрома»
| Вид материала | Лекция |
- Элективный цикл, 36.5kb.
- Превентивная программа лечения метаболического синдрома на базе клиники «Слатина», 31.01kb.
- Научная программа конференции: Эпидемиология метаболического синдрома. Новое в патогенезе, 40.17kb.
- Научная программа конференции предполагает обсуждение следующих вопросов: эпидемиологические, 46.92kb.
- Вивтаненко татьяна Владимировна Абдоминальный тип ожирения у детей и подростков как, 643.86kb.
- Избыточный вес и гипертония — особенные терапевтические подходы, 51.58kb.
- Тема проекта, 257.45kb.
- Распределение глюкозы, жирных кислот и холестерина в организме человека. Этиология, 138.29kb.
- Никифоров Алексей Геннадиевич Подпись: Преподаватель: Ногина Подпись: курсовая, 747.95kb.
- I всероссийская научно-практическая конференция молодых ученых по профилактике и лечению, 222.04kb.
Лекция
«Гигиеническое воспитание по профилактике
и лечению ожирения и метаболического синдрома»
Актуальность проблемы гигиенического воспитания в профилактике и лечении ожирения и метаболического синдрома.
В нашей стране проводятся интенсивные мероприятия, направленные на улучшение благополучия населения и качество медицинской помощи. Тем не менее, показатели средней ожидаемой продолжительности здоровой жизни и средняя продолжительность жизни в России пока уступает таковым ряда стран мира.
Сердечно-сосудистые заболевания являются самой частой причиной смерти и потери трудоспособности в Российской Федерации.
Как показали результаты крупных эпидемиологических исследований, заболевания, в основе патогенеза которых лежит атеросклероз, сокращают ожидаемую продолжительность жизни на 8-12 лет.
На протяжении последних пяти лет, в США на фоне снижения средних уровней содержания холестерина в популяции и количества лиц не неконтролируемой артериальной гипертонией, смертность от сердечно-сосудистых заболеваний снизилась более, чем на 20%.
В то же время, по данным ВОЗ, смертность в нашей стране от сердечно-сосудистых заболеваний за последние годы выросла, причем среди лиц женского пола темпы роста смертности выше, чем среди лиц мужского пола.
Так как же снизить заболеваемость и смертность от сердечно-сосудистых заболеваний? Необходимо проводить борьба с факторами риска на уровне популяции, внедрять методы выявления лиц с повышенным риском и использовать эффективные меры по профилактике и лечению заболеваний.
Как показали результаты исследования INTERHEART, 9 факторов риска ответственны за развитие нежелательных сердечно-сосудистых событий - инфаркта миокарда, мозгового инсульта и смерти в 95% случаев.
Сахарный диабет - одно из самых распространенных заболеваний в популяции, существенно повышающее риск развития нежелательных сердечно-сосудистых событий. Так, по данным ВОЗ, количество больных сахарным диабетом за последнее десятилетие почти удвоилось и составляет примерно 2.1% населения Земли. По своему влиянию на прогноз, сахарный диабет 2-го типа подобен перенесенному инфаркту миокарда. У больных сахарным диабетом 2-го типа существенно повышен риск развития ИБС, атеросклероза периферических артерий, ампутации конечностей, диабетической нейропатии, церебрального инсульта, потери зрения, почечной недостаточности, инвалидности.
Патогенез атеросклероза тесно связан с патогенезом сахарного диабета. Патогенез атеросклероза включает много факторов; атеросклероз развивается задолго до выявления СД 2 типа. Более чем у 50% больных с впервые выявляемым СД 2 типа имеется ИБС. СД повышает риск ОКС в 2-4 раза. Примерно 65% смертности от СД связано с ИБС, ЦВБ или ЗПА
Распространенность ожирения среди населения экономически развитых стран в настоящее время представляет собой не только медицинскую, но и социальную проблему. В индустриальных странах избыточная масса тела наблюдается у 25-30% взрослого населения. Согласно оценкам ВОЗ, в 2000 году на планете имелось более 300 миллионов человек с ожирением.
Учитывая, что изменения в генетическом аппарате не могут происходить так быстро, можно предположить, что основную роль в существенном увеличении распространенности ожирения играют такие факторы, как особенности питания и низкий уровень физической активности.
Актуальность обсуждаемой проблемы определяется появлением все большего числа доказательств существования причинно-следственной связи между избыточной массой тела и сердечно-сосудистыми заболеваниями. В частности, в исследовании Nurses Health Study увеличение относительного риска развития сердечно-сосудистых заболеваний отмечался на каждый дополнительный килограмм массы тела и составлял 3,1%.
Ожирение связано с целым рядом заболеваний, среди которых ишемическая болезнь сердца, артериальная гипертония, сахарный диабет 2 типа, некоторые злокачественные новообразования, а также синдром ночного апноэ. Исследования показали, что ожирение является независимым фактором риска сердечно-сосудистых заболеваний, более того, доказано, что ожирение повышает риск сердечно-сосудистых заболеваний также у детей. Действительно, существует зависимость между индексом массы тела и общей смертностью. Так, исследование, продолжавшееся в течение 31,5 лет, показало, что у лиц с индексом массы тела, превышавшим 95-й перцентиль из общей выборки, частота смерти от всех причин оказалась выше на 80% среди мужчин и на 100% среди женщин, по сравнению с лицами, показатели индекса массы тела которых находились в пределах между 25-м и 75-м перцентилями. По сравнению с лицами с индексом массы тела, соответствовавшим значениям в промежутке между 85-м и 95-м перцентилями, риск смерти от всех причин у лиц со значениями индекса массы тела, превышавшими 95-й перцентиль, был на 30% выше.
При наличии избыточной массы тела риск развития сердечно-сосудистых заболеваний и смерти от сердечно-сосудистых причин возрастает в 2 раза.
Степень риска резко повышается при ИМТ выше пороговых критериев ожирения. Увеличение риска при ожирении отчасти может быть обусловлено весьма распространенным сочетанием избыточной массы тела с другими факторами риска, такими как артериальная гипертония, дислипидемия, сахарный диабет 2 типа. Тем не менее, результаты многофакторного анализа после учета сопутствующих факторов риска убедительно свидетельствуют, что избыточная масса тела является независимым фактором риска сердечно-сосудистых осложнений.
В отношении ишемической болезни сердца получены данные эпидемиологических исследований, свидетельствующие, что ожирение является мощным предиктором развития заболевания. Это было продемонстрировано в исследованиях с участием от 1000 до 2000 человек среднего возраста, у которых в течение 10-18 лет относительная масса тела составляла 140% от нормы или индекс мессы тела (ИМТ) был более 30 кг/м2. Исследования Honolulu Heart Program и Paris Prospective Study позволили установить, что при любом значении ИМТ риск ишемической болезни сердца повышается двукратно для верхних квинтилей и децилей распределения индекса Trunk Fat Index. В исследовании Normative Aging Study была продемонстрирована обратная корреляция между возрастом, в котором развивается ожирение, и вероятностью ишемической болезни сердца. Как показали результаты исследований Framingham Heart Study и Manitoba Study, длительность наблюдения в которых составляла более 26 лет, ожирение является независимым предиктором риска ишемической болезни сердца у женрщин. В исследовании Study of Men Born in 1913, проведенном у мужчин, родившихся в 1913 году, и в нескольких других, менее крупных исследованиях, было выявлено, что ожирение абдоминального (висцерального) типа является независимым фактором риска ишемической болезни сердца (Schunkert H., 2002).
Таким образом, ожирение связано с повышенным риском заболеваемости и смертности, а также со снижением ожидаемой продолжительности жизни. У лиц с избыточным количеством жировой ткани наблюдаются нарушения структуры и функции сердца и сосудов, носящие отчасти приспособительный характер и наблюдаемые при отсутствии других причинных факторов и заболеваний. Неблагоприятное влияние ожирения на сердечно-сосудистую систему обусловлено его связью как с известными факторами риска, к которым относятся: дислипидемия, артериальная гипертония, нарушение толерантности к глюкозе, повышение уровня воспалительных маркеров в крови, синдром ночного апноэ/гиповентиляции так и с повышенным риском тромбообразования, а также с еще не известными факторами. Как результат, избыточный вес и ожирение напрямую или косвенно связаны с различными сердечно-сосудистыми заболеваниями, такими как ишемическая болезнь сердца, сердечная недостаточность или внезапная смерть.
Определение и диагностические критерии ожирения.
Под ожирением понимают нарушение обмена веществ, характеризующееся избыточным объемом жировой ткани, которое обладает тенденцией к прогрессированию в отсутствие специфической терапии. С целью количественной оценки выраженности ожире-ния была предложена формула индекса массы тела (индекс Кетле):
Индекс массы тела (ИМТ) = масса тела (кг)/рост (м)2
Предложенные ВОЗ критерии ожирения основывались на оценке увеличения индекса массы тела (ИМТ). Ожирение диагностировалось при значениях ИМТ, превышающих 30 кг/м2. Позднее было установлено, что показатель сердечно-сосудистого риска начинает возрастать при более низких значениях ИМТ (при уровне ИМТ приблизительно 25 мг/кг2), т. е. ниже диагностического порога ожирения. В соответствии с этими данными, значения ИМТ в диарпазоне от 25 до 29,9 кг/м2 было предложено рассматривать не как норму, а как «избыточную массу тела».
В клинической практике часто возникает необходимость оценки степени выраженности избытка массы тела.
Тем не менее, следует учитывать, что значения индекса Кетле не всегда достаточно точно характеризуют массу жировой ткани в организме, что обусловливает возникновение методических ошибок, особенно при оценке данного показателя у лиц среднего возраста.
В зависимости от характера распределения жировой ткани ожирение классифицируется на абдоминальное (мужской, или андроидный, тип ожирения), когда основная масса жировой ткани распределена в брюшной полости, на передней брюшной стенке и бедренно-ягодичное (женский, или гиноидный, тип) с преимущественной локализацией жировой ткани на бедрах и в ягодичной области. Дифференциальная диагностика типов ожирения проводится на основании значений индекса талия/бедро – отношения окружности талии (наименьшей окружности, измеренной ниже грудной клетки над пупком) к окружности бедер (наибольшей окружности, измеренной на уровне ягодиц):
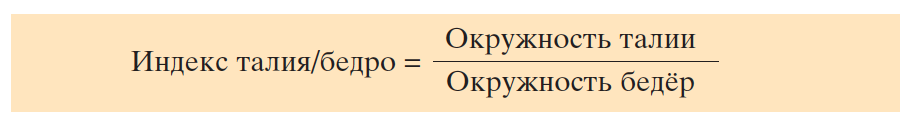
Возникающее в структуре метаболического синдрома ожирение носит черты андроидного с индексом талия/бедро более 0,9. Индекс талия/бедро от 0,8 до 0,9 расценивают как промежуточный, при его значениях менее 0,8 ожирение характеризуют как гиноидное.
Самым лучшим способом для выявления и оценки степени ожирения является метод измерения окружности пояса. Окружность пояса измеряется следующим образом: измерительная лента располагается параллельно полу, на уровне середины расстояния между нижним краем реберной дуги и остью подвздошной кости
Жировая ткань как орган внутренней секреции. Адипоцитокины.
Жировая ткань является не просто пассивным накопителем жира, но важным эндокринным органом, который способен синтезировать и выделять в кровоток различные важные биологически активные соединения пептидной и непептидной природы, которые играют важную роль в гомеостазе различных систем, в том числе, и сердечно-сосудистой системы.
Адипоцитокины регулируют обмен энергии, обмен глюкозы и липидов, сосудистый гомеостаз, иммунный ответ, репродукцию, участвуют в патогенезе ряда заболеваний.
Жировая ткань является важным источником фактора некроза опухолей альфа, интерлейкина-6, ингибитора активатора плазминогена (ИАП-1), резистина, липопротеиновой липазы, протеина, стимулирующего ацетилирование транспортного белка эфиров холестерина, протеина, связывающегося с сетчаткой глаза, эстрогенов (благодаря активности фермента ароматазы Р450, лептина, ангиотензиногена, адипонектина, инсулиноподобного фактора роста (ИФР-1), белка, связывающего ИФР и монобутирина. На сегодняшний день имеются данные о связи уровней в крови ингибитора активатора плазминогена (ИАП-1), ангиотензина II, С-реактивного протеина, фибриногена и фактора некроза опухолей альфа с индексом массы тела. Установлено, что примерно 30% всего циркулирующего в крови интерлейкина-6 синтезируется в жировой ткани. О значении этого фактора свидетельствует тот факт, что интерлейкин-6 стимулирует синтез С-реактивного белка в печени, а С-реактивный белок, в свою очередь, является маркером хронического воспаления, которое может способствовать развитию острого коронарного синдрома. Все это свидетельствует о том, что роль жировой ткани не может быть сведена к роли плацдарма метаболических процессов. Жировая ткань находится в центре сигнальных путей, при нарушении функционирования которых возникают неблагоприятные последствия для организма в целом.
Важное значение в развитии инсулинорезистентности придается таким биологически активным веществам, как ФНО-альфа и лептин, в связи с их влиянием на клеточные инсулин-опосредованные сигнальные пути. Экспрессия этих белков повышена у лиц с ожирением. Hotamisligil с соавт. (1993) по результатам экспериментов на грызунах первыми сообщили о наличии сильной зависимости между увеличением экспрессии ФНО-альфа при ожирении и развитием резистентности к инсулину и сахарного диабета 2 типа. В дальнейшем появились сообщения, что ФНО-альфа индуцирует фосфорилирование остатка серина в субстрате рецептора инсулина (IRS)-1, а фосфорирлированный таким образом IRS-1 действует как ингибитор активности инсулинового рецептора (Hotamisligil G.S. et al., 1996).
Отмечена зависимость между выраженностью избытка массы тела, снижением чувствительности тканей к инсулину и повышением уровня АД. Ожирение сопровождается также дисфункцией эндотелия и активацией ряда тромбогенных факторов. В частности, при ожирении повышается уровень фибриногена плазмы, нарушается фибринолиз, возрастает активность факторов VII и VIIа, увеличивается концентрация ингибитора активатора плазминогена. У больных с абдоминальным ожирением выявляются более высокие концентрации гомоцистеина в плазме, по сравнению с лицами, имеющими нормальную массу тела.
Жировая ткань является основным источником повышенного уровня ингибитора активатора плазминогена PAI-1 у лиц с ожирением. PAI-1 снижает активность фибринолитической системы способствует развитию сердечно-сосудистых осложнений; способствует дифференцировке адипоцитов; является фактором риска развития СД2 типа и смерти от ССЗ.
Лептин – гормон, который синтезируется адипоцитами, – не только является основным регулятором количества жира в организме, но и способствует уменьшению поступления пищи и повышению расхода энергии.
Он может также принимать участие в индукции резистентности к инсулину, возможно, благодаря периферическим эффектам. Лептин быстро активирует сигнальные пути, действуя непосредственно на чувствительные к инсулину ткани. Эти сигнальные пути частично перекрываются, однако отличаются от путей, посредством которых передаются сигналы инсулина. Таким образом, представленные данные свидетельствуют о том, что в развитии резистентности к инсулину необходимо участие других факторов.
Лептин и инсулин рассматриваются в качестве гормонов, опосредующих отрицательную обратную связь со структурами мозга, что позволяет поддерживать относительно постоянное содержание жировой ткани в организме.
Введение лептина или инсулина в ткани ЦНС приводит к дозозависимому эффекту в вирде снижения потребности в пище и уменьшения массы тела, причем эти эффекты не связаны с какими-либо патологическими последствиями и заболеваниями. Генетические аномалии, приводящие к уменьшению содержания лептина или нарушению передачи сигналов инсулина в ЦНС, связаны с повышением потребления пищи и развитием ожирения.
Значение гиперлептинемии при метаболическом синдроме выходит за рамки участия этого гормона в патогенезе ожирения. Так же, как и инсулин, лептин регулирует чувство насыщения, но его эффекты реализуются на уровне дугообразного ядра гипоталамуса (Filer J.S., 2000). Уровень лептина тесно коррелирует не только с ИМТ, но и с уровнем АД, активностью ангиотензина II и норадреналина плазмы, что свидетельствует о вероятной патогенетической взаимосвязи гиперлептинемии, активации нейрогуморальных систем и артериальной гипертонии у больных с ожирением.
Установлено, что уровень лептина в плазме, положительно коррелирует с массой жировой ткани.
Кроме того, уровень лептина в плазме является независимым фактором сердечно-сосудистого риска (Alpert M. A., 2002).
Адипонектин по строению имеет сходство с белками коллагена и синтезируется исключительно клетками белой жировой ткани. Молекула адипонектина состоит из 247 аминокислот с четырьмя функционально активными участками. Анализ кристаллической структуры позволяет также обнаружить сходство молекулы адипонектина со структурой ФНО-альфа, что предполагает эволюционную близость этих соединений и позволяет отнести адипонектин к данному семейству белков. В крови молекулы адипонектина образуют сложные многомерные структуры.
Основной структурной единицей является тример, состоящий из трёх молекул, соединенных глобулярным доменом. Более крупные образования – олигомеры, состоящие из 4-6 тримеров, циркулируют в крови в концентрации 5-30 мкг/мл.
Повышение уровней адипонектина отмечается при anorexia neurosa, у больных СД 1 типа, ХПН, при гиперинсулинемии.
В отличие от других адипоцитокинов, уровень которых существенно повышается при ожирении, содержание адипонектина в крови снижается. Это объясняется, вероятно, тем, что экспрессию и секрецию его подавляет ФНО-альфа. Увеличение уровня ФНО-альфа, наблюдающееся, помимо ожирения, при таких заболеваниях, как сахарный дибет, метаболический сидром, гиперлипидемия, сопровождается выраженным снижением концентрации адипонектина. Уровни адипонектина оказались достоверно ниже у мужчин, чем у женщин; у лиц пожилого возраста ниже, чем у молодых. Низкий уровень адипонектина в крови (гипоадипонектинемия) является независимым фактором риска развития ишемической болезни сердца и церебрального инсульта.
Наиболее важное свойство адипонектина заключается в его способности препятствовать развитию атеросклеротического процесса в сосудистой стенке. При этом он оказывает положительное действие на разные звенья патогенеза атеросклероза. Известно, что одним из важных этапов атеросклеротического процесса является дисфункция эндотелия и образование участков повреждения клеточного слоя эндотелия. Эти участки становятся «открытыми воротами» для проникновения в интиму липопротеидов низкой плотности, что впоследствии при их окислении способствует появлению воспалительной реакции при атерогенезе. Циркулирующие в крови молекулы адипонектина находят участки повреждения эндотелия и связываются с коллагеновыми волокнами субэндотелия. При этом большое количество молекул адипонектина обнаруживается в глубоких слоях интимы.
Адипонектин подавляет активность воспаления в сосудистой стенке, воздействуя на различные клетки – макрофаги, эндотелиоциты и гладкомышечные клетки. Под влиянием адипонектина подавляется экспрессия молекул адгезии – селектина Е, VCAM, ICAM. В результате уменьшается захват эндотелием моноцитов. Воздействуя на моноциты, адипонектин подавляет их активность по трансформации в макрофаги, уменьшает образование макрофагами цитокинов и факторов воспаления, снижает экспрессию скевенджер-рецепторов, что ведет к уменьшению захвата макрофагами липопротеидов низкой плотности. В результате подавляется формирование липидных пятен. Воздействуя на гладкомышечные клетки, адипонектин снижает их активность по трансфомации в секреторную форму.
Доказано, что на фоне гипергликемии уровни адипонектина в крови снижаются.
Подобным образом, уровни адипонектина снижаются на фоне гиперинсулинемии. Выявлена связь адипонектина и уровней артериального давления.
Грелин является пепетидным гормоном, который синтезируется как препрогормон эпителием дна желудка (а также клетками плаценты, почек, шишковидной железы). В практике грелин хорошо зарекомендовал себя как маркер статуса питания.
Висфатин был обнаружен в висцеральной жировой ткани и подкожной жировой клетчатке человека. Висфатин оказывает инсулиноподобной действие, снижает уровни сахара в крови и повышает захват глюкозы тканями.
Как показали исследования, в нестабильных коронарных и каротидных атеросклеротических бляшках экспрессия висфатина повышена. Не исключено, что висфатин является воспалительным медиатором, продуцируемым пенистыми клетками/макрофагами и участвует в дестабилизации атеросклеротической бляшки.
В 2001 году появились сообщения об открытии нового гормона, который получил название резистин в связи с вызываемым эффектом снижения чувствительности тканей к инсулину (Steppan C.M., Bailey S.T., Bhat S. et al., 2001; Steppan C.M., Brown E.J., Wright C.M. et al., 2001). Отсутствие у мышей гена транспортёра глюкозы (GLUT4), приводило к тому, что при нормальном росте животных и нормальном количестве жировой ткани имело место значительное нарушение стимулированного инсулином потребления глюкозы адипоцитами (Abel E.D., Peroni O., Kim J.K. et al., 2001).
Уровни резистина коррелируют с уровнями маркеров воспаления в крови. Несмотря на присутствие в мышцах мышей экспрессии GLUT4, в печени и мышцах развивалась резистентность к инсулину. Селективное истощение GLUT4 в жировой ткани приводило к снижению толерантности к глюкозе и к развитию резистентности к инсулину при сохранении у мышей массы жировой ткани. Следовательно, резистентность к инсулину в мышцах и в печени развивалась вторично, что подтверждается выявлением нарушений проксимального сигналинга и подавления физиологических реакций. Более того, резистентность к инсулину не может объясняться только изменением уровней циркулирующих свободных жирных кислот, триглицеридов, или лептина, или изменением экспрессии ФНО-альфа в жировой ткани. Результаты экспериментальных исследований показали, что селективное подавление экспрессии GLUT4 и транспорта глюкозы в жировой ткани может вызывать резистентность к инсулину и, вследствие этого, – увеличение риска развития сахарного диабета.
Было показано, что выраженность кальциноза коронарных артерий кореллирует с уровнями резистина. Несмотря на то, что большая часть синтезируется в печени, жировая ткань является основным внепеченочным источником ангиотензиногена, что обуславливает артериальную гипертензию при ожирении . Доказано, что ангиотензин II стимулирует образование новой жировой ткани и увеличению её массы.
Неэстерифицированные жирные кислоты. НЭЖК образуются из триглицеридов в жировой ткани в результате липолиза и являются основным источником энергии во время голодания. Липолиз ингибируется инсулином. При ожирении и резистентности к инсулину продукция НЭЖК превышает потребность, что приводит к повышению их содержания.
Избыток НЭЖК приводит к развитию инсулинорезистентности, усилению глюконеогенеза и продукции глюкозы, а также активации атерогенеза и развитию атерогенной дислипидемии. Также отмечается накопление жира в печени, вследствие которого усиливается печеночный синтез ингибитора активатора плазминогена (PAI-1), фибриногена и воспалительных белков.
Как при ожирении, так и при сахарном диабете 2 типа увеличение уровня свободных жирных кислот в крови сопровождается повышением уровня холестерина липопротеидов низкой плотности, а также достаточно часто – к снижению уровня липопротеидов высокой плотности, что повышает риск развития ишемической болезни сердца.
Инсулинорезистентность.
Определение: инсулинорезистентность - нарушенное взаимодействие инсулина с его рецепторами в периферических тканях.
Роль генетических факторов в развитии резистентности к инсулину и сахарного диабета 2 типа общепризнанна. Тем не менее, ожирение рассматривается в качестве наиболее значимого конституционального фактора риска развития сахарного диабета 2 типа.
Повышение массы тела и абдоминальный тип отложения жира приводят к возрастанию потребности в инсулине, что в свою очередь способствует развитию гиперинсулинемии и сахарного диабета 2 типа, а также ряда других изменений, характерных для метаболического синдрома. К развитию инсулинорезистентности у больных с ожирением предрасполагают также дислипидемия и нарушения гормональной регуляции. Повышение уровней свободных жирных кислот в плазме, часто выявляемое у больных с ожирением, может приводить к нарушению чувствительности периферических тканей к инсулину.
Сахарный диабет 2 типа и ожирение сопровождаются формированием кластера атерогенных изменений.
Клинически о наличии инсулинорезистентности можно предполагать у больных с признаками ожирения, нарушенной толерантности к глюкозе, артериальной гипертонии и атеросклероза.
Оценить степень выраженности инсулинорезистентности и динамику ее изменения позволяют лабораторные методы исследования, на основании результатов которых рассчитывается ряд показателей.
Показано, что у больных с впервые выявленным сахарным диабетом 2-го типа недиагносцированная инсулинорезистентность могла иметь место на протяжении 5-10 лет.
Как показали результаты Paris Prospective Study, риск смерти от сердечно-сосудистых заболеваний коррелирует с уровнями инсулина в плазме крови.
В этом же исследовании было показано, что риск смерти выше у больных с сочетанием повышения уровней общего холестерина и триглицеридов в плазе крови.
Ожирение является причиной развития атерогенной дислипидемии, характеризующейся гипертриглицеридемией, снижением уровней Хс ЛВП и повышением уровней Апо B (Хс ЛОНП).
В то время как у больных ишемической болезнью сердца прогностическая значимость определения апобелков в плазме крови вызывает сомнения, в первичной профилактике, а особенно у лиц с ожирением и метаболическим синдромом, определение уровней АроВ и АроА1 позволяет выявить больных с повышенным риском развития нежелательных сердечно-сосудистых событий.
Изменения гемодинамики у лиц с ожирением.
Известно, что жировая ткань содержит хорошо развитую капиллярную сеть. Адипоциты располагаются очень близко к кровеносным сосудам, благодаря чему расстояние для транспорта молекул между капиллярами и адипоцитами очень невелико; стенка этих капилляров обладает высокой проницаемостью, и гидростатическое давление внутри этих сосудов относительно низкое.
В покое кровоток составляет примерно 2-3 мл/мин на 100 г жировой ткани. Однако он может увеличиваться до 10 раз, достигая величины примерно 20 мл/мин на 100 г ткани. Для сравнения, кровоток в скелетной мускулатуре способен увеличиваться до 50-75 мл/мин на 100 г мышечной ткани. Кровоток в жировой ткани увеличивается после приема пищи, однако у лиц с ожирением и метаболическим синдромом регуляция кровотока в жировой ткани, как правило, нарушена. Общий вес жировой ткани составляет значительную часть веса тела. В межклеточном пространстве жировой ткани находится большое количество жидкости. Избыток жидкости в жировой ткани у лиц с ожирением может иметь неблагоприятные по-следствия при сердечной недостаточности, особенно при переходе накопленной жидкости в общий кровоток. Однако, как правило, внутренние регуляторные механизмы препятствуют этому перераспределению. Так, кровоток в жировой ткани регулируется берта-1 адренорецепторами, активация которых вызывает вазодилатацию, в то время как в ткани скелетной поперечно-полосатой мускулатуры кровоток регулируется преимущественно бета-2 адренорецепторами. Вследствие этого, при снижении кровотока в жировой ткани, жидкость из межклеточного пространства не поступает в систему общей циркуляции.
Несмотря на то, что при увеличении содержания жира в организме сердечный выброс увеличивается, перфузия жировой ткани оказывается не только не повышена, но, наоборот, снижена. Так, при увеличении содержания жира с 15% до 36% и более, кровоток в жировой ткани снижается с 2,36 мл/мин до 1,53 мл/мин на 100 г ткани, то есть примерно на 35%. В связи с этим, повышение системного кровотока у лиц с ожирением не может быть просто объяснено повышением перфузии жировой ткани, так как степень васкуляризации жировой ткани гораздо ниже степени васкуляризации других тканей и органов в организме. Вероятной причиной такого увеличения сердечного выброса является возможное сопутствующее увеличение массы других тканей и органов. Действительно, исследования показывают, что увеличение ударного объема, сердечного выброса и массы миокарда левого желудочка в большей степени зависят не от массы жировой ткани, а от массы других тканей и органов.
Ожирение приводит к увеличению общего объема крови и сердечного выброса, что является отчасти следствием увеличения массы тела и повышенной активности метаболических процессов. Таким образом, при ожирении рабочая нагрузка на миокард всегда выше, чем у лиц без ожирения. У лиц с ожирением отмечается более высокий сердечный выброс и относительно низкое общее периферическое сопротивление, чем у лиц с нормальным весом тела. Повышение сердечного выброса при ожирении связано в основном с повышенным ударным объемом, в то время как частота сердечных сокращений, если и увеличивается, то незначительно. При ожирении кривая Франка-Старлинга смещается влево вследствие увеличения давления наполнения и объема левого желудочка, что со временем может приводить к расширению полостей сердца. Расширение полости левого желудочка может приводить к повышению механического напряжения стенки левого желудочка, что, в свою очередь, сопровождается увеличением массы миокарда и, в конечном итоге – к гипертрофии левого желудочка, преимущественно эксцентрического типа. У лиц с ожирением без признаков артериальной гипертонии может происходить и увеличение полости левого предсердия, но это, как правило, наблюдается у лиц с увеличенной массой левого желудочка. Увеличение левого предсердия является следствием не только нарушения диастолической функции левого желудочка, но также результатом физиологической адаптации к увеличенному объему крови. В результате увеличения размеров полости левого предсердия, при ожирении отмечается повышенный риск развития мерцательной аритмии. Сопутствующие ожирению артериальная гипертония и гипертрофия левого желудочка повышают вероятность развития нежелательного ремоделирования левого предсердия и возникновения мерцательной аритмии.
Лицам с ожирением для снижения массы тела часто помимо прочих рекомендаций предлагают увеличить физическую активность, однако следует учитывать, что при ожирении во время выполнения физической нагрузки сохраняется повышенный уровень давления наполнения левого желудочка. Повышенный сердечный выброс при выполнении физической нагрузки обычно сопровождается увеличением давления наполнения левого желудочка более чем на 20 мм рт. ст. Таким образом, у лиц с ожирением в покое давление наполнения левого желудочка уже находится на уровне верхней границы нормальных значений, а при выполнении физической нагрузки оно возрастает в еще большей степени. Подобные особенности гемодинамики характерны для артериальной гипертонии, и, соответственно, у лиц с ожирением при выполнении физической нагрузки повышаются давление наполнения правого желудочка, систолическое давление правого желудочка, сердечный выброс и индекс сосудистого сопротивления в малом круге кровообращения. Увеличение сосудистого сопротивления в малом круге кровообращения может отражать наличие легочного заболевания, нарушения функции левого желудочка, или синдрома ночного апноэ/гиповентиляции. При повышении венозного возврата к сердцу, даже небольшое увеличение объема центрального кровотока сопровождается существенным увеличением конечного диастолического давления левого желудочка.
Эксцентрическая гипертрофия левого желудочка, которая обычно наблюдается у лиц с тяжелыми формами ожирения (индекс массы тела более 40 кг/м2) часто сопровождается нарушением диастолической функции левого желудочка. Более того, как и в случае увеличения массы миокарда левого желудочка, с течением времени ожирение приводит к нарушению сократительной функции миокарда, что ведет к еще большему ухудшению диастолического наполнения левого желудочка. Факторами риска развития нарушения систолической функции левого желудочка являются возраст и гипертрофия левого желудочка концентрического типа. У человека и некоторых млекопитающих развитие ожирения приводит не только к увеличению количества жира в типичных местах его депонирования, но и к значительному накоплению жира в различных внутренних органах. Увеличение количества жира в органах и тканях может приводить к нарушению их функций по двум путям:
- при значительном увеличении жировой прослойки, окружающей некоторые важные органы, функция их может нарушаться за счет внешней компрессии или как результат синтеза биологически активных адипоцитокинов жировой тканью;
- накопление липидов может происходить не только в жировых клетках, но и в клетках других типов, вследствие чего функциональная активность клеток снижается или клетки могут подвергаться апоптозу.
Изменения в миокарде у лиц с ожирением.
Нарушения клеточной адаптации могут проявляться в миокарде, и наиболее типичным проявлением таких нарушений является развитие кардиомиопатии. Кардиомиопатия, возникающая на фоне ожирения, была впервые описана Чейном в 1818 году. Данный случай интересен еще и тем, что у этого больного наблюдался осорбый тип дыхания, впоследствии получивший название дыхания Чейн-Стокса. Впоследствии было опубликовано большое количество работ, в которых было описано избыточное накопление жира в эпикарде и в миокарде, имеющее вид жировой инфильтрации миокарда, которые расценивались в качестве структурных изменений, приводящих к нарушениям сократительной функции миокарда. Процессы, происходящие в сердце на начальных этапах, носят метапластический характер. При этом метаплазия является обратимым процессом, при котором один тип зрелых клеток (эпителиальных или мезенхимальных) заменяется другим типом зрелых клеток. Вначале в миокарде появляются клеточные тяжи, которые постепенно накапливают жир между мышечными волокнами, впоследствии развивается дегенерация кардиомиоцитов. Тяжи, состоящие из жировых клеток, могут располагаться изолированно в толще миокарда или или иметь вид образований, берущих начало от эпикардиальных адипоцитов и проникающих вглубь миокарда. Замещаться жиром могут клетки как синусового, так и атриовентрикулярного узла, правой ножки пучка Гиса, а также миокарда правого желудочка в области предсердно-желудочкового соединения. В редких случаях жировая кардиомиопатия имеет вид рестрирктивного процесса. В этом случае мелкие участки и включения жировой ткани разделяют кардиомиоциты, что является результатом атрофии клеток миокарда под воздействием давления, оказываемого жировыми скоплениями. Другой процесс, имеющий место при ожирении, заключается в липоцитотоксичном воздействии на клетки миокарда, оказываемом свободными жирными кислотами, при этом кардиомиоциты, содержащие избыточное количество липидов, становятся менее устойчивыми к нагрузке, воздействию катехоламинов и в них раньше возникают процессы апоптоза. В результате этого общее количество кардиомиоцитов в миокарде уменьшается. Таким образом, в основе возникновения сердечной недостаточности при ожирении лежат различные процессы: увеличение объема внутрисосудистой жидкости, увеличение сердечного выброса, гипертрофия миокарда, нарушение диастолической функции левого желудочка и жировая кардиомиопатия.
Артериальная гипертония и ожирение.
У лиц с ожирением, независимо от пола, артериальная гипертония наблюдается в 6 раз чаще, чем у лиц без ожирения. Увеличение массы тела в молодом возрасте является фактором, способствующим появлению артериальной гипертонии в возрасте после 50 лет. Показано, что повышение массы тела на 10 кг связано с повышением уровня систолического артериального давления на 3 мм рт. ст., а диастолического – на 2,3 мм рт. ст. Это увеличение уровня артериального давления соответствует повышению риска развития ишемической болезни сердца на 12% и мозгового инсульта – на 24%. Результаты исследования NHANES III позволили получить дополнительные данные, свидетельствующие о близкой связи значения индекса массы тела с артериальной гипертонией и риском сердечно-сосудистых заболеваний. Так, среди мужчин с индексом массы тела более 30 кг/м2, количество больных артериальной гипертонией в 3 раза больше, чем среди лиц с индексом массы тела менее 25 кг/м2 (42% против 15%). У женщин также наблюдается подобная закономерность – среди лиц с индексом массы тела менее 25 кг/м2 частота встречаемости лиц с артериальной гипертонией не превышает 15%, тогда как при значениях индекса массы тела более 30 кг/м2 артериальная гипертония выявляется у 38%. Подобные закономерности отмечаются как среди лиц европейского происхождения, так среди чернокожих и мексиканцев.
Следует отметить, что у лиц с избыточной массой тела могут возникать определенные трудности при измерении артериального давле-ния по методу Короткова, при использовании которого могут быть получены несколько завышенные результаты измерения. Влияние избыточной массы тела на артериальное давление особенно выражено у лиц с абдоминальным ожирением. Факторы, участвующие в развитии артериальной гипертонии при избыточной массе тела, включают увеличение сердечного выброса и общего периферического сосудистого сопротивления. Ожирение оказывает непосредственное влияние на центральную и периферическую гемодинамику, вызывая эндотелиальную дисфункцию, способствуя усилению активности симпатической нервной системы, появлению инсулинорезистентности, синдрома ночного апноэ и усилению образования биологически активных соединений адипоцитокинов – интерлейкирна-6, фактора некроза опухолей альфа, и т. д.
Ожирение само по себе способствует появлению существенных изменений гемодинамики. Повышение потребности в кислороде, связанное с избыточной массой жировой ткани (≈1,5 мл/кг в минуту), вызывает увеличение сердечного выброса. Параллельно увеличению сердечного выброса, увеличивается объем циркулирующей крови. У лиц с нормальным артериальным давлением подобные изменения центральной гемодинамики должны сопровождаться снижением общего сосудистого сопротивления. Однако у лиц с ожирением общее сосудистое сопротивление или находится в пределах средних, «нормальных», значений, или повышено. Таким образом, принято считать, что основным фактором, от которого зависит повышение артериального давления у лиц с избыточным весом, является величина общего периферического сосудистого сопротивления.
Метаболический синдром.
Метаболический синдром представляет собой сочетание взаимозависящих факторов риска, связанных с изменением обмена веществ в организме, - так называемых метаболических факторов риска, которые непосредственно способствуют развитию атеросклероза и нежелательных острых атеротромботических событий.
Еще в 1923 г: Kylin указывал на неблагоприятное сочетание АГ, подагры и гипергликемии. В 1988 г Reaven ввел понятие “Метаболический синдром X”, сочетающий артериальную гипертонию, гипергликемию, нарушенную толерантность к кглюкозе, гипертриглицеридемию, и снижение уровней Хс ЛВП.
При метаболическом синдроме на фоне действия так называемых первичных факторов риска, включающих абдоминальное ожирение, инсулинорезистентность, сниженную физическая активность, гормональные нарушения (менопауза) и возраст, создаются условия для возникновения вторичных метаболических факторов риска: атерогенной дислипидемии
(↑ТГ, ↑апо В, ↑мелких частиц ЛНП, ↓ Хс ЛВП), артериальной гипертонии, гипергликемии, повышения риска тромбообразования, активации системного вялотекущего воспаления и др.
В финском исследовании (The Kuopio Ischaemic Heart Disease Risk Factor Study), целью которого было оценить влияние метаболического синдрома на общую смертность и смертность от сердечно-сосудистых заболеваний, было показано, что у лиц с метаболическим синдромом существенно повышен риск развития всех нежелательных сердечно-сосудистых событий.
Несмотря на большое количество факторов, участвующих в патогенезе метаболического синдрома, для его диагностики достаточно выявление 3 факторов из пяти. Помимо ожирения и инсулиновой резистентности, на каждый фактор риска, входящий в состав метаболического синдрома, в свою очередь оказывают влияние как внутренние, генетические, так и внешние факторы. Это приводит к широкому диапазону выраженности изменений и взаимному влиянию различных факторов риска. Например, на метаболизм липопротеидов оказывают влияние генетические факторы, в связи с чем вероятность развития и выраженность дислипидемии, обусловленной ожирением и/или инсулиновой резистентностью, у различных лиц значительно варьирует. Это также справедливо и в отношении регуляции артериального давления. Более того, уровень глюкозы в крови зависит как от возможности секретировать инсулин, так и от выраженности инсулиновой резистентности. При изучении причин развития метаболического синдрома следует принимать во внимание многие факторы, влияющие на развитие патологических изменений, наблюдающихся при метаболическом синдроме.
Увеличение возраста оказывает влияние на все звенья патогенеза, что, по всей вероятности, позволяет объяснить высокую распространенность метаболического синдрома среди пожилых лиц. Недавно было выявлено, что вялотекущее воспаление напрямую связано как с развитием инсулиновой резистентности, так и с атерогенезом. И наконец, обнаружено, что изменения в содержании гормонов оказались связаны с нарушениями в перераспределении жировой ткани в организме и, соответственно, косвенно – с метаболическим синдромом. Таким образом, патогенез метаболического синдрома является достаточно сложным и требует дальнейшего изучения.
Различными профессиональными обществами были предложены целый ряд критериев, позволяющих диагносцировать метаболичесий синдром. ATP III (The National Cholesterol Education Program’s Adult Treatment Panel III –комиссия по лечению атеросклероза у взрослых, действующая в рамках Национальной образовательной программы). Метаболический синдром диагностируется в том случае, если выявляются 3 из 5 представленных ниже критериев. Абдоминальная форма ожирения, определяемая как увеличение окружности талии, в классификации АТР III рассматривается как главный признак и находится на первом месте. Это отражает приоритетное значение, придаваемое абдоминальной форме ожирения в развитии метаболического синдрома. Среди диагностических критериев представлены также повышенные уровни триглицеридов, сниженное содержание холестерина ЛПВП в плазме крови, увеличение артериального давления и повышенный уровень глюкозы в крови. Следует обратить внимание на то, что для диагноза метаболического синдрома по критериям АТР III нет необходимости документально подтверждать наличие инсулиновой резистентности, хотя она присутствует у большинства лиц, соответствующих представленным критериям диагноза. И наконец, наличие сахарного диабета 2 типа не исключает диагноза метаболического синдрома.
В 1998 году группа экспертов ВОЗ предложила модифицированную классификацию сахарного диабета, в которую были включены определение и критерии метаболического синдрома. Согласно определениям ВОЗ, основным исходом метаболического синдрома является развитие сердечно-сосудистых заболеваний.
Однако, в отличие от классификации ATP III, необходимым критерием диагноза метаболического синдрома является наличие инсулиновой резистентности. Инсулиновая резистентность диагностируется на основании выявления одного из перечисленных признаков: сахарный диабет 2 типа, повышение уровня глюкозы в крови натощак, нарушение толерантности к глюкозе или нарушение транспорта глюкозы в ткани при проведении эугликемического гиперинсулинового клэмп-теста. Кроме выявления инсулиновой резистентности, для диагноза метаболического синдрома необходимо наличие хотя бы двух факторов риска. В отличие от критериев ATP III, определение ВОЗ включает наличие артериальной гипертонии. Вместо окружности талии используется индекс массы тела (или соотношение окружности талии к окружности бедер). Также в число критериев включена микроальбуминурия. Включение в качестве необходимого критерия выявления объективных признаков инсулиновой резистентности должно привести к тому, что развитие сахарного диабета 2 типа будет чаще встречаться в качестве исхода метаболического синдрома, диагностированного на основании классификации ВОЗ.
Так же, как в классификации ATP III, выявление сахарного диабета 2 типа не исключает диагноза метаболического синдрома. Основным недостатком критериев ВОЗ является то, что, помимо обычного клинического обследования, для выявления метаболического синдрома необходимо проводить дополнительное специальное обследование состояния углеводного обмена.
Еще один вариант диагностических критериев метаболического синдрома предлагает Американская ассоциация клинических эндокринологов.
Представленная классификация является как бы обобщающей, включающей основные критерии метаболического синдрома АТР III и ВОЗ. Однако здесь нет определенных четких критериев, и диагноз у каждого конкретного больного устанавливается лечащим врачом на основании клинической картины. Когда у больного развивается сахарный диабет, термин «метаболический синдром» уже не используется. У больных с подозрением на наличие метаболического синдрома без повышения уровня глюкозы натощак, необходимо проведение теста толерантности к глюкозе или определения уровня глюкозы в крови. При этом, в качестве диагностического критерия используется уровень глюкозы через 2 часа после приема пищи (или нагрузочной дозы глюкозы) более 140 мг/дл. Выявление повышенного уровня глюкозы в крови через 2 часа после пищевой нагрузки также будет является предиктором развития сахарного диабета 2 типа.
Согласно классификациям ВОЗ и американской ассоциации клинических эндокринологов, одними из критериев диагноза метаболического синдрома являются нарушение толерантности к глюкозе или повышенный уровень глюкозы в крови через 2 часа после пищевой нагрузки, определяемые на основании перорального терста толерантности к глюкозе. Однако классификация АТР III не включает эти критерии в связи с дополнительными расходами, которые подразумевает проведение этого теста, а также с неоднозначной оценкой его результатов. Так, дополнительная проргностическая значимость перорального теста толерантности к глюкозе для оценки риска развития сердечно-сосудистых заболеваний невелика. Предлагается использовать этот тест у больных c метаболическим синдромом без сахарного диабета при наличии более двух метаболических факторов риска. Положительной стороной теста толерантности к глюкозе является возможность объективного выявления нарушенной толерантности к глюкозе, которая является одним из факторов, позволяющих диагностировать метаболический синдром. Так, если бы наличие нарушенной толерантности к глюкозе было добавлено к критериям диагноза метаболического синдрома АТР III, частота встречаемости метаболического синдрома среди лиц старше 50 лет увеличилась бы на 5%. Нарушение толерантности к глюкозе связано с повышенным риском развития сахарного диабета 2 типа. Постпрандиальная гипергликемия у больного с нарушенной толерантностью к глюкозе подразумевает наличие самого сахарного диабета, являющегося фактором риска сердечно-сосудистых заболеваний.
Независимо от того, какие критерии использовались для диагностики метаболического синдрома, его выявление означает, что риск нежелательных сердечно-сосудистых событий в течение последующих 10 лет повышен в 1.5-2 раза.
Как показали результаты исследования Finnish Diabetes Prevention Study, лечение метаболического синдрома сопровождалось снижением риска развития сахарного диабета 2-го типа на 58%.
Лечение больных с метаболическим синдромом подразумевает в первую очередь снижение веса. При этом, ни в одном из клинических исследований не было показаны, что медикаментозные средства, «улучшающие» инсулиновую резистентность, способствовали бы улучшению прогноза.
Лечение метаболического синдрома также подразумевает коррекцию атерогенной дислипидемии. Обратите внимание на то, что «нормализация» артериального давление при помощи медикаментозных средств не сопровождается элиминацией метаболического синдрома.
Показано, что у лиц с повышением уровней общего холестерина и холестерина липопротеинов низкой плотности следует исключить жирную пищу, уменьшить потребление мяса до 170 г/день, холестерина пищи - до <200 мг/день, а также уменьшить употребление продуктов, содержащих транс-изомеры жирных кислот.
У лиц с повышением уровней триглицеридов и снижением уровней холестерина липопротеинов низкой плотности целесообразно ограничить употребление легкоусвояемых углеводов, алкоголя и продуктов, содержащих транс-изомеры жирных кислот.
Снижение веса.
Снижение массы тела у лиц с ожирением позволяет снизить риск или предотвратить развитие многих сердечно-сосудистых заболеваний. Современные методы лечения ожирения основаны на создании отрицательного баланса затраченной организмом пациента и поступившей с продуктами питания энергии и включают диетическое питание, физические упражнения, медикаментозное и хирургическое лечение. Лечение таких пациентов должно сопровождаться рекомендациями, касающимися изменения образа жизни.
При уменьшении массы тела отмечается пропорциональное снижение потребления кислорода в покое, что сопровождается уменьшением сердечного выброса. Минутный объем снижается параллельно уменьшению массы тела. Наблюдается снижение артериального давления, однако системное сосудистое сопротивление при этом практически не изменяется. Отмечается тенденция к снижению давления заклинивания легочной артерии, однако оно остается достаточно высоким относительно сердечного выброса, по сравнению с лицами с нормальным весом. Нарушения сократительной функции левого желудочка могут сохраняться в течение долгого времени и быть наиболее заметными при выполнении физической нагрузки. При любом уровне сердечного выброса, у лиц с ожирением после снижения веса давление в правых отделах сердца выше, чем у лиц без ожирения, конечное диастолическое давление в левом желудочке у них также повышено.
Даже в тех случаях, когда на фоне снижения веса происходит снижение массы миокарда левого желудочка, только в 14-25% случаев это снижение может быть объяснено исключительно снижением веса тела. Вероятно, наиболее важным показателем, изменяющимся при снижении веса, является снижение артериального давления и связанное с этим изменение уровней катехоламинов в крови. Механизмы, связанные с повышенной активностью симпатической нервной системы, участвуют в развитии гипертрофии миокарда левого желудочка, и снижение веса сопровождается уменьшением активности симпатической нервной системы, о чем свидетельствует снижение уровней норадреналина в плазме крови и экскреции норадреналина с мочой. Ренин-ангиотензиновая система может также быть вовлечена в патогенез формирования гипертрофии левого желудочка при ожирении, в результате чего снижение веса может приводить к снижению уровней альдостерона и уменьшению активности ренина в плазме крови. Уменьшение степени гиперинсулинемии также может сопровождаться снижением массы миокарда левого желудочка у больных с ожирением и артериальной гипертонией, так как показано, что уровни инсулина в крови являются одним из факторов, способствующих развитию гипертрофии миокарда левого желудочка. Механизмы, объясняющие связь между гиперинсулинемией и гипертрофией левого желудочка, пока остаются неизвестными, однако при гиперинсулинемии в миокарде происходят изменения, подобные изменениям, наблюдающимся под влиянием гормона роста. Также большое значение имеет уменьшение активности ангиотензинпревращающего фермента на фоне снижения массы тела.
Как показали результаты исследований, на фоне снижения веса при помощи разных способов, например голодания, изолированной белковой диеты, низкокалорийной диеты и даже хирургического вмешательства, отмечается удлинение интервала QT. Степень удлинения интервала QT не зависит от белкового состава диеты или добавления витаминов или микроэлементов в рацион. Более того, как показали результаты суточного мониторирования ЭКГ, использование в качестве диеты жидких растворов белков сопровождалось развитием потенциально опасных нарушений ритма. Наблюдения свидетельствуют о том, что смерть в подобных случаях наступала от желудочковой тахикардии (по типу «torрsade de pointes») и фибрилляции желудочков, рефрактерных к назначению лидокаина, пропранолола, фенитоина, мексилетина, дирзопирамида и прокаинамида. Тем не менее, подобные диеты продолжают использоваться и по сей день. При использовании лечебрной диеты следует уделять внимание адекватному употреблению витаминов и минеральных веществ, а также выявлять возможные осложнения.
На сегодняшний день из всех медикаментозных средств, позволяющих снизить вес, наиболее безопасными и разрешенными к применению в большинстве стран мира являются орлистат и сибутрамин.
Действие орлистата связано с нарушением всасывания жиров в тонкой кишке.
Длительный прием препарата позволяет снизить вес примерно на 10-15 кг.
При этом, на фоне действия орлистата отмечается снижение уровней холестерина липопротеинов низкой плотности.
На данном слайде представлена частота развития вероятных побочных действий на фоне приема орлистата.
Сибутрамина гидрохлорид является препаратом с центральным механизмом действия, он разрешен к длительному применению и не обладает нежелательным действием на клапаны сердца. Однако на фоне его приема может отмечаться повышение артериального давления и частоты сердечных сокращений, в связи с чем сибутрамин не рекомендуется к назначению у больных гипертонической болезнью, ишемической болезнью сердца, с недостаточностью кровообращения, нарушениями ритма или нарушениями мозгового кровообращения.
Как показали результаты проведенных исследований, эффективность сибутрамина при прерывистом приеме не уступает таковой при длительном постоянном приеме
После отмены сибутрамина действие препарата сохраняется в течение длительного времени.
Для эффективного лечения ожирения и метаболического синдрома медикаментозной терапии недостаточно. Следует комбинировать диетотерапию, медикаментозную терапию и физические нагрузки.
Эффективность снижения веса тела с помощью диеты с низкой и очень низкой калорийностью изучалась в большом количестве исследований. Суть низкокалорийной диеты состоит в том, чтобы энергетическая ценность потребляемой пищи составляла от 1000 до 1500 ккал в сутки. Это достигается различными способами, например, путем ограничения потребления жира или уменьшением порций отдельных продуктов. Рекомендуемые пропорции пищевых компонентов в рационе (по АТР III) представлены в таблице 10. В большинстве клинических исследований длительностью от 3 до 12 месяцев было показано, что соблюдение низкокалорийной диеты приводило к снижению массы тела в среднем на 8% по сравнению с исходными значениями. Диета с очень низкой калорийностью (<800 ккал/сут) является более строгой, при этом больной должен находиться под тщательным медицинским контролем. Клинические эффекты этого вида диеты более выражены – снижение массы тела достигает 15-20%, однако частота возврата к прежней массе тела более высокая, а результаты диетотерапии через 1 год не лучше, чем при назначении низкокалорийной диеты (Wadden T.A. et al., 1989; 1994).
Роль физических упражнений в профилактике нежелательных сердечно-сосудистых событий высока. Регулярные аэробные физические упражнения позволяют не только нормализовать массу тела, но и улучшить функциональные параметры сердечно-сосудистой системы, поэтому пациентам следует рекомендовать активный образ жизни. Физическую активность рассчитывают, исходя из того, что на выполнение упражнений должно затрачиваться не менее 250 ккал в день. Регулярные физические нагрузки повышают чувствительность тканей к инсулину, улучшают липидный спектр крови. Больным необходимо рекомендовать выполнять умеренные аэробные нагрузки, например, ходьбу на свежем воздухе не менее 30 минут в день, не реже 5 раз в неделю.
Показано, что умеренная физическая активность (физические нагрузки умеренной интенсивности до 6 часов в неделю) снижает риск нежелательных сердечно-сосудистых событий примерно на треть. При этом, по мере повышения тренированности, следует постепенно повышать интенсивность занятий, что позволит снизить риск нежелательных сердечно-сосудистых событий еще в большей степени.
В настоящее время с целью снижения массы тела применяются различные хирургические вмешательства, основанные на двух принципах: 1) уменьшение объема желудка, приводящее к ограничению объема пищи, в сочетании с формированием кишечного анастомоза или без него (т. е. создание «физиологического демпинга») и 2) искусственное создание синдрома мальабсорбции.
Показаниями для проведения у больных подобных хирургических операций являются:
- Увеличение массы тела, не имеющее тенденции к снижению:
- превышение на 45,5 кг или на 100% идеальной массы тела на протяжении не менее 5 лет;
- ИМТ более 40 кг/м2;
- ИМТ более 35 кг/м2 при наличии сопутствующих заболеваний.
- Неэффективность медикаментозных способов уменьшения массы тела.
- Психологическая стабильность:
- отсутствие неконтролируемых психических заболеваний;
- отсутствие склонности к перееданию;
- понимание риска и благоприятных эффектов хирургической операции;
- согласие на изменение образа жизни и регулярные визиты к врачу.
В настоящее время наиболее часто используют следующие варианты хирургических операций: гастропластика с вертикальным бандажированием желудка, наложение обходного желудочного анастомоза по Ру и наложение билиапанкреатического обходного анастомоза. Все вышеперечисленные операции приводят к значительному снижению массы тела и во многих случаях сопровождаются уменьшением выраженности имевшихся ранее метаболических нарушений.
В заключение, следует отметить, что требования к профилактике нежелательных сердечно-сосудистых событий, которые ставит перед нами новый век, подразумевают смену концепций самой профилактике. Для того, чтобы выявлять лиц с повышенным риском нежелательных сердечно-сосудистых событий необязательно использовать дорогостоящие методы лабораторной или инструментальной диагностики или искусственно создавать «новые синдромы». Всем пациентам, которые не соответствуют критериям «идеального здоровья», следует рекомендовать те или иные медикаментозные или немедикаментозные методы профилактики и лечения с учетом индивидуальных особенностей.
