Местная сочетанная иммунотерапия в комплексном лечении и профилактике послеоперационных гнойных осложнений острых травматических внутричерепных гематом 14. 01. 17 хирургия
| Вид материала | Автореферат диссертации |
СодержаниеРезультаты исследования и их обсуждение 3 –сосудистая оболочка (5) узлы |
- Применение озонированного перфторана в комплексном лечении острых перитонитов и профилактике, 652.97kb.
- Диагностика и хирургическое лечение травматических внутричерепных гематом у детей раннего, 379.1kb.
- Местная цитокинотерапия в комплексном лечении и профилактике раневой инфекции открытых, 199.33kb.
- Стимуляция заживления и профилактика гнойных осложнений послеоперационных ран передней, 683.25kb.
- Местная иммуномодулирующая терапия в профилактике гнойно-воспалительных осложнений, 431.5kb.
- А. И. Неймарк, И. B. Снегирев,, 129.75kb.
- Особенности диагностики и лечения острых гнойных заболеваний мягких тканей у больных, 287.56kb.
- Реконструкция глубокой бедренной артерии в комплексном хирургическом лечении больных, 294.19kb.
- Комплексная диагностика и прогнозрование осложнений острых воспалительных заболеваний, 763.74kb.
- Внутрипортальная лазеротерапия в комплексном послеоперационном лечении осложнённого, 415.55kb.
Таблица 2
Распределение больных по уровню нарушения сознания
(по шкале ком Глазго) при поступлении
| Показатель | Ясное созна-ние | Умерен-ное оглу-шение | Глубо-кое оглу-шение | Сопор | Поверх-ностная кома | Умерен-ная кома | Глубо-кая кома | Число больных |
| Группа сравнения (I группа) | 6 (3%) | 40 (20%) | 52 (26%) | 28 (14%) | 24 (12%) | 36 (18%) | 14 (7%) | 200 (100%) |
| Основная группа (II группа) | 1 (1,7) | 13 (21,6%) | 16 (26,7%) | 16 (26,7%) | 5 (8,3%) | 5 (8,3%) | 4 (6,7%) | 60 (100%) |
Как видно из табл. 2, в обеих клинических группах все больные были относительно равномерно распределены по глубине нарушения сознания. В большей части больные поступали в состоянии глубокого оглушения – умеренной комы.
Все больные в обеих клинических группах были оперированы в среднем в течение 1,5-2 часов после поступления.
У 108 (54%) больных группы сравнения и у 32 (53%) – основной группы была диагностирована хроническая алкогольная интоксикация. Значительно преобладали мужчины - 123 б-х (88%).
Другие экзогенные интоксикации у больных обеих клинических групп выявлены не были, отсутствовали также инфекционные, инфекционно-аллергические или аутоиммунные заболевания, которые могли бы влиять на их иммунный статус.
Как видно из табл. 3, обе клинические группы были сопоставимы по указанным в ней показателям, что позволило провести сравнительное исследование клинического эффекта от введения в стандартную схему лечения больных с ОТВГ из основной группы местной интраоперационной иммуномодулирующей терапии тактивином.
Таблица 3
Сравнительная характеристика основных
показателей I и II клинических групп.
-
Показатель
I группа
II группа
Достоверность разницы
Вид гематомы
(число больных в %):
СГ
76,0%
76,7%
р < 0,05
ЭГ
13,5%
10,0%
р < 0,05
ВГ
4,5%
8,3%
р > 0,05
Сочетанные
6%
5%
р < 0,05
Возраст больных (лет)
31,3 ± 11,7
39,5 ± 10,2
р < 0,05
Соотношение
мужчин и женщин
3,3 : 1
7,5 : 1
р > 0,05
Гематомы большого объема
(в %)
71%
75%
р < 0,05
Гематомы малого объема
(50 мл и менее) и пластинчатые
(в %)
29%
25%
р < 0,05
Число часов от момента получения травмы до поступления в стационар (число больных в %):
Менее 6 часов
64,5
58,3%
р < 0,05
6-24 часа
31,5%
36,7%
р < 0,05
Более 24 часов
3%
5%
р < 0,05
Время до операции после поступления в стационар (число больных в %):
1,5 – 2 часа
100%
100%
р < 0,05
Средний обьем гематомы (мл)
68,0 ± 9,3
61,3 ± 10,7
р < 0,05
Наличие хронического алкоголизма (число больных в %)
54%
53%
р < 0,05
В основной группе из 60 больных умерло 18. Послеоперационная летальность составила 30%.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Медико-статистический анализ 400 аутопсийных наблюдений ОТВГ у больных, оперированных и леченых по стандартной схеме (при изолированных ЧМТ со сходными повреждениями головного мозга), показал, что частота экстракраниальных гнойно-воспалительных осложнений (пневмоний) составила 56%. Это оказалось в средней зоне показателей, которые приводятся в литературе. Так, по данным большинства авторов, частота пневмоний при острых травматических внутричерепных гематомах колеблется по клиническим данным от 20 до 80% (в зависимости от тяжести ЧМТ), а по данным аутопсий достигает 95-97%.
Первое место (54-67%) по частоте пневмоний занимали эпидуральные гематомы и сочетанные гематомы (эпидуральные + субдуральные гематомы, эпидуральные + субдуральные + внутримозговые гематомы, субдуральные + внутримозговые гематомы). Второе место принадлежало СГ (54%), третье – ВГ (50%). Разница по частоте пневмоний была достоверна (в 1,3 раза, р<0,05) только между ЭГ, СГ + ВГ с одной стороны и ВГ – с другой. Было бы логичнее ожидать более высокую частоту пневмоний у больных с ВГ и СГ, а не с ЭГ, когда травма ГМ обычно выражена меньше. Кроме того, не отмечалась достоверная зависимость частоты пневмоний от пола и возраста больных.
По-видимому, возникновение пневмоний, которые являются ярким проявлением тяжелых иммунных нарушений, в большей мере связано не с видом гематомы, а с другими особенностями ЧМТ, в частности, с тяжестью поражения ткани ГМ, влиянием сопутствующей патологии и других факторов, определяющих глубину ВИДС у конкретного больного. На это обращают внимание и другие авторы (Горбунов В.И., 1990; Пиголкин Ю.И. и соавт., 1998; Пашинян Г.А. и соавт, 1997, 1999; Лебедев В.В. и соавт., 2000; Goodpasture С., 1976; Van Woerkom T.H. et al., 1997).
Доказательством этого положения явилось то, что пневмонии, как и интракраниальные осложнения, возникали значительно чаще (первые – в 6 раз, последние – в 1,4 раза) у больных, страдающих хроническим алкоголизмом. Кроме того, пневмонии были выявлены практически у всех больных с ОТВГ, страдавших хроническими обструктивными заболеваниями легких.
Частота интракраниальных гнойно-воспалительных осложнений (гнойные менингит, менингоэнцефалит, вентрикулит, пахименингит, субдуральная эмпиема) составила 14%. Полученные результаты соответствуют данным других исследователей. Большинство авторов указывают на частоту развития интракраниальных гнойно-воспалительных осложнений у 2-18% больных.
Внутримозговые и сочетанные гематомы среди причин развития интракраниальных гнойно-воспалительных осложнений статистически достоверно лидировали (30-46% против 7-15%, р<0,05), что, по-видимому, обусловлено более тяжелым поражением ткани ГМ. Интракраниальные осложнения, независимо от пола, в 2-3 раза чаще встречались у больных старше 30 лет (р<0,05). Более 50% интракраниальных осложнений развивалось на 4-10 сутки после получения травмы. Эти данные не отличаются от известных из литературы, в соответствии с которыми посттравматический менингит возникает, в основном, независимо от особенностей нейрохирургического вмешательства, в течение первых 14 суток после ЧМТ.
Среди интракраниальных осложнений превалировал гнойный менингит (50% наблюдений). По данным литературы он также является одним из наиболее тяжелых и частых гнойных интракраниальных осложнений.
Результаты исследования интракраниальных гнойно-воспалительных осложнений согласуются с данными литературы о том, что они могут возникнуть как при открытой, так и при закрытой ЧМТ. При целостности костей черепа основную роль в их возникновении играют гематогенный и метастатический пути проникновения инфекции в область гематомы, а также оперативное вмешательство и активация аутоинфекции.
Отмеченные выше причины экстра- и интракраниальных гнойно-воспалительных осложнений (микробные ассоциации с преобладанием условно патогенной флоры и резистентность к проводимой терапии) характерны также для больных с ВИДС (вторичный иммуно-дефицитный синдром). Особенностью гнойно-воспалительных осложнений у больных с ЧМТ, протекающих на фоне иммунных нарушений, являются резистентность к терапии и низкая чувствительность микрофлоры к антибиотикам.
Важное значение для прогнозирования развития гнойно-воспалительных осложнений у больных с ОТВГ и своевременной организации профилактических и лечебных мероприятий имеет факт обнаружения достоверной разницы частоты и структуры гнойно-воспалительных осложнений в зависимости от латерализации гематомы – локализации ОТВГ в левом или правом полушариях ГМ.
Ранее, в отдельных исследованиях, было отмечено более частое развитие гнойно-воспалительных осложнений и выраженный ВИДС при поражении различными патологическими процессами левого (доминантного у большинства людей) полушария ГМ. На ограниченном числе наблюдений ЧМТ было показано, что пневмонии также преобладают при травмах левого полушария.
Проведенное исследование показало, что при двустороннем поражении ГМ как пневмонии, так и интракраниальные гнойно-воспалительные осложнения, наблюдались достоверно чаще (разница в 1,3 – 2 раза, р<0,05), чем при одностороннем, особенно по сравнению с локализацией ОТВГ в правом полушарии. Отмечалась также тенденция, хотя и статистически недостоверная, к более частому (в 1,2 раза) развитию пневмоний при поражении левого полушария ГМ, по сравнению с правым. Для интракраниальных осложнений существовала обратная зависимость, они развивались в 1,2 раза чаще при поражении правого полушария ГМ.
При изучении только монолатеральных гематом малого объема (50 мл и менее) и пластинчатых, объемом до 80 мл, обнаруженная тенденция зависимости вида и частоты гнойно-воспалительных осложнений от латерализации ОТВГ, становилась статистически достоверной. По сравнению с другими, такие ОТВГ объединяет менее выраженная тяжесть поражения ткани ГМ противоположенного полушария, где локализована гематома. Это позволило уточнить зависимость развития гнойно-воспалительных осложнений от травмы левого или правого больших полушарий ГМ.
Частота экстракраниальных гнойно-воспалительных осложнений (пневмоний) при малых и пластинчатых ОТВГ составляла 38% (в 1,5 раза меньше, чем при анализе всех 400 наблюдений – 56%). Также ниже, в 1,7 раза, была частота интракраниальных осложнений (8 против 14%). Эти различия частоты гнойно-воспалительных осложнений от объема ОТВГ были статистически достоверны (р<0,05).
При наличии ОТВГ малого объема в области левого полушария ГМ частота экстракраниальных гнойно-воспалительных осложнений (пневмоний) оказалась в 2,2 раз выше, чем при травме правого (58 против 27%). Частота интракраниальных гнойно-воспалительных осложнений (гнойных менингита и менингоэнцефалита), напротив, была в 2 раза выше при локализации гематомы в области правого полушария ГМ (10 против 5%).
Таким образом, результаты медико-статистического исследования показали, что лечение гнойно-воспалительных осложнений у больных с ОТВГ, по-прежнему, представляют собой нерешенную проблему. Полученные данные об их частоте несколько ниже приводимых в литературе. По нашим данным пневмонии развились у 46-56% больных, а гнойные менингиты и другие интракраниальные гнойно-воспалительные осложнения – у 7-14%. Достоверно, в 1,2 раза, снизилась частота пневмоний у больных в 2004 г., леченых по стандартной схеме, по сравнению с наблюдениями предыдущих 5-ти лет. Это обусловлено включением в лечение таких больных небулайзерной терапии и других современных методов, которые позволили снизить показатели бронхолегочных осложнений у оперированных больных. Особенности этих осложнений подтверждают общепринятое мнение о ведущей роли ВИДС в их патогенезе. Следовательно, целесообразность включения иммуномодуляторов в комплексное лечение ВИДС и гнойно-воспалительных осложнений ОТВГ следует считать обоснованной.
Полученные данные о гетерогенности частоты и структуры гнойно-воспалительных осложнений при ОТВГ в зависимости от латерализации гематомы, позволяют прогнозировать большую или меньшую вероятность развития этих осложнений. С другой стороны, получено еще одно доказательство ведущей роли центральной регуляции функций иммунной системы доминантным полушарием ГМ (у правшей – левого). При его поражении общая частота гнойно-инфекционных осложнений и, особенно, пневмоний достоверно выше. Известно, что именно развитие пневмонии ярко отражает наличие тимус-зависимого ВИДС. Следовательно, тяжесть ВИДС при левосторонних ОТВГ выражена больше, чем при травме правого полушария ГМ.
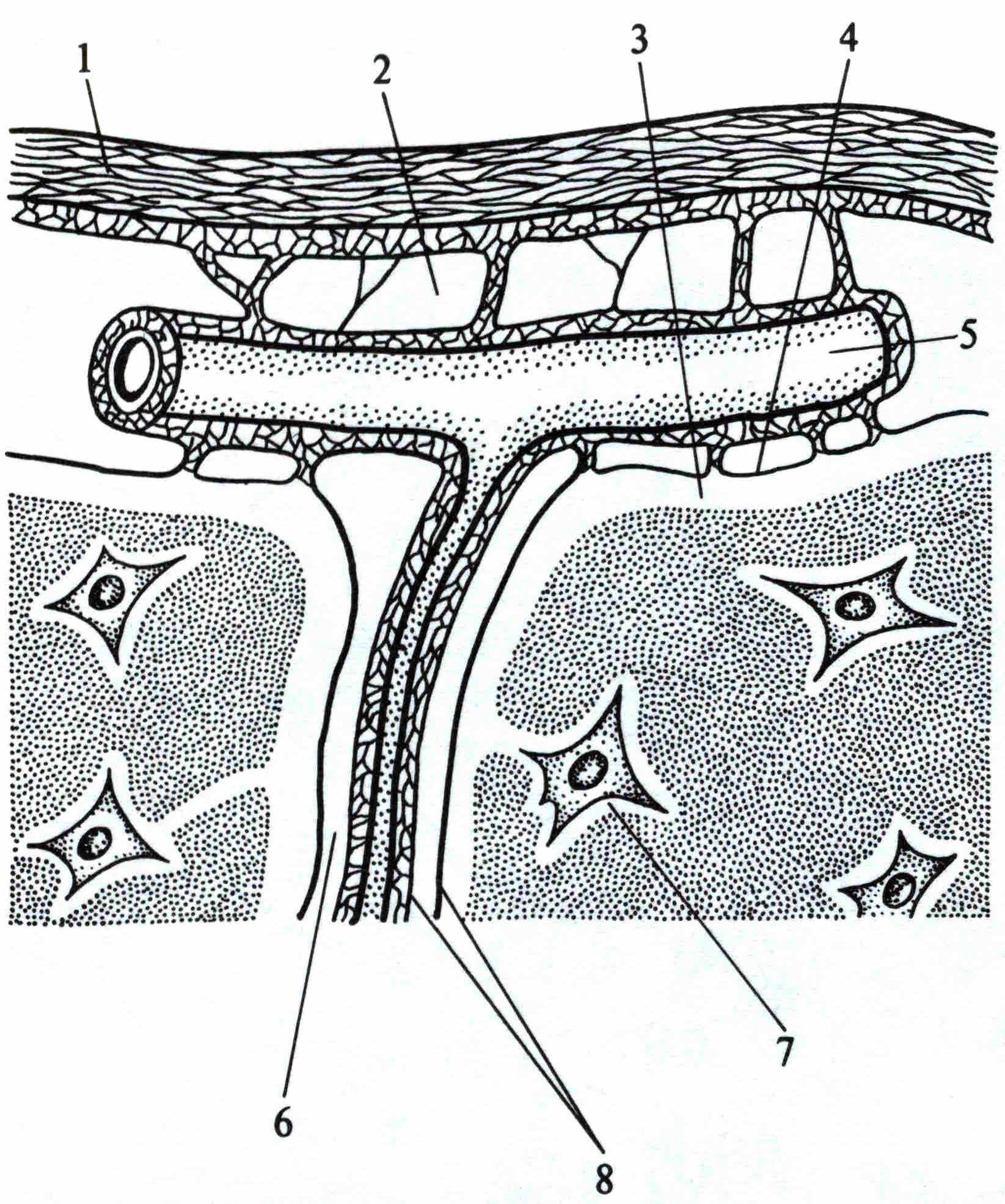
Морфологическое исследование оболочек ГМ в наблюдениях контрольной группы и при ОТВГ, а также анализ литературных источников, позволили выяснить и описать структурную основу их уникальной местной системы иммунитета (рис.5).
Особенностями системы местного иммунитета оболочек ГМ являются:
- одновременное участие ликвора, тканевой жидкости дурально-арахноидального слоя и крови в афферентных и эфферентных путях местной системы иммунитета. Ликвор выполняет роль лимфы для ткани ГМ и его мягких оболочек (сосудистой и паутинной), а тканевая жидкость дурально-арахноидального слоя – для паутинной и, частично, твердой оболочек. Кровоснабжение оболочек ГМ осуществляется из двух артериальных систем (интра- и экстракраниальных), объединенных множественными анастомозами, особенно в бассейнах средней оболочечной и наружной сонной артерий. Венозный отток осуществляется в синусы и вены твердой мозговой оболочки, в вены мягкой оболочки и ткани ГМ;
- немногочисленные популяции иммунокомпетентных клеток (Т- и В-лимфоцитов, макрофагов) в оболочках ГМ, но большое число резидентных макрофагов (микроглии и астроглии) в его ткани;
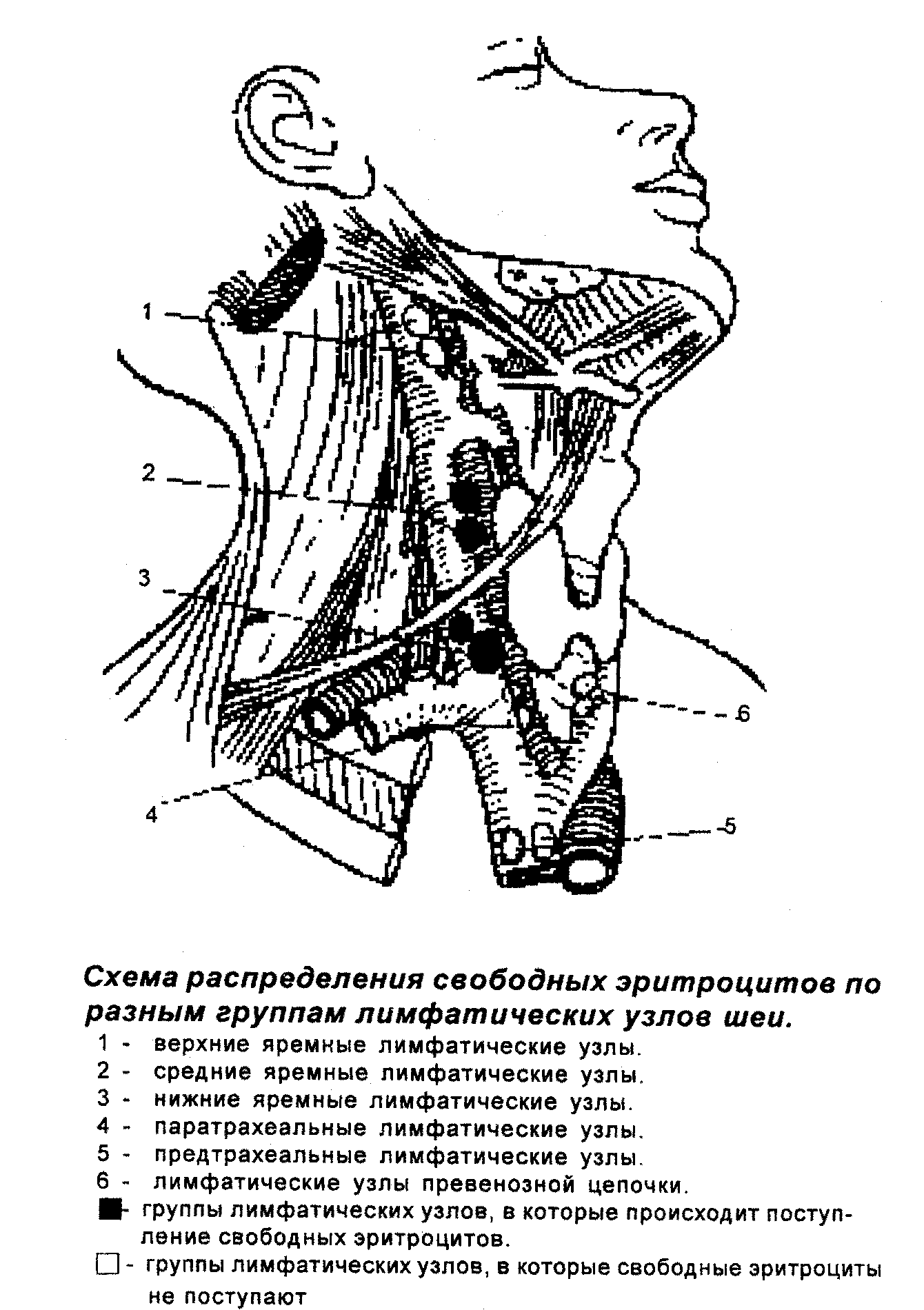
- значение средних и нижних яремных лимфатических узлов как регионарных лимфоидных органов местной иммунной системы мозговых оболочек. В этих лимфатических узлах происходят антигензависимые пролиферация и дифференцировка лимфоцитов, ассоциированных с оболочками ГМ. Оттекает лимфа от этих лимфатических узлов в яремный лимфатический ствол, далее – в правый лимфатический проток (слева – непосредственно в грудной проток). Грудной проток открывается в левую подключичную вену. Таким образом, эфферентный путь от регионарной системы иммунитета мозговых оболочек прямо или косвенно приводит к верхней полой вене.
1
2
3
4

11
5
о
 тток лимфы
тток лимфыо


2
т твердой оболочки

 в глубокую
в глубокую лимфатическую
систему шеи
1 – твердая оболочка, 1, 2 - средние и нижние
2 – паутинная оболочка, яремные лимфатические
3 –сосудистая оболочка (5) узлы
4 – ткань головного мозга
Рис. 5. Схема структурной основы местной (регионарной) системы иммунитета оболочек головного.
Важнейшим структурно-функциональным компонентом регионарного иммунитета оболочек ГМ являются местные клеточные кооперации, которые в твердой оболочке представлены немногочисленными Т- и В-лимфоцитами, лаброцитами и клетками системы мононуклеарных фагоцитов (гистиоцитами, моноцитами, макрофагами). Лимфоциты не формируют каких-либо структур, а присутствуют в виде диффузно рассеянных клеток. По-видимому, большое значение в местных иммунных реакциях принадлежит лаброцитам и эндотелиоцитам сосудов. Внутренний листок твердой оболочки покрыт изнутри слоем пограничных уплощенных отростчатых клеток. Роль этого мезотелиоподобного эпителия оболочек в иммунных реакциях остается неясной. Эти клетки связаны десмосомальными контактами с такими же клетками дурально-арахноидального промежуточного слоя – бессосудистого клеточного синцития, образующего сотовую структуру между твердой и паутинной оболочками ГМ. В ее ячейках циркулирует не ликвор, а межклеточная (тканевая) жидкость дурально-арахноидального слоя. При патологии, например, развитии субдуральной гематомы, в клеточном синцитии дурально-арахноидального промежуточного слоя формируется субдуральное пространство.
Изнутри дурально-арахноидальный клеточный синцитий контактирует с наружным слоем клеток (арахноэндотелием) паутинной оболочки, ячейки которой в субарахноидальном пространстве заполнены ликвором. При анализе особенностей местного иммунитета оболочек ГМ важно учитывать то, что они участвуют в фильтрации и резорбции ликвора. Из ГМ часть ликвора (в норме около 70%) через арахноидальные ворсины (грануляции), выступающие в просвет венозных синусов твердой оболочки, поступает непосредственно в кровь. Другая часть (около 30%, при патологии – до 70-80%) фильтруется через клеточный синцитий паутинной оболочки и, уже в виде межклеточной жидкости дурально-арахноидального слоя попадает в лимфатические и кровеносные сосуды твердой оболочки.
Субарахноидальное пространство ограничено мягкой оболочкой, содержащей множество сосудов и покрытой эпителиоподобными клетками. В мягкой оболочке, как и в ткани ГМ, лимфатические сосуды отсутствуют, а клетки омываются ликвором (Haines D., 1991. Frederickson R., 1991). Клетки иммунной системы представлены единичными Т- и В-лимфоцитами, моноцитами и макрофагами гематогенного происхождения и мигрировавшими из ликвора. Мягкая оболочка тесно прилежит к ткани ГМ и, при развертывании в ней иммунных реакций, в них принимают участие, прежде всего, микроглия и расположенные в периваскулярных пространствах сосудов ГМ лимфоциты и клетки системы мононуклеарных фагоцитов.
Другим структурно-функциональным компонентом регионарного иммунитета оболочек ГМ являются хорошо развитые сети лимфатических сосудов твердой оболочки, лимфатическая сеть слизистой оболочки носовой полости, адвентиции крупных сосудов головы и шеи, глубокая лимфатическая сеть шеи и регионарные лимфатические узлы. Лимфа из сосудов твердой оболочки (и, после фильтрации ликвора в области обонятельных луковиц, через лимфатическую сеть слизистой оболочки носовой полости) поступает, главным образом, в глубокую лимфатическую систему шеи. Другой путь лимфы идет по лимфатическим сосудам адвентиции крупных сосудов головы и шеи. Большая часть лимфы, в итоге, поступает в группу глубоких шейных лимфатических узлов, главным образом, средние и нижние яремные. Сходные данные получили И.И. Каган и А.В. Демин (1998, 1999). Именно эти группы лимфатических узлов являются регионарными для всей лимфатической системы оболочек ГМ. Их особенностью является сложная обратная связь с тканью ГМ и ликвором из-за наличия гемато-энцефалического барьера и прямая связь с артериальной системой мозговых оболочек.
Таким образом, структурной основой уникальной системы местного (регионарного) иммунитета оболочек ГМ являются: артериальные сосуды оболочек и ГМ, оболочечные и внутримозговые пути циркуляции ликвора, оболочечные пути циркуляции дурально-арахноидальной тканевой жидкости (афферентные пути); клеточные кооперации оболочек и ткани ГМ; сеть лимфатических сосудов твердой оболочки, адвентиции крупных кровеносных сосудов шеи и глубокая лимфатическая сеть шеи (эфферентные пути); нижние и средние яремные лимфатические узлы (регионарные лимфатические узлы).
Изучение структурно-функциональных особенностей регионарного иммунитета при ОТВГ показало, что первыми реакциями оболочек ГМ являются микроциркуляторные: миграция и дегрануляция лаброцитов, миграция полиморфноядерных лейкоцитов, а в ткани ГМ – микроциркуляторные (приводящие к его отеку) и активация микроглии. Уже в первые сутки большое число эритроцитов из гематомы, следовательно, и различные биологически активные вещества из поврежденных тканей, поступают в лимфатические сети твердой оболочки, адвентиции крупных сосудов шеи, глубокую лимфатическую сеть шеи и синусы регионарных для оболочек ГМ глубоких шейных лимфатических узлов. Таким образом «запускается» уникальный регионарный иммунный ответ, который включает в себя реакцию ткани ГМ и изменения ликвора, активацию клеточных коопераций мягкой, паутинной и твердой оболочек ГМ, лимфоидной ткани средних и нижних яремных лимфатических узлов. По-видимому, важную роль играет эритрофагия макрофагами в синусах этих лимфатических узлов. Умеренная активация В-системы иммунитета отражает, вероятно, в том числе и т.н. «санитарные» аутоиммунные реакции в ответ на нарушение целостности гематоэнцефалического барьера и поступления в лимфу и кровоток антигенов ткани ГМ и разрушенных эритроцитов. В отдельных случаях трансформация гомеостатических санитарных аутоиммунных реакций в патологические может приводить к прогрессирующему аутоиммунному посттравматическому поражению ГМ.
Включение в комбинированное лечение ОТВГ местной иммунотерапии тактивином активирует как регионарные иммунные реакции, так и репаративные процессы в оболочках ГМ. В отличие от традиционно леченых больных, после введения тактивина заметно усиливаются пролиферативные процессы (фибробластов, эндотелия) и рост грануляционной ткани со стороны твердой оболочки, лимфо-макрофагальная инфильтрация оболочек и, напротив, уменьшаются микроциркуляторные нарушения и лейкоцитарная инфильтрация, особенно эозинофильными лейкоцитами (что указывает на быструю нормализацию функции лаброцитов). В регионарных лимфатических узлах фаза опустошения лимфоидной ткани сменяется на гиперпластическую с выраженным усилением пролиферации лимфоцитов, активацией Т- и В-звеньев иммунитета. Однако выраженной активации В-звена не происходит, что указывает на отсутствие риска прогрессирования аутоиммунных реакций. Специально проведенные иммунологические исследования показали, что проведенная местная иммуномодулирующая терапия тактивином не сопровождается повышением активности аутоиммунных реакций. Уменьшение выраженности асептического реактивного воспаления в области гематомы и снижение частоты его трансформации в гнойное воспаление, приводит к формированию меньшего объема посттравматических рубцовых изменений мозговых оболочек.
Исследование анатомо-функциональных особенностей поверхностной височной артерии проводили двумя методами: 1) окрашиванием сосудистого бассейна наружной сонной артерии, в частности, поверхностной височной артерии и 2) проведением серии посмертных селективных ангиографий наружной сонной артерии.
При введении красителя в ретроградном направлении мы получили его поступление в сосуды твердой мозговой оболочки через сеть анастомозов, в частности, через верхнюю челюстную артерию, от которой и отходит средняя оболочечная артерия.
При введении красящего вещества в антероградном направлении отмечено интенсивное прокрашивание сосудистой сети мягких покровов мозгового отдела головы: кожи, подкожной жировой клетчатки, апоневроза, как на стороне введения, так и на противоположенной стороне, надкостницы, височной мышцы, и костей свода черепа вдоль швов. После проведения циркулярной трепанации черепа обнаружено наличие красителя в сосудах твердой мозговой оболочки, в основном в ветвях средней оболочечной артерии. При этом отмечено незначительное окрашивание самой твердой мозговой оболочки, в основном вдоль сагиттальной линии. Полученные данные свидетельствуют о наличии развитой артериальной анастоматической сети между ветвями поверхностной височной артерии и средней оболочечной артерии.
После прокрашивания сосудов твердой мозговой оболочки производили забор участка твердой мозговой оболочки для гистологического исследования. При данном исследовании находили краситель в просвете и на внутренней поверхности стенок как основных, так и мелких ветвей средней менингиальной артерии. Красящим веществом заполнялись так же мелкие интратекальные артерии и артериолы. Вблизи артериол отмечалось небольшое накопление красителя в капиллярах. Следует заметить, что вены, расположенные рядом с артериями, не содержали красителя.
Полученные данные позволяют судить о возможности применения регионарной иммунотерапии через поверхностную височную артерию у больных с внутричерепными травматическими кровоизлияниями.
Для изучения диаметра исследуемых сосудов в секционной, по описанной ранее методике, произведен забор сегментов поверхностной височной артерии (ПВА) и её ветвей: основного ствола до его деления, теменной и лобной ветвей.
Иссеченные участки сосудов были направлены на патогистологическое исследование и измерение диаметра сосудов.
Нами установлено, что диаметр основного ствола ПВА, колеблющийся в пределах от 1,3 до 1,57 мм. При этом после деления диаметр его ветвей чаще всего не уменьшался менее 0,65 мм. Следует отметить, что чаще лобная ветвь ПВА по диаметру немного превосходит теменную. Однако лобная ветвь отходит от основного ствола под углом, в отличие от теменной ветви, которая чаще является продолжением основного ствола ПВА.
Эти анатомические особенности предопределили преимущественную интраоперационную катетеризацию либо основного ствола ПВА при ее высоком делении, или теменной ветви при низком делении ПВА.
При проведении посмертной ангиографии были получены ангиографические снимки сосудистого русла наружной сонной артерии при введении контраста в ретроградном направлении через катетер, установленный в поверхностную височную артерию. Это дает основание предполагать возможность введения лекарственных средств через регионарное сосудистое русло.
Следует учесть, что на всех произведенных ангиограммах отсутствует ангиографическая капиллярная фаза, так как сосуды диаметром 0,5-1 мм контрастом не заполняются (рис. 6).
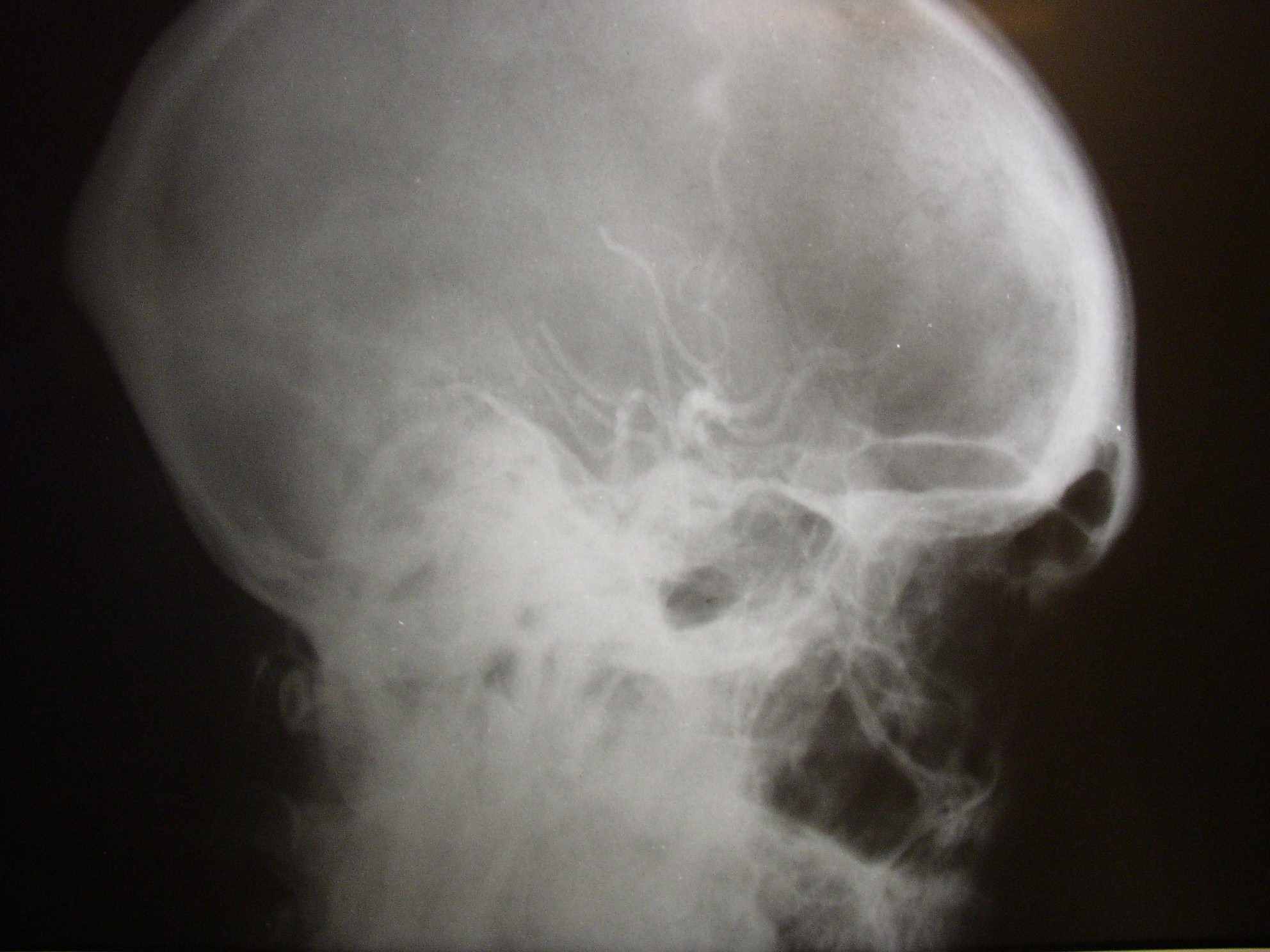



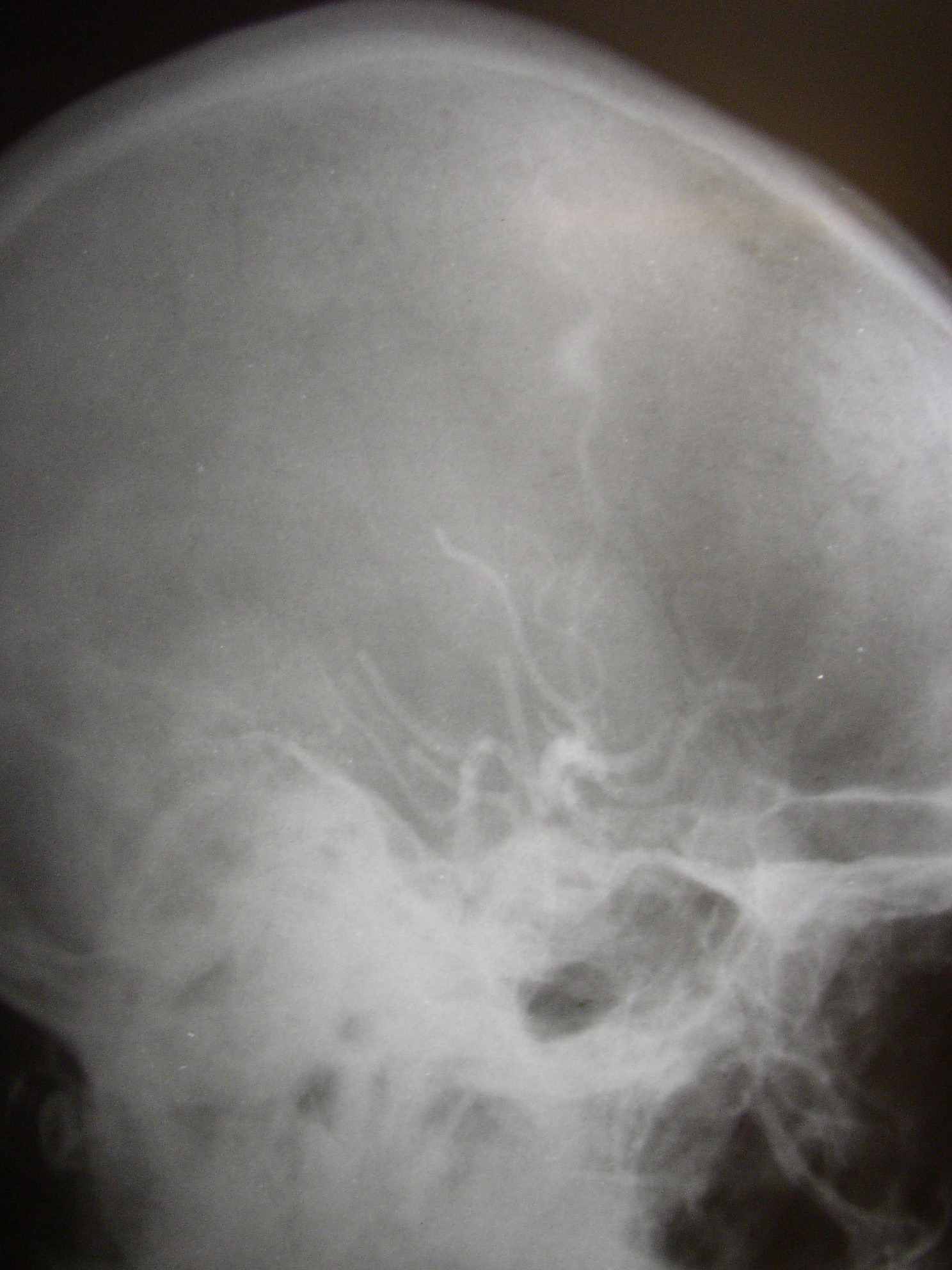 Рис. 6. Ангиограммы наружной сонной артерии (стрелками указана контрастированная средняя оболочечная артерия).
Рис. 6. Ангиограммы наружной сонной артерии (стрелками указана контрастированная средняя оболочечная артерия).Необходимо отметить, что в ряде случаев контрастное вещество частично попадало во внутреннюю сонную артерию, контрастируя её основные ветви (рис. 7).
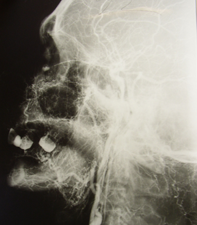





А

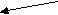
Б
Рис. 7. Ангиограмма наружной сонной артерии. Катетер (указан белой стрелкой) введен в ретроградном направлении через поверхностную височную артерию. Отмечается контрастирование средней оболочечной (стрелка А) артерии. Частичное попадание контраста в бассейн внутренней сонной артерии (стрелка Б).
Исходя из вышеизложенного, можно сделать вывод о возможности подведения лекарственных препаратов и, в частности, иммуномодуляторов в регионарное сосудистое русло методом катетеризации поверхностной височной артерии. В условиях кровотока вероятность поступления препарата в сосуды твердой мозговой оболочки при антероградном введении катетера в поверхностную височную артерию в настоящее время мы можем рассматривать лишь теоретически. Напротив, при ретроградном введении катетера в ПВА проведенные исследования подтверждают достоверное поступление лекарственных веществ в артериальные сосуды твердой мозговой оболочки.
Таким образом, нами были определены два основных способа введения иммуномодулирующих препаратов (тактивина) в область оперативного вмешательства для регионарной терапии: 1. интраоперационное орошение операционной раны или введение его между листками твердой мозговой оболочки,
2. интраоперационная катетеризация поверхностной височной артерии для проведения регионарной иммунотерапии в послеоперационном периоде.
Результаты лечения в клинических группах оценивались по шкале исходов Глазго (табл. 4). Как видно из табл., у больных основной клинической группы послеоперационный период протекал более благоприятно. Летальность в группе сравнения составила 37%, а в основной группе – 30% (меньше в 1,23 раза, р<0,05), что видно из табл. 5.
