Автореферат диссертации на соискание ученой степени
| Вид материала | Автореферат диссертации |
- Автореферат диссертации на соискание ученой степени, 378.33kb.
- Автореферат диссертации на соискание учёной степени, 846.35kb.
- Автореферат диссертации на соискание ученой степени, 267.76kb.
- Акинфиев Сергей Николаевич автореферат диссертации, 1335.17kb.
- L. в экосистемах баренцева моря >03. 02. 04 зоология 03. 02. 08 экология Автореферат, 302.63kb.
- Автореферат диссертации на соискание ученой степени, 645.65kb.
- Автореферат диссертации на соискание ученой степени, 678.39kb.
- Автореферат диссертации на соискание ученой степени, 331.91kb.
- Автореферат диссертации на соискание ученой степени, 298.92kb.
- Автореферат диссертации на соискание ученой степени, 500.38kb.
На правах рукописи
РЯБЧЕНКО
АЛЕКСАНДР ВЛАДИМИРОВИЧ
ПОЛУЧЕНИЕ РЕКОМБИНАНТНЫХ БЕЛКОВ ЗАПАДНОСИБИРСКИХ ИЗОЛЯТОВ BORRELIA BURGDORFERI SENSU LATO И ИЗУЧЕНИЕ ИХ АНТИГЕННЫХ СВОЙСТВ
03.00.04 – биохимия
03.00.03 – молекулярная биология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Новосибирск – 2009
Работа выполнена в Государственном учреждении Научно-исследовательском институте биохимии Сибирского отделения Российской академии медицинских наук
Научный руководитель:
доктор биологических наук Беклемишев Анатолий Борисович
Официальные оппоненты:
доктор биологических наук,
профессор Ильичёв Александр Алексеевич
доктор биологический наук,
профессор Гуляева Людмила Федоровна
Ведущая организация: Институт цитологии и генетики Сибирского отделения Российской академии наук, г. Новосибирск
Защита состоится « » 2009 г. в 10 часов на заседании диссертационного совета Д 001.034.01 в Государственном учреждении Научно-исследовательском институте биохимии СО РАМН по адресу: 630117, Новосибирск, ул. Академика Тимакова, 2; тел.: 8 (383) 333-54-81.
С диссертацией можно ознакомиться в библиотеке Государственного учреждения Научно-исследовательского института биохимии Сибирского отделения Российской академии медицинских наук
Автореферат разослан «___» ___________ 2009г.
Ученый секретарь
диссертационного совета,
кандидат биологических наук Русских Г. С.

ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
По морфологическим и генетическим признакам различают 13 геновидов спирохет комплекса Borrelia burgdorferi sensu lato (s.l.) (Baranton et al, 1998), относящихся к семейству SPIROCHAETACAE. Этиологическая роль спирохет этого комплекса как инфекционных агентов, переносимых клещами рода Ixodes была установлена в 1982 г. американскими исследователями и была названа «болезнью Лайма» (Steere, 2006). В нашей стране это природноочаговое трансмиссивное заболевание получило название «иксодового клещевого боррелиоза» (ИКБ). Три геновида этого комплекса являются патогенными для человека (Wang et al, 1999) и три условнопатогенными (Richter et al, 2006; Hofmann, 2005; Stanek and Strle, 2003; Hengge et al, 2003). По широте распространения и уровню заболеваемости ИКБ занимает одно из ведущих мест среди природно-очаговых заболеваний. Ареал инфекции простирается по всей Северной Америке, Европе, России, Японии, Китае (Stanek, 2003).
Отличия в генетической структуре патогенных геновидов боррелий, обусловливают полиморфизм клинических проявлений и органных поражений человека. Основные симптомы ИКБ сходны во всем мире, но есть и региональные отличия. В первую очередь между болезнью, обнаруженной в Америке и вызываемой исключительно геновидом B.burgdorferi sensu stricto (s.s.) с характерными проявлениями артрита, и болезнью, обнаруженной в Европе. В Европе болезнь вызывается, прежде всего, геновидами B.garinii - возбудителем, характеризующимся нейротропностью и B.afzelii, поражающим часто только кожу с развитием акродерматитов. При отсутствии своевременного лечения, инфекции переходят в хроническую форму.
В виду разнообразия клинических проявлений заболевания, для подтверждения диагноза используют дополнительные лабораторные методы, среди которых широкое распространение получили методы, основанные на выявление антител к возбудителю. В качестве антигенов используются лизаты клеток боррелий, либо рекомбинантные белки спирохет. Большая изменчивость антигенов возбудителя обуславливает сложность серодиагностики. Высокая вариабельность особенно характерна для внешних поверхностных белков боррелий, которые с одной стороны являются иммунодоминантными, с другой стороны - гомология среди белков этого класса варьирует от 70 до 100% даже среди изолятов выделенных на одной территории.
Используемые для серологической диагностики белки североамериканских и западноевропейских изолятов боррелий, такие как внешние поверхностные липопротеины, флагеллярные белки, основные мембранные белки, декорин-связывающие белки и некоторые другие хорошо изучены и описаны. Однако, практически отсутствует информация об аминокислотных последовательностях и иммунохимических свойствах антигенов спирохет комплекса B. burgdorferi s.l. распространенных на территории азиатской части России. Большая протяженность территории России с запада на восток позволяет предполагать, значительное отличие антигенов в изолятах циркулирующих на этой территории. В связи с этим, целью настоящего исследования являлось получение рекомбинантных иммунодоминантных белков западносибирских изолятов B. burgdorferi s.l. и сравнительное исследование их первичных структур и антигенных свойств.
Задачи исследования:
- Оценить зараженность клещей Ixodes persulcatus Shulze, населяющих рекреационную зону Новосибирского Научного Центра, различными геновидами спирохет B.burgdorferi s.l.
- Получить культуры западносибирских изолятов B. burgdorferi s.l.
- На основе анализа литературных данных выбрать в качестве объектов исследования белки спирохет B.burgdorferi s.l. наиболее перспективные для создания средств серодиагностики ИКБ.
- Сконструировать экспрессирующиие плазмидные векторы, пригодные для получения в клетках E.coli рекомбинантных белков боррелий и их последующей аффинной очистки.
- Клонировать кодирующие области генов выбранных иммунодоминантных белков B.burgdorferi s.l. в клетках E.coli в составе экспрессирующих векторов.
- Определить нуклеотидные последовательности клонированных генов спирохет B.burgdorferi s.l. и исследовать гомологию соответствующих им белков с опубликованными в базе данных GeneBank аналогичными белками боррелий.
- Получить очищенные рекомбинантные белки западносибирских изолятов B.burgdorferi s.l. и исследовать их антигенные свойства методом ИФА на сыворотках больных ИКБ.
- Оценить пригодность каждого из рекомбинантных антигенов боррелий для серодиагностики локализованной и диссеминированной стадий ИКБ.
Научная новизна работы
Исследована зараженность клещей Ixodes persulcatus Shulze, отловленных в рекреационной зоне ННЦ в 2003, 2005, 2006 и 2008 годах, различными геновидами спирохет B.burgdorferi s.l. Отмечены зависимые от года наблюдений колебания в количестве инфицированных спирохетами особей (20% - 32%). Установлено, что только два геновида боррелий циркулировали до 2006 г. в популяции иксодовых клещей на обследованной терриртории – B.garinii и B.afzelii, с доминирующим преобладанием первого (70%-80%), включающего представителей двух геномных групп: NT29 и 20047. В 2006 и 2008 г.г. в нескольких особях клещей обнаружены спирохеты геновида B. japonica.
Сконструированы оригинальные бактериальные экспрессирующие вектора pRAC и pRAC3, содержащие химерные регуляторные районы, полилинкер для клонирования генов и участки, кодирующие олигогистидиновые последовательности в С-концевой области рекомбинантных белков. Штаммы E.coli, несущие полученные векторы обеспечивают трёхкратное увеличение синтеза белка GFP по сравнению с клетками, содержащими исходный экспрессирующий вектор pREB.
Определены нуклеотидные последовательности кодирующих областей генов flaA, flaB, ospC, ospA и dbpB западносибирского изолята B.garinii, группы 20047Т и гена ospC западносибирского изолята B.afzelii; выведены соответствующие этим генам аминокислотные последовательности белков. Нуклеотидные последовательности выше названных генов депонированы в электронную международную базу данных генетической информации GenBank под инвентарными номерами: EU979631.1, EU979630.1, EU979629.1, EU979628.1, EU979626.1 и EU979627.1.
На основе сравнения аминокислотных последовательностей антигенов FlaA, FlaB, OspC, OspA и DbpB спирохет B. burgdorferi s.l., представленных в базе данных GeneBank (декабрь 2008 г.) и установленных в настоящей работе, показано, что западносибирский изолят B.garinii группа 20047Т (NSK-10-06, музейный штамм №10) филогенетически близок изолятам B.garinii, выделенным в Европе.
Исследованы антигенные свойства рекомбинантных белков FlaA, FlaB, OspC, OspA и DbpB методом ИФА в экспериментах с сыворотками от больных ИКБ и здоровых доноров. Продемонстрирована перспективность использования названных рекомбинантных белков для серодиагностики ИКБ. Предложена комбинация рекомбинантных антигенов для выявления антител к возбудителям ИКБ в крови больных, как с локализованной, так и с диссеминированной стадиями заболевания.
Практическая значимость работы
Полученные в настоящей работе данные о зараженности клещей Ixodes persulcatus, отловленных в рекреационной зоне ННЦ в 2003, 2005, 2006 и 2008 годах, различными геновидами спирохет B.burgdorferi s.l. могут быть использованы для прогнозирования эпидемической ситуации по ИКБ и возможных клинических проявлений заболеваний.
Создана музейная коллекция западносибирских изолятов B.burgdorferi s.l. распространенных на территории Новосибирской области и определена их геновидовая принадлежность. Коллекция включает 2 изолята B.afzelii, 14 изолятов B.garinii, 7 образцов смеси изолятов B.afzelii и B.garinii. Культуры полученных изолятов боррелий могут быть использованы в качестве посевного материала для культивирования и наработки биомассы спирохет и решения исследовательских и прикладных задач.
Сконструированы векторы pRAC и pRAC3 пригодные для клонирования и эффективной индуцируемой экспрессии генов в клетках E.coli. Штаммы E.coli, содержащие в составе этих векторов экспрессируемые гены флюоресцирующих белков, могут применяться в химической, фармацевтической, пищевой промышленности и в экологическом мониторинге окружающей среды в качестве цельноклеточных биосенсоров для обнаружения генотоксикантов в исследуемых образцах.
Сконструированные штаммы E.coli - продуценты рекомбинантных белков FlaA, OspC, OspA, DbpB и FlaB, специфичных для геновидов B.garinii (группа 20047Т), и OspC B.afzelii, могут быть использованы в качестве источников получения соответствующих антигенов боррелий.
Разработана технология получения рекомбинантных белков B.burgdorferi s.l. с помощью экспрессии соответствующих им генов в составе сконструированного вектора pRAC3 и модифицированного в настоящей работе вектора pET36b(+) (pETm) в клетках E.coli (шт. BL-21(DE3) и Rosetta 2) и последующей аффинной очистки рекомбинантных полипептидов на металло-хелатных сорбентах.
Полученные в настоящей работе рекомбинантные антигены FlaA, FlaB, OspC, OspA и DbpB могут быть использованы в серодиагностике ИКБ, вызываемого спирохетами B.burgdorferi s.l., циркулирующими на азиатской территории России.
Положения, выносимые на защиту:
- В рекреационной зоне Новосибирского научного центра в период с 2003 по 2008 г.г. в популяции клещей Ixodes persulcatus Schulze циркулировали только три геновида боррелий – B.garinii, B.afzelii и B.japonica с доминирующим преобладанием B.garinii (более 75%). Заражённость иксодовых клещей боррелиями составляла, в зависимости от года наблюдений, 20% - 32%.
- Западносибирский изолят B.garinii группы 20047Т (NSK10-06, музейный штамм №10) филогенетически близок боррелиям, изолированным на территории Европы.
- Сконструированные плазмидные векторы pRAC, pRAC3 и модифицированный в настоящей работе вектор pET36b(+) (pETm) являются эффективными системами для экспрессии клонируемых в их составе генов в клетках E.coli.
- Штамм E.coli, содержащий в составе плазмиду pRAC может применяться в качестве цельноклеточного биосенсора для обнаружения генотоксикантов.
- По результатам исследований антигенных свойств рекомбинантных белков FlaA, FlaB, OspC, OspA и DbpB, данные белки могут быть рекомендованы для серодиагностики ИКБ.
Апробация материалов диссертации. Материалы диссертационной работы доложены на следующих научных форумах: Междисциплинарный конгресс "Прогресс в фундаментальных и прикладных науках для здоровья человека", 10-21 июня 2004, Судак, Украина; Международная конференция «Развитие международного сотрудничества в области изучения инфекционных заболеваний». «Сосновка», Новосибирская область, 8-10 сентября 2004; Третий Московский международный конгресс "Биотехнология: состояние и перспективы развития", 14-18 марта, 2005 г., Москва; Московская международная конференция «Биотехнология и медицина», 14-17 марта, 2006 г., Москва.
Публикации. По материалам диссертации опубликованы 14 работ, из них 4 тезиса, 9 статей и один патент.
Объем и структура диссертации. Диссертация состоит из введения, 4-х глав, включающих обзор литературы, материалов и методов, результатов исследований и обсуждения, заключения, выводов, списка литературы, включающих 27 отечественных и 225 зарубежных источников и приложения. Материалы диссертации изложены на 160 страницах машинописного текста, включая 5 страниц приложений. Работа иллюстрирована 8 таблицами и 25 рисунками. Диссертация выполнена в соответствии с планом научно-исследовательских работ НИИ биохимии СО РАМН.
Основное содержание работы
Оценка зараженности клещей Ixodes persulcatus, населяющих рекреационную зону Новосибирского научного центра, спирохетами Borrelia burgdorferi s.l.
В работе использовали клещей Ixodes persulcatus Schulze, собранных в весенние периоды 2003, 2005, 2006 и 2008 гг. на территории Новосибирского научного центра (ННЦ). Для обнаружения и генотипирования геномных ДНК спирохет Borrelia burgdorferi s.l., выделенных непосредственно из клещей, использовали двух-этапную процедуру (Postic et al, 1994). На первом этапе определяли присутствие геномных ДНК боррелий в препаратах ДНК, выделенных из клещей, с помощью амплификации методом ПЦР межгенной области rrf-rrl (генов 5S и 23S рРНК) генома спирохет. ПЦР проводили в присутствии прямого (№ 126: 5’-TGCGAGTTCGCGGGAG-3’) и обратного (№ 127: 5’-TCCTAGGCATTCACCATAGACTCTT-3’) праймеров, причём для исключения ложноотрицательных результатов анализа, реакцию проводили в присутствие ДНК внутреннего контроля, в качестве которого служил ампликон фрагмента генома вируса гепатита В, размером 150 п.н. (Beklemishev et al., 2003). В качестве положительного контроля в ПЦР использовали геномную ДНК B.burgdorferi sensu stricto эталонного штамма В31. На втором этапе исследовали полиморфизм длин рестриктных фрагментов, полученных гидролизом ампликонов межгенной области rrf-rrl эндонуклеазами рестрикции MseI или Tru9I. Поскольку представителям каждого геновида геномной группы спирохет B.burgdorferi s.l. свойственен определённый набор отличающихся по размерам рестриктных фрагментов ампликона межгенной области rrf-rrl (Postic et al, 1996), то по результатам электрофоретического анализа полученных рестриктов можно судить о геновидовой принадлежности боррелий, содержащихся в исследуемом клеще.
На рис. 1 представлены результаты типичного анализа ПДРФ ампликонов межгенной области rrf-rrl, полученных на исследуемых образцах ДНК клещей.

Рис. 1. Электрофореграмма рестриктных фрагментов ампликонов межгенной области, полученных в процессе генотипирования анализируемых образцов ДНК B.burgdorferi s.l. Электрофорез проводили в 12% ПААГ.
Дорожки: 1, 14 - маркеры молекулярных масс ДНК (pBR322, гидролизованная HaeIII); 2-13 - ампликоны межгенной области rrf-rrl анализируемых образцов ДНК B.burgdorferi s.l., гидролизованные рестриктазой MseI.
На рис. 1 видно, что 7 исследуемых образцов (дорожки 2, 4, 7, 10-13) содержат геномную ДНК спирохет, относящихся к геновиду B.garinii (геномная группа 20047T); 1 образец (дорожка 3) – к геновиду B.japonica; 1 образец (дорожка 8) – к геновиду B.afzelii; 1 образец (дорожка 6) содержат смесь геномных ДНК спирохет B.garinii (геномные группы NT29 и 20047T); 1 исследуемый образец (дорожка 9) содержат смесь геномных ДНК спирохет B.japonica и B.garinii 20047T.
За 6-ти летний период мониторинга заражённости боррелиями иксодовых клещей, населяющих рекреационную зону ННЦ, было установлено, что в этой популяции клещей, циркулируют два патогенных для человека геновида спирохет B.burgdorferi s.l.: B.garinii и B.afzelii, и один непатогенный геновид - B.japonica. Результаты этих исследований представлены в таблице 1.
Доминирующим геновидом являются спирохеты B.garinii, включающие представителей двух геномных групп: NT29 и 20047T (с преобладанием подгруппы 20047T), и обнаруживаемые в более чем 75% инфицированных спирохетами клещей. Зараженность иксодовых клещей спирохетами Borrelia burgdorferi s.l., колебалась в зависимости от года наблюдений в пределах 20% - 32%. Средняя годичная зараженность за весь наблюдаемый период составила 22,4±1,1%. С 2006 г. на территории Новосибирской области зафиксировано появление геновида B.japonica, распространённого в популяции клещей в Японии и на Дальнем Востоке РФ.
Таблица 1. Заражённость взрослых клещей I. persulcatus, отловленных в рекреационной зоне ННЦ в весенний период 2003 – 2008 г.г., различными геновидами спирохет B. burgdorferi s.l.
| Год | Кол-во клещей | ПЦР-позитив-ные клещи, (%) | Количество генотипированных ПЦР-позитивных образцов ДНК из клещей | |||||
| общее кол-во | B garinii NT29 | B.garinii 20047T | B.afzelii | B.japonica | mix | |||
| 2003 | 210 | 31,7±6,0 | 37 | 10 | 14 | 3 | - | 10 |
| 2005 | 306 | 21,2±2,3 | 64 | 8 | 31 | 15 | - | 10 |
| 2006 | 590 | 26,1±1,8 | 154 | 13 | 97 | 20 | 6 | 24 |
| 2008 | 303 | 20,1±2,3 | 61 | 6 | 53 | 2 | 5 | - |
| 2 | 1409 | 22,4±1,1 | 316 | 37 | 195 | 40 | 11 | 44 |
1 Общая средняя ежегодная зараженность клещей за весь наблюдаемый период.
mix – смесь геновидов B.afzelii и B.garinii.
Доля позитивных клещей определялась как p ± SD, по формулам:
p = P/n * 100% (1);
SD = √р*(100 – p)/n (2);
где Р – количество позитивных особей в конкретной выборке, n – величина выборки.
Изоляция и культивирование спирохет Borrelia burgdorferi s.l.
Изоляцию и выращивание боррелий проводили на среде BSK II, в двух вариантах: прямое культивирование из клещей и с использованием лабораторных мышей в качестве природного фильтра. При выращивании боррелий непосредственно из клещей I.persulcatus, в качестве посевного материала использовали гомогенат клещей. По 5 особей клещей гомогенизировали в среде BSK II, хитиновые оболочки осаждали центрифугированием, а надосадочную жидкость инокулировали в пробирки со средой. Пробы инкубировали 15 суток при 320С, после чего культуры пересевали на свежую среду BSK II и выращивали еще 15 дней. Культивирование в общей сложности проводили в течение месяца. Во втором варианте, гомогенат клещей инъецировали животным внутрибрюшинно. Мышей после инъекций содержали 20 дней в виварии, затем кровь, сердце и мочевой пузырь извлекали и помещали в культуральную среду BSK II. Далее процедура была аналогична той, которая описана для культивирования боррелий из клещей. В результате этой работы нами было получено 37 изолятов боррелий, среди которых 24 изолята B.garinii; 3 изолята B.afzelii; и 10 образцов культур были представленны смесью изолятов B.garinii и B.afzelii. Полученные культуры использовали в качестве стабильного источника выделения ДНК спирохет и последующей амплификации методом ПЦР генов иммунодоминантных антигенов боррелий.
Выбор белков спирохет Borrelia burgdorferi s.l., перспективных для серодиагностики ИКБ
Известно, что спирохеты Borrelia burgdorferi s.l. характеризуются высокой антигенной изменчивостью. В связи с этим большую сложность представляет решение проблемы создания универсальных тестов для серодиагностики ИКБ. Принципиальное значение приобретает рациональный выбор антигенов боррелий и подбор их композиций для создания диагностических систем. На основе проведённого нами анализа литературных данных, наибольший интерес, с точки зрения создания тестов для серодиагностики ИКБ, представляют внешние поверхностные белки OspC и OspA, флагеллярные белки FlaA и FlaB и декоринсвязывающий белок DbpB. Белки OspC, FlaA и FlaB являются одними из первых антигенов индуцирующих иммунный ответ на ранней стадии инфекции ИКБ. Антигены OspA и DbpB индуцируют иммунный ответ на стадии диссеминированной инфекции и при хронизации болезни. Однако какие-либо сведения о первичной структуре генов этих белков для сибирских изолятов Borrelia burgdorferi s.l. в литературе отсутствовали. В связи с этим мы поставили перед собой задачу клонировать белок-кодирующие области этих генов, определить их первичные структуры, получить кодируемые ими рекомбинантные белки и исследовать их антигенные свойства.
Конструирование экспрессирующих векторов серии pRAC
Для удобства клонирования выбранных нами генов иммунодоминантых белков боррелий и обеспечения эффективной экспрессии этих генов в клетках E.coli были сконструированы экспрессирующие векторы серии pRAC. Новые конструкции векторов были созданы на основе вектора pREB-SAT, обеспечивающего экспрессию гена стафилококкового альфа-токсина (SAT) в E.coli (Камынина и Беклемишев, 1997; Беклемишев и др., 2008). Экспрессия гена SAT осуществлялась под контролем регуляторной области гена recA Proteus mirabilis (рис. 2). Вектор pREB имеет ряд недостатков. В частности, терминатор транскрипции Т0 в векторе pREB расположен на расстоянии 565 п.н. правее терминатора трансляции (стоп-кодона) вследствие чего существенно увеличивается длина транскрипта, синтезируемого на клонированном в составе вектора pREB целевом гене. Кроме того, сайт связывания рибосом (SD) расположен в векторе не на оптимальном расстоянии от инициирующего кодона ATG. Мы попытались усовершенствовать эту конструкцию, чтобы увеличить эффективность экспрессии клонируемых в её составе целевых генов. Для того, что бы отслеживать изменения в уровне экспрессии целевого гена, в составе различных конструкций векторов, вместо гена стафилококкового α-токсина был встроен ген зеленого флюоресцирующего белка GFP. Это позволило определять с помощью флюориметра относительное количество синтезируемого белка GFP непосредственно в культуре клеток. Затем мы выполнили ряд последовательных процедур по реконструкции вектора pREB2: 1) участок вектора pREB2, расположенный между сайтом рестрикции BamHI и терминатором транскрипции T0, включающий ген дигидрофолатредуктазы, был удалён, таким образом стоп кодон трансляции был помещён вблизи терминатора транскрипции T0; 2) заменили участок плазмиды, включающий сайт SD и последовательность до инициирующего кодона ATG, регуляторного района гена recA Proteus mirabilis на соответствующий район сильного синтетического промотора Ptaq; 3) слева от сайта SD промотора Ptaq был встроен энхансер трансляции гена 10 бактериофага Т7 с помощью пары комплементарных синтетических олигонуклеотидов. Структуры исходной регуляторной области гена recA Proteus mirabilis и модифицированных конструкций показаны на рис. 3. Новый вектор получил рабочее название pRAC (рис.2).
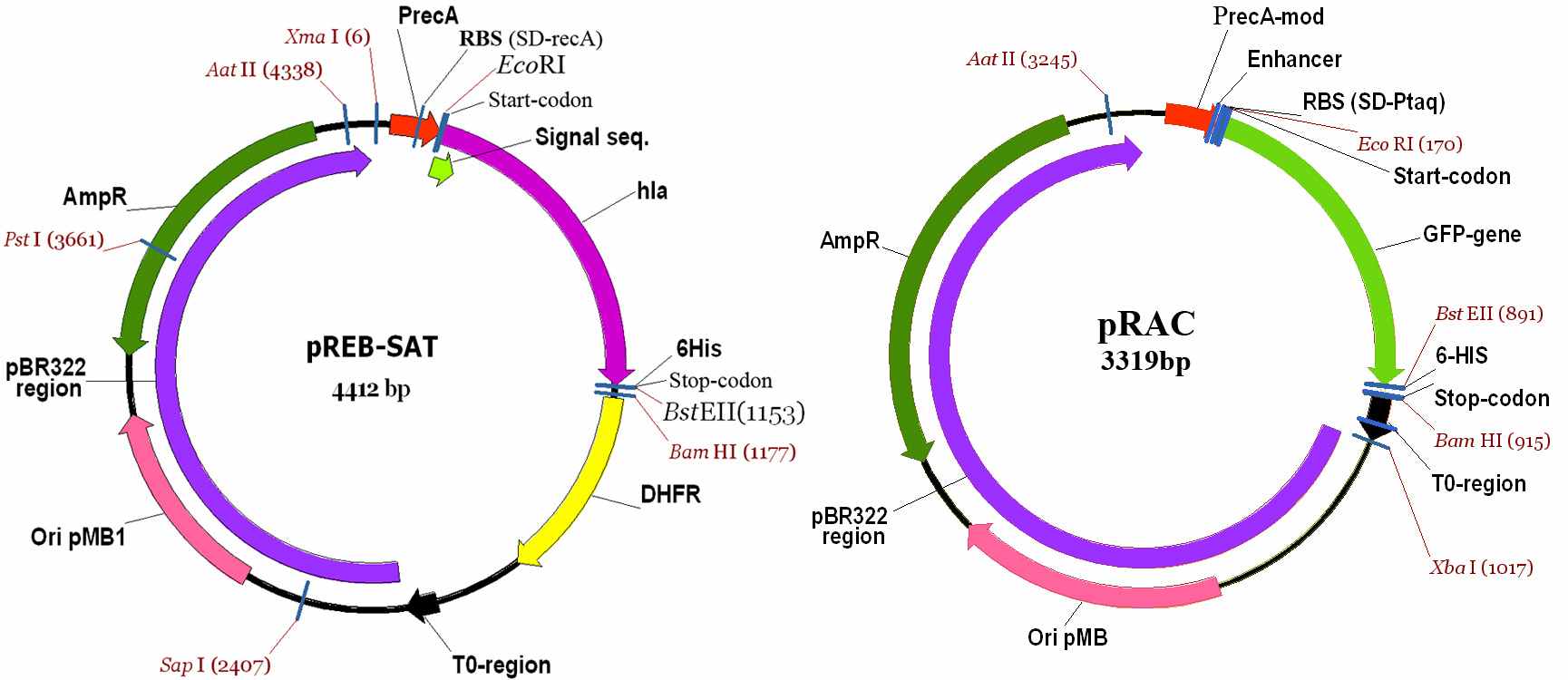
Рис. 2. Генетические карты рекомбинантных плазмид pREB-SAT и pRAC.
PrecA – регуляторная область гена recA Proteus mirabilis; PrecA-mod – модифицированная регуляторная область гена recA Proteus mirabilis; RBS – рибосомосвязывающий сайт (последовательность Шайна-Дальгарно); Signal seq. – фрагмент гена hla S.aureus, кодирующий сигнальный пептид стафилококкового альфа-токсина (САТ); hla – область гена hla S.aureus, кодирующая полипептид-предшественник альфа-токсина; 6His – участок ДНК, кодирующий 6-ти гистидиновую последовательность; DHFR – ген дигидрофолатредуктазы; T0-region – область терминатора транскрипции гена t0 бактериофага λ; Ori pMB1 – ориджин репликации плазмиды pMB1; pBR322 region – участок ДНК плазмиды pBR322; AmpR - ген bla, кодирующий бета-лактамазу – фермент обусловливающий устойчивость клеток E.coli к ампициллину.
SD Start
(1)-aatggtagtgacccatctttatgcttcactgcccagagggagataacatg
(2)-*******************************************ATT*TATG
(3)---------------------attaactttatacaggaaaca**att*tatg
Enhancer SD Start
Рис. 3. Сравнение первичных структур исходной и модифицированных регуляторных областей в районе сайта связывания рибосом разработанных плазмидных конструкций, содержащих промотор гена recA Proteus mirabilis
Обозначения: (1) - регуляторная область гена recA Proteus mirabilis; (2-3) - модифицированная регуляторная область гена recA Proteus mirabilis, в составе экспрессирующих векторов pREB (1), pREB2/pREB3 (2) и pRAC (3).
После проведённых реконструкций мы сравнили уровень синтеза белка GFP в клетках E.coli, содержащих различные варианты сконструированных плазмид. Клетки E.coli шт. BL21(DE3), содержащие плазмиду pRАС, примерно в три раза больше синтезировали белка GFP по сравнению с клетками, содержащими исходную плазмиду pREB2, со встроенным геном gfp (рис. 4А).
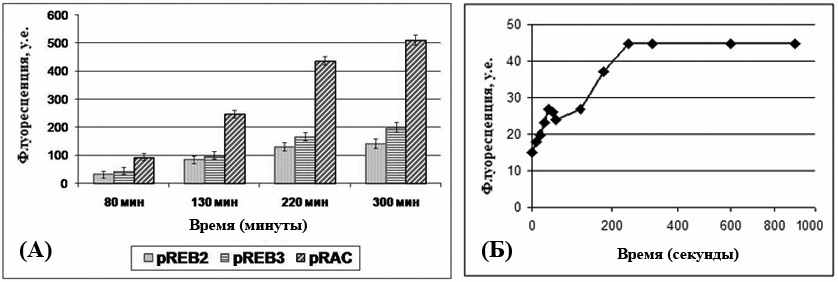
Рис. 4А. Гистограмма величин флюоресценции белка GFP в индуцированных налидиксовой кислотой клетках E.coli шт. Bl21(DE3), содержащих различные плазмидные конструкции pREB2, pREB3 и pRAC.
Рис. 4Б. Влияние различных экспозиций УФ-облучения на длине волны 302 нм на индукцию экспрессии гена белка GFP в клетках E.coli шт. Bl21(DE3), содержащих рекомбинантную плазмиду pRAC.
Вектор pRAC был использован в лаборатории для клонирования и экспрессии гена ксилозо(глюкозо)изомеразы Escherichia coli K12 в клетках E.coli шт. BL21(DE3). Выход рекомбинантной ксилозоизомеразы составлял стабильно более 40% от общего белка клетки. Всё выше изложенное позволяет сделать вывод, что сконструированный нами вектор pRАС может быть использован для высокоэффективной экспрессии клонированных в его составе генов.
Экспрессия целевых генов, клонированных в составе векторов серии pREB и pRAC, осуществляется под контролем регуляторной области гена recA Proteus mirabilis и индуцируется, в нашем случае, известным мутагеном - налидиксовой кислотой. Мы предположили, что штамм E.coli, содержащий вектор pRAC, может отвечать индукцией экспрессии гена белка GFP в ответ на воздействие каких-либо мутагенов физической или химической природы. Действительно, в серии экспериментов было показано, что при воздействии на клетки этого штамма ультрафиолетового излучения (рис. 4Б) и различных концентраций перекиси водорода, митомицина С, формальдегида и налидиксовой кислоты (рисунки не представлены), в клетках наблюдается дозозависимая индукция синтеза белка GFP. Полученные результаты позволили сделать вывод, что рекомбинантный штамм E.coli BL21(DE3), содержащий плазмиду pRAC может быть использован в качестве цельноклеточного биосенсора для обнаружения мутагенов в исследуемых образцах.
На завершающем этапе конструирования вектора, ген gfp был заменен на полилинкер - фрагмент ДНК содержащий сайты узнавания эндонуклеазами рестрикции EcoRI, KpnI, BssHII, BstEII, HindIII и XhoI. Такая структура полилинкера была получена в целях удобства клонирования выбранных нами генов боррелий. За полилинкером следовала нуклеотидная последовательность, кодирующая 8-ми гистидиновый аминокислотный фрагмент в С-концевой области рекомбинантных белков. Это позволяло очищать белки с помощью аффинной хроматографии на металло-хелатных сорбентах. Этот вариант экспрессирующего вектора получил название pRAC3.
Клонирование генов ospA, ospC изолята B.garinii и гена ospC изолята B.afzelii в составе вектора pRAC3
Кодирующие области генов белков OspC, OspA, FlaA, FlaB и DbpB были получены с помощью ПЦР. Для амплификации генов использовали праймеры, подобранные исходя из сравнения нуклеотидных последовательностей соответствующих генов, опубликованных в базе данных GenBank. В каждом праймере на 5’-конце был предусмотрен сайт узнавания определённой эндонуклеазой рестрикции, имеющийся в полилинкере вектора pRAC3. По этим сайтам осуществляли гидролиз генов и их встраивание в вектор. В качестве матрицы для амплификации всех 5-ти генов использовали ДНК изолята B.garinii группы 20047Т (NSK-10-06), поскольку этот геновид являлся самым встречаемым на территории Новосибирской области. Ген ospC амплифицировали также на ДНК изолята B.afzelii (NSK-05-06).
В качестве первых генов, проклонированных нами в составе вектора pRAC3 в клетках E.coli шт. Rosetta 2, были гены внешних поверхностных белков OspA и OspC. Наличие вставки генов в составе вектора подтверждали секвенированием. Клоны, в которых рамка трансляции белка не нарушалась, исследовали на индуцируемую продукцию целевого рекомбинантного антигена методом электрофореза лизатов клеток в ПААГ. Ни в одном из проанализированных клонов не было обнаружено видимых количеств белков OspA и OspC. По-видимому, очень низкий уровень синтеза этих полноразмерных антигенов обусловлен их высокой токсичностью для клеток E.coli, которую отмечали и другие исследователи (Dunn et al., 1990). Определённую ингибирующую роль могли сыграть и вторичные структуры синтезированных мРНК этих белков. В связи с этим в дальнейшей работе мы клонировали гены ospC, ospA, flaA и flaB, с делетированными последовательностями, кодирующими сигналы секреции соответствующих белков. Кроме того, для повышения экспрессии генов было решено использовать вектор pET36b(+), содержащий один из самых сильных промоторов (промотор гена 10 бактериофага Т7).
Клонирование кодирующих областей генов ospC, ospA, flaA, flaB и dbpB в составе вектора рЕТm
Чтобы вектор pET36b(+) был удобен для клонирования выше названных генов, мы модифицировали его, путем встраивания под регуляторную область промотора полилинкера из вектора pRAC3. Модифицированный вектор был назван рЕТm. Для амплификации фрагментов генов ospC, ospA, flaA и flaB, кодирующих соответствующие белки, лишённые сигналов секреции были подобраны новые праймеры.
В результате клонирования фрагментов генов ospC, ospA, flaA, flaB и гена dbpB в клетках E.coli в составе модифицированного вектора рЕТm, и последующей индукции экспрессии генов, мы наблюдали на электрофореграммах четкие мажерные полосы, соответстующие рекомбинантным белкам OspA, OspC B.garinii (OspC-Bg), OspC B.afzelii (OspC-Ba), FlaA, FlaB и DbpB (рис. 5).
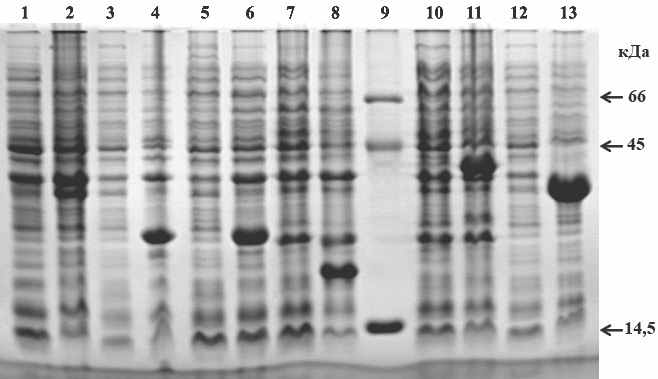
Рис. 5. Электрофореграмма лизатов клеток клонов E.coli шт. Rosetta 2, содержащих рекомбинантные плазмиды pETm со встроенными фрагментами генов ospA, ospC-Bg, ospC-Ba, dbpB, flaA и flaB.
Дорожки: 1, 3, 5, 7, 10 и 12 - лизаты неиндуцированных ИПТГ клеток E.coli, продуцирующих белки OspA (1), OspC-Bg (3), OspC-Ba (5), DbpB (7), FlaA (10) и FlaB (12);
дорожки: 2, 4, 6, 8, 11 и 13 лизаты индуцированных ИПТГ клеток E.coli, продуцирующих белки OspA (2), OspC-Bg (4), OspC-Ba (6), DbpB (8), FlaA (11) и FlaB (13);
дорожка 9 – маркерные белки массой 65, 45 и 14,5 кДа.
Получение и очистка рекомбинантных белков боррелий.
В качестве штамма-продуцента рекомбинантных антигенов боррелий был использован штамм E.coli Rosetta2, содержащий плазмиду, обеспечивающую экспрессию генов т-РНК специфичных для редко встречаемых в E.coli кодонов. Полученные штаммы-продуценты обеспечивали высокий уровень синтеза рекомбинантных белков, который составлял от общего белка клетки 13% для OspA, 28% для OspC-Bg, 20% для OspC-Ba, 29% для DbpB, 30% для FlaA и 41% для FlaB. Рекомбинантные белки выделяли с помощью колоночной аффинной хроматографии на никель-хелатном сорбенте в денатурирующих или нативных условиях. В среднем выход очищенных белков составлял: 30 - 65 мг/л культуры клеток-продуцентов. Чистоту рекомбинантных белков определяли методом электрофореза в ПААГ (рис. 6). Как видно на рисунке степень очистки белков достигала не менее 90%.
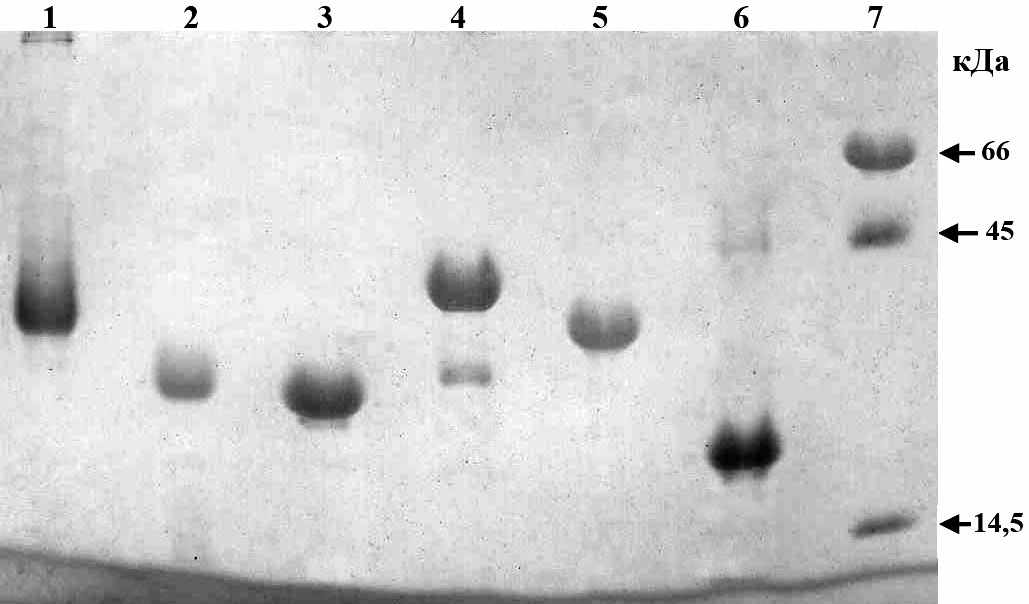
Рис. 6. Электрофореграмма препаратов очищенных рекомбинантных белков. Белки нанесены на дорожки в количестве ~20 мкг. Дорожки: (1 – 6) – препараты очищенных рекомбинантных белков OspА (1), OspC-Ba (2), OspC-Bg (3), FlaA (4), FlaB (5) и DbpB (6); 7 – маркерные белки (65, 45 и 14,5 кДа).
Изучение антигенных свойств рекомбинантных белков боррелий
Антигенные свойства очищенных рекомбинантных белков боррелий исследовали методом твердофазного ИФА на панели сывороток больных с достоверным диагнозом ИКБ с мигрирующей эритемой (стадия локализованной инфекции) и более поздней стадией - стадией диссеминированной инфекции. Результаты исследования представлены в таблице 2.
В экспериментах по выявлению методом ИФА специфических антител класса IgM и IgG наибольшей чувствительностью обладали рекомбинантные белки OspC-Bg и FlaB в обеих стадиях заболевания, локализованной и диссеминированной. Наименьшей чувствительностью обладали белки OspA и DbpB.
Рекомбинантные белки FlaA, FlaB, OspC-Bg и OspC-Ba примерно в равной степени выявляли антитела в сыворотках больных с локализованной и диссеменированной стадиями заболевания. Существенные отличия были обнаружены только в случае использования рекомбинантных белков OspA и DbpB. При тестировании сывороток больных ИКБ с локализованной стадией инфекции на наличие специфических антител класса IgM оба этих антигена показали низкую чувствительность 21,7% и 26,1%, соответственно. При выявлении в сыворотках больных ИКБ с диссеминированной стадией инфекции антител класса IgG, специфичных к белкам OspA и DbpB чувствительность к этими антигенами увеличивалась примерно в два раза – до 42%. Основываясь на этих данных можно утверждать, что белки OspA и DbpB более пригодны для выявления специфичных им IgG в сыворотках крови больных ИКБ с диссеминированной стадией инфекции.
Таблица 2. Выявление методом ИФА специфических антител класса IgM и IgG к рекомбинантным белкам B.burgdorferi s.l. в сыворотках больных ИКБ
| Антигены | Вид | Количество сывороток с положительными результатами ( % чувствительности) | |||
| IgM | IgG | ||||
| Стадия I (с МЭ; n=46) (а) | Стадия II (без МЭ; n=28) (б) | Стадия I (с МЭ; n=30) (а) | Стадия II (без МЭ; n=24) (б) | ||
| OspA | B.garinii | 10 (21,7) | 3 (10,7) | 10 (33,3) | 10 (41,6) |
| DbpB | B.garinii | 12 (26,1) | 9 (32,1) | 10 (33,3) | 10 (41,6) |
| FlaA | B.garinii | 18 (39,1) | 12 (42,8) | 12 (40,0) | 11 (45,8) |
| FlaB | B.garinii | 25 (54,3) | 16 (57,1) | 19 (63,3) | 16 (66,6) |
| OspC-Ba | B.afzelii | 23 (50,0) | 11 (39,3) | 15 (50,0) | 12 (50,0) |
| OspC-Bg | B.garinii | 28 (60,9) | 20 (71,4) | 21 (70,0) | 18 (75,0) |
(а) – группа больных ИКБ с мигрирующей эритемой (локализованная инфекция), сыворотка взята в период 2-4 недели с начала заболевания; (б) – группа больных ИКБ без мигрирующей эритемы (диссеминированная инфекция), сыворотка взята в период 4-8 недели с начала заболевания; n – количество исследуемых образцов сывороток.
В ряде работ содержатся сведения о том что, некоторые белки боррелий взаимодействуют с антителами сывороток пациентов больных сифилисом и ревматоидным артритом. Поэтому специфичность каждого антигена мы определяли тестированием 30 сывороток здоровых доноров, 20 - больных сифилисом и 12 - ревматоидным артритом. Результаты тестирования представлены в таблице 3.
Таблица 3. Выявление методом ИФА антител класса IgM и IgG к рекомбинантным белкам B.burgdorferi s.l. в сыворотках от больных сифилисом, ревматоидным артритом и здоровых доноров
| Антигены | Сыворотки больных сифилисом (n=20) | Сыворотки больных ревматоидным артритом (n=12) | Сыворотки здоровых доноров (n=30) | ||
| IgM | IgG | IgM | IgG | IgM/IgG | |
| OspA | 0 | 0 | 0 | 0 | 0 |
| DbpB | 0 | 0 | 0 | 0 | 0 |
| FlaA | 2 (10,0) | 3 (15,0) | 1 (8,3) | 1 (8,3) | 0 |
| FlaB | 3 (15,0) | 3 (15,0) | 2 (16,7) | 2 (16,7) | 0 |
| OspC-Ba | 1 (5,0) | 1 (5,0) | 1 (8,3) | 0 | 0 |
| OspC-Bg | 1 (5,0) | 1 (5,0) | 1 (8,3) | 1 (8,3) | 0 |
n – количество исследуемых образцов сывороток.
По результатам тестирования этих сывороток на наличие антител класса IgM и IgG к исследуемым рекомбинантным антигенам отрицательные результаты были получены только с белками OspA и DbpB. В случае использования флагеллярных белков FlaA и FlaB ложноположительные результаты были получены примерно в 17% проанализированных сывороток от больных сифилисом и ревматоидным артритом; в случае применения антигенов OspC-Ba и OspC-Bg – в 8%. Следует отметить, что со всеми изучаемыми белками не было получено ни одного ложноположительного результата при тестировании сывороток здоровых доноров.
Проанализировав взаимодействия сывороток с каждым рекомбинантным белком (данные не представлены) мы обнаружили, что одни антигены выявляют сыворотки, которые не выявляются другими антигенами. Если предусмотреть одновременное использование пары антигенов для обнаружения антител, например методом Вестерн-блотта или иммунохроматографическим методом, то можно ожидать, что чувствительность такого анализа существенно увеличится. В нашем случае мы ожидаем повышения чувствительности выявления специфических антител для пар антигенов OspA/DbpB, FlaA/FlaB и OspC-Ba/OspC-Bg. Наибольшей чувствительностью, по результатам ИФА, полученным на исследуемой панели сывороток с индивидуальными антигенами, должна обладать пара антигенов OspC-Ba/OspC-Bg (табл. 4). Таким образом, используя композицию полученных рекомбинантных антигенов в Вестерн-блот анализе или иммунохроматографическом тесте можно добиться чувствительности обнаружения антител к антигенам спирохет B.burgdorferi s.l. в сыворотках больных ИКБ, приближающейся к 100%.
Таблица 4. Ожидаемое количество (%) выявляемых сывороток больных ИКБ в ИФА с использованием пар рекомбинантных антигенов боррелий
| Пара антигенов | Выявляемый класс антител на различных стадиях ИКБ | |||
| Локализованная стадия | Диссеменированная стадия | |||
| IgM, (n=46) | IgG, (n=30) | IgM, (n=28) | IgG, (n=24) | |
| OspA/DbpB | 20 (43,5%) | 18 (60,0%) | 12 (42,8%) | 20 (83,3%) |
| FlaA/FlaB | 28 (60,9%) | 22 (73,3%) | 21 (75,0%) | 24 (100%) |
| OspC-Bg/OspC-Ba | 39 (84,8%) | 29 (96,7%) | 26 (92,8%) | 24 (100%) |
n – количество исследованных образцов сывороток с индивидуальными антигенами.
Сравнительный анализ аминокислотных последовательностей полученных рекомбинантных белков боррелий
Аминокислотную последовательность каждого из полученных в настоящей работе рекомбинантных белков (DbpB, OspA, FlaA, FlaB, OspC B.garinii 20047т и OspC B.afzelii) сравнивали с последовательностями аналогичных белков боррелий, представленными в электронной базе данных GenBank (декабрь 2008 г.).
Самая высокая степень гомологии была установлена для флагеллярных белков FlaA и FlaВ. Оба белка показали максимальную 100%-ю гомологию с соответствующими белками-аналогами изолятов B.burgdorferi s.l. выделенных на территории Европы. В отличие от флагеллярных белков, для белка DbpB высокая гомология 92-100% была показана с аналогичными белками только изолятов геновида B.garinii, выделенных на территории Европы. Вариабельность белка OspA была значительно больше. Даже в рамках изолятов одного геновида B.garinii, полученных на территории Европы, гомология сравниваемых белков OspA варьировала от 75% до 100%.
Самая высокая гетерогенность была свойственна белкам OspC. При сравнении первичных структур полученных нами рекомбинантных антигенов OspC с опубликованными аминокислотными последовательностями аналогичных белков, наибольшая гомология была установлена с белками OspC изолятов боррелий, выделенных на территории Европы (97-67%). Следует отметить, что рекомбинантные антигены OspC-Bg и OspC-Ba изолятов B.garinii и B.afzelii циркулирующих на одной территории Новосибирской области имели гомологию по отношению друг к другу, составляющую всего 67%. Вполне понятно, что такие отличия в первичных структурах этих антигенов обусловливают их различную иммунореактивность с сыворотками больных ИКБ.
ЗАКЛЮЧЕНИЕ
В настоящей работе была определена зараженность и геновидовой состав спирохет Borrelia burgdorferi s.l. в клещах Ixodes persulcatus Schulze, обитающих на территории Новосибирского научного центра и отловленных в весенние периоды 2003, 2005, 2006 и 2008 г.г. Впервые на территории Новосибирской области в клещах Ixodes persulcatus были обнаружены спирохеты геновида Borrelia japonica (2006 и 2008 г.г.). В работе были получены культуры спирохет B.garinii и B.afzelii, циркулирующих в популяции иксодовых клещей, населяющих рекреационную зону ННЦ. Были проклонированы в клетках E.coli в составе экспрессирующих векторов pRAC3 и pETm кодирующие области генов внешних поверхностных липопротеинов (OspA и OspC), флагеллярных белков (FlaA и FlaB) и декоринсвязывающего белка В (DbpB) изолята B.garinii группы 20047Т и белка OspC изолята B.afzelii.
В работе были получены высоко очищенные рекомбинантные белки боррелий OspC-Bg, OspC-Ba, OspA, FlaA, FlaB и DbpB и исследованы их антигенные свойства методом ИФА на сыворотках больных ИКБ. По результатам ИФА можно сделать вывод о пригодности полученных в данной работе рекомбинантных антигенов OspC, FlaA и FlaB B.garinii и OspC B.afzelii для серодиагностики инфекций ранней и диссеминированной стадий. Рекомбинантные белки OspA и DbpB могут быть использованы для серодиагностики диссеминированной и хронической стадий ИКБ. Результаты ИФА свидетельствуют о необходимости использования композиций антигенов для увеличения чувствительности методов серодиагностики ИКБ. На примере рекомбинантных белков OspC изолятов B.garinii и B.afzelii показана необходимость использования для серодиагностики гомологичных вариабельных антигенов, всех патогенных изолятов боррелий циркулирующих на территории Новосибирской области.
По данным сравнения аминокислотных последовательностей, полученных в настоящей работе рекомбинантных белков, с первичными структурами аналогичных белков боррелий, представленных в базе данных GenBank, изолят B.garinii 20047Т (Nsk-10-06) филогенетически близок изолятам этого геновида, выделенным на территории Европы.
ВЫВОДЫ
- Зараженность клещей Ixodes persulcatus Schulze, отловленных в рекреационной зоне ННЦ в весенние периоды с 2003 по 2008 г.г., спирохетами Borrelia burgdorferi s.l., колебалась в зависимости от года наблюдений в пределах 20% - 32%.
- В популяции исследованных клещей Новосибирской области выявлены только три геновида боррелий – Borrelia garinii (группы NT29 и 20047T), Borrelia afzelii и Borrelia japonica с явным преобладанием первого (~75%).
- Сконструированные плазмидные векторы pRAC3 и рЕТm, обеспечивают эффективную экспрессию клонируемых в их составе генов в клетках E.coli шт. BL21(DE3) и шт. Rosetta2 и последующую аффинную очистку рекомбинантных белков.
- Штамм E.coli, содержащий вектор pRAC, может применяться в качестве цельноклеточного биосенсора для обнаружения мутагенов химичечской и физической природы в исследуемых образцах.
- Штаммы E.coli BL21(DE3) и Rosetta2, несущие экспрессирующий вектор рЕТm со встроенными в него кодирующими областями генов flaA, flaB, ospC, ospA и dbpB B.garinii 20047Т и ospC B.afzelii обеспечивают эффективный синтез соответствующих этим генам рекомбинантных белков.
- Полученные в настоящей работе рекомбинантные антигены FlaA, FlaB, OspC, OspA и DbpB могут быть использованы для конструирования тест-систем серодиагностики локализованной и диссеменированной стадий ИКБ.
- Западносибирский изолят B.garinii 20047Т (Nsk-10-06) филогенетически близок изолятам этого геновида, выделенным на территории Европы.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Рябченко А.В., Ивлева И.Н., Беклемишев А.Б. Комплексная оценка зараженности клещей Ixodes persulcatus, распространённых в рекреационной зоне новосибирского научного центра, спирохетами Borrelia burgdorferi s.l. // Журнал инфекционной патологии. – 2004. – Т. 11. – № 3-4. – С. 107-110.
2. Рябченко А.В., Терехова Д.В., Ивлева И.В., Бирюков А.Ю., Беклемишев А.Б. Выделение и типирование западно-сибирских изолятов боррелий, возбудителей иксодового клещевого боррелиоза // Тезисы докладов Международного мультидисциплинарного конгресса «Прогресс в фундаментальных и прикладных науках для здоровья человека». – 2004. – Судак, Украина. – С. 141-142.
3. Рябченко А.В. Получение западно-сибирских культур Borrelia burgdorferi s.l. // Аспирантский сборник НГПУ 2004. – Новосибирск: Изд. НГПУ. – 2004. – Ч. 2. – С. 160-168.
4. Рябченко А.В., Караваев В.С., Ивлева И.Н., Терехова Д.В., Беклемишев А.Б. Оценка пригодности ряда антигенов сибирских изолятов Borrelia burgdorferi sensu lato для диагностики иксодового клещевого боррелиоза // Тезисы докладов Международной конференции «Развитие международного сотрудничества в области изучения инфекционных заболеваний». – 2004. – Новосибирск, Россия. – С. 272.
5. Рябченко А.В., Беклемишев А.Б. Оценка зараженности клещей Ixodes persulcatus, отловленных весной 2005 г. в рекреационной зоне новосибирского научного центра, спирохетами Borrelia burgdorferi s.l. // Журнал инфекционной патологии. – 2005. – Т. 12. – № 3-4. – С. 109-110.
6. Рябченко А.В., Беклемишев А.Б., Ивлева И.Н. Конструирование вектора для эффективной экспрессии генов в клетках E.coli. // Материалы третьего Московского международного конгресса "Биотехнология: состояние и перспективы развития". – М: ЗАО "Экспо-биохим-технология", РХТУ им. Д.И. Менделеева. – 2005. – Ч. 1. – С. 99-100.
7. Рябченко А.В., Караваев В.С., Беклемишев А.Б. Получение рекомбинантных форм некоторых иммунодоминантных белков западносибирских изолятов возбудителя Лайм-боррелиоза и оценка их диагностической значимости // Материалы московской международной конференции «Биотехнология и медицина». – М.: ЗАО «Экспо-биохим-технология», РХТУ им. Д.И. Менделеева. – 2006. – С. 55.
8. Лавриненко И.А., Лавриненко В.А., Рябченко А.В., Беклемишев А.Б. Создание биосенсорной тест-системы для детекции повреждений ДНК путем использования репортерного белка GFP //Бюллетень экспериментальной биологии и медицины. – 2006. – Т. 141. – № 1. – С. 38-40.
9. Рябченко А.В., Беклемишев А.Б. Мониторинг заражённости клещей рекреационной зоны г. Новосибирска возбудителями Лайм-боррелиоза // Вестник НГУ. – 2007. – Т. 5. – С. 106-110.
10. Лавриненко И.А., Рябченко А.В., Беклемишев А.Б. Создание цельноклеточной биосенсорной тест-системы для обнаружения генотоксических воздействий на клетку // Вестник НГУ. – 2007. – Т. 5. – С. 95-99.
11. Рябченко А.В., Лавриненко И.А., Беклемишев А.Б. Рекомбинантная плазмидная ДНК для обнаружения агентов, повреждающих генетический аппарат клетки (варианты) // Патент РФ № 2311459 от 27.11.2007.
12. Караваев В.С., Иванов И.Д., Рябченко А.В. Оценка иммунореактивности рекомбинантных белков OspC и фрагмента FlaB (f-FlaB) Borrelia garinii NT29 в экспериментах с сыворотками больных Лайм-боррелиозом // Бюллетень СО РАМН. – 2007. – № 5. – С. 53-57.
13. Рябченко А.В., Мамаев А.Л. Инфицированность клещей Ixodes persulcatus, отловленных весной 2006г. в лесопарковой зоне новосибирского академгородка // Бюллетень СО РАМН. – 2007. – № 5. – С. 58-61.
14. Караваев В.С., Иванов И.Д., Рябченко А.В., Беклемишев А.Б. Получение рекомбинантных белков OspC и фрагмента FlaB (f-FlaB) западно-сибирских изолятов Borrelia garinii NT29 и исследование их свойств // Мол. генетика, микробиол. и вирусол. – 2008. – № 1. – С. 18-22.
