Лекция №14. Строение и реакционная способность галогенов
| Вид материала | Лекция |
- Клатрохелатные комплексы d -металлов различной природы, симметрии и функциональности:, 629.47kb.
- Программа работы IX международной конференции " Проблемы сольватации и комплексообразования, 828.27kb.
- Программа работы III региональной конференции молодых ученых «теоретическая и экспериментальная, 281.9kb.
- Алкилиденанилины: структура и реакционная способность в гидрировании 02. 00. 03 органическая, 495.9kb.
- Координационная химия и реакционная способность смешанных ацидопорфириновых комплексов, 804.83kb.
- Социология лекция 6 Социальная стратификация и мобильность. Социальные противоречия, 34.07kb.
- «вооружить», 54.49kb.
- Строение и свойства металлических материалов лекция 2 Строение и свойства металлов, 103.5kb.
- М. Л. Калужский филиал взфэи в г. Омске Маркетинг Лекция, 177.72kb.
- Урок биологии в 7 классе. Тема: «Внутреннее строение рыб», 112.94kb.
Лекция № 14. Строение и реакционная способность галогенов.
§ 1. Электронные конфигурации и свойства атомов.
| 1. | Заряд ядра | 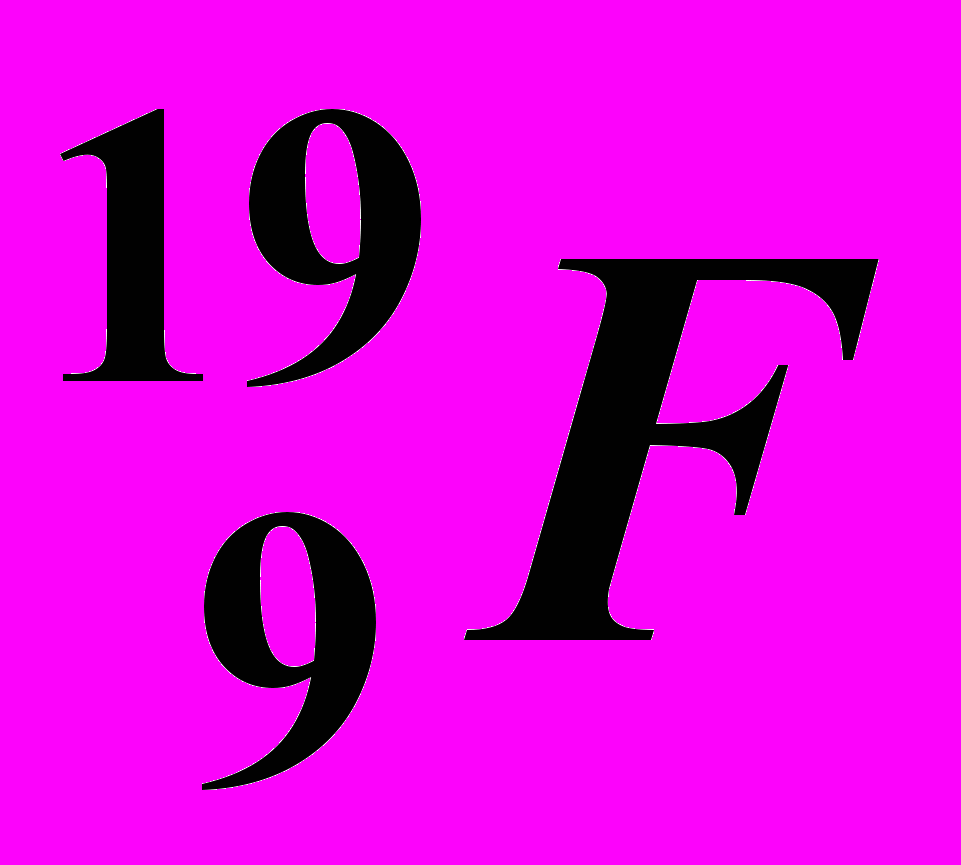 | 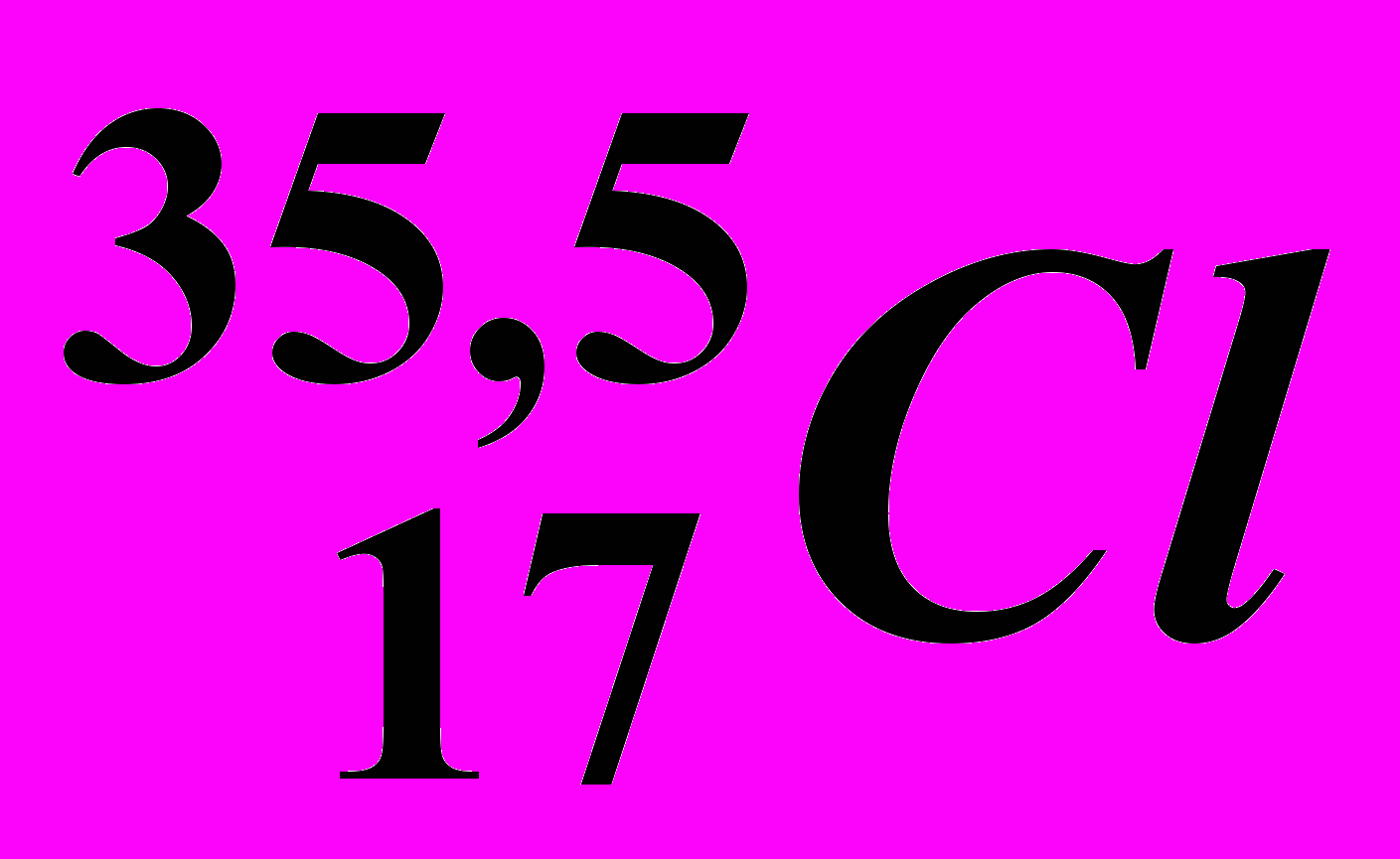 | 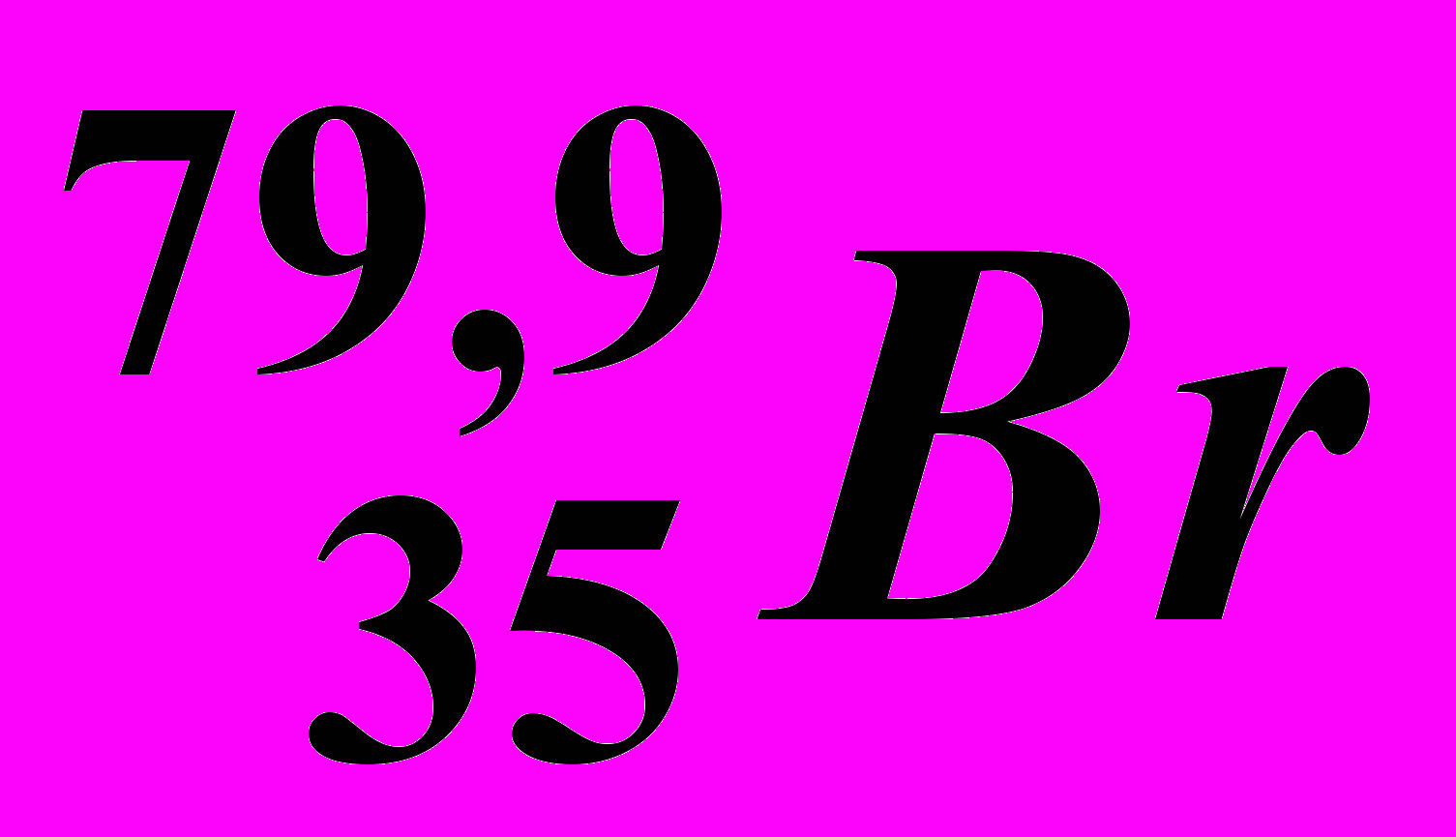 |  |  | |
| 2. | Электронная конфигурация | [He]2s22p5 | [Ne]3s3p53do | [Ar]3d10 4s24p54do | [Fr]4d105s25p55do | | |
| ns2np5 | Приметить: а) ns2np5 – валентные электроны; b) у хлора появляется 3d пустая орбиталь; с) Различие энергий s- и р-орбиталей уменьшается; d) Число валентных электронов увеличивается; e) Разная подкладка: F 2 Cl – 8 Br – 18 I – 18 + 18 Э Э ⊙⊙ At – 32 | ||||||
| 3. | Р Э Э ⊙⊙ Гков  адиус Эо адиус Эо | At I Br Cl F     | |||||
| еЭ – Э |     | ||||||
Ш


| 4. | Энергия ионизации: Го = Г+ + е + I | | At I Br Cl F       | | |||
| 5. | Энергия cродства: Го + е = Г + Е | Е At Br Cl F       | I | | |||

Выводы:
1. ns2np5 ns2np6; неметаллические свойства.
1
0
+1
+3
+5
+7
2. Способность образовывать ковалентную связь.
3. Степени

в с е

все, кроме F (почему?)
окисления:
§
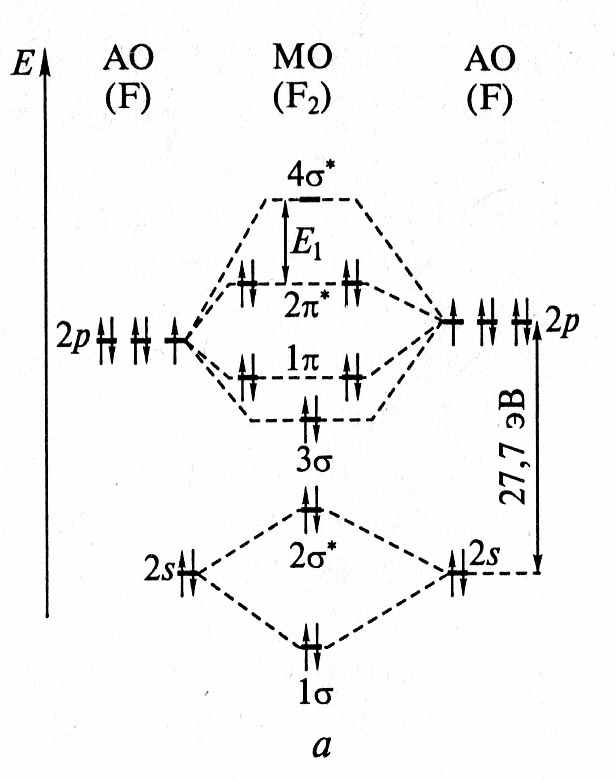 2. Строение и свойства простых веществ
2. Строение и свойства простых веществ1. (1св)2(2разр)2(3св)2(1св)4(2разр)4
2. Порядок связи =
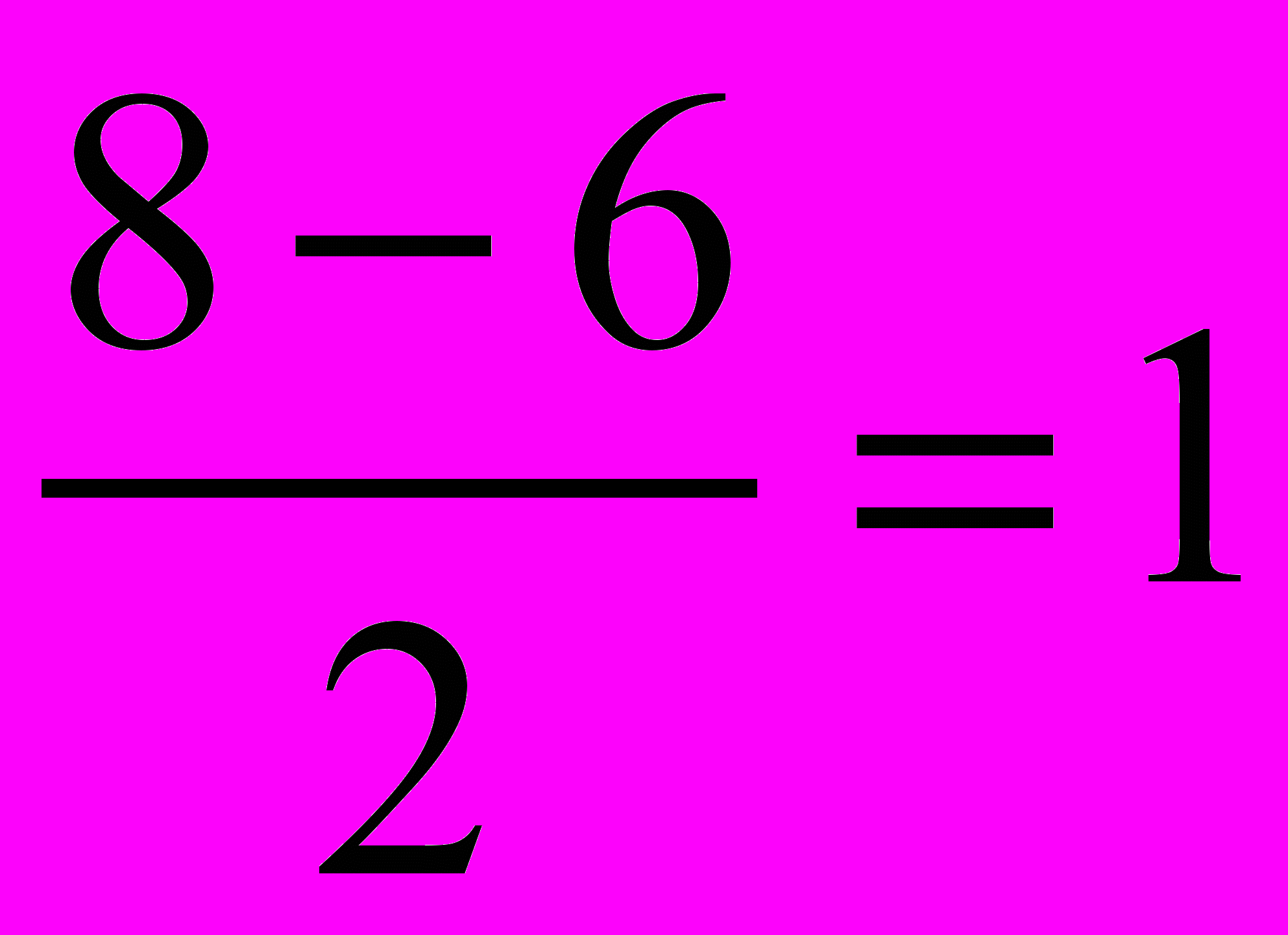
3. Диамагнетизм
Окраска: Поглощение

 ;
; 
| | Полоса поглощения, нм | Окраска (дополнительный цвет) |
| F2 | 285 нм фиолетовая | Светло-желтая |
| Cl2 | 330 Фиолетовая | Желто-зеленая |
| Br2 | 420 Зелено-синяя | Оранжевая |
| I2 | 560 Желто-зеленая | Фиолетовая |
5. Энергия диссоциации молекул Г2 (Dо)
Do

Причины экстремума
 :
:а) F2 Cl2 уменьшение е–е отталк.
Cl2
Br2


I2
F2

2I2 = I4
1,4% мол I4
240оC; 2,5 атм
At2
z

6. Структура, энергия кристаллической решетки.
Температуры плавления, кипения.
Т

При 25оС F2 и Cl2 – газы
Br2 – жидкость; Тпл = 7оС
I2 – твердое; Тпл = 113оС
Причина: с увеличением размера растет межмолекулярное взаимодействие.
I2
25oC
Br2
F2

Cl2

z

Растворимость в неполярных растворителях (CCl4, предельные углеводороды).
- Iтв. = Iр-р + G1;
- K = c = exp(G1/RT) =
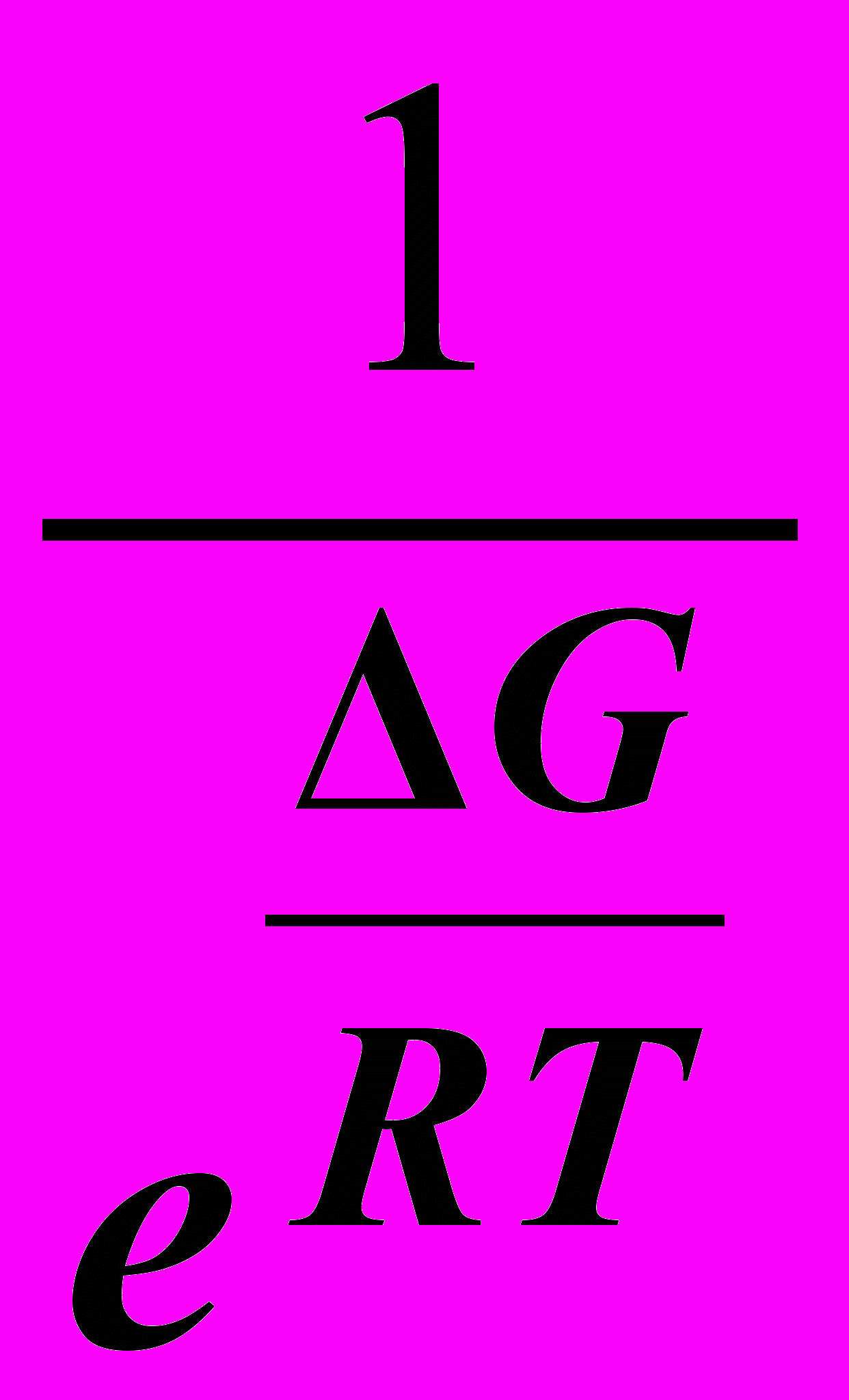 ;
;
3. Gp = Hp TSp;
4. Hp ~ 0;
5. rS(CCl4) > rS(H2O);
6. S = K ln
Почему S растет? a) – число микросостояний, по которым размещается молекула галогена.
b
N – общее число молекул = 6
N1 – их число в твердом йоде
N2 – их число в растворе
)
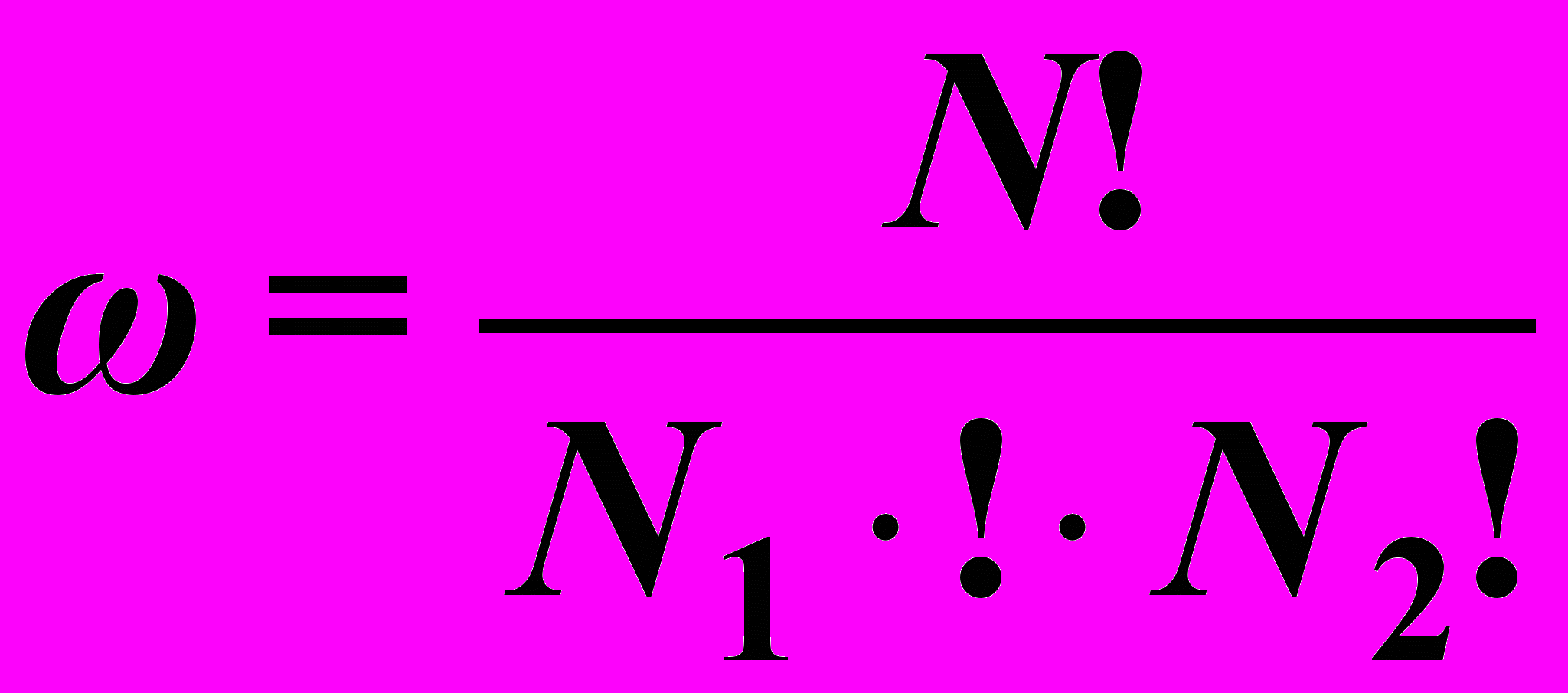
c) Если N2 = 0, то N1 = 6 и
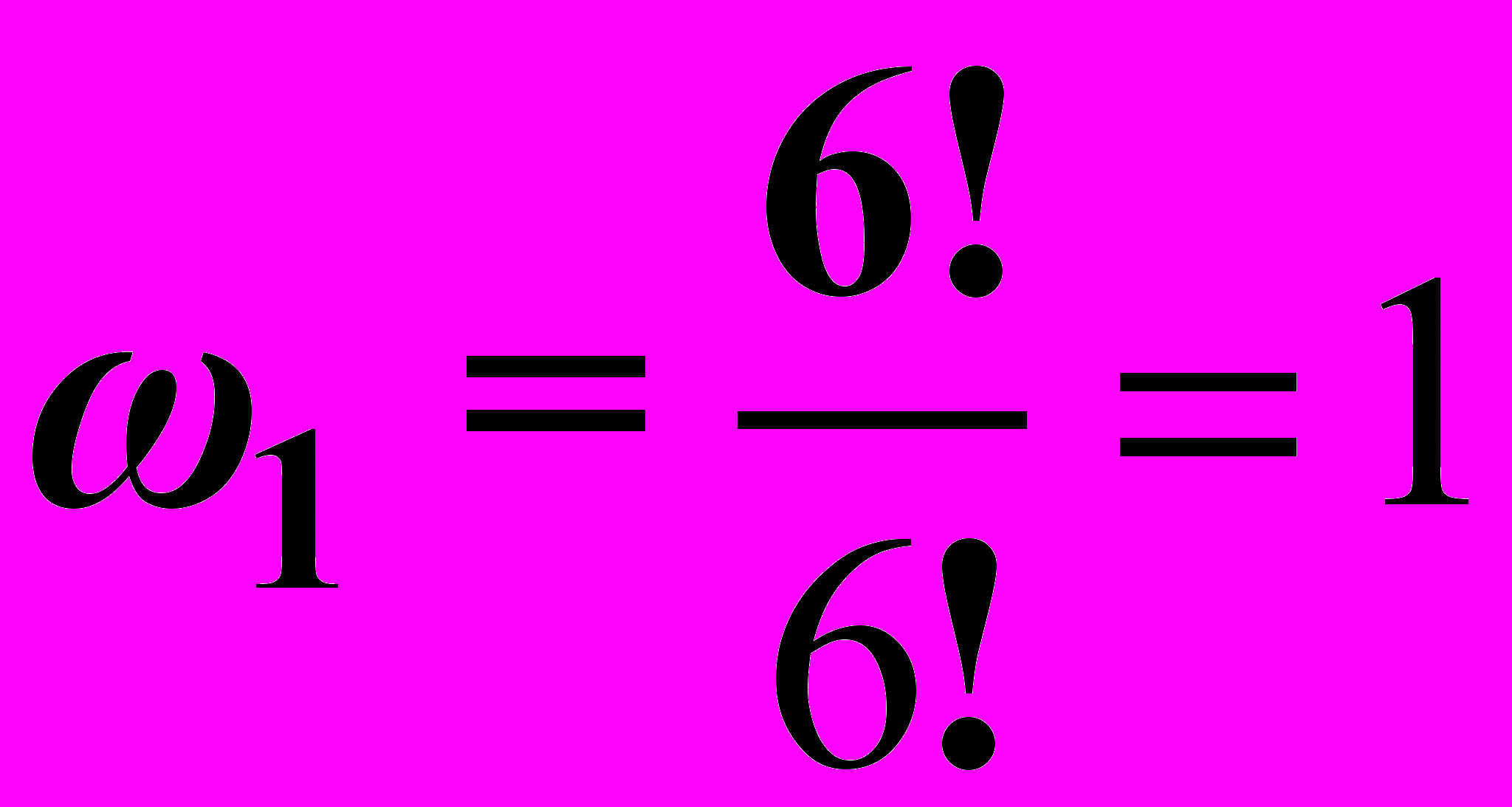
d) Если N2 = 3, N1 = 3, то







Еопт
Е2
4*


E1
2х*
*



Донорная орбиталь растворителя
Молекула иода
y





: N(CH3)3
Триметиламин
Орбиталь комплекса
I2 – растворитель
(S)
х y
Взаимодействие пустой *-орбитали йода с донорной орбиталью растворителя дает В-связывающую и А-разрыхляющую молекулярные орбитали комплекса I2 · S. Окраска обсуловлена поглощением (переходом электронов) А:
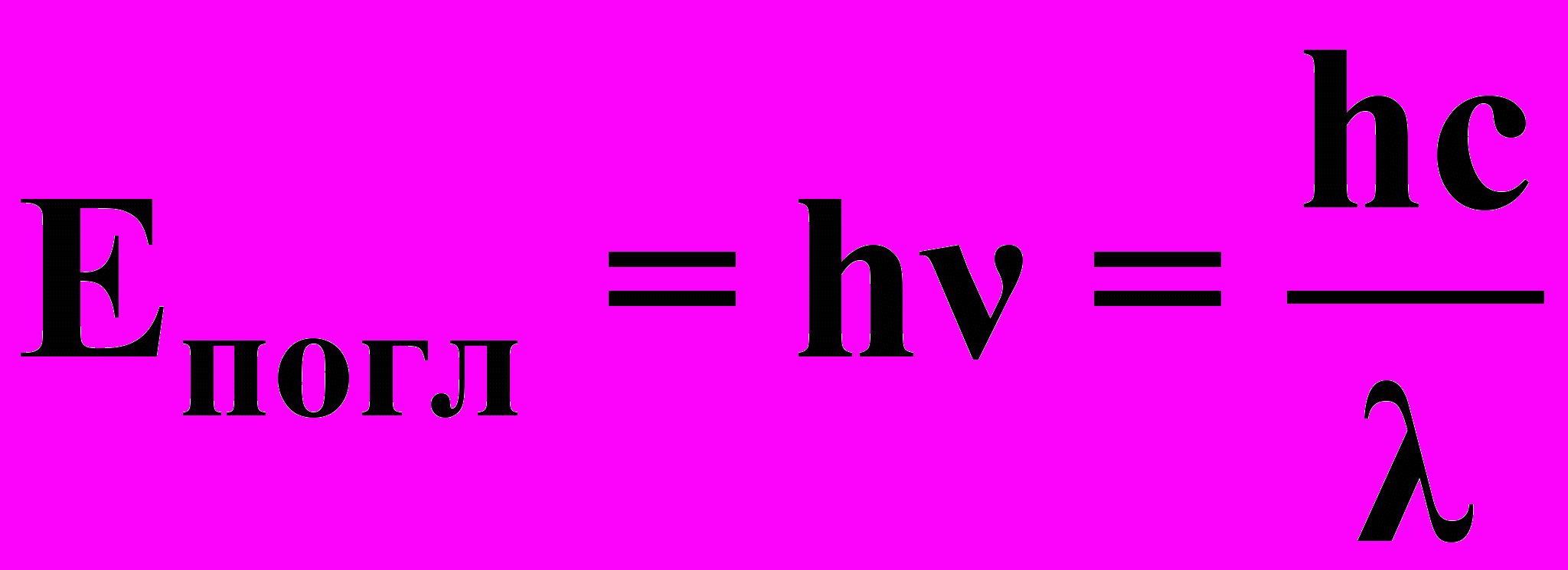 : Чем сильнее I2 · S взаимодействие, тем в более коротковолновую область сдвигается полоса поглощения.
: Чем сильнее I2 · S взаимодействие, тем в более коротковолновую область сдвигается полоса поглощения.| Вещество | Полоса поглощения | Окраска |
| Иод | 540 – 560 нм (желто-зеленая | Черно-фиолетовый |
| I2 · S комплекс | 460 – 480 нм (синяя, фиолетовая) | Коричневый (красноватый) |
§ 3. Прочность связи Э – Э и реакционная способность
1. Гомолитический распад:

Cl2 (244)
Do кДж/моль
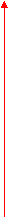


Br2 (193)

I2 (151)
F2 (158)


2. Гетеролитический распад: Х : Х = Х + Х+ +Нгет.
а
Hr
Cl2
1150
F2
1510

 )
) 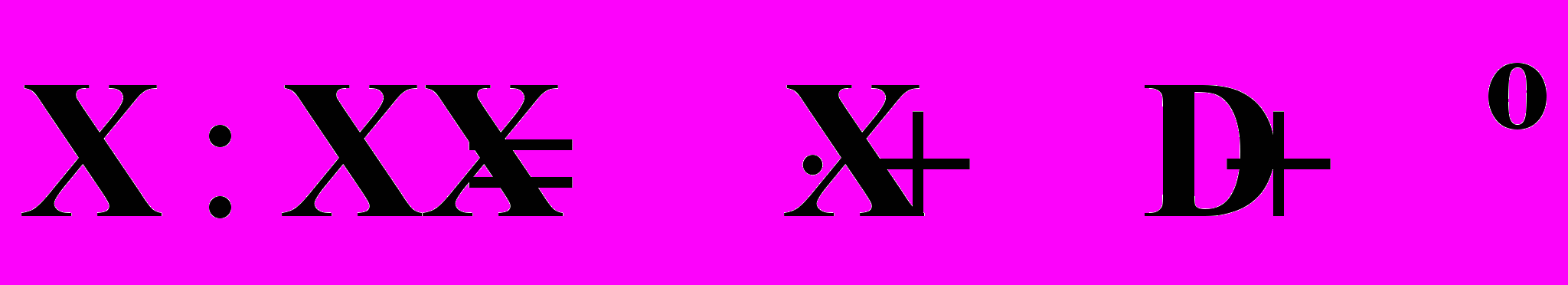
b
I2
866
Br2
1010
 )
) 
с
 )
) 
d
 )
) 

C5H5N:
пиридин
I+



N
N


C5H5N:
§ 4. Химические свойства галогенов: (а) Г ׃ Г ; (b) Г ׃ Г2 = Г + Г+
Неметаллы | Фтор | Хлор | Бром | Иод | а) Полярные растворители сольватация b) Комплексо-образование: Br2 + AlBr2 = = Br+ +[AlBr4] |
He, Ne, Ar | Не взаимодействуют | ||||
| Kr, Xe | ЭFn, n = 2, 4, 6 | Не взаимодействуют | |||
Галогены | ЭFn; n = 1, 3, 5 n = 7 для Э = I | ClFn n = 1, 3, 5 | BrCl BrFn (n = 1,2,3) | ICl, IBr, ICl3 | |
| O2 | F2O4 (при эл. разряде) | Не взаимодействуют | |||
S | SF6, S2F10 | S2Cl2, SCl2, SCl4 | S2Br2 | Не реагирует | |
| N2 | Не взаимодействуют | ||||
| P (Sb) | РГ3 и РГ5 (кроме иода) | ||||
| Н2 | Со взрывом, в темноте, при 200оС | Со взрывом, на свету | Реагирует выше 200оС; Pt – катализатор | Равновесие H2 + I2 = 2HI смещено влево | Опыт 4 Опыт 5 |
| Металлы | загораются | Реагируют при нагревании | Опыт 3 | ||
S + 3F2 = SF6 H = 1207 кДж
2P + 5F5 = 2PF5 H = 3186 кДж
SiO2 + 2F2 = SiF4 + O2
2H2O + 2F2 = 4HF + O2
Cl2 + P (б) PCl5 PCl3
Br2 + P = PBr3 + PBr5
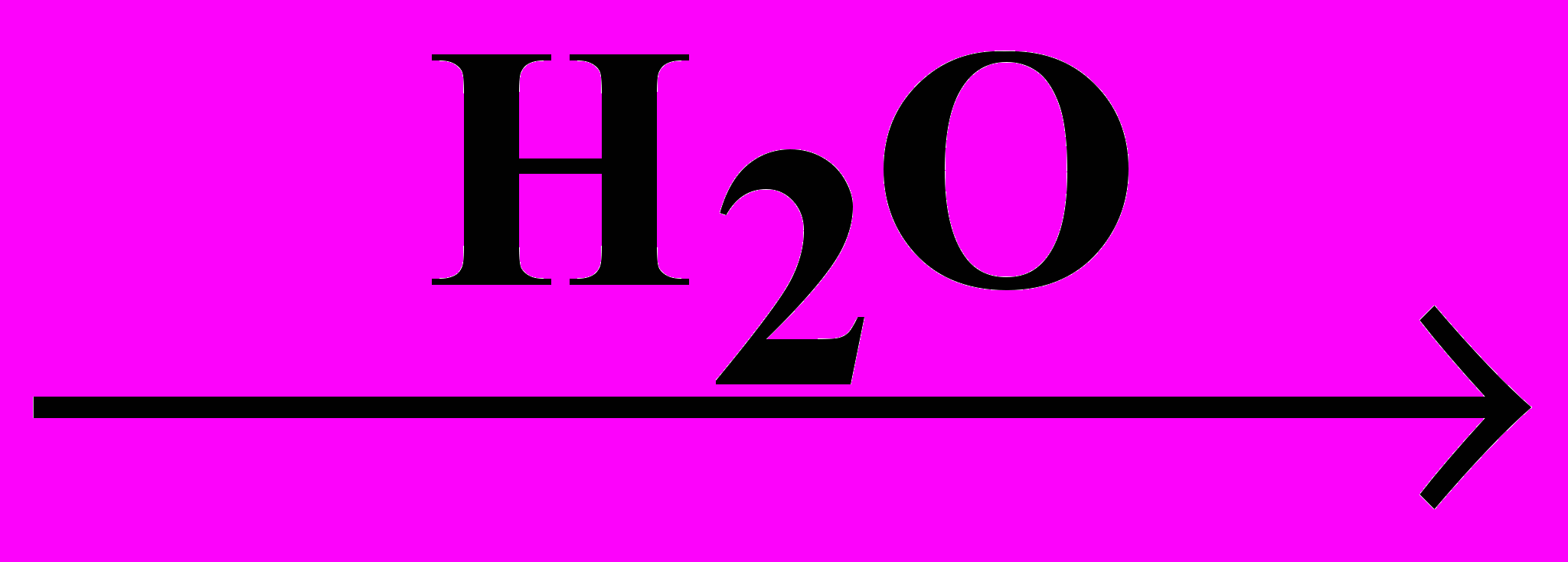 HBr + H3PO3 (H3PO4)
HBr + H3PO3 (H3PO4)Cl2 + Sb SbCl5 SbCl3
Br2 + Al = AlBr3
I2 + Al
 AlI3
AlI32KI + Cl2 = I2 + 2KCl
5Cl2 + I2 + 6H2O = 2HIO3 + 10 HCl
- Химическая активность уменьшается от фтора к хлору.
- Связи «неметалл – галоген» являются ковалентными; связи
«металл – галоген» ионными.
3. Наибольшая прочность связи Э – F.
- При взаимодействии со F2 элементы проявляют высшую степень окисления.
- Высокая реакционная способность F2 обусловлена:
а) низкой энергией диссоциации;
- большой энергией связи Э – F;
- малой энергией активации реакции Э + F2 ЭFn
V = K[Э][F2] = exp(S /K) exp

§ 4. Взаимодействие галогенов с водой.
- Растворение.
Х2 = Х2(раствор) +
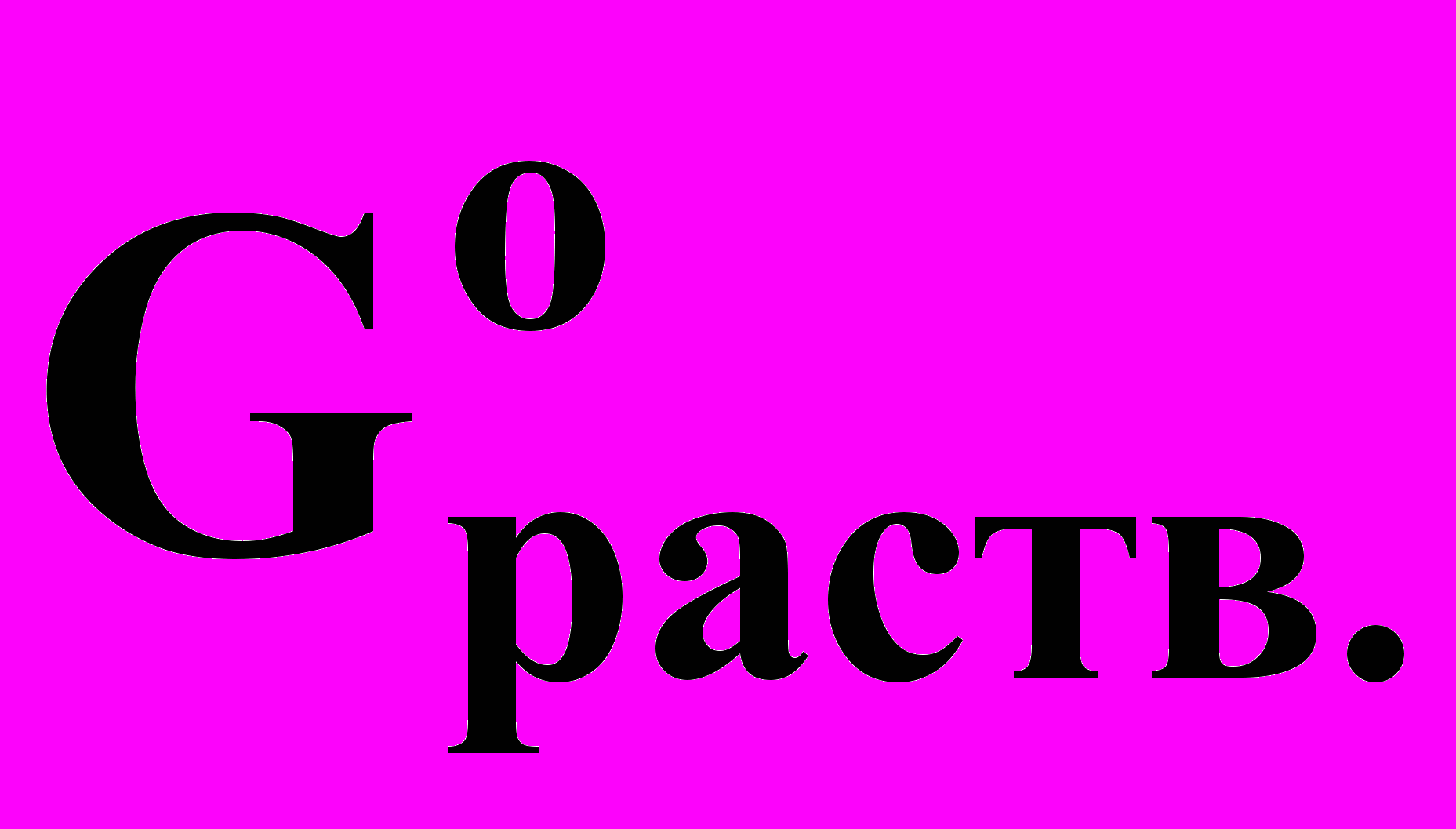
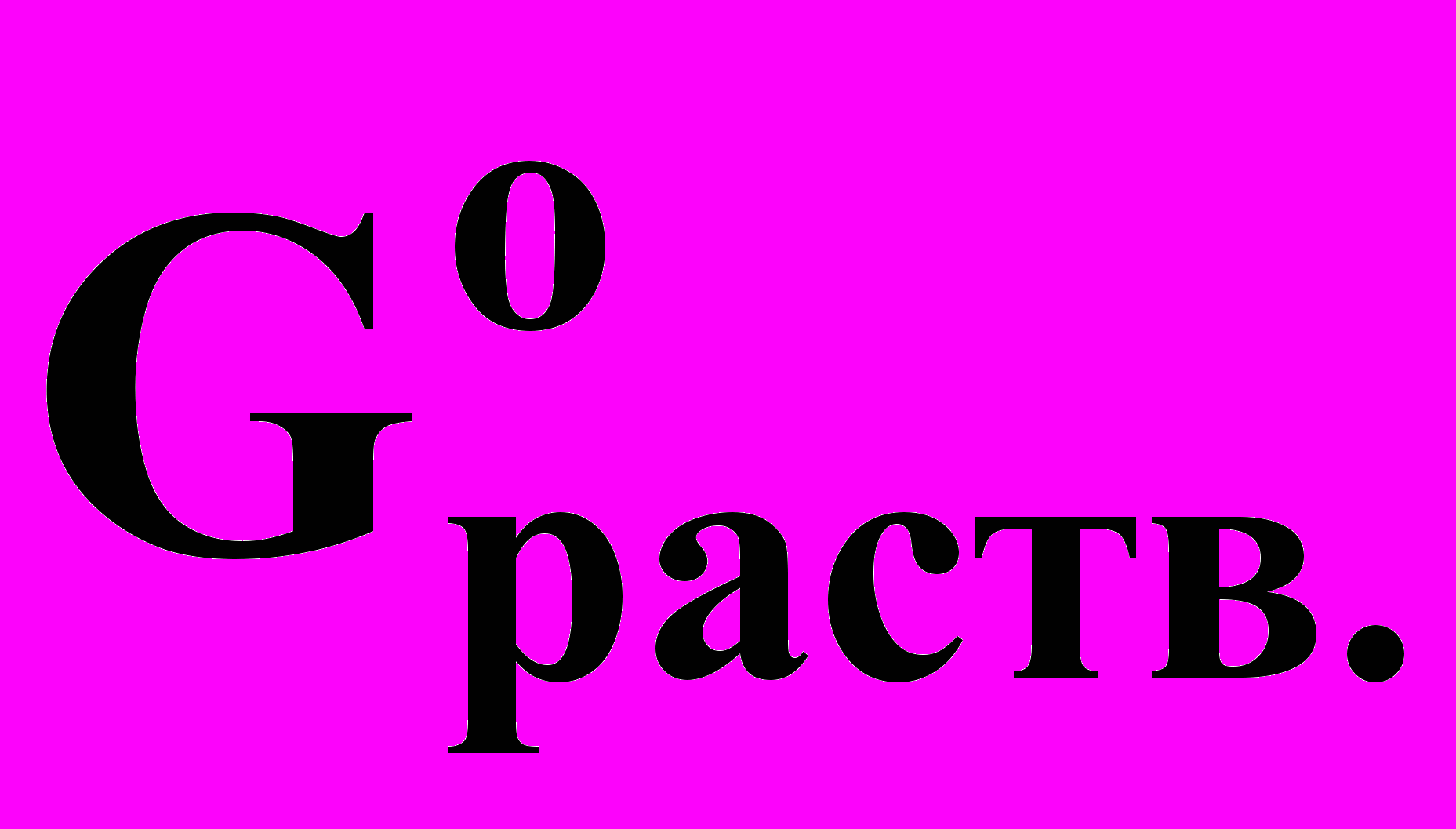 = Нраств. ТSраств = RTlnK = RTlnc
= Нраств. ТSраств = RTlnK = RTlncc =
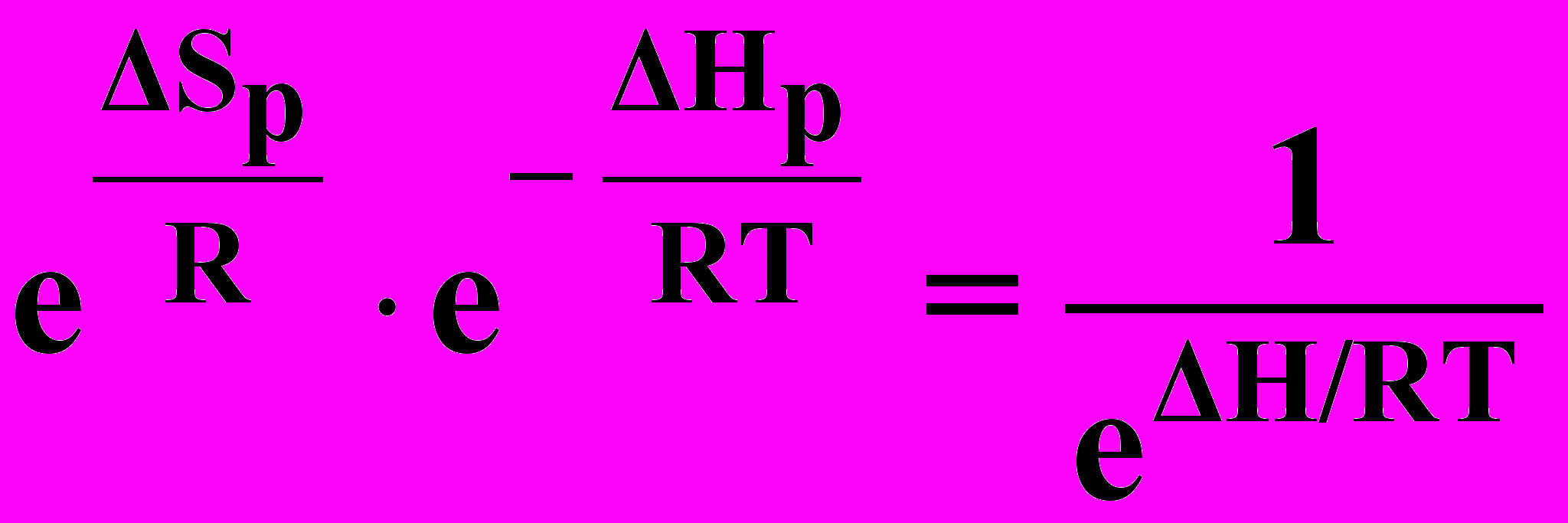
1) Иод: Нр = Нкр.реш. Нсольв. 0
I2
с
2) Бром: Н ~ 0.
3) Хлор



Br2





Cl2

25оС
Т

2) При низких температурах – клатраты X2 nH2O.
Пример: 8Cl2 46H2O.
3. Химическое взаимодействие с водой. Гетеролитическое расщепление связи Х ׃ Х = Х+ + Х.
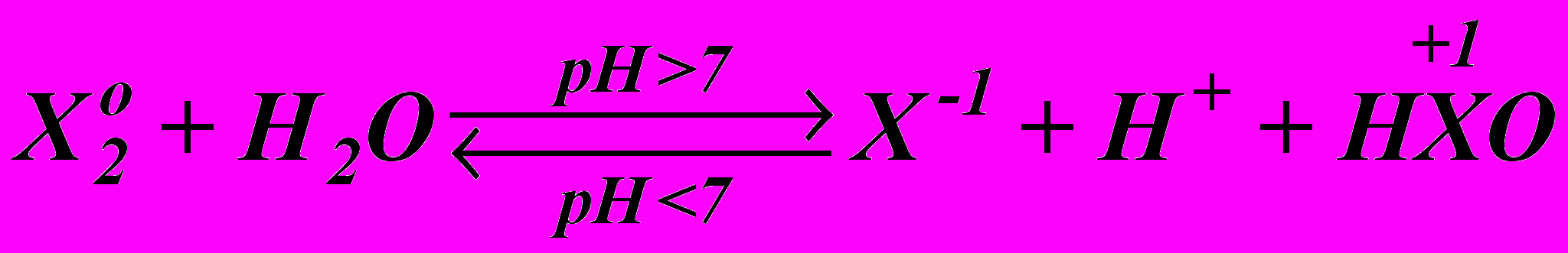
4. Смещение равновесия.
4.1. рН
4.2. Удаление продуктов
а) I + KI = KI3
b) H+ + OH = H2O
Cl2 + 2NaOH = NaOCl + NaCl + H2O
c) нагревание
3
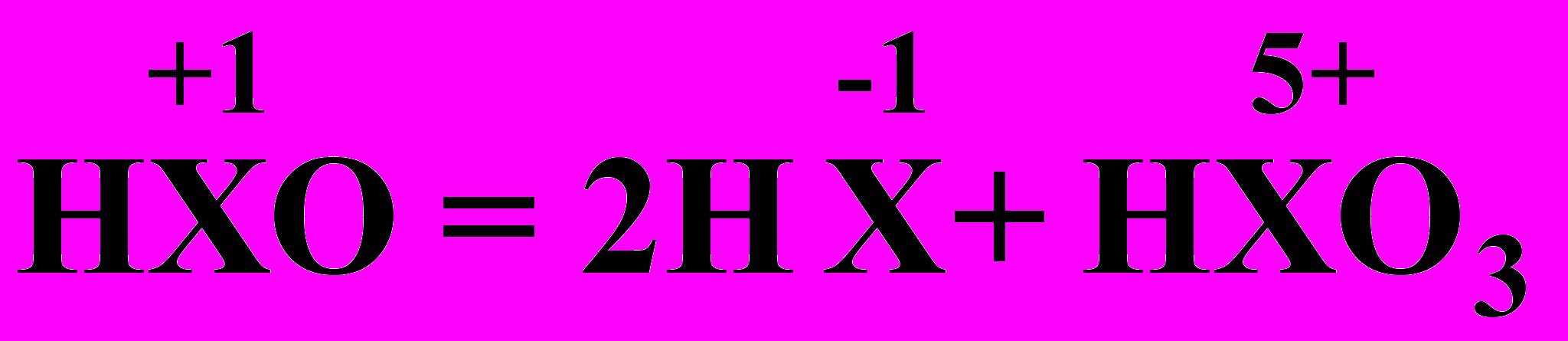
Cl2 + 2KOH
 KCl + KClO + H2O
KCl + KClO + H2OНо! Cl2 + 6KOH
 KClO3 + 5KCl + 3H2O
KClO3 + 5KCl + 3H2O5. Состав продуктов взаимодействия галогенов с водой
Br2 и I2
Cl2 + HClO (холодная вода)
HClO3 (горячая вода)
