Программа прикладного курса «Биохимия» 10 класс
| Вид материала | Программа |
- Программа элективного курса биохимия, 101.78kb.
- Программа прикладного курса по истории Казахстана 10 класс, 174.97kb.
- Программа кандидатского экзамена «Биохимия», 166.06kb.
- Основы истории декоративно-прикладного искусства, 15.6kb.
- Программа прикладного курса «Экологическая этика» (34 часа, 1 час в неделю) 10 класс, 204.92kb.
- Программа дисциплины «Основы творческо-конструкторской деятельности и декоративно -прикладного, 369.37kb.
- Рабочая программа базового курса «Технология. 6 класс», 166.41kb.
- Учебно-методический комплекс биохимия продуктов питания (Учебная и рабочая программа,, 1160.67kb.
- Программа интегрированного курса в рамках работы историко-литературного клуба 6 класс, 148.97kb.
- Программа элективного курса, 68 часов в год (2 ч/нед.). 10-й класс Пояснительная записка, 276.21kb.
ПРОГРАММА
Прикладного курса «Биохимия»
10 класс
(1 час в неделю, всего 34часа)
Пояснительная записка
Курс предназначен для учащихся 10-х классов, выбравших профиль биолого-химический, и является логическим продолжением базисного курса биологии. Курс знакомит учащихся с основами биохимии- науки о химических процессах, протекающих в живых клетках и организмах, а также о биологических субстратах, участвующих в этих процессах. Рассматривается место биохимии, и ее обособившихся разделов в системе наук о жизни, характеризует взаимоотношения биохимии, органической и биоорганической химии. Иллюстрируется применение биохимических знаний в решении химико-технологических, инженерно-экологических и социальных проблем. Основные разделы курса посвящены живой материи, строению и функциям клетки и клеточных органелл, строению и биологическим функциям важнейших биополимеров и биорегуляторов (белки, нуклеиновые кислоты, углеводы, липиды, витамины, коферменты, гормоны). Большое внимание уделяется специфическим для живых систем процессам: ферментативному катализу, обмену углеводов, белков и липидов, мембранному транспорту, превращениям энергии, метаболизму ксенобиотиков.
Цели курса.
Подготовка личности, наделенной определенными знаниями о собственных целях и возможностях, инструментарием для прописывания себя и своей деятельности в современные социально-экономические коммуникации.
Задачи курса:
- формировать у учащихся целостную систему взглядов, об окружающем мире на основе интегрированного материала, средств и методов двух дисциплин, обеспечивающих усвоение знаний по предметам естественного цикла в единстве и целостности;
- учить владеть сформированными навыками и умениями учения и самообразования, самокритично оценивать их результаты;
- учить владеть системой навыков чтения, выбирать и определять цель чтения, рациональные формы извлечения и систематизации информации;
- учить овладению навыками самостоятельного изучения школьной программы;
- учить выявлять аналогии в учебном материале;
- учить творчески применять знания в новых, нестандартных ситуациях;
- учить владению навыками аналитического подходок изучаемому;
- учить аргументировать свое высказывание.
Новизна:
- курс отражает практическое осуществление интегрированного процесса как одного из перспективных направлений в работе школы, которое выражается
в планировании нового курса, разработке уроков в их логической последовательности.
- курс отражает реализацию методологического подхода средствами двух предметов в их взаимопроникновении и взаимодополнении.
- курс отражает реализацию модели учебно-воспитательного процесса "воспитание через обучение" в единстве урочной и внеурочной деятельности.
Требования к знаниям и умениям
- Знать основные положения цитологии.
- Знать строение, классификацию, принципы действия основных органических веществ клетки;
- Знать о биомедицинском значении ферментов и витаминов.
- иметь представление об метаболизме и метаболических путях.
- уметь характеризовать основные энергетические биохимические циклы.
- Знать о современных достижениях биохимии.
- Уметь проводить определение уровня сахара в крови.
- Уметь проводить химические реакции по определению первичной структуры белка.
Формы проведения занятий: проблемные беседы-лекции, семинары, лекции, дискуссии, практические работы, защита реферата.
Методы обучения:
- мозговой штурм (включить в работу всех членов группы; определение уровня знаний и основных интересов участников; активизировать творческого потенциала участников);
- групповая работа (КО – это метод решения общих задач посредством взаимодействия небольшой группы участников);
- тесты (являются исключительно объективным способом контроля результатов обучения; тесты обладают высокими обучающими возможностями);
- выполнение разных заданий (составить график спроса или предложения; построить кривую спроса или предложения; ответить на вопросы; решить задачи; работа с терминами).
- ролевая игра – это метод, который позволяет обучаться на собственном опыте путем специально организованного и регулируемого “проживания” жизненной или профессиональной ситуации;
- анализ литературы.
Итоговая работа: реферат
Примерный перечень итоговых работ:
Биосинтез белка (основные этапы и регуляция)
- Биосинтез нуклеиновых кислот (основные этапы и регуляция)
- Метаболизм углеводов
- Метаболизм липидов
- Витамины (классификация и основные авитаминозы)
- Гормоны.
- Ферменты.
Содержание курса
Введение (1 час).
Предмет биохимии. Связь биохимии с родственными дисциплинами. Статическая биохимия: изучение химического состава и строения веществ, содержащихся в живых организмах. Динамическая биохимия: изучение обменных процессов как основы деятельности живых организмов. Основные методы биохимии.
Тема 1. Основные положения цитологии (1 час).
Элементы теории клеточного строения. Клеточные органеллы их строение и функции: ядро, цитоплазма (митохондрии, лизосомы, эндоплазматический ретикулум, микросомы, гиалоплазма), клеточная мембрана. Роль, воды в жизнедеятельности клетки.
Тема 2. Аминокислоты и белки (5 часов).
Аминокислоты: классификация, методы анализа. Пептидный синтез. Первичная структура белков. Химические свойства и методы определения первичной структуры белков. Внутри- и межмолекулярные взаимодействия, определяющие пространственную структуру белков. Вторичная, третичная и четвертичная структуры. Влияние иерархической структуры белков на их биологические функции. Классификация белков. Роль белков в питании.
Тема 3. Ферменты и витамины (4 часа).
Биомедицинское значение ферментов. Номенклатура и классификация ферментов. Структура и каталитические свойства ферментов. Принципы действия ферментов. Количественное определение ферментативной активности. Влияние температуры, рН, концентраций фермента и субстрата: на скорости ферментативных реакций. Регуляция активности ферментов: аллостерический контроль, конкурентное и неконкурентное ингибирование, ковалентная модификация и генетический контроль. Коферменты и кофакторы. Витамины: определение и классификация. Строение витаминов и их роль в ферментативных реакциях и в обменных процессах. Ингибиторы ферментов как лекарственные средства.
Тема 4. Углеводы (4 часа).
Биомедицинское значение углеводов. Фотосинтез углеводов. Классификация углеводов и их наиболее важные реакции. Дезоксисахара и аминосахара. Дисахариды и полисахариды: лактоза, мальтоза, сахароза, крахмал, гликоген, целлюлоза, хинин. Роль углеводов в питании. Гликоген: гликогенезис и гликогенолиз.
Тема 5. Липиды (2 часа).
Биомедицинское значение липидов. Структурами классификация липидов. Насыщенные и ненасыщенное кислоты и их эфиры. Жиры и масла. Гидрогенизированные масла и маргарин. Глицериды и фосфоглицериды. Терпены и стероиды. Строение и транспортные свойства клеточных мембран. Эйкозаноиды: простагландины и лейкотриены. Сфинголипиды.
Тема 6. Нуклеиновые кислоты (3 часа).
Биологическое значение нуклеиновых кислот. Дезоксирибонуклеиновая и рибонуклеиновая кислоты. Нуклеотиды.
Строение и функции в живых организмах. Передача наследственных признаков. Биосинтез белков. Процессы репликации, транскрипции и трансляции. Мутагенез и наследственные заболевания. Биотехнология и генная инженерия.
Тема 7. Метаболизм и обмен веществ (2 часа).
Понятие о метаболизме и метаболических путях. Катаболизм и анаболизм. Метаболизм углеводов. Проблемы невосприимчивости к лактозе. Регуляция содержания глюкозы в крови (инсулин и глюкагон). Диабет. Методы анализа глюкозы в крови и моче. Метаболизм липидов. Хранение и расщепление жиров. Окисление и биосинтез насыщенных кислот. Метаболизм белков и аминокислот. Взаимосвязь обмена белков, углеводов и липидов. Проблемы регуляции метаболизма. Регуляция и интеграция обмена веществ у млекопитающих;
Тема 8. Энергетические биохимические циклы (5 часов).
Эндергонические и экзергонические реакции в живой клетке. Метаболизм и получение биохимической энергии. Роль АТФ в обмене энергии. Метаболические пути и сопряженные реакции. Окисленные и восстановленные формы коферментов. Цикл лимонной кислоты. Организация дыхательной , цепи. Регуляция цепи переноса электронов в процессах дыхания. Отрицательные свойства эпоксидов. Витамины - антиоксиданты.
Тема 9.Биорегуляторы (5часов).
Классификация биорегуляторов: гормоны, нейромедиаторы, лекарства и ксенобиотики. Гормоны — химические регуляторы эндокринной системы. Классификация гормонов: белковые гормоны, стероидные, производные аминокислот. Принципы работы гормонов. Адреналин. Нейромедиаторы -химические регуляторы нервной системы. Механизм передачи нервного сигнала и роль нейромедиаторов. Ацетилхолин, его агонисты и антагонисты. Гистамин и антигистаминные препараты. Серотонин, дофамин и антидепрессанты. Дофамин и наркотическая зависимость. Лекарства и ксенобиотики: механизмы действия и метаболизм.
Рекомендуемая литература:
1. Ленинджер А. Основы биохимии. Изд. Мир, Москва, i 985, тт. 1 -3.
2. Мусил Я., Новакова О., Купи К. Современная биохимия в схемах. Изд. Мир, М., 1981.
3. Кольман Я., Рем К.-Г. Наглядная биохимия. Изд. Мир, Москва, 2000.
4. . Основы биохимии / Под ред, Л.Л. Лнисимова. - М.: Высшая школа, 1986.-546 с.
5. . Бсречов 'Г/Г., Коровкип Б.Ф. Биологическая химия. - М.: Медицина, 1990.-543 с.
6. . Маррн I'. и соавт. Биохимия человека. - М.; Мир, 1993. - '1:1. -3$1 с.; T.2.-4I4 с
7. . Белки и пептиды.-М.:11аука, 1995. — T.I.-433 с.
Приложение 1
Примерное учебно-тематическое планирование.
| № п/п | № урока по теме | Тема занятия |
| Введение (2ч) | ||
| 1 | 1 | Предмет биохимии. |
| 2 | 2 | Основные методы биохимии |
| Тема 1. Основные положения цитологии (2 час). | ||
| 3 | 1 | Основные положения цитологии. |
| 4 | 2 | Роль воды в жизнедеятельности клетки |
| Тема 2. Аминокислоты и белки (5 часов). | ||
| 5 | 1 | Классификация аминокислот |
| 6 | 2 | Химические свойства белков |
| 7 | 3 | Лабораторная работа: «Определение первичной структуры белка» |
| 8 | 4 | Классификация белков |
| 9 | 5 | Роль белков в питании |
| Тема 3. Ферменты и витамины (4 часа). | ||
| 10 | 1 | Биомедицинское значение ферментов |
| 11 | 2 | Номенклатура и классификация ферментов |
| 12 | 3 | Влияние температуры, рН, концентраций фермента и субстрата на скорость ферментативных реакций |
| 13 | 4 | Витамины |
| Тема 4. Углеводы (4 часа). | ||
| 14 | 1 | Биомедицинское значение углеводов |
| 15 | 2 | Фотосинтез углеводов |
| 16 | 3 | Классификация углеводов |
| 17 | 4 | Роль углеводов в питании |
| Тема 5. Липиды (2 часа). | ||
| 18 | 1 | Биомедицинское значение липидов |
| 19 | 2 | Структура и классификация липидов |
| Тема 6. Нуклеиновые кислоты (3 часа). | ||
| 20 | 1 | Биологическое значение нуклеиновых кислот |
| 21 | 2 | Биосинтез белков |
| 22 | 3 | Мутагенез, биотехнология и генная инженерия |
| Тема 7. Метаболизм и обмен веществ (2 часа). | ||
| 23 | 1 | Метаболизм углеводов и липидов |
| 24 | 2 | Метаболизм белков и аминокислот |
| Тема 8. Энергетические биохимические циклы (5 часов). | ||
| 25 | 1 | Эндергонические и экзергонические реакции в живой клетке |
| 26 | 2 | Роль АТФ в обмене энергии |
| 27 | 3 | Метаболические пути и сопряженные реакции |
| 28 | 4 | Организация дыхательной цепи |
| 29 | 5 | Витамины-антиоксиданты |
| Тема 9.Биорегуляторы (5часов). | ||
| 30 | 1 | Классификация биорегуляторов |
| 31 | 2 | Классификация гормонов |
| 32 | 3 | Нейромедиаторы |
| 33 | 4 | Наркотическая зависимость |
| 34 | 5 | Лекарства и ксенобиотики |
Приложение 2
Материал к теме «Белки. Классификация белков»
(лекция)
Белки ― высокомолекулярные природные полимеры, построенные из остатков аминокислот, соединенных амидной (пептидной) связью ―CO―NH―.
Каждый белок характеризуется специфической аминокислотной последовательностью и индивидуальной пространственной структурой (конформацией). На долю белков приходится не менее 50% сухой массы органических соединений животной клетки. Функционирование белка лежит в основе важнейших процессов жизнедеятельности организма. Обмен веществ (пищеварение, дыхание и др.), мышечное сокращение, нервная проводимость и жизнь клетки в целом неразрывно связаны с активностью ферментов - высокоспецифичных катализаторов биохимических реакций, являющихся белками. Основу костной и соединительной тканей, шерсти, роговых образований составляют структурные белки. Они же формируют остов клеточных органелл (митохондрий, мембран и др.). Расхождение хромосом при делении клетки, движение жгутиков, работа мышц животных и человека осуществляются по единому механизму при посредстве белка сократительной системы (напр., Актин, Миозин). Важную группу составляют регуляторные белки, контролирующие биосинтез белка и нуклеиновых кислот. К регуляторным белкам относятся также пептидно-белковые гормоны, которые секретируются эндокринными железами. Информация о состоянии внешней среды, различные регуляторные сигналы (в т. ч. гормональные) воспринимаются клеткой с помощью спец. рецепторных белков, располагающихся на наружной поверхности плазматической мембраны. Эти белки играют важную роль в передаче нервного возбуждения и в ориентированном движении клетки (хемотаксисе). В активном транспорте ионов, липидов, сахаров и аминокислот через биологические мембраны участвуют транспортные белки, или белки-переносчики. К последним относятся также гемоглобин и миоглобин, осуществляющие перенос кислорода. Преобразование и утилизация энергии, поступающей в организм с питанием, а также энергии солнечного излучения происходят при участии белков биоэнергетической системы (напр., родопсин, цитохромы). Большое значение имеют пищевые и запасные белки ( напр., Казеин, Проламины), играющие важную роль в развитии и функционировании организмов. Защитные системы высших организмов формируются защитными белками, к которым относятся иммуноглобулины (ответственны за иммунитет), белки комплемента (ответственны за лизис чужеродных клеток и активацию иммунологической функции), белки системы свертывания крови ( напр. Тромбин, Фибрин) и противовирусный белок интерферон.
По составу белки делят на простые, состоящие только из аминокислотных остатков (протеины), и сложные (протеиды). Сложные могут включать ионы металла (металлопротеиды) или пигмент (хромопротеиды), образовывать прочные комплексы с липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеиды), а также ковалентно связывать остаток фосфорной кислоты (фосфопротеиды), углевода (гликопротеины) или нуклеиновой кислоты (геномы некоторых вирусов).
По ряду характерных свойств протеины можно разделить на несколько подгрупп:
Альбумины. Они растворимы в воде, свёртываются при нагревании, нейтральны, сравнительно трудно осаждаются растворами солей. Примерами их могут служить: альбумин белка куриного яйца, альбумин кровяной сыворотки, альбумин мускульной ткани, молочный альбумин.
Глобулины. Они нерастворимы в воде, но растворяются в очень слабых растворах солей. Более концентрированными растворами солей они вновь осаждаются; осаждение происходит при меньшей концентрации, чем та, которая необходима для осаждения альбуминов. Эти белки являются очень слабыми кислотами. Примерами глобулинов могут служить: фибриноген, глобулин кровяной сыворотки, глобулин мускульной ткани, глобулин белка куриного яйца.
Гистоны. Белки основного характера. Находятся в виде нуклеопротеидов в лейкоцитах и красных кровяных шариках.
Протамины. Не содержат серы, обладают сравнительно сильными основными свойствами, дают кристаллические соли; содержатся (в виде нуклеопротеинов) в сперматозоидах рыб.
Проламины. Находятся в зернах различных хлебных злаков. Замечательной их особенностью является растворимость в 80% -ном спирте. Представителем этих белков может служить глиадин, составляющий главную часть клейковины.
Склеропротеины. Нерастворимые белки, которые составляют наружный покров тела животного и находятся в скелете и в соединительной ткани. К ним относятся кератин, коллагены, эластин, фиброин.
Керотин является главной составной частью волос, рогов, копыт, ногтей, перьев и верхнего слоя кожи. Скорлупа куриного яйца состоит из извести и кератина. Если растворить известь скорлупы яйца в кислоте, то останется мягкая кожа, состоящая из кератина; из кератина состоит кожица, которая следует за скорлупой яйца. По химическому составу кератин богат серой.
Коллагены. Чрезвычайно распространены в живых организмах. Из коллагенов состоит соединительная ткань; они находятся в хрящах. Кости позвоночных животных состоят из неорганических веществ (фосфорнокислого и углекислого кальция), жира и коллагенов.
При кипячении с водой или при действии перегретого водяного пара коллагены образуют клей. Если из костей извлечь жир и потом, обработав их кислотой, растворить фосфорнокислый кальций, то останется белковое вещество-оссеин. При обработке оссеина перегретым водяным паром он переходит в клей. Чистый костяной клей называется желатиной. Особенно чистая желатина получается из рыбьего пузыря кипячением с водой.
Эластин входит в состав жил и других эластичных веществ соединительной ткани.
Нити сырого шелка состоят из белкового вещества-фиброина, покрытого другим белковым веществом, играющим роль шелкового клея,-серицином. При кипячении с водой шелк освобождается от клея который при этом переходит в раствор.
Протеиды также можно разделить на несколько групп: фосфоропротеиды содержат в своем составе фосфор. Они, в противоположность протаминам, обладающим, как указано выше, основными свойствами, имеют определенно выраженный кислотный характер.
Главнейшим представителем фосфоропротеидов является казеин молока. Он обладает настолько ясно выраженным кислотным характером, что разлагает углекислые соли с выделением углекислого газа. Казеин растворяется в слабых растворах щелочей, образуя с ними соли. Соли казеина называются казеинатами.
При нагревании казеин не свертывается. При действии кислот на соли казеина он выделяется в свободном виде. Этим объясняется свертывание молока при прокисании.
Казеин применяется для изготовления твердой, напоминающей рог пластмассы-галалита).Для получения галалита казеин смешивают с водой, красками и наполнителями, прессуют под давлением, и полученные пластины обрабатывают формалином. Казеин содержит фосфор в виде сложного эфира фосфорной кислоты.
Из других фосфоропротеинов следует отметить вителлин, который находится в желтке куриного яйца.
Нуклеопротеиды находятся в клеточных ядрах. При осторожном гидролизе они расщепляются на белок и нуклеиновую кислоту.
Нуклеиновые кислоты являются весьма сложными веществами, расщепляющимися при гидролизе на фосфорную кислоту, углеводы и азотосодержащие органические вещества группы пиримидина и группы пурина.
Хромопротеиды. Под этим названием известны протеиды, которые представляют собой сочетание белков с окрашенными веществами. Из хромопротеидов наиболее изучен гемоглобин красящее вещество красных кровяных шариков. Гемоглобин, соединяясь с кислородом,
превращается в оксигемоглобин, который, отдавая свой кислород другим веществам, снова превращается в гемоглобин. Значение гемоглобина в жизни человека и животных очень велико. Он играет роль переносчика кислорода от легких к тканям. Образовавшийся в легких оксигемоглабин кровью разносится по телу и, отдавая свой кислород, способствует протекание в организме окислительных процессов. Кроме того, гемоглобин вместе с плазмой крови осуществляет регуляцию величины pH крови и перенос углекислоты в организме.
Характерной особенностью гемоглобина является его способность соединятся с окисью углерода, после чего он теряет способность соединяться с кислородом. Этим объясняется ядовитое действии окиси углерода.
Гемоглобин представляет собой соединение белка глобина с красящим началом гемохромогеном. Вне организма гемоглобин, при действии воздуха, превращается в метгемоглобин, который отличается от оксигемоглобына прочностью связи с кислородом. При обработке ледяной уксусной кислотой метгемоглобин расщепляется с образованием глобина и гематина C34H32O4N4Fe(OH). Обработкой метгемоглобина тем же реактивом, но в присутствии NaCℓ, получается хлористая соль гематина, называемая гемином, C34H32O4N4FeCℓ. Гемин образует характерные красно-коричневые таблички, которые дают возможность открыть присутствие крови в пятнах даже через несколько лет. Гематин очень близок к гемохромогену, но все же от него отличается.
Глюкопротеиды. Некоторые белки этой группы встречаются в слизистых соединениях животных организмов и обусловливаются свойства этих выделений тянуться в нити даже при сравнительно большом разбавлении. Эти белки образуются в подчелюстной железе(подчелюстная железа-одна из слюнных желез),печени, железах желудка и кишечника. Другие глюкопротеиды находятся в хрящах, яичном белке, стекловидном теле глаза и т.д. Исследованные представители глюкопротеидов являются сочетанием белков с веществами, содержащими остатки некоторых производных углеводов, серной и уксусной кислот.
Строение белковых молекул.
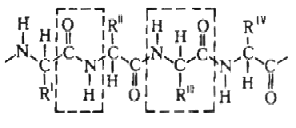 Практически все белки построены из 20
Практически все белки построены из 20  -аминокислот, принадлежащих, за исключением глицина, к L-ряду. Аминокислоты соединены между собой пептидными связями, образованными карбоксильной и
-аминокислот, принадлежащих, за исключением глицина, к L-ряду. Аминокислоты соединены между собой пептидными связями, образованными карбоксильной и  -аминогруппами соседних аминокислотных остатков Белковая молекула может состоять из одной или нескольких цепей, содержащих от 50 до нескольких сотен (иногда –более тысячи) аминокислотных остатков. Молекулы, содержащие менее 50 остатков часто относят к пептидам . В состав многих молекул входят остатки цистина, дисульфидные связи которых ковалентно связывают участки одной или нескольких цепей. В нативном состоянии макромолекулы белка обладают специфичной конформацией. Характерная для данного белка конформация определяется последовательностью аминокислотных остатков и стабилизируется водородными связями между пептидными и боковыми группами аминокислотных остатков, а также гидрофобными и электростатическими взаимодействиями.
-аминогруппами соседних аминокислотных остатков Белковая молекула может состоять из одной или нескольких цепей, содержащих от 50 до нескольких сотен (иногда –более тысячи) аминокислотных остатков. Молекулы, содержащие менее 50 остатков часто относят к пептидам . В состав многих молекул входят остатки цистина, дисульфидные связи которых ковалентно связывают участки одной или нескольких цепей. В нативном состоянии макромолекулы белка обладают специфичной конформацией. Характерная для данного белка конформация определяется последовательностью аминокислотных остатков и стабилизируется водородными связями между пептидными и боковыми группами аминокислотных остатков, а также гидрофобными и электростатическими взаимодействиями. 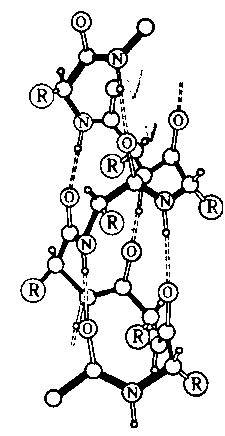 Различают четыре уровня организации белковых молекул.
Различают четыре уровня организации белковых молекул.Первичной структурой называют последовательность аминокислотных остатков в полипептидной цепи. Все белки различаются по первичной структуре, потенциально их возможное число практически неограничено.
Вторичная структура белка – это
 -спираль, которая образуется в результате скручивания полипептидной цепи за счет водородных связей между группами:
-спираль, которая образуется в результате скручивания полипептидной цепи за счет водородных связей между группами:―C― и ―N―.
║ │
O H
В одном витке спирали обычно содержится 3,6 аминокислотных остатка, шаг спирали – 0,544 нм.
Под третичной структурой белка понимают расположение его полипептидной цепи в пространстве. Существенное влияние на формирование третичной структуры оказывают размер, форма и полярность аминокислотных остатков. Третичная структура многих белков составляется из нескольких компактных глобул, называемых доменами. Между собой домены обычно бывают связаны тонкими перемычками – вытянутыми полипептидными цепями.
Термин четвертичная структура относится к макромолекулам, в состав которых входит несколько полипептидных цепей (субъединиц), не связанных между собой ковалентно. Между собой эти субъединицы соединяются водородными, ионными, гидрофобными и другими связями. Примером может служить макромолекула гемоглобина.
Приложение 3.
Тестовые вопросы по биохимии
1.В полипептидной цепочке белка аминокислоты соединяются:
A) гидрофобной связью B) пептидной C) дисульфидной D) водородной E) эфирной
2.Мембранный слой образуют:
A) белки B) углеводы C) фосфолипиды D) триацилглицеролы E) нуклеиновые кислоты
3
 .Увеличение этого гормона в крови вызывает голод, слабость, дрожание, головокружение:
.Увеличение этого гормона в крови вызывает голод, слабость, дрожание, головокружение:A) гидрокортизон B) тестостерон C) глюкагон D) инсулин E) кортикотропин
4. В состав нуклеопротеидов входят:
A) липиды B) углеводы C) пигменты D) полинуклеотиды E) металлы
5. Секреция какого гормона активизируется при недостатке в крови глюкозы?
A) инсулин B) глюкагон C) адреналин D) глюкокортикоид E) тироксин
6.Какой фермент не достает в кишечнике, если у человека не переваривается молоко?
A) амилаза B) трипсин C) хемотрипсин D) липаза E) лактаза
7. Ожирение возникает при избытке в пище:
A) белков B) углеводов C) фосфолипидов D) витаминов E) аминокислот
8. Какие связи образуют α-спираль во вторичной структуре белка?
A) дисульфидные B) гидрофобные C) пептидные D) водородные E) Вандер-Ваальса
9. Первичная структура белка строится путем:
A) соединения полипептидов B) соединения аминокислот
C) пространственного расположения полипептида
D) образования спирали полипептида E) образования глобулы
10. Понижение синтеза некоторых ферментов (репрессия) в клетках происходит из-за увеличения:
A) субстрата B) аллостерического эффекта C) метаболита D) фермента
E) фермент-субстратного комплекса
11. Ферменты, катализирующие окислительно-восстановительные реакции:
A) оксидоредуктазы B) гидролазы C) трансферазы D) лиазы E) лигазы
12. Какой гормон не относится к стероидам?
A) тестостерон B) эстриол C) кортизол D) альдостерон E) тироксин
13. В ДНК содержится: аденина – 21%, тимина – 21%, цитозина – 29%, гуанина – 29%. Каков процентный состав РНК после транскрипции?
A) А – 21%, Г- 20%, Ц – 20%, У – 20% B) А – 21%, Г- 21%, Ц – 21%, У – 20%
C) А – 21%, Г- 29%, Ц – 29%, У – 21% D) А – 29%, Г- 21%, Ц – 21%, У – 29%
E) нельзя подсчитать
14. Какая молекула сгорает в цикле Кребса?
A) пировиноградная кислота B) ацил-KоA C) ацетил-KоA D) щавелевоуксусная кислота
E) лимонная кислота
15. При какой температуре ферменты обладают очень высокой активностью?
A) выше 50о B) около 100о C) около 0о D) 37о E) ниже 0о
16. В каком месте фермента идет присоединение субстрата, в результате которого образуется фермент-субстратный комплекс?
A) в любом месте B) в активном центре C) в аллостерическом центре D) на коферменте
E) в простетической группе
17. Катализаторы реакции с присутствием воды::
A) оксидоредуктазы B) гидролазы C) трансферазы D) лиазы E) лигазы
18.Что такое профермент?
A) соединение, находящееся в клетке в неактивной форме B) несколько ферментов, катализирующих одну реакцию C) фермент, состоящий из нескольких субъединиц
D) фермент, катализирующий несколько реакций E) активная часть фермента
19. Влияние какого гормона быстрее воспринимается клетками-мишенями?
A) инсулин B) глюкагон C) адреналин D) глюкокортикоид E) паратгормон
20. Какой гормон, находясь в большом количестве в крови, усиливает окислительно-восстановительные реакции, уменьшая АТФ?
A) кальцитонин B) тироксин C) адреналин D) глюкокортикоид E) инсулин
КЛЮЧ (Номер вопроса -Правильный ответ) 1-B; 2-C; 3-D; 4-D; 5-B; 6-E; 7-B; 8-C; 9-B; 10-C; 11-A; 12-E; 13-C; 14-C; 15-D; 16-B; 17-B; 18-A; 19-C; 20-B.
