Конспект лекций по курсу «Введение в специальность» направление
| Вид материала | Конспект |
- Конспект лекций по курсу макроэкономика для студентов заочников факультета бухгалтерского, 2421.87kb.
- Конспект лекций по курсу «Организация производства», 2032.47kb.
- Конспект лекций по курсу «Организация производства», 2034.84kb.
- Предлагаемый конспект опорных лекций отражает традиционный набор тем и проблем курса, 1047.31kb.
- Конспект лекций по курсу "Начертательная геометрия и инженерная графика" Кемерово 2002, 786.75kb.
- Конспект лекций по курсу «бизнес-планирование в условиях рынка», 461.46kb.
- Конспект лекций по курсу «Неорганическая и аналитическая химия», 18.21kb.
- Конспект лекций по курсу "Информатика и использование компьютерных технологий в образовании", 1797.24kb.
- Конспект лекций дисциплина «Эффективность информационных технологий» Направление, 2946.75kb.
- Конспект лекций 12. 88 Специальность 270114 «Проектирование зданий», 27.06kb.
ЛЕКЦИЯ 10-11.
СЫРЬЕ ХИМИЧЕСКОЙ ПРОМЫШЛЕННОСТИ
Сырьем называют природные материалы, используемые в производстве промышленных продуктов. Сырье — один из основных элементов технологического процесса, который определяет в значительной степени экономичность процесса, технику производства и качество продукта. Для химической промышленности характерны высокие материалоемкость и расход сырья; затраты на сырье составляют 60—70% себестоимости продукции.
Во многих случаях продукция одних предприятий служит сырьем другим для получения новых веществ. Так. основное количество кислот – серной, фосфорной и азотной перерабатывается на соли, которые необходимы в различных областях народного хозяйства.
Ни одна отрасль промышленности не выпускает такой широкий ассортимент продуктов, как химическая и ни одна отрасль не сравнится с ней по разнообразию и количеству потребляемого сырья. Вследствие роста промышленного производства и увеличения ассортимента химической продукции возникает необходимость в новых видах сырья. Развитие техники добычи, подготовки, обогащения сырья позволяет использовать новые виды сырья, полезные ископаемые, содержащие малые количества полезных компонентов. Таким образом, сырьевая база химической промышленности непрерывно расширяется. Исходным материалом многих производств является сырье, уже подвергшееся промышленной переработке, которое называют полупродуктом (полуфабрикатом или основным материалом). Некоторые химические производства используют в качестве сырья отходы и побочные продукты других производств.
Сырье химической промышленности классифицируют по различным признакам. По происхождению его делят на минеральное, растительное и животное. Преобладает минеральное сырье, т. е. полезные ископаемые, добываемые из земной коры. Основная химическая промышленность перерабатывает главным образом минеральное сырье.
По агрегатному состоянию различают твердое, жидкое (нефть, рассолы) и газообразное сырье (воздух, природный газ). По составу оно подразделяется на органическое и неорганическое.
Минеральное сырье в свою очередь делится на рудное, нерудное и горючее (органическое). Рудным минеральным сырьем называют горные породы или минеральные агрегаты, содержащие металлы (Fe, Cu, Zn, Al и др.), которые могут быть экономически выгодно извлечены в технически чистом виде. Так, например, железо содержится в магнитном железняке в виде Fe304, в красном железняке Fe203, буром железняке Fe(OH)3 и др. Медные руды обычно содержат сернистые соединения меди Cu2S, CuS, FeCuS2 и т. п. Кроме минералов, включающих основной металл, руды всегда имеют примеси. Те примеси, которые не используются в производстве для получения продуктов, называются пустой породой. Руды, содержащие несколько металлов в количествах, достаточных для их извлечения, называются полиметаллическими. Например, к ним относятся руды, содержащие сульфиды нескольких цветных металлов: медно-цинковые, свинцово-цинково-серебряные и др. Нерудными ископаемыми называют все виды минерального сырья, применяемого в производстве химических, строительных и др. неметаллических материалов. К горючему минеральному сырью относятся горючие ископаемые: уголь, торф, нефть, природный газ и т.д., которые служат энергетическим топливом или сырьем в химической промышленности.
Запасы полезных ископаемых распределяются по двум группам:
1) балансовые – удовлетворяющие промышленным требованиям и их экономически эффективной разработки в данный период;
2) забалансовые – с низким процентным содержанием полезного компонента или минерала, маломощные залежи, запасы находящиеся в условиях особой сложности эксплуатации или малоизученные с точки зрения возможности промышленной переработки. Данная группа запасов имеет перспективный характер, и при изменении условий забалансовые запасы могут перейти в балансовую группу.
Комплексное использование сырья
Комплексная переработка минерально-сырьевых ресурсов предполагает извлечение нескольких ценных элементов из полезного ископаемого. Комплексное извлечение сырья достигается комбинированием предприятий – объединением производств, относящихся к различным отраслям промышленности. В настоящее время нередки объединения цветной или черной металлургии и основной химической промышленности, предприятий органического и неорганического синтеза, основной химии с промышленностью строительных материалов.
Сульфидные руды таких металлов, как Cu, Zn, Pd, содержат 1-5, реже 10-12% металла, остальное – железный колчедан. При обогащении руд железный колчедан отделяется в отходы производства, и его можно использовать как сырье для получения серной кислоты. В свою очередь отходом сернокислого производства является огарок, образующийся при обжиге колчедана, содержащий в среднем около 60% Fe, 3,4% Zn, 0,6% Cu, 0,3% Pb и небольшое количество благородных металлов.
Пластовые воды, добываемые вместе с нефтью, представляют собой главную сырьевую базу иодо-бромного производства, они могут быть источниками получения стронция, поваренной соли. Примером комплексной переработки сырья являются также коксохимические заводы, где отходящие газы, образующиеся при коксовании угля, используются для получения серы, серной кислоты, сульфата аммония и аммиака.
Вода в химической промышленности.
Вода в химической промышленности является ключевым сырьевым материалом. Она расходуется для нагревания или охлаждения продуктов и аппаратов, для создания вакуума и производства пара, для приготовления растворителей, реакционной среды, экстрагента или абсорбента, транспортирующего средства, для промывки продуктов, при перегонке веществ. Она служит сырьем и реагентом, например, в производствах кислот и щелочей, в различных реакциях гидратации и гидролиза. Во многих процессах она – продукт реакции: она выделяется при сжигании топлива, окислении аммиака, коксовании углей. Многие технологические процессы проводится при высоких температурах и давлениях, для таких технологий необходима деминерализованная вода высокой чистоты.
Расход воды на предприятиях химической промышленности определяется мощностью производства, видом выпускаемой продукции и совершенством технологий, квалификацией обслуживающего персонала, а также ресурсом воды на предприятии.
Природные воды делятся на три вида: атмосферные, поверхностные и подземные.
Поверхностные воды – речные, озерные и морские. Однако морская вода из-за высокого содержания солей (12-35 кг/м3) в промышленных целях практически не используется.
Подземные воды – воды колодцев, ключей, артезианских скважин. Основные запасы пресных вод содержаться под землей. Они содержат меньше органических и твердых примесей, чем поверхностные.
В зависимости от типа производства, в котором используется вода, к ней предъявляются определенные требования. Качество воды определяется многими показателями. Для промышленного применения наибольшее значение имеют общее солесодержание и, жесткость и реакция рН среды. Жесткость воды обусловлена содержанием солей кальция и магния.
Основные операции водоподготовки: коагуляция коллоидов, отстаивание взвешенных частиц, умягчение и фильтрование. В отдельных случаях осуществляется обессоливание и дегазация, т.е. полное удаление растворимых солей и газов.
Правильный выбор схемы водоподготовки и воднохимического режима, с учетом состава исходной природной воды позволяет значительно сократить капиталовложения.
В настоящее время, в свете новой экологической политики, одной из важнейших задач, стоящих перед химической промышленностью, является резкое сокращение водопотребления и стокообразования, а также создание заводов с бессточными технологиями.
Виды и источники энергии, применяемой в химической промышленности.
Современная химическая промышленность – основной потребитель тепловой и электрической энергии. Производство многих химических продуктов характеризуется высокими удельными энергозатратами, превышающими иногда 10-15 тонн условного топлива на 1 т готового продукта. В мире ежегодно потребляется примерно 6,5 млрд. тонн условного топлива. Энергия затрачивается не только на проведение эндотермических химических реакций, но также на выполнение вспомогательных операций: нагрев, сжатие газов, дробление и измельчение твердых веществ, транспортировку материалов и т.д. Вследствие этого химические предприятия потребляют значительные количества энергии различных видов. В стоимости химической продукции затраты энергии составляют около10%.
Энергоемкость различных предприятий, т.е. расход энергии на единицу продукции, различается весьма значительно. Наибольший расход энергии характерен для производств, осуществляемых при высоких давлениях и температурах.
| Продукция | Расход электроэнергии, кВт.ч/т |
| Алюминий | 18000-20000 |
| Фосфор | 13000-18000 |
| Карбид кальция (СаС2) | 2700-3200 |
| Синтетический аммиак | 1400-2500 |
| Хлор | 2300-3500 |
| Серная кислота | 60-100 |
| Аммиачная селитра | 7-15 |
| Суперфосфат | 2-10 |
| Кальцинированная сода | 60 |
В химической промышленности применяются электрическая, тепловая, химическая, световая и внутриядерная энергия.
Различные транспортирующие машины, конвейеры, компрессоры, насосы, мешалки – имеют электрический привод. Электроэнергия используется для создания высоких температур, например, при производстве фосфора и карбида кальция. Она необходима для осуществления электролиза растворов ( получения водорода, хлора, гидроокисей щелочных металлов) и расплавов (получение Mg, Al, Na, K, Ca и др.), для работы электрофильтров по очистки газов от пыли и тумана.
Подавляющую часть электроэнергии дают тепловые электростанции. Основными видами энергетического топлива являются каменный и бурый уголь, мазут и газ.
Энергетические затраты составляют значительную часть себестоимости продукции, поэтому совершенствование производства с целью снижения расхода энергии – важная задача химиков технологов.
Показатели производств продукции основного неорганического синтеза России.
| Виды продукции | 2004 г. | 2005 г. |
| Кальцинированная сода, тыс.т. | 2575,6 | 2582,3 |
| Минеральные удобрения, тыс.т. | 15800,6 | 16618,8 |
| азотные | 6590,7 | 6727,6 |
| фосфорные | 2802,2 | 2765,3 |
| калийные | 6405,3 | 7129,4 |
| Метанол, тыс.т. | 2911 | 2900,5 |
| Аммиак, тыс.т. | 11978,7 | 12422,1 |
| Серная кислота, тыс.т. | 9172,7 | 9333,5 |
Внешняя торговля I квартал 2006г.
| продукция | Экспорт, тыс.т. | Импорт, тыс.т. | ||
| 1кв 2005 | 1кв 2006 | 1кв 2005 | 1кв 2006 | |
| Мин. удобрения | 1962,7 | 2304 | 8,4 | 15 |
| азотные | 928 | 1124 | 3,4 | 6,5 |
| карбамид | 563,1 | 592,8 | 3 | 7,3 |
| аммиачная селитра | 211,4 | 326,3 | 0 | 0 |
| калийные | 1034,6 | 1181,2 | 4,9 | 6,5 |
| фосфорные | 1732,1 | 2069,3 | 3,2 | 7 |
| Аммиак | 782,7 | 868,5 | 0 | 0 |
| Метанол | 338,6 | 448,1 | 0 | 0 |
| Сода кальц. | 109,4 | 131,3 | 28 | 48 |
Химическая промышленность дает народному хозяйству тысячи продуктов, без которых трудно представить жизнь современного общества. Постоянный рост потребности в этих продуктах стимулирует увеличение производительности существующих мощностей, а также строительство новых производств. Известно, что повышение производительности любого аппарата можно достичь увеличением его размеров или интенсивности его работы.
Одним из путей интенсификации производительности аппаратов химической промышленности является увеличение скорости процесса, и достижение максимально возможного его значения.
Как оказалось, в присутствии некоторых веществ реакции ускоряются в тысячи и миллионы раз, протекают при низких температурах и давлениях, что экономически выгодно.
Ряд промышленных процессов удалось осуществить лишь благодаря применению катализаторов. В настоящее время до 90% производств химической промышленности осуществляется в присутствие катализаторов. Это крупнотоннажные производства серной и азотной кислот, аммиака, водорода (конверсией природного газа паром), синтез метанола и тд.
Первым случаем сознательного применения катализаторов принято считать образование диэтилового эфира из спирта в присутствие серной кислоты, открытое в VIII веке арабским ученым Дабир-Ибн-Хаямом. В конце 18 века впервые применены твердые катализаторы: глины при дегидратации спиртов и металлы в процессе их дегидрирования. В 1811 г. Константин Кирхгоф (академик Петербургской АН) открыл каталитическое превращение крахмала в сахар под действием разбавленных кислот. В тоже время было открыто каталитическое действие платины.
Эти и другие открытия привели к выделению особой группы реакций, которые немецкий химик Эйльгард Мичерлих объединил под общим термином – «контактные реакции», а в 1835 г. швед Йенс Якоб Берцелиус предложил термин катализ, а причину вызывающую катализ, назвал каталитической силой. Хотя сам Берцелиус не придавал какого-то мистического значения малоизученной каталитической силе, это понятие вызвало большую дискуссию в научных кругах, что в итоге принесло пользу науке.
Так в 1852 г. в России А.И. Ходнев объяснил протекание каталитических реакций последовательными превращениями с образованием промежуточных парных соединений между катализатором и реагирующими веществами, которые можно выделить. Наряду с химическими представлениями развиваются и физические теории катализа, основанные на исключительной роли процессов адсорбции реагентов на поверхности катализатора. Наибольший вклад в развитие этих теорий внесли И. Ленгмюр и Х.С. Тейлор.
Одной из сильнейших школ в области катализа была советская. Такие известные ученые как А.А. Баландин, Г.К. Боресков, С.З. Ратчинский и другие внесли неоценимый вклад в развитие теории катализа.
Катализом (от греч. «katalysis» - разрушение) называют изменение скорости или возбуждение химической реакции при воздействии веществ – катализаторов, которые участвуют в реакции, но не входят в состав конечных продуктов.
Обычно катализаторы многократно вступают в химическое взаимодействие, поэтому масса самого катализатора может быть на порядок меньше массы реагентов и продуктов реакции. Например, 1г платинового катализатора вызывает превращение 10 тыс. г SO2 при окисление в SO3 или 1 млн. г NH3 при окисление в NO.
Катализ называется положительным, если скорость реакции увеличивается, и отрицательным, если она уменьшается. В последнем случае говорят об ингибирование. В большинстве случаев под термином «катализ» понимают положительный катализ.
Явление ускорения реакции при воздействии продукта реакции или одного из промежуточных веществ называется автокатализом.
Каталитическое ускорение химической реакции достигается за счет изменения ее механизма.
Основываясь на фазовом состоянии катализатора и реагирующих веществ можно выделить 3 типа процессов:
1. Гомогенный катализ – процесс, в котором катализатор и реагирующие вещества находятся в одном агрегатном состоянии (жидком или газообразном). Для данного типа катализа характерно проявление активности отдельным ионом или молекулой катализатора. Поэтому, как правило, увеличение скорости реакции прямо пропорционально концентрации введенного катализатора.
2. Гетерогенный катализ – процессы в которых реагирующие вещества и катализатор находятся в разных агрегатных состояниях. Гетерогенный катализ характеризуется наличием границы раздела фаз (катализатор – реагирующие вещества), и тем, что одним из участников химической реакции является твердое тело. Процесс осуществляется через образование промежуточных поверхностных химических соединений нестехиометрического состава, с широким набором энергий связи между атомами реагирующих веществ и атомами катализатора.
3. Ферментативный катализ (микрогетерогенный) – играет ведущую роль в химических превращениях в живой природе. Ферменты (энзимы) – катализаторы белковой природы, образующиеся в живых организмах. По химической специфичности и активности ферменты значительно превосходят промышленные катализаторы.
По типам реакций катализ делится на окислительно-востановительный и кислотно-основной. Первый связан с переходами электронов между катализатором и реагентом. Второй с переходом протона (гидролиз, крекинг, дегидратация и т.д.) где в качестве катализаторов применяют основания и кислоты, или кислотные и амфотерные окислы.
Стадии каталитического действия гетерогенного катализа.
В общем случае гетерогенный катализ складывается из следующих элементарных стадий:
- диффузия реагирующих веществ из ядра потока к поверхности зерен катализатора;
- диффузия реагентов в порах ядра катализатора;
- активированная адсорбция (хемосорбция) на поверхности катализатора с образованием поверхностных химических соединений – активированных комплексов (реагенты – катализатор);
- перегруппировки атомов с образованием поверхностных комплексов (продукты – катализатор);
- десорбция продукта с поверхности (регенерация активного центра катализатора);
- диффузия продуктов в порах зерна катализатора;
- диффузия продуктов от поверхности зерна катализатора в ядро потока.
Общая скорость гетерогенного каталитического процесса определяется относительными скоростями отдельных стадий и может лимитироваться наиболее медленной из них. Скорости отдельных стадий определяются в свою очередь параметрами технологического режима.
Важной и необходимой стадией гетерогенного катализа является стадия адсорбции реагентов на поверхности катализатора. Наличие границы раздела фаз приводит к повышению концентрации вещества у поверхности раздела по сравнению с общим объемом. Это явление называется сорбцией (от лат. sorbeo – поглощаю).
Сорбция включает в себя два основных процесса:
адсорбция – увеличение концентрации вещества на поверхности в результате поглощения его сорбентом;
абсорбция – проникновение сорбируемого вещества в массу сорбента.
Каталитический акт происходит в молекулярном слое, непосредственно примыкающем к поверхности катализатора. Т.о. катализ тесно связан с адсорбцией, которая является предварительной стадией катализа, но не все адсорбированные атомы или молекулы способны участвовать в каталитическом процессе.
Виды адсорбции.
Характер возникающей при адсорбции связи адсорбирующего вещества с поверхностью определяется относительной степенью насыщенности поверхности и ее химическим составом. Различают два основных типа адсорбции: физическую и химическую.
Физическая адсорбция – это процесс, при котором молекулы адсорбируемого вещества (адсорбата) связываются с поверхностью адсорбента физическими силами притяжения (силами межмолекулярного взаимодействия)
Химическая адсорбция (хемосорбция) - это процесс, при котором молекулы адсорбата связываются с поверхностью адсорбента химическими связями (ковалентной или ионной).
Адсорбция сопровождается убылью свободной энергии и энтропии, т.е. проходит с выделением тепла (экзотермический процесс).
Обратный адсорбции процесс называется десорбция, который идет с поглощением тепла (эндотермический процесс).
Если адсорбция – экзотермический процесс, следует ожидать уменьшение количества адсорбируемого вещества с ростом температуры. Однако эта зависимость имеет более сложный характер:
Большинство неорганических веществ, которые принято относить к продукции основной химической промышленности, выпускаемых в больших количествах, производят с использованием каталитических процессов. Только применение катализаторов позволило получать минеральные кислоты, такие как серная и азотная, аммиак, метанол в объемах, превышающих миллионы тонн в год. Подготовка технологических газов для промышленных крупнотоннажных производств и очистка хвостовых газов от загрязняющих окружающую среду вредных выбросов осуществляется также с помощью активных катализаторов. В таблице приведены основные марки промышленных катализаторов, используемых в технологии неорганических веществ.
Таблица – Важнейшие каталитические процессы
и катализаторы ТНВ
| Процесс | Реакция | Марки катализаторов |
| Конверсия природного газа |  | ГИАП-16 ГИАП-3-6Н, ГИАП-5 |
| Конверсия моноксида углерода | 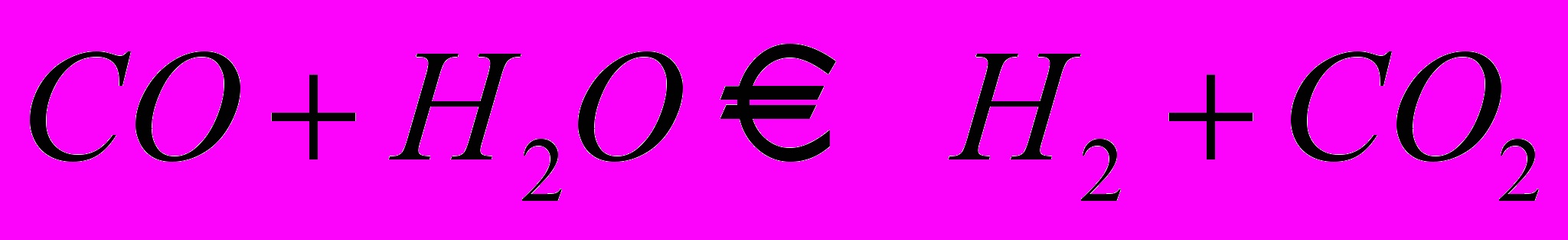 | СТК-1-5, СТК-1-7, СТК-1М, СТК-2-5, НТК-4 |
| Синтез аммиака |  | СА-1 |
| Окисление аммиака | 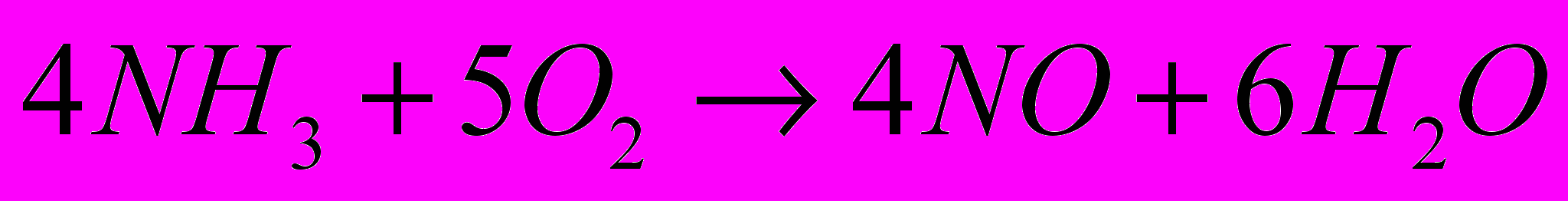 | КН-2, КН-2Т, НК-2У |
| Окисление сернистого ангидрида | 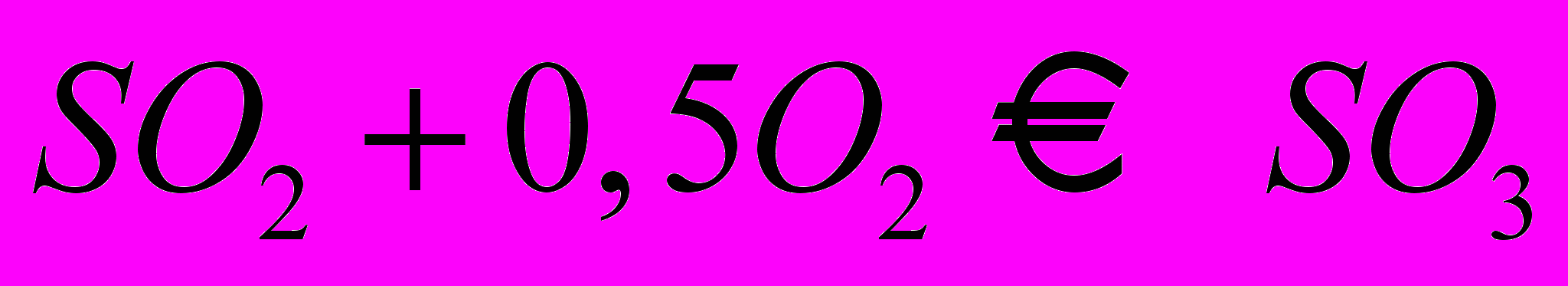 | СВД БАВ КС СВС |
| Синтез метанола |  | СНМ-1 |
| Очистка газов от NOx | 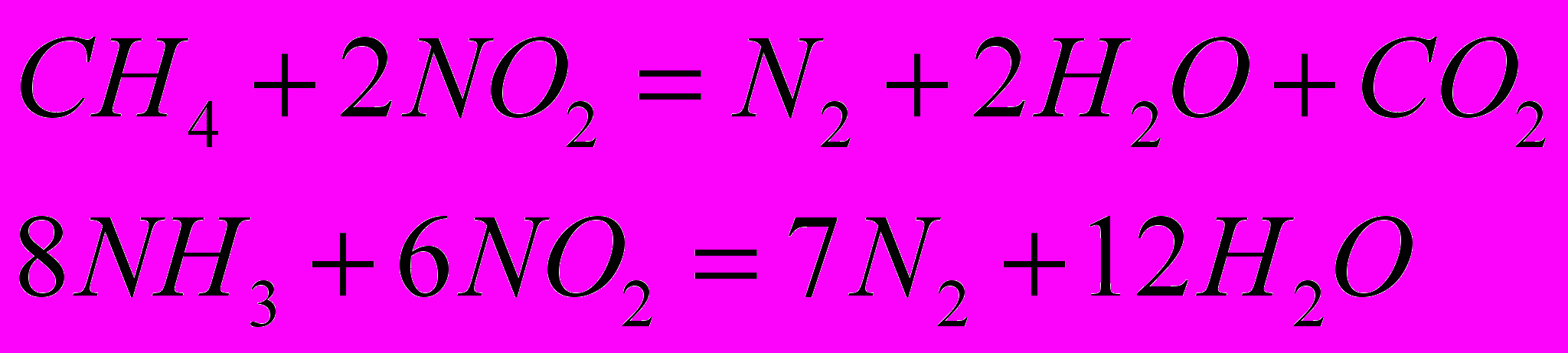 | АПК-2 АВК-10М |
ГИАП – государственный институт азотной промышленности
СТК – среднетемпературный катализатор
НТК – низкотемпературный катализатор
СА – синтез аммиака
КН – катализатор неплатиновый
СНМ - Северодонецкий низкотемпературный метанольный
АПК - алюмопалладиевый катализатор
АВК – алюмованадиевый катализатор
СВД – сульфованадатдиатомитовая контактная масса
БАВ – бариевая алюмованадиевая контактная масса
КС – контактная масса, предназначенная для проведения процесса в кипящем слое
СВС – сульфованадатсиликагелевая контактная масса
Широкое применение каталитического синтеза обусловливает производство большого количества катализаторов, различающихся как химическим составом, так и методом приготовления. Целесообразность применения того или иного катализатора и метода его получения определяется технико-экономическими показателями процесса, в котором он применяется. Для достижения удовлетворительных результатов катализатор должен обладать рядом свойств, обеспечивающих рентабельность его использования. Эксплуатационные характеристики катализатора формируются на основании требований, среди которых главными можно считать следующие:
– высокая активность и селективность;
– оптимальная величина и доступность поверхности активного компонента;
– устойчивость к действию ядов и высоких температур;
– необходимая прочность;
– оптимальные гидродинамические характеристики;
– невысокая стоимость.
Активность и селективность катализатора определяется в первую очередь его химическим и фазовым составом. Вместе с тем фазовый состав зависит не только от природы и количества вводимых ингредиентов, но в значительной мере определяется способом приготовления. Вследствие этого для одинаковых процессов химической технологии применяют различные по составу катализаторы, которые могут отличаться и методом приготовления.
Технологии контактных масс помимо прочего учитывают стоимость сырья и используемого аппаратурного оформления, легкость химических превращений исходных веществ в каталитически активный компонент, возможность обезвреживания или утилизации стоков и газовых выбросов.
Особое место метод приготовления занимает в формировании пористой структуры контактных масс. При этом на характеристики пористой структуры твердого тела могут оказывать влияние различные технологические стадии и режимы термообработки.
Перечень рекомендуемой литературы:
1. Общая химическая технология . Под ред. И.П. Мухленова. Учебник для химико-технологических специальностей вузов. - М.: Высшая школа.;
2. Б. В. Некрасов. Основы общей химии, т. 3,. - М.: Химия, 1970.;
3. Фурмер И.Э., Зайцев В.Н. Общая химическая технология. - М., Высшая школа, 1978. – 264с.;
4. Кузнецов В.И. Общая химия. Тенденция развития. – М., Высшая школа,1989. - 288 с.;
5. Поллер З. Химия на пути в третье тысячелетие. - М.: Мир, 1982, - 400 с.;
6. И.П. Мухленов и др. Технология катализаторов. Л: Химия, 1989 – 324с.;
7. Д.В. Сокольский, В.А. Друзь. Введение в теорию гетерогенного катализа. - М., Высшая школа, 1981 – 915с.;
8. В.В. Коробочкин, Е.А. Ханова. Технология катализаторов. Часть I. Методы приготовления катализаторов. Учебное пособие. – Томск, из-во ТПУ, 2008. – 50 с.;
9. Амелин А.Г. Технология серной кислоты. – М., Химия, 1983. – 360 с.
10. Общая химическая технология.Фурмер И.Э., Зайцев В.Н. - М.: Высшая школа, 1978



