Конспект лекций по курсу «Введение в специальность» направление
| Вид материала | Конспект |
- Конспект лекций по курсу макроэкономика для студентов заочников факультета бухгалтерского, 2421.87kb.
- Конспект лекций по курсу «Организация производства», 2032.47kb.
- Конспект лекций по курсу «Организация производства», 2034.84kb.
- Предлагаемый конспект опорных лекций отражает традиционный набор тем и проблем курса, 1047.31kb.
- Конспект лекций по курсу "Начертательная геометрия и инженерная графика" Кемерово 2002, 786.75kb.
- Конспект лекций по курсу «бизнес-планирование в условиях рынка», 461.46kb.
- Конспект лекций по курсу «Неорганическая и аналитическая химия», 18.21kb.
- Конспект лекций по курсу "Информатика и использование компьютерных технологий в образовании", 1797.24kb.
- Конспект лекций дисциплина «Эффективность информационных технологий» Направление, 2946.75kb.
- Конспект лекций 12. 88 Специальность 270114 «Проектирование зданий», 27.06kb.
ЛЕКЦИЯ 8. Фосфорная кислота Фосфорные кислоты — соединения ссылка скрыта в степени окисления +5 общей формулы P2O5·nH2O:
P2O5 + H2O = 2HPO3 (на холоде);
HPO3 + H2O = H3PO4 (при кипячении);
2H3PO4 = H4P2O7 + H2O (нагревание при 200°C); Из ортофосфорной кислоты легко испаряется ссылка скрыта и она становится концентрированной. При нагревании до 300°C ортофосфорная кислота отдает воду, разлагаясь сначала на пирофосфорную кислоту, затем различные полифосфорные кислоты. При этом образуется ссылка скрыта стекловидная масса. Если затем эту массу разбавить водой, то она превратится обратно в ортофосфорную кислоту. Наибольшее значение имеет ортофосфорная кислота (или просто фосфорная), которую для технических целей получают по реакции Са3(РО4)2 + 3H2SO4 = 3CaSO4 + 2Н3РО4, и её соли — ссылка скрыта. Н3РО4 применяют для производства ссылка скрыта, в пищевой, текстильной промышленности, в медицине, как ссылка скрыта при ссылка скрыта. Фосфаты применяют как фосфорные ссылка скрыта, в производстве ссылка скрыта, ссылка скрыта. По «дырообразующей» активности ортофосфорная кислота превосходит серную. История открытия и получения фосфорной кислоты. Фосфорную кислоту открыл Р. Бойль с помощью индикаторов. Сжигая фосфор и растворяя образовавшийся белый продукт в воде он получил неизвестную химикам кислоту. По исходному веществу он назвал её фосфорной. Технически фосфорную кислоту впервые получили более 100 лет назад разложением низкокачественных фосфоритов разбавленной (5-10%) серной кислотой, в которой соединения железа и особенно алюминия переходят в раствор в незначительной степени. Раствор с концентрацией 8-10% Р2О5 упаривали до содержания в нем примерно 40% Р2О5. При разложении фосфатной породы более концентрированной (30-40%) серной кислотой выделяются игольчатые кристаллы гипса. Они удерживают значительное количество жидкой фазы и плохо промываются. Вследствие этого потери Р2О5 велики. Существенным шагом вперед в производстве фосфорной кислоты был переход к установкам непрерывного действия и разбавления 75 и 93%-ной серной кислоты не водой или слабыми промывочными водами, а раствором фосфорной кислоты, т.е. проведение процесса с применением раствора разбавления. В этих условиях выделяются ромбические кристаллы, которые хорошо фильтруются и отмываются. Физические свойства. Ортофосфорная кислота в чистом виде при обычных условиях представляет бесцветные кристаллы ромбической формы, плавящиеся при температуре 42.3оС. Однако с такой кислотой химики встречаются редко. Гораздо чаще они имеют дело с полугидратом Н3РО4 * 0.5 Н2О, который выпадает в виде бесцветных гексагональных призм при охлаждении концентрированных водных растворов ортофосфорной кислоты. Температура плавления полугидрата 29.3оС. Чистая Н3РО4 после плавления образует вязкую маслообразную жидкость с малой электрической проводимостью и сильно пониженной способностью к диффузии. Эти свойства, а также детальное изучение спектров показывают, молекулы Н3РО4 в данном случае практически не диссоциированы и объединены прочными водородными связями в единую макромолекулярную структуру. Как правило, молекулы связаны друг с другом одной, реже двумя и очень редко тремя водородными связями. Если же кислоту разбавлять водой, то ее молекулы охотнее образуют водородные связи с водой, чем друг с другом. Из-за таких "симпатий" к воде кислота смешивается с ней в любых отношениях. Энергия гидратации здесь не так велика, как у серной кислоты, поэтому разогревание Н3РО4 при разбавлении не столь сильное и диссоциация выражена меньше. Химические свойства Н3РО4 Ортофосфорная кислота в водных растворах намного слабее серной и азотной кислот. Это трехосновная кислота. Электролитическая диссоциация кислоты, как и других многоосновных кислот, осуществляется ступенчато: По первой ступени диссоциации ортофосфорная кислота считается электролитом средней силы, по второй - слабым, по третьей - очень слабым. В соответствии с существованием трех видов кислотных остатков при нейтрализации фосфорной кислоты щелочами образуются соли: дигидрофосфаты, гидрофосфаты, а также фосфаты, например: Ортофосфорную кислоту можно отличить от других фосфорных кислот по реакции с нитратом серебра – образуется желтый осадок Н3РО4 + 3AgNO3=Ag3PO4 + HNO3 Все остальные фосфорные кислоты образуют белые осадки. При упаривании ортофосфорной кислоты образуется дифосфорная (пирофосфорная) кислота: 2Н3РО4 = Н4Р2О7 + Н2О. Значение фосфорной кислоты Фосфорная кислота имеет большое значение как один из важнейших компонентов питания растений. Фосфор используется растениями для построения своих самых жизненно важных частей - семян и плодов. Производные ортофосфорной кислоты очень нужны не только растениям, но и животным. Кости, зубы, панцири, когти, иглы, шипы у большинства живых организмов состоят, в основном, из ортофосфата кальция. Кроме того, ортофосфорная кислота, образуя различные соединения с органическими веществами, активно участвуют в процессах обмена веществ живого организма с окружающей средой. В результате этого производные фосфора содержатся в костях, мозге, крови, в мышечных и соединительных тканях организмов человека и животных. Особенно много ортофосфорной кислоты в составе нервных (мозговых) клеток, что позволило А.Е. Ферсману, известному геохимику, назвать фосфор "элементом мысли". Весьма отрицательно (заболевание рахитом, малокровие, и др.) сказывается на состоянии организма понижение содержания в рационе питания соединений фосфора или введение их в неусвояемой форме. Применяют ортофосфорную кислоту в настоящее время довольно широко. Основным ее потребителем служит производство фосфорных и комбинированных удобрений. Для этих целей ежегодно добывается во всем мире фосфоросодержащей руды около 100 млн. т. Фосфорные удобрения не только способствуют повышению урожайности различных сельскохозяйственных культур, но и придают растениям зимостойкость и устойчивость к другим неблагоприятным климатическим условиям, создают условия для более быстрого созревания урожая в районах с коротким вегетативным периодом. Они также благоприятно действуют на почву, способствуя ее структурированию, развитию почвенных бактерий, изменению растворимости других содержащихся в почве веществ и подавлению некоторых образующихся вредных органических веществ. Немало ортофосфорной кислоты потребляет пищевая промышленность. Дело в том, что на вкус разбавленная ортофосфорная кислота очень приятна и небольшие ее добавки в мармелады, лимонады и сиропы заметно улучшают их вкусовые качества. Этим же свойством обладают и некоторые соли фосфорной кислоты. Гидрофосфаты кальция, например, с давних пор входят в хлебопекарные порошки, улучшая вкус булочек и хлеба. Интересны и другие применения ортофосфорной кислоты в промышленности. Например, было замечено, что пропитка древесины самой кислотой и ее солями делают дерево негорючим. На этой основе сейчас производят огнезащитные краски, негорючие фосфодревесные плиты, негорючий фосфатный пенопласт и другие строительные материалы. Различные соли фосфорной кислоты широко применяют во многих отраслях промышленности, в строительстве, разных областях техники, в коммунальном хозяйстве и быту, для защиты от радиации, для умягчения воды, борьбы с котельной накипью и изготовления различных моющих средств. Фосфорная кислота, конденсированные кислоты и дегидротированные фосфаты служат катализаторами в процессах дегидротирования, алкилирования и полимеризации углеводородов. Особое место занимают фосфорорганические соединения как экстрагенты, пластификаторы, смазочные вещества, присадки к пороху и абсорбенты в холодильных установках. Соли кислых алкилфосфатов используют как поверхностно-активные вещества, антифризы, специальные удобрения, антикоагулянты латекса и др. Кислые алкилфосфаты применяют для экстракционной переработки урановорудных щелоков. ЛЕКЦИЯ 9. ПРОИЗВОДСТВО ЩЕЛОЧЕЙ. В широком смысле слово «щелочь» относится к большому числу химических соединений, хорошо растворимых в воде и создающих в водном растворе высокую концентрацию гидроксид-ионов. К щелочным продуктам относятся гидроокиси, бикарбонаты и карбонаты щелочных металлов, аммиак и гидроксид аммония. Они применяются практически во всех областях народного хозяйства. Щелок. Наименование «щелок» (K2CO3, Na2CO3, NaOH) было присвоено продуктам, получаемым путем выщелачивания древесной золы. Она содержит приблизительно 70% карбоната калия (поташа), используемого в основном для изготовления мыла и стекла. Карбонат натрия (кальцинированная сода) — главный компонент золы некоторых растений. Путем обработки гашеной известью (гидроксидом кальция) карбонат натрия превращают в каустическую соду (гидроксид натрия), которая применяется для бытовых и промышленных целей под названием «щелок» или «каустик». Кальцинированная сода. Углекислая сода (карбонат натрия) была известна еще в глубокой древности. Издавна соду получали из золы морских и солончаковых растений и извлекали из природных содовых озер. Кальцинированная сода встречается в природе главным образом в соляных пластах и отложениях троны (минерала состава Na2CO3*NaHCO3*2H2O). Её использовали в стеклоделии и в качестве моющего средства. К концу XVIII века эти источники уже не могли удовлетворить возрастающую потребность в соде. В 1775 году французский фармацевт Леблан предложил получать соду прокаливанием смеси сульфата натрия, измельченного мела или известняка и угля согласно реакции:  Из полученного плава соду выщелачивали водой, затем раствор упаривали, выделяя 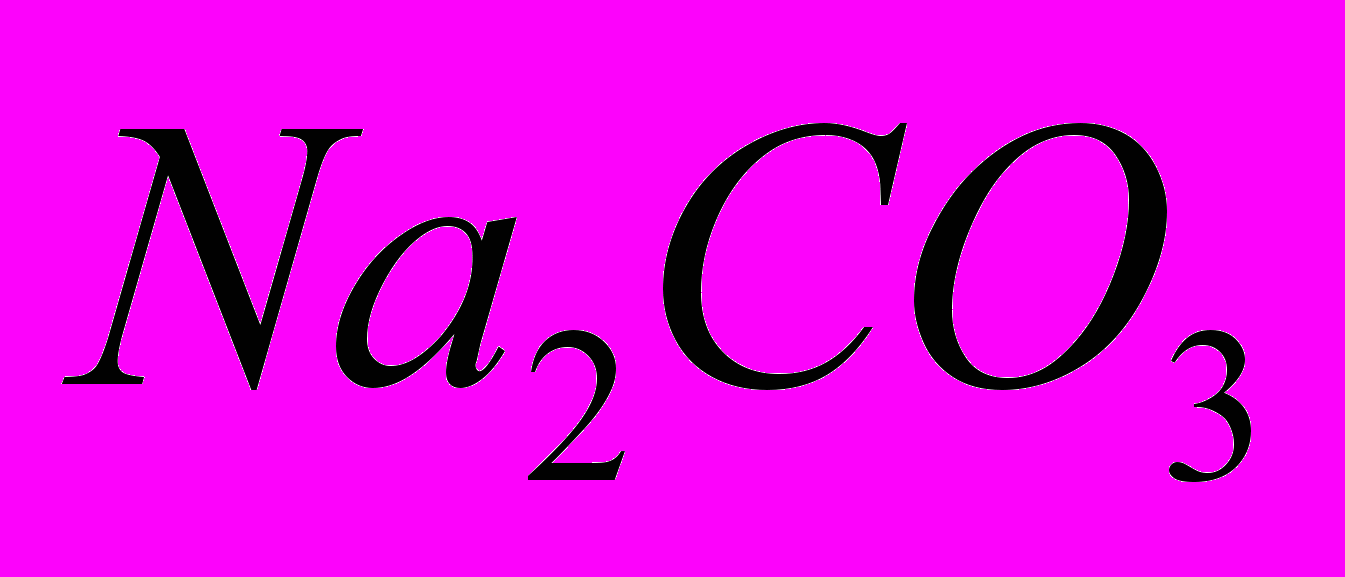 в твердом виде. В шламе оставался в твердом виде. В шламе оставался  , являющийся отходом производства. , являющийся отходом производства. Способ Леблана сыграл большую роль в развитии химической промышленности и разработке сырьевых баз. В то же время, существенные недостатки этого способа, и в первую очередь обильные отходы, выявившиеся, как только производство достигло значительных масштабов, привели к созданию более рациональных способов производства кальцинированной соды. В 1838 году англичане Гаррисон и Хемминг взяли патент на производство соды по аммиачному способу. Несмотря на кажущуюся простоту этого метода в лабораторных условиях, осуществление его в промышленном масштабе было сопряжено с огромными трудностями. С этого времени основное внимание исследователей было направлено на решение вопросов аппаратурного оформления, так как именно они являются ключом к решению всей проблемы аммиачно-содового производства в целом. В 1861 году к практическому осуществлению аммиачно содового производства приступил бельгийский инженер Э. Сольве. К 1872 году ему удалось создать удачное аппаратурное оформление аммиачно-содового способа, что позволило обеспечить непрерывность производственного процесса. При этом в первой четверти XX столетия содовое производство явилось центром, вокруг которого возникли, развились и от которого потом отделились другие химические производства минеральные продуктов. Первый в России завод, начавший систематическую выработку соды по способу Леблана, был построен в 1864 году. Он был построен в Сибири на базе природного сульфата натрия. Попытка осуществить аммиачный способ на базе привозной поваренной соли была предпринята Лихачевым, построившим под руководством инженера-химика Тиса в 1869 году в Казанской губернии небольшой (2,5 т/сут) завод. Однако из-за больших потерь соли и аммиака при их высокой стоимости завод просуществовал только четыре года. Аммиачный способ утвердился в России с 1883 года, когда был построен содовый завод в Березниках на базе Соликамского месторождения поваренной соли. Затем в 1892 году построен второй – Донецкий содовый завод, работавший по способу Гонигман. Процесс Сольве осуществленный в конце 1860-х годов двумя бельгийцами, братьями Эрнестом и Альфредом Сольве, аммиачный способ получения кальцинированной соды основан на реакции взаимодействия гидрокарбоната аммония с хлоридом натрия, в результате которой получаются хлорид аммония и гидрокарбонат натрия. На практике процесс проводят, вводя в почти насыщенный раствор хлорида натрия сначала аммиак, а потом диоксид углерода. Гидрокарбонат натрия выпадает в осадок, когда диоксид углерода вводится в раствор:  Прокаливая отфильтрованный гидрокарбонат натрия, получают карбонат натрия и диоксид углерода, который используют повторно:  Экономичность процесса Сольве связана с тем, что аммиак регенерируется путем обработки раствора хлорида аммония оксидом кальция, который получают из карбоната кальция путем нагрева (при этом одновременно образуется также используемый в процессе диоксид углерода):   Хлорид кальция, образующийся в процессе извлечения аммиака, является важным побочным продуктом. Преимущества аммиачного способа производства соды: относительная дешевизна, широкая распространенность и доступность извлечения необходимого сырья (поваренная соль и карбонат кальция); незначительность температур (до 100  С), при которых осуществляются основные реакции процесса и близкие к атмосферному давления; достаточная отлаженность способа и устойчивость технологических процессов; высокое качество получаемого продукта; невысокая себестоимость кальцинированной соды. С), при которых осуществляются основные реакции процесса и близкие к атмосферному давления; достаточная отлаженность способа и устойчивость технологических процессов; высокое качество получаемого продукта; невысокая себестоимость кальцинированной соды.Для получения 1т кальцинированной соды (95%) расходуется 1,49 т NaCl (100%), 1,37 т известняка (40,5% CO2), 10 кг аммиачной воды (25,5%), 60 кВт ч электроэнергии, 75 м3 воды, 5,65 МДж пара. В качестве отхода образуется 8,3 м3 жидкости, содержащей 993 кг CaCl2 и 446 кг NaCl. Аммиачному способу получения соды присущи, однако, и серьезные недостатки, главными из которых являются: низкая степень использования исходного сырья (натрий используется всего примерно на 2/3, а хлор и кальций не используются совсем); большие количества твердых и жидких отходов, требующих утилизации, сброса или длительного хранения; значительный расход энергетических ресурсов; большие удельные капиталовложения, необходимые для создания содового производства. Недостатки аммиачного получения сода становятся все существеннее по мере ужесточения требований к комплексности использования природного сырья и к охране окружающей среды от загрязнений, а также с ростом стоимости энергоносителей. Многочисленные попытки сделать способ безотходным до сих пор не увенчались успехом. Электролизный процесс. Карбонат натрия можно также получить посредством электролизного процесса. Водяной пар и диоксид углерода запускаются в катодное отделение установки с камерой диафрагменного типа для электролиза растворов солей, где, взаимодействуя с едким натром, они превращают его в карбонат натрия. Применение соды. Крупнейшими потребителями соды являются химическая, металлургическая и другие отрасли промышленности. В химической промышленности сода применяется для получения каустической соды, гидрокарбоната натрия, моющих средств, соединений хрома, сульфитов и фторидов, фосфатов, нитрита натрия, натриевой селитры. Также карбонат натрия используется при производстве листовых, прокатных, светотехнических стекол, силикатной глыбы, бутылок, хрусталя, сортовой посуды и др. В состав всех этих продуктов и изделий сода входит в виде 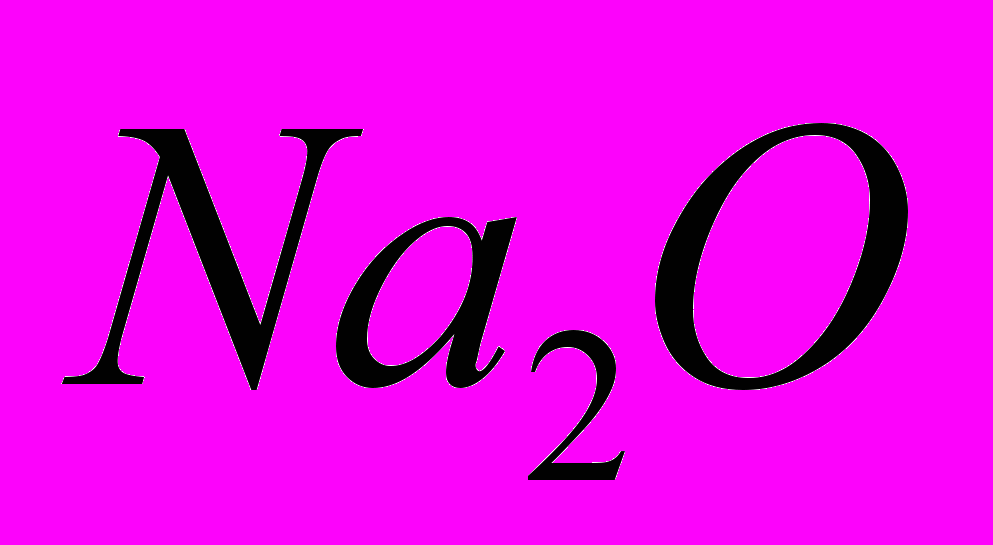 . В стекольной промышленности кальцинированная сода является основным компонентом шихты для варки стекла. . В стекольной промышленности кальцинированная сода является основным компонентом шихты для варки стекла.Большое количество карбоната натрия используется в цветной металлургии в основном при переработке свинцово-цинковых, кобальт-никелевых, а также вольфрамо-молибденовых руд. Значительное количество соды использует целлюлозно-бумажная промышленность (при проклейке бумаги и картона, в производстве пергамента, дубителей и главным образом сульфитной варке целлюлозы). Сода также необходима в нефтехимической и нефтеперерабатывающей промышленности при производстве синтетических жирных кислот, синтетических моющих средств, а также при переработке нефти в других процессах. В черной металлургии карбонат натрия используется для удаления серы и фосфора из чугуна. В машиностроении также не обойтись без содопродуктов. В медицинской промышленности сода применяется в производстве медикаментов. В электронной промышленности сода применяется для производства электровакуумного стекла. Применение содопродуктов для нейтрализации кислых сточных вод и извлечения из них смолистых и органических соединений, как, например фенолов, позволяет предохранять водоемы от загрязнения. Значительное количество содопродуктов расходуется для обезжиривания и очистки тары и рабочих мест на предприятиях мясомолочной и рыбной промышленности, что имеет большое значение для повышения качества пищевых продуктов. В легкой промышленности кальцинированная сода используется для мытья, беления и крашения ткани, получения искусственного шелка, нитроцеллюлозы и др. В кожевенной и обувной промышленности, при выработке мехов сода применяется для щелочной обработки материалов. Применение карбоната натрия для очистки воды, питающей паровые котлы, способствует удлинению срока службы котлов и значительной экономии топлива. Поташ. Хотя в химической промышленности поташом называют главным образом карбонат калия (K2CO3), в сельском хозяйстве это наименование охватывает все соли калия, идущие на изготовление удобрений, но в основном хлорид калия (KCl) с небольшой примесью сульфата калия (K2SO4). Обычные способы получения поташа — электролизный процесс с участием гидроксида калия и более распространенный процесс на основе химического взаимодействия смеси хлорида калия и карбоната магния с диоксидом углерода. В результате этой реакции образуется нерастворимая двойная соль гидрокарбоната калия и карбоната магния, которая при нагревании разлагается на карбонаты калия и магния, воду и диоксид углерода. Карбонат калия применяется в производстве стекла, солей калия, красителей и чернил. Карбонат калия — важный компонент специальных стекол, например оптических и лабораторных. Каустическая сода (едкий натр). Гидроксид натрия NaOH получил свое название по причине сильного разъедающего действия на животные и растительные ткани. Каустическую соду получают либо путем электролиза раствора хлорида натрия (NaCl) с образованием гидроксида натрия и хлора, либо, реже, с помощью более старого способа, основанного на взаимодействии раствора кальцинированной соды с гашеной известью. Большое количество производимой в мире кальцинированной соды используется для получения каустической соды. Взаимодействие раствора кальцинированной соды с гашеной известью. Каустическую соду получают из кальцинированной на установке периодического или непрерывного действия. Процесс обычно проводят при умеренных температурах в реакторах, оборудованных мешалками. Реакция образования каустической соды представляет собой реакцию обмена между карбонатом натрия и гидроксидом кальция:  Карбонат кальция выпадает в осадок, а раствор гидроксида натрия отводится. Электролизные методы. Когда концентрированный раствор хлорида натрия подвергается электролизу, образуются хлор и гидроксид натрия, но они реагируют друг с другом с образованием гипохлорита натрия — отбеливающего вещества. Этот продукт, в свою очередь, особенно в кислых растворах при повышенных температурах, окисляется в электролизной камере до перхлората натрия. Чтобы избежать этих нежелательных реакций, электролизный хлор должен быть пространственно отделен от гидроксида натрия. В большинстве промышленных установок, используемых для получения электролизной каустической соды, это осуществляется с помощью диафрагмы, помещенной вблизи анода, на котором образуется хлор. Существуют установки двух типов: с погруженной или непогруженной диафрагмой. Камера установки с погруженной диафрагмой целиком заполняется электролитом. Соляной раствор втекает в анодное отделение, где из него выделяется хлор, а раствор каустической соды заполняет катодное отделение. В установке с непогруженной диафрагмой раствор каустической соды отводится из катодного отделения по мере образования, так что камера оказывается пустой. В некоторых установках с непогруженной диафрагмой в пустое катодное отделение напускается водяной пар, чтобы облегчить удаление каустической соды и поднять температуру. В диафрагменных установках получается раствор, содержащий как каустическую соду, так и соль. Большая часть соли выкристаллизовывается, когда концентрация каустической соды в растворе доводится до стандартного значения 50%. Такой «стандартный» электролизный раствор содержит 1% хлорида натрия. Продукт электролиза пригоден для многих применений, например для производства мыла и чистящих препаратов. Однако для производства искусственного волокна и пленки требуется каустическая сода высокой степени очистки, содержащая менее 1% хлорида натрия (соли). «Стандартный» жидкий каустик можно надлежащим образом очистить методами кристаллизации и осаждения. Непрерывное разделение хлора и каустика можно также осуществить в установке с ртутным катодом. Металлический натрий образует с ртутью амальгаму, которая отводится во вторую камеру, где натрий выделяется и реагирует с водой, образуя каустик и водород. Хотя концентрация и чистота соляного раствора для установки с ртутным катодом более важны, чем для установки с диафрагмой, в первой получается каустическая сода, пригодная для производства искусственного волокна. Ее концентрация в растворе составляет 50-70%. Более высокие затраты на установку с ртутным катодом оправдываются получаемой выгодой. В России согласно ссылка скрыта 2263-79 производятся следующие марки натра едкого: ТР - твердый ртутный (чешуированный); ТД - твердый диафрагменный (плавленый); РР - раствор ртутный; РХ - раствор химический; РД - раствор диафрагменный. Показатели российского рынка жидкого натра едкого в: 2005 г. – 1184 тыс. тонн 2006 г. – 1217 тыс. тонн Показатели российского рынка твердого натра едкого в: 2005 г. – 108.565 тонн 2006 г. – 106219 тонн Применение. Наиболее важные области потребления каустической соды (перечислены в порядке уменьшения потребляемого количества) — химическое производство; переработка нефти; производство искусственного волокна и пленки, целлюлозы и бумаги, алюминия, моющих средств и мыла; обработка тканей; рафинирование растительного масла; регенерация резины. Каустический поташ (едкое кали). Соединения калия менее распространены и поэтому более дороги, чем соответствующие соединения натрия. Они применяются только в тех случаях, когда необходим присущий им комплекс физико-химических свойств, не обеспечиваемый соединениями натрия. Гидроксид калия KOH, в обиходе называемый каустическим поташем, не является исключением из этого правила. Подобно каустической соде, каустический поташ можно получить путем обработки раствора карбоната калия K2CO3 гашеной известью Ca(OH)2 или электролизом раствора хлорида калия. Этот материал продается в виде массивных блоков, хлопьевидной массы, гранул или небольших кусков, а также 40 × 50%-х растворов. Применение. Главная область применения гидроксида калия — производство мягкого мыла. Смеси калиевых и натриевых мыл используются для получения жидких мыл, моющих средств, шампуней, кремов для бритья, отбеливателей и некоторых фармацевтических препаратов. Другая важная область применения каустического поташа — производство различных солей калия. Например, перманганат калия получают путем сплавления диоксида марганца с каустическим поташем и последующего окисления образовавшегося манганата калия в электролизной камере. Дихромат калия можно получить аналогичным способом, хотя чаще его изготовляют сплавлением тонко измельченной хромитной руды (FeO * Cr2O3) с карбонатом или гидроксидом калия и воздействием на полученный хромат кислотой с образованием дихромата калия. Каустический поташ также применяют вместе с каустической содой в производстве многих красителей и других органических соединений. |
