Автореферат диссертации на соискание ученой степени
| Вид материала | Автореферат диссертации |
- Автореферат диссертации на соискание ученой степени, 378.33kb.
- Автореферат диссертации на соискание учёной степени, 846.35kb.
- Автореферат диссертации на соискание ученой степени, 267.76kb.
- Акинфиев Сергей Николаевич автореферат диссертации, 1335.17kb.
- L. в экосистемах баренцева моря >03. 02. 04 зоология 03. 02. 08 экология Автореферат, 302.63kb.
- Автореферат диссертации на соискание ученой степени, 645.65kb.
- Автореферат диссертации на соискание ученой степени, 678.39kb.
- Автореферат диссертации на соискание ученой степени, 331.91kb.
- Автореферат диссертации на соискание ученой степени, 298.92kb.
- Автореферат диссертации на соискание ученой степени, 500.38kb.
На правах рукописи
Косарева Ольга Владимировна
Кинетика диссоциации и каталитическая активность медь(II)- и палладий(II)-
мезо-фенил-β-октаалкилпорфиринов
02.00.04 – физическая химия
02.00.03 – органическая химия
Автореферат диссертации на соискание ученой степени
кандидата химических наук
Иваново - 2007
Работа выполнена в Институте химии растворов Российской академии наук
Научные руководители:
доктор химических наук, профессор Ломова Татьяна Николаевна.
доктор химических наук, доцент Клюева Мария Евгеньевна.
Официальные оппоненты:
доктор химических наук, профессор Михайлов Олег Васильевич, Казанский государственный технологический университет.
доктор химических наук, профессор Базанов Михаил Иванович, Ивановский государственный химико-технологический университет.
Ведущая организация Институт проблем химической физики Российской академии наук
Защита состоится 13 декабря 2007 г. в 10 часов на заседании диссертационного совета Д 002.106.01, Институт химии растворов РАН, 153045 г. Иваново, ул. Академическая, д. 1
С диссертацией можно ознакомиться в библиотеке Института химии
растворов РАН
Автореферат разослан ноября 2007 г.
Ученый секретарь
диссертационного совета Ломова Т. Н.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Высокая каталитическая активность металлопорфиринов во многих химических реакциях обусловлена ароматичностью их молекул и сопряжением координированного атома металла с π-системой лиганда. Ярко выраженный электронобуферный характер π-системы порфирина и способность катионов металла в составе металлопорфиринов присоединять различные лиганды делает перспективным исследование их в каталитических окислительно-восстановительных реакциях, в частности, в реакции диспропорционирования пероксида водорода. Первостепенный интерес представляют порфириновые комплексы с металлами в устойчивой степени окисления 2+, удовлетворяющие требованию наличия двухстороннего доступа реагентов к координационному центру. Поэтому в качестве объектов исследования в данной работе выбраны медь(II)- и палладий(II)порфирины с различной природой и степенью замещения в органической части молекулы. Для подтверждения выводов о важной роли процессов дополнительной координации (сверх макроцикла) в ходе катализа реакции диспропорционирования H2O2 медь(II)- и палладий(II)порфиринами необходимо выяснить также роль эффективности связывания макроцикла катионом металла. Изучение устойчивости медных и палладиевых производных порфиринов в зависимости от электронного и геометрического строения органической части молекул позволит выявить закономерности и механизм влияния структурной модификации макроцикла на состояние связей металл – органический лиганд и координирующую способность на аксиальных направлениях в отсутствие эффектов дополнительного экранирования атома металла экстралигандами.
Работа выполнена при поддержке Программы РАН № 8 «Разработка методов получения химических веществ и создание новых материалов» (2006 - 2007 г.г.) и Программы Министерства образования и науки РФ «Развитие научного потенциала высшей школы» (проект 2.2.1.1.7181).
Цель работы состоит в изучении реакционной способности мезо-фенил-β-октаалкилпорфиринов меди(II) и палладия(II) в среде сильных кислот, в получении количественных характеристик и обосновании особенностей механизмов катализа реакции разложения пероксида водорода стабильными металлопорфиринами.
Для достижения поставленной цели необходимо выявить формы существования замещенных порфиринов меди(II) и палладия(II) в смешанных растворителях, содержащих H2SO4, и установить природу интермедиатов в реакции разложения пероксида водорода, катализируемой металлопорфиринами; определить скорости, параметры активации, кинетические уравнения и обосновать механизмы реакций в среде сильных кислот и реакций каталитического разложения H2O2 в водно-органической среде; провести сравнительный анализ количественных характеристик устойчивости и каталитической активности комплексов меди(II) и палладия(II), выявить роль эффектов от варьирования металла и заместителей в - и мезо-положениях порфина в формировании механизма и параметров катализа металлопорфиринами; предложить простые модели природных каталаз.
Научная новизна.
Получены количественные данные по кинетике и обоснованы стехиометрические механизмы реакций медь(II)- и палладий(II)мезо-фенил--алкил-порфиринов с закономерно изменяющейся структурой с кислотами различной силы. Выявлена роль структурных факторов и состава растворителя – реагента в формировании механизмов процессов. Получен полный ряд кинетической устойчивости медь(II)октаэтилпорфиринов с различным числом (вплоть до исчерпывающего) мезо-фенильных заместителей, в котором положение органических комплексов определяется электронным и геометрическим факторами от мезо-фенилзамещения.
Исследованием кинетики в политермических условиях установлено, что в среде сильных аэрированных кислот палладий(II)порфирины аналогичного строения подвергаются медленному одноэлектронному окислению по порфириновому макроциклу с образованием соответствующих -катион-радикалов. Окисленные формы комплексов впервые в химии порфиринов выделены экстракцией в CHCl3 в неизменном виде после переосаждения из кислоты на лед.
Определены закономерности кинетики, обоснованы многостадийные ион-молекулярные механизмы реакции диспропорционирования пероксида водорода в присутствии порфириновых производных CuII и PdII, включающие стадии координации двух молекул H2O2 (или HO2-), двухэлектронного окисления и восстановления металлопорфирина и кислотно-основные равновесия пероксида. Показано, что каталитическую активность органических комплексов можно регулировать путем варьирования заместителей в ароматическом макроцикле и иона металла. Найдены медь(II)- и палладий(II)порфирины с высокой каталитической активностью.
Практическая значимость. Полученные данные о реакционной способности и механизмах реакций медь(II)- и палладий(II)порфиринов с кислотами и в ходе каталитического разложения H2O2 являются новым вкладом в химию органических производных металлов и необходимы при разработке материалов на основе порфиринов. Обнаруженная каталазная активность медь(II)- и палладий(II)порфиринов и обоснованные механизмы катализа разложения H2O2 позволяют рассматривать эти соединения в качестве моделей природных каталаз, а замещение в органической части комплексов – в качестве способа регулирования указанной активности.
Апробация работы. Основные результаты работы были представлены и обсуждены на Всероссийской научной конференции «Актуальные проблемы современного естествознания» (Иваново, 2002); V и VI школах – конференциях молодых ученых стран СНГ по химии порфиринов и родственных соединений (Звенигород, 2002; Санкт-Петербург, 2005); XXI и XXIII Чугаевских конференциях по координационной химии (Киев, 2003; Одесса, 2007); IX Международной конференции по химии порфиринов и их аналогов (Суздаль, 2003); XI Международной конференции по химии органических и элементоорганических пероксидов (Москва, 2003); XXV и XXIX Российском семинаре по химии порфиринов и их аналогов (Иваново, 2004; Иваново, 2006); IX Международной конференции «Проблемы сольватации и комплексообразования в растворах» (Плёс, 2004); IV Международной конференции по порфиринам и фталоцианинам (New Orleans, USA, 2004); Международной конференции по органической химии «От Бутлерова и Бельштейна до современности» (Санкт-Петербург, 2006); Всероссийской научной конференции «Природные макроциклические соединения и их синтетические аналоги» (Сыктывкар, 2007); X International conference on the problems of solvation and complex formation in solution (Suzdal, 2007); XVIII Менделеевском съезде по общей и прикладной химии (Москва, 2007).
Публикации. По теме диссертации опубликовано 22 работы, в том числе 1 обзор, 6 статей в рецензируемых журналах и научных сборниках, тезисы 15-ти докладов на международных и российских конференциях.
Структура и объем диссертации. Диссертация объемом _____ стр. состоит из введения, двух глав обзора литературы, одной главы экспериментальной части, трех глав обсуждения результатов, выводов, списка цитируемой литературы из 206 наименований и содержит 33 таблицы, 33 рисунка и 4 схемы.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении дано обоснование актуальности работы, сформулирована ее цель, определена научная новизна и практическая ценность, указан личный вклад автора в проведение исследования. Он состоит в получении и обработке экспериментальных данных, проведении расчетов кинетических параметров, обсуждении и опубликовании совместно с руководителями полученных новых научных результатов и выводов, апробации работы.
Обзор литературы
Глава I. Закономерности и механизмы реакций металлопорфиринов с кислотами. Проанализированы литературные данные по формам существования и реакционной способности металлопорфиринов в среде сильных кислот, показана специфика кинетики и механизмов диссоциации соединений на катион металла и органический лиганд и окисления до -катион-радикалов, обусловленная особенностями их молекулярного строения.
Глава II. Катализ на металлопорфиринах. Рассмотрены каталитические реакции окисления-восстановления органических и неорганических соединений с участием металлопорфиринов и металлфталоцианинов. Показана зависимость каталитической активности макрогетероциклических комплексов от строения ароматической части молекулы и природы центрального иона металла.
Глава III. Синтез и исследование спектральных свойств медь(II)- и палладий(II)порфиринов, методики кинетических экспериментов и расчета параметров. Глава содержит описание методик синтеза и идентификации соответственно комплексов меди(II) с тетрафенилпорфином и монофенилоктаметилпорфином и меди(II) и палладия(II)* с октаэтилпорфином и его мезо-фенилзамещенными.
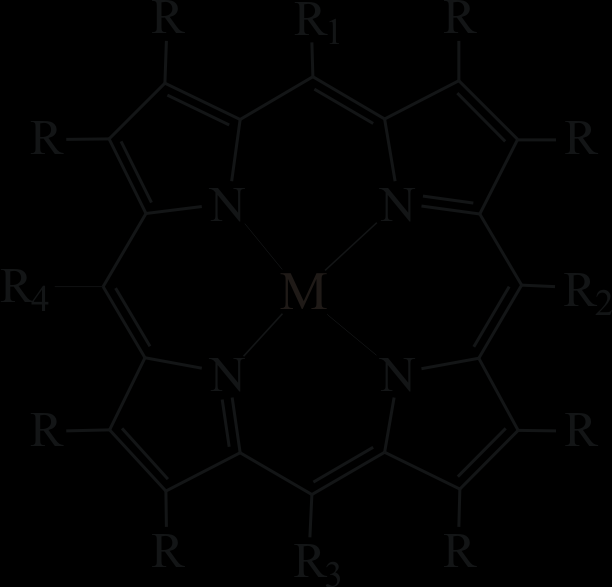 | CuOEP | M=Cu, R1 = R2 = R3 = R4 = H, R = C2H5 |
| CuMPOEP | M=Cu, R1 = C6H5, R2 = R3 = R4 = H, R = C2H5 | |
| CuMPOMP | M=Cu, R1 = C6H5, R2 = R3 = R4 = H, R = CH3 | |
| Cu5,15DPOEP | M=Cu, R1 = R3 = C6H5, R2 = R4 = H, R = C2H5 | |
| Cu5,10DPOEP | M=Cu, R1 = R2 = C6H5, R3 = R4 = H, R = C2H5 | |
| CuTrPOEP | M=Cu, R1 = R2 = R3 = C6H5, R4 = H, R = C2H5 | |
| CuTetPOEP | M=Cu, R1 = R2 = R3 = R4 = C6H5, R = C2H5 | |
| CuTPP | M=Cu, R1 = R2 = R3 = R4 = C6H5, R = H | |
| PdOEP | M=Pd, R1 = R2 = R3 = R4 = H, R = C2H5 | |
| PdMPOEP | M=Pd, R1 = C6H5, R2 = R3 = R4 = H, R = C2H5 | |
| Pd5,15DPOEP | M=Pd, R1 = R3 = C6H5, R2 = R4 = H, R = C2H5 | |
| Pd5,10DPOEP | M=Pd, R1 = R2 = C6H5, R3 = R4 = H, R = C2H5 | |
| PdTrPOEP | M=Pd, R1 = R2 = R3 = C6H5, R4 = H, R = C2H5 | |
| PdTetPOEP | M=Pd, R1 = R2 = R3 = R4 = C6H5, R = C2H5 |
______________________
* Палладий(II)порфирины синтезированы профессором А. С. Семейкиным в ИГХТУ
Обсуждение результатов
Глава IV. Влияние строения органического макроциклического лиганда в медь(II)порфиринах на их реакционную способность в среде кислот. Изучена кинетика и механизм диссоциации Cu5,10DPOEP и CuTrPOEP в смешанном растворителе AcOH – H2SO4, что позволило получить полный ряд кинетической устойчивости октаэтилпорфиринов меди(II) с постепенным (вплоть до исчерпывающего) мезо-фенильным замещением.
IV.1. Кинетика и механизм реакций медь(II)порфиринов в смешанных растворителях AcOH – H2SO4.
Cu5,10DPOEP и CuTrPOEP диссоциируют в AcOH – 0.00015 ÷ 0.005 M H2SO4 с выделением двукратно протонированного порфирина (рис. 1) в соответствии с суммарным уравнением (1).
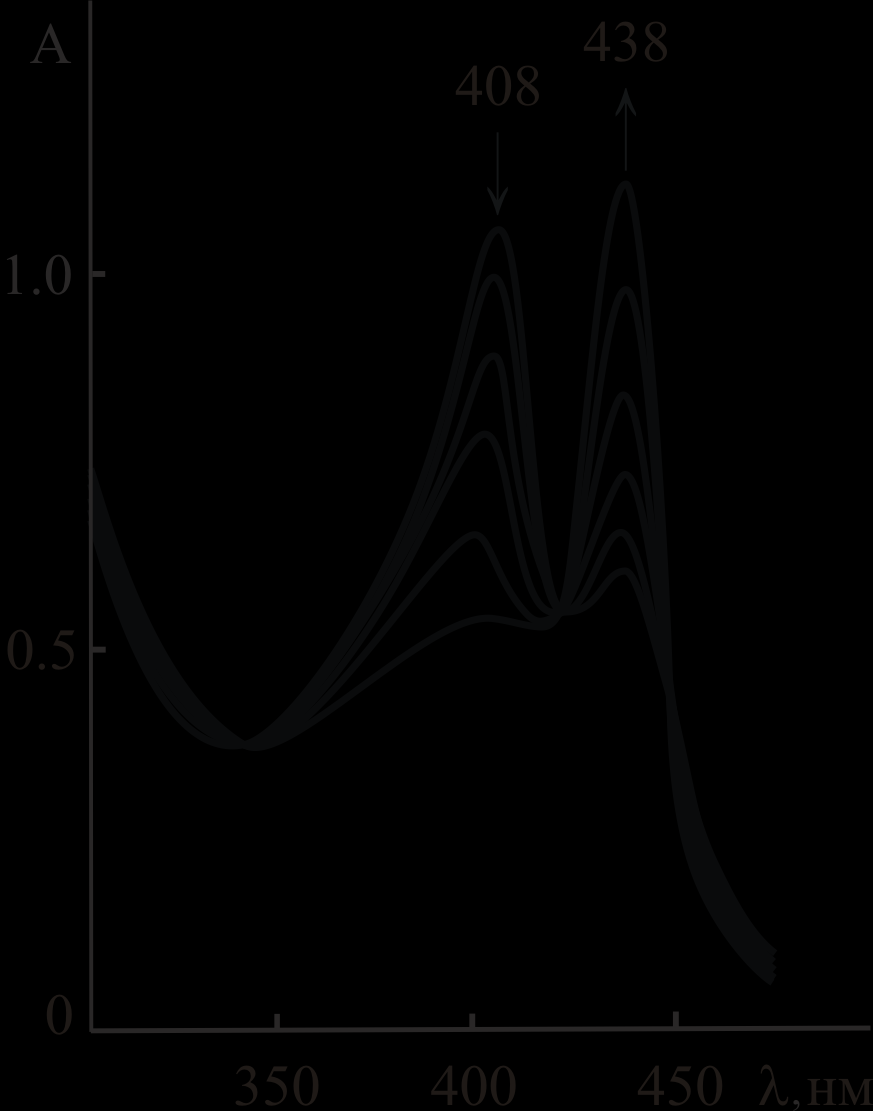 | CuP + 4H+ H4P2+ + Cu2+ (1) В диссертации показано, что реакция (1) имеет первый порядок по концентрации CuP. Скорость реакции тем больше, чем больше добавка серной кислоты (рис. 2), порядок по 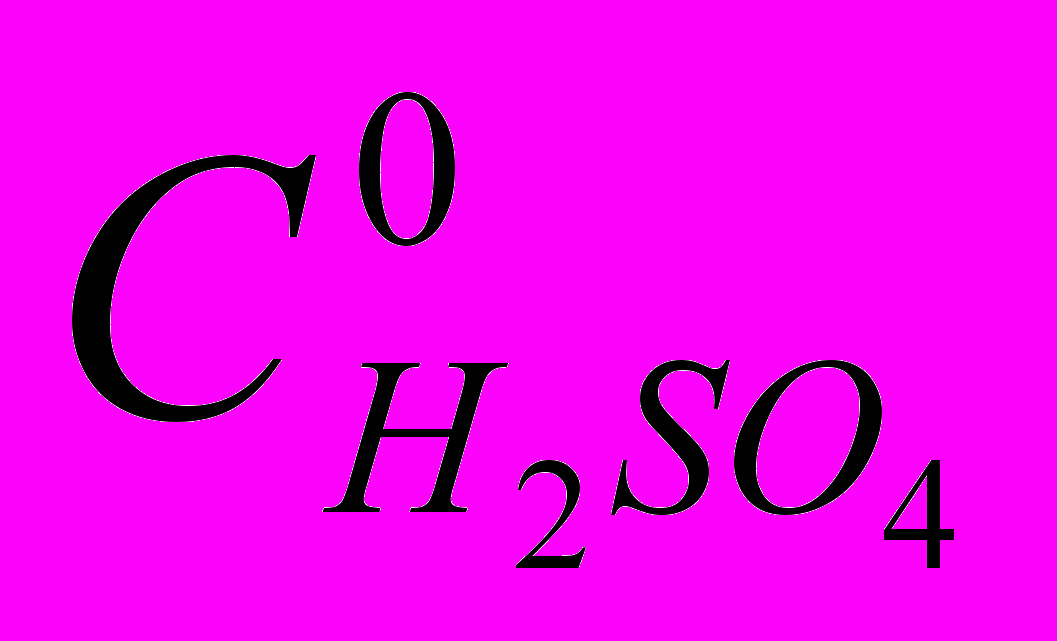 близок к 2. близок к 2. Кинетическое уравнение для реакции (1) имеет вид: 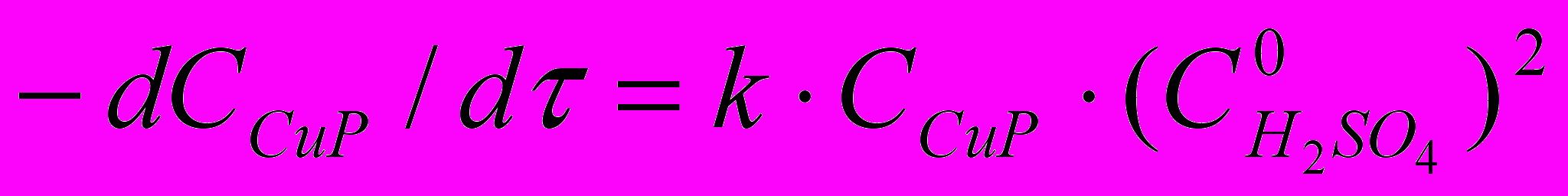 (2) (2)Константы скорости и параметры активации реакции представлены в табл. 1. |
| Рис. 1. Изменение электронного спектра поглощения (ЭСП) Cu5,10DPOEP в AcOH–0.004 M H2SO4 при 293 K |
Таблица 1. Кинетические параметры диссоциации Cu5,10DPOEP и CuTrPOEP в смешанном растворителе AcOH – H2SO4.
| Комплекс | 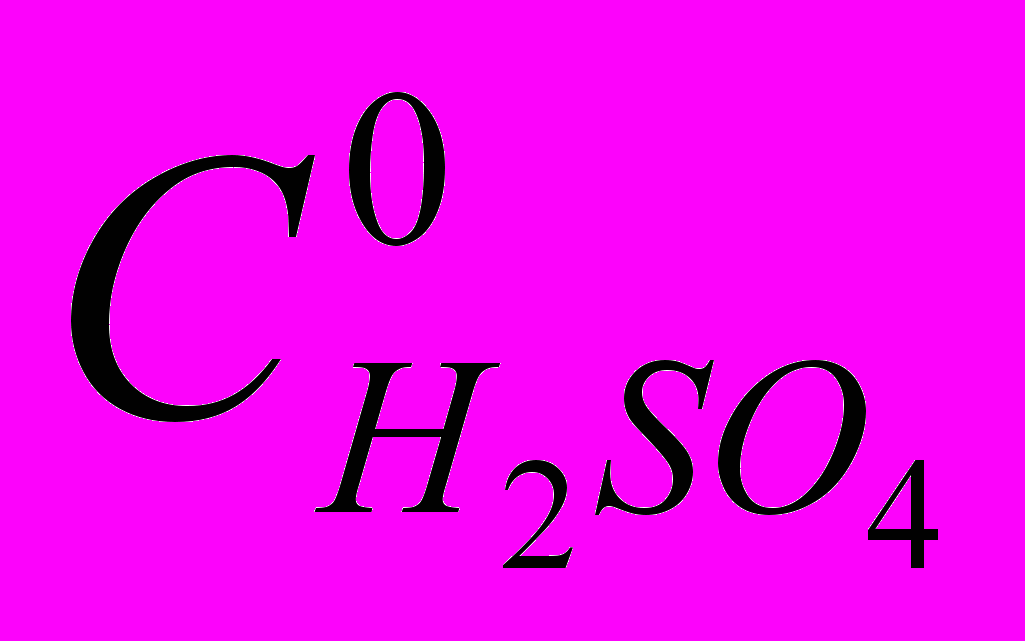 , моль/л , моль/л | T, K | k, с-1∙моль-1∙л | E, кДж/моль | S, Дж/моль.K |
Cu5,10DPOEP | 0.0020.005 | 308 | 120 3 | | |
| | | 298 | 77 3 | 33 1 | -105 3 |
| | | 288 | 49 2 | | |
CuTrPOEP | 0.00015 | 298 | (74 3).103 | | |
| | 0.00041 | 293 | (52 3).103 | 52 2 | 14 6 |
| | | 288 | (36 3).103 | | |
 |  |
| а | б |
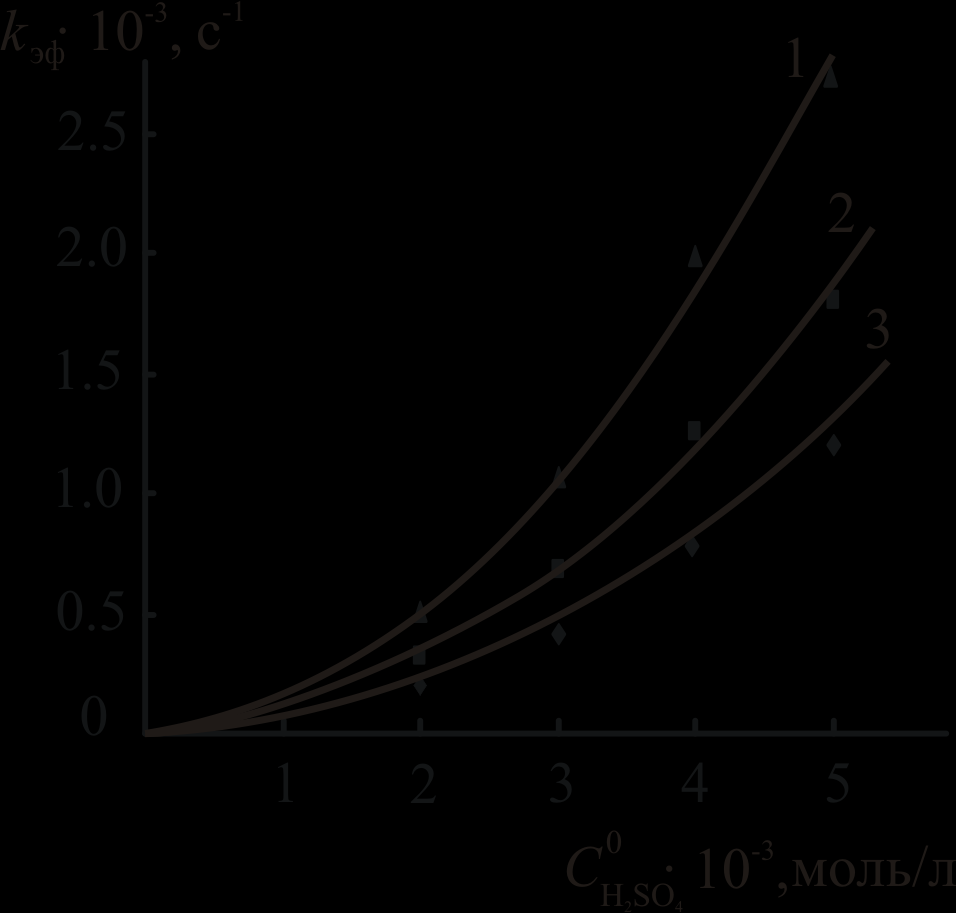
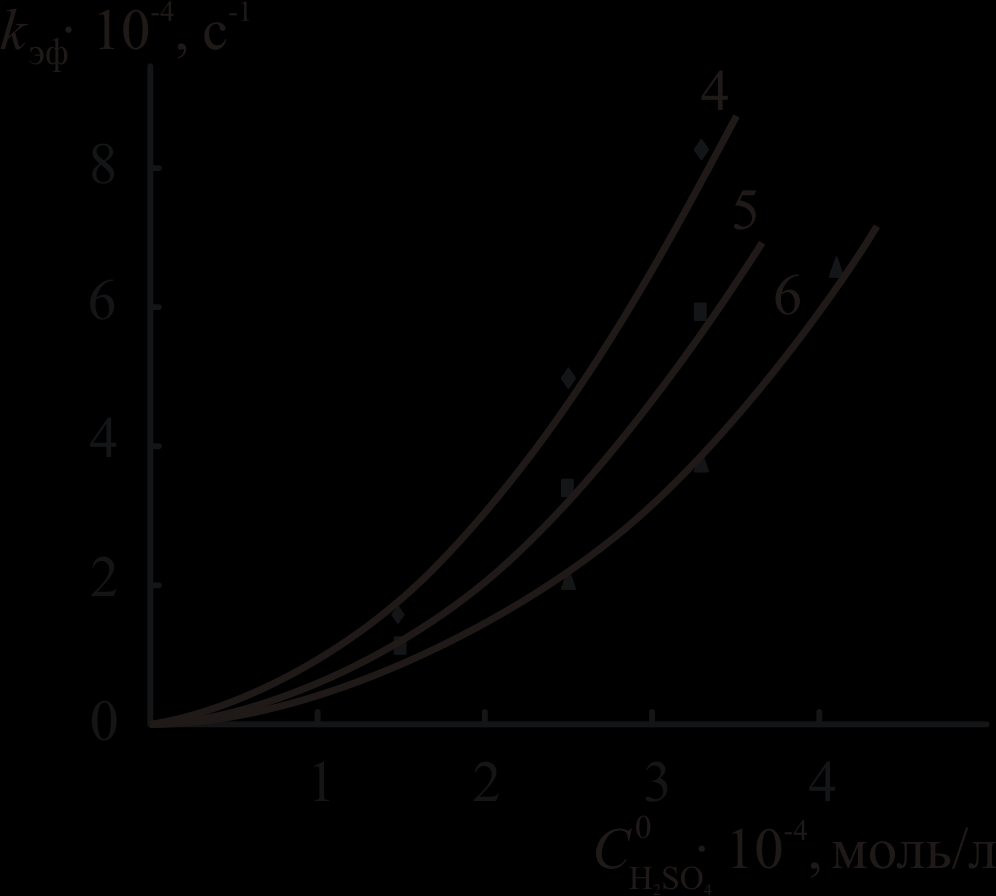
Рис. 2. Зависимость kэф -
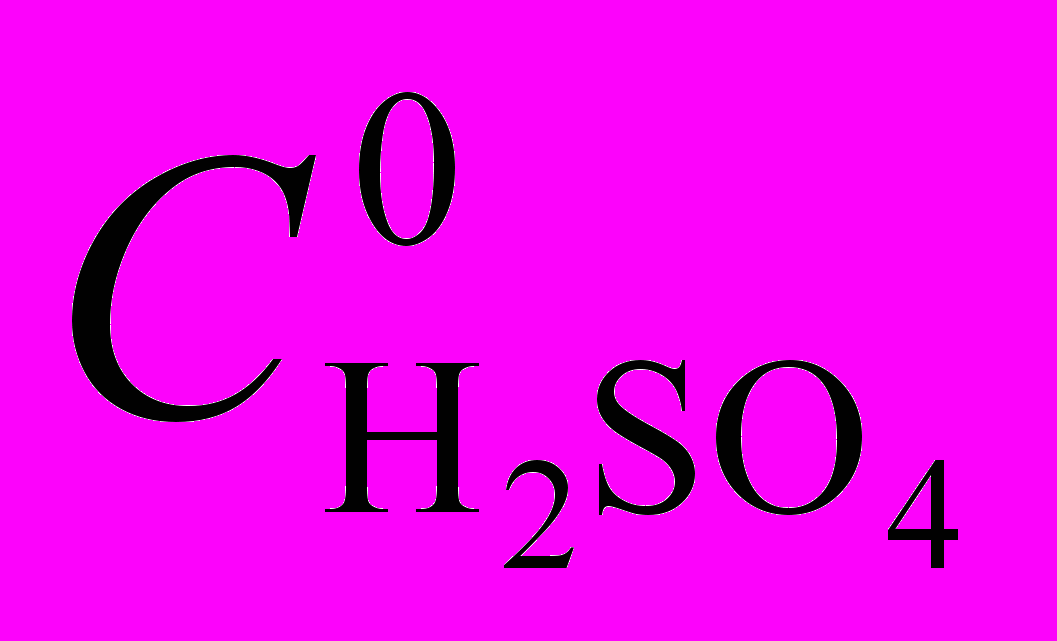 для комплексов Cu5,10DPOEP (а) и CuTrPOEP (б).
для комплексов Cu5,10DPOEP (а) и CuTrPOEP (б).T, K: 308 (1), 298 (2, 4), 293 (5), 288 (3, 6). R2 > 0.995.
Вывод кинетического уравнения с учетом элементарных реакций (3-6), сделанный в диссертации, приводит к уравнению, идентичному экспериментальному уравнению (2) и равенству:

 | (3) |
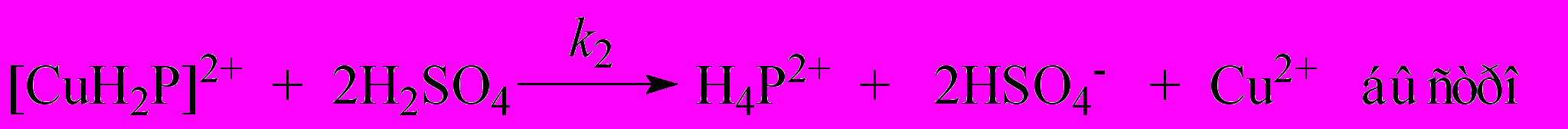 | (4) |
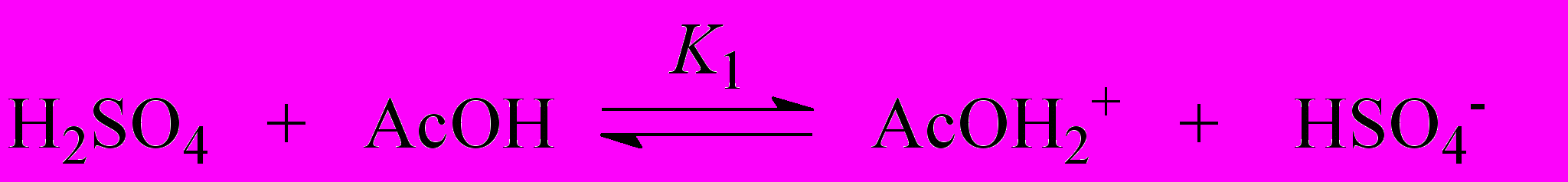 | (5) |
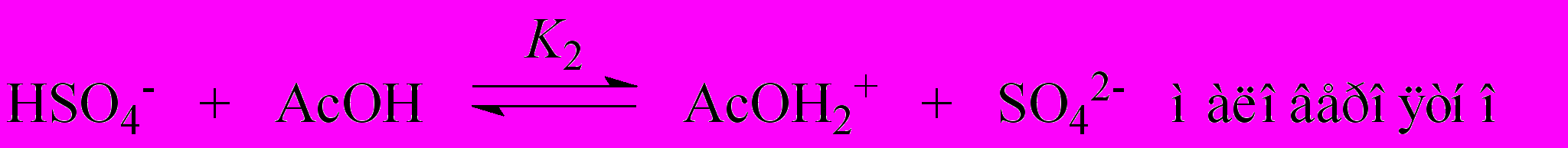 | (6) |
IV.2. Взаимосвязь устойчивости медь(II)порфиринов со строением.
С использованием данных по кинетике диссоциации органических комплексов Cu5,10DPOEP и CuTrPOEP получен полный ряд кинетической устойчивости медь(II)октаэтилпорфиринов с постепенным (вплоть до полного) фенильным замещением по мезо-положениям, соответствующий ряду возрастания k298:
CuOEP* > CuMPOEP* > Cu5,15DPOEP* > Cu5,10DPOEP > CuTrPOEP > CuTetPOEP* (7)
В диссертации показано, что понижение кинетической устойчивости комплексов обусловлено электроноакцепторным (- I-эффект) действием мезо-фенильных заместителей по отношению к макроциклу. Изменения энергии активации, в целом, согласуются с этим положением.
____________________
* литературные данные
Показана также роль стерического искажения макроцикла при замещении, выражающаяся в отсутствии проявления - C-эффекта от мезо-замещения в изменении обратных дативных -взаимодействий в медь(II)порфиринах.
Глава V. Кислотно – основные и окислительно – восстановительные свойства палладий(II)порфиринов в среде сильных кислот.
Изучено состояние и реакции PdOEP и его мезо-фенилзамещенных PdMPOEP, Pd5,15DPOEP и PdTetPOEP в смешанном растворителе AcOH – H2SO4 и в концентрированной водной серной кислоте.
V.1 Состояние и реакции палладиевых производных октаэтилпорфина и его мезо-фенилзамещенных в смешанных растворителях
AcOH – H2SO4.
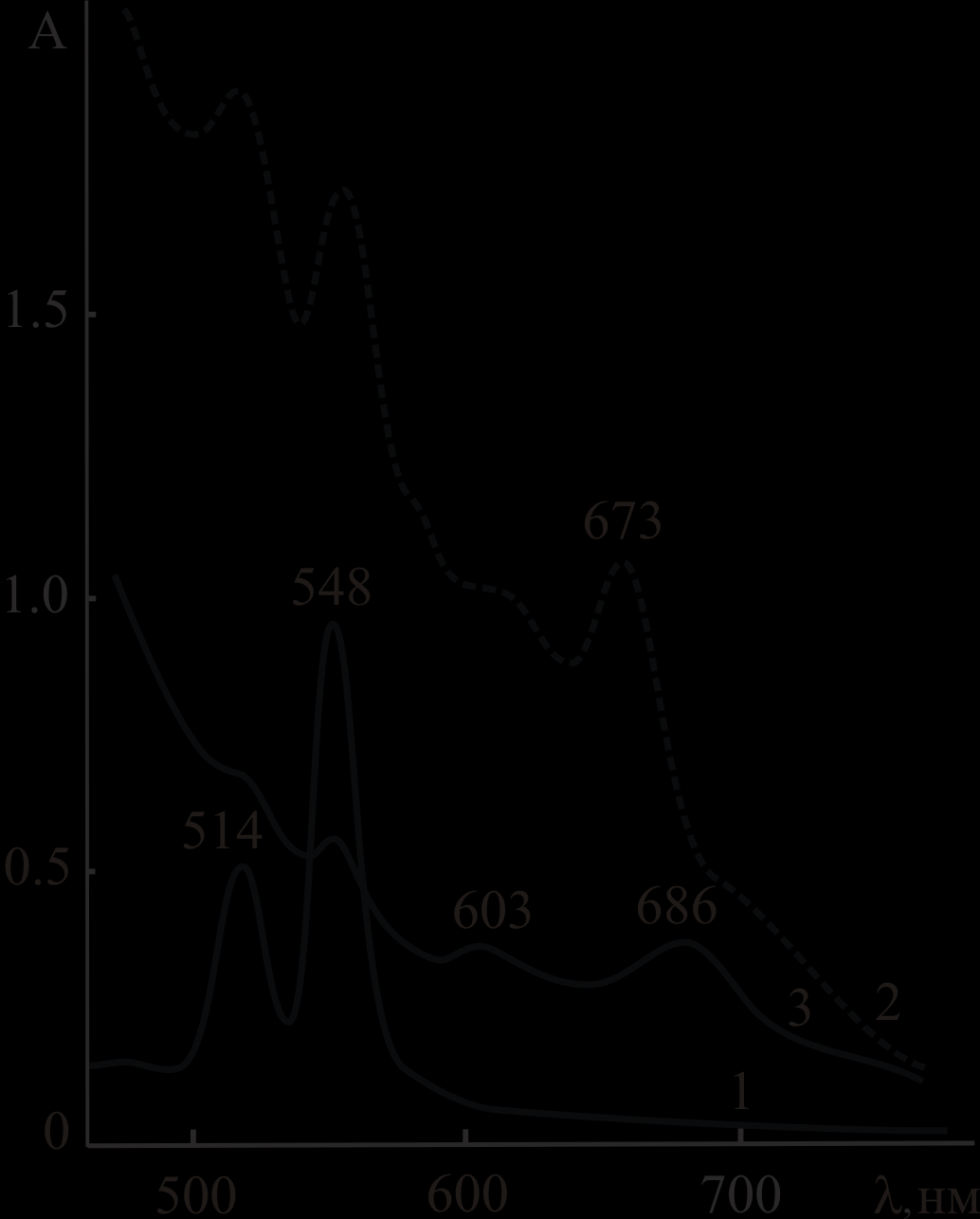
Анализ ЭСП реакционных смесей и продуктов реакций показал, что в среде AcOH – 0.1 ÷ 8.0 моль/л H2SO4 при 298 ÷ 363 K комплексы палладия(II) подвергаются одноэлектронному окислению по ароматическому макроциклу с образованием соответствующих π-катион-радикальных форм (рис.3, линия 2).
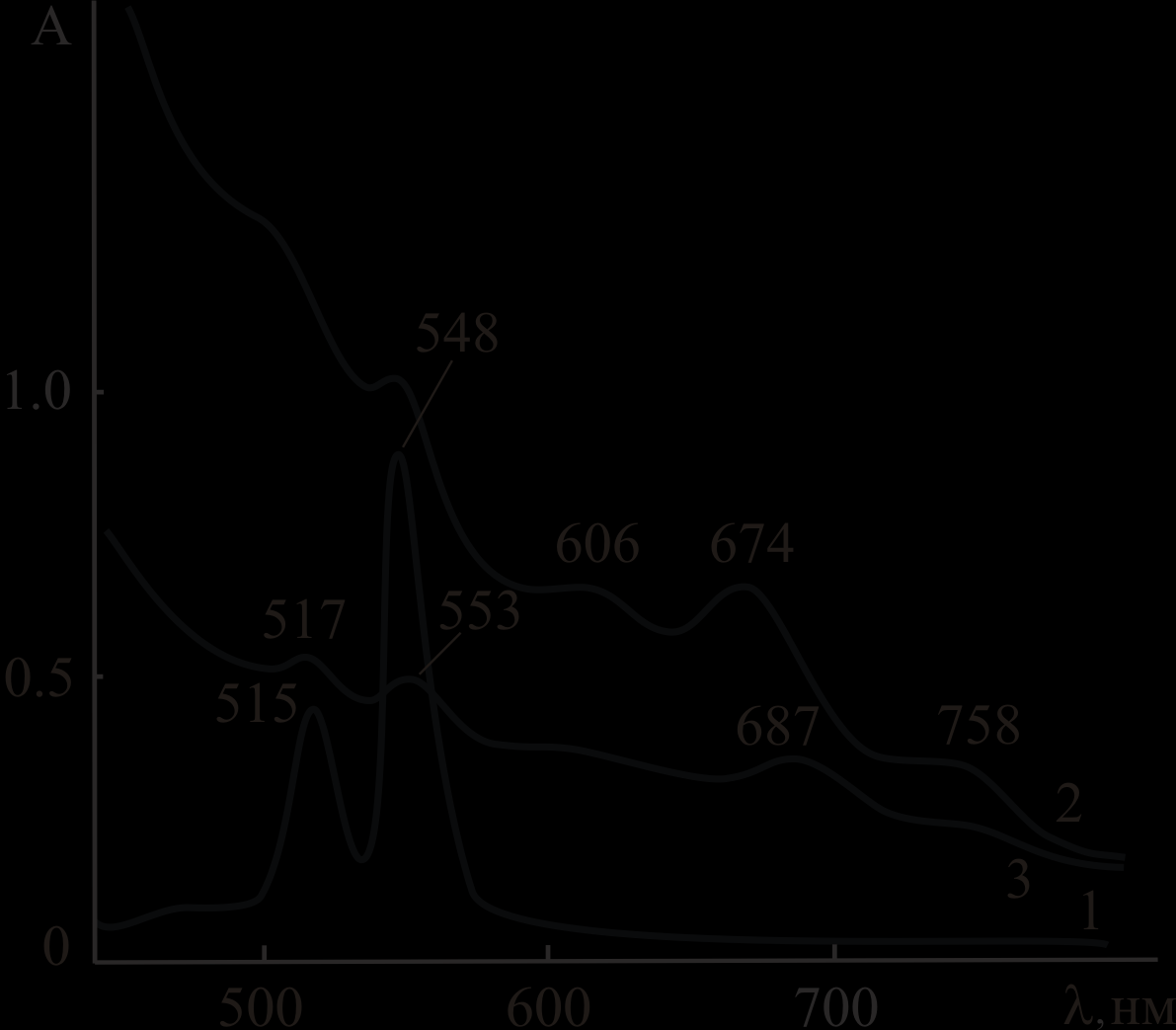 |  |
| а | б |
| Рис.3. ЭСП PdMPOEP (а) и Pd5,15DPOEP (б) в CHCl3 (1); PdMPOEP (а) и Pd5,15DPOEP (б) после окончания реакции в смесях AcOH – H2SO4 (2); продуктов реакции PdMPOEP (а) и Pd5,15DPOEP (б) с кислотой после переосаждения – в CHCl3е (3). 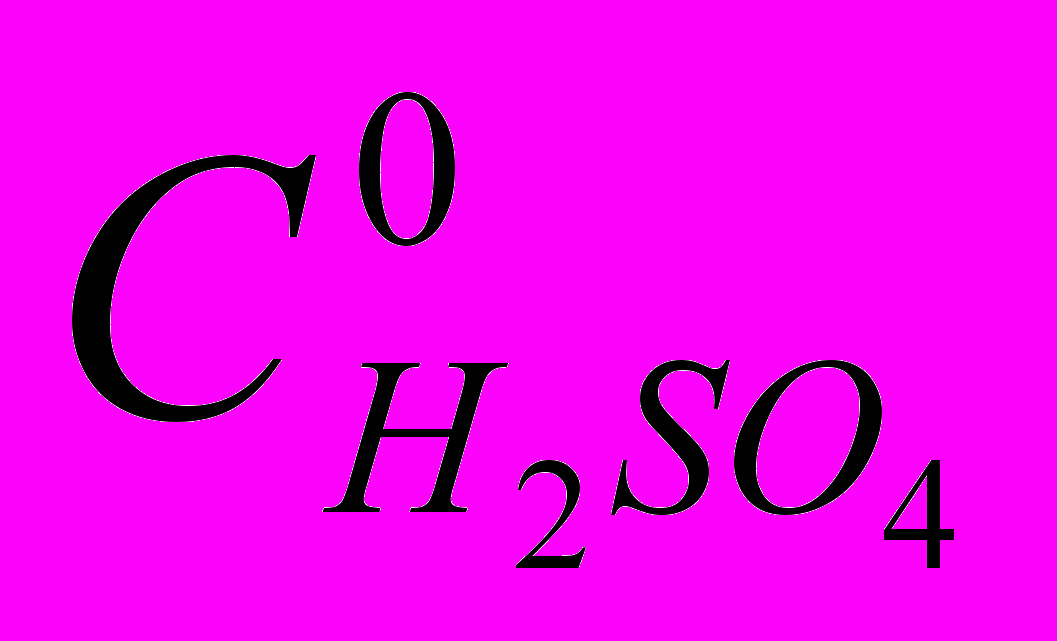 = 4.5 моль/л (а) и = 4.5 моль/л (а) и 4.1 моль/л (б). Т, К: 358 (а), 343 (б). | |
С учетом известных окислительных свойств аэрированной H2SO4 реакция окисления записана в виде:
PdP + О2 + Н+ PdP+• + НО2• (8)
| Окисленные формы комплексов экстрагированы в неизменном виде в CHCI3 после переосаждения из смешанного растворителя на лед, что свидетельствует об их устойчивости (рис.3, линия 3). Для PdOEP, PdMPOEP и Pd5,15DPOEP получены кинетические характеристики процессов окисления, приведенные в диссертации, и установлены первый порядок по PdP и порядок по 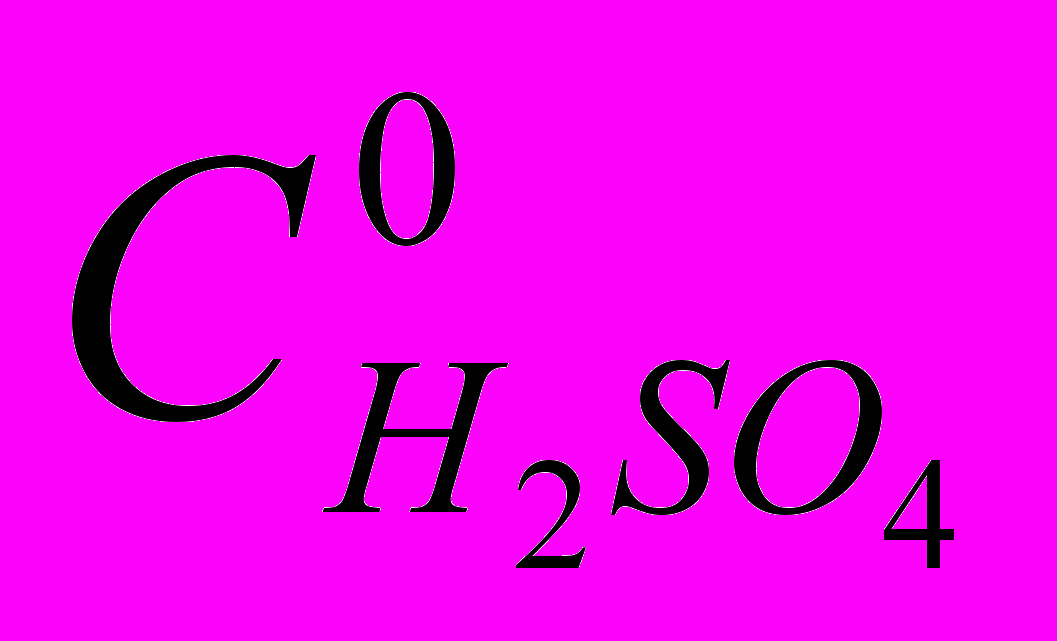 , равный 2 для PdOEP, PdMPOEP (рис. 4) и 1 для Pd5,15DPOEP. Обнаружена и , равный 2 для PdOEP, PdMPOEP (рис. 4) и 1 для Pd5,15DPOEP. Обнаружена и | 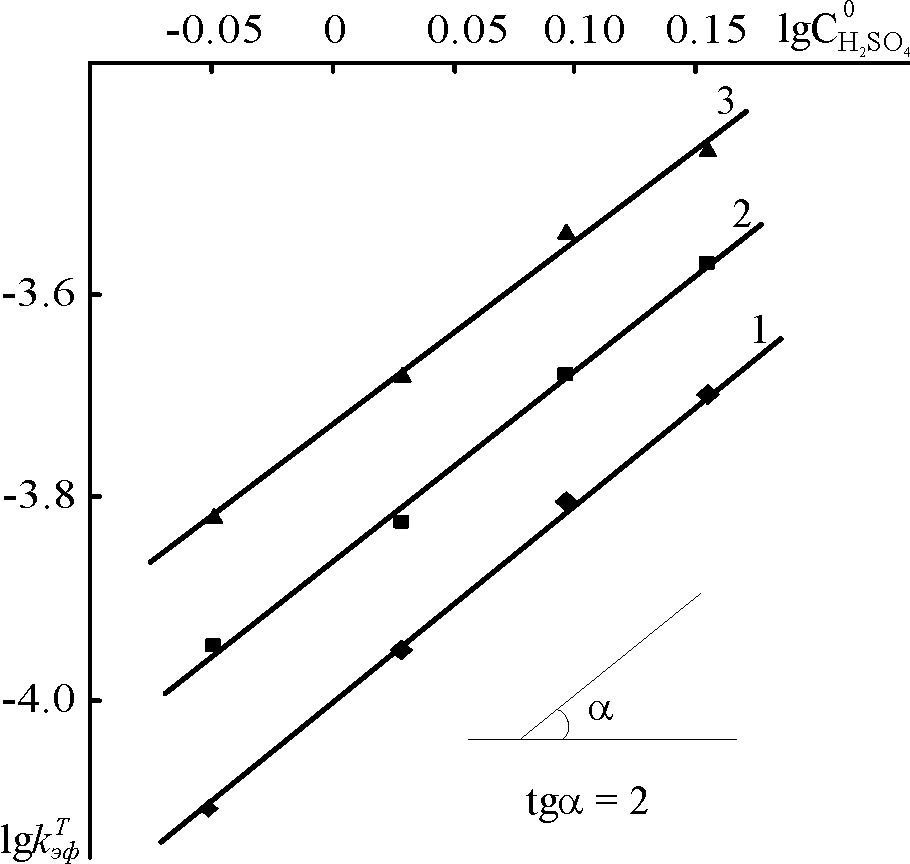 |
| Рис. 4. Зависимость 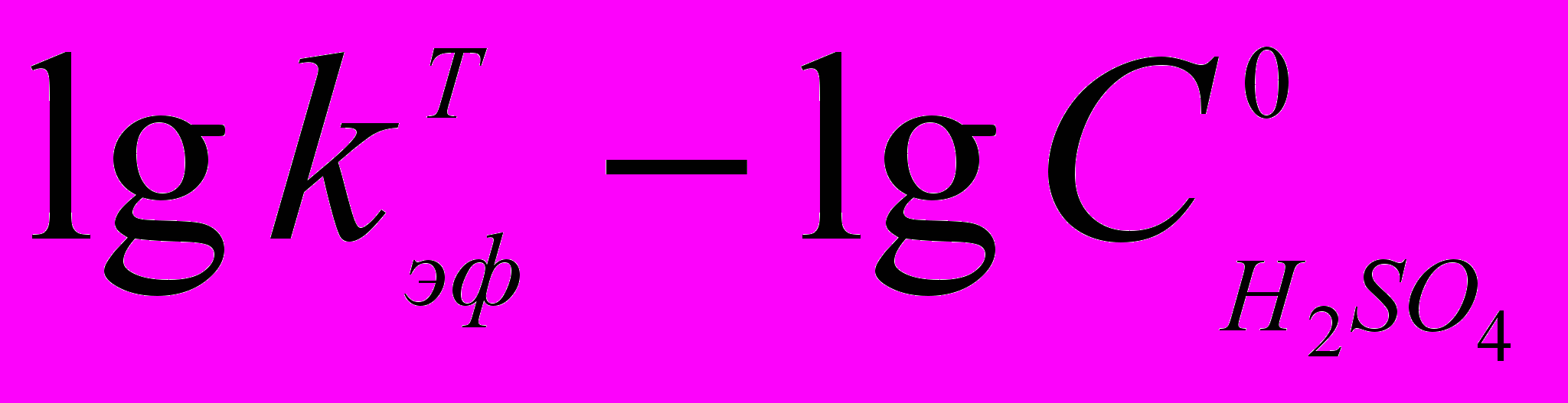 для реакции PdOEP в AcOH – H2SO4. T, K: 353 (1), 358 (2), 363 (3). |
объяснена линейная корреляция
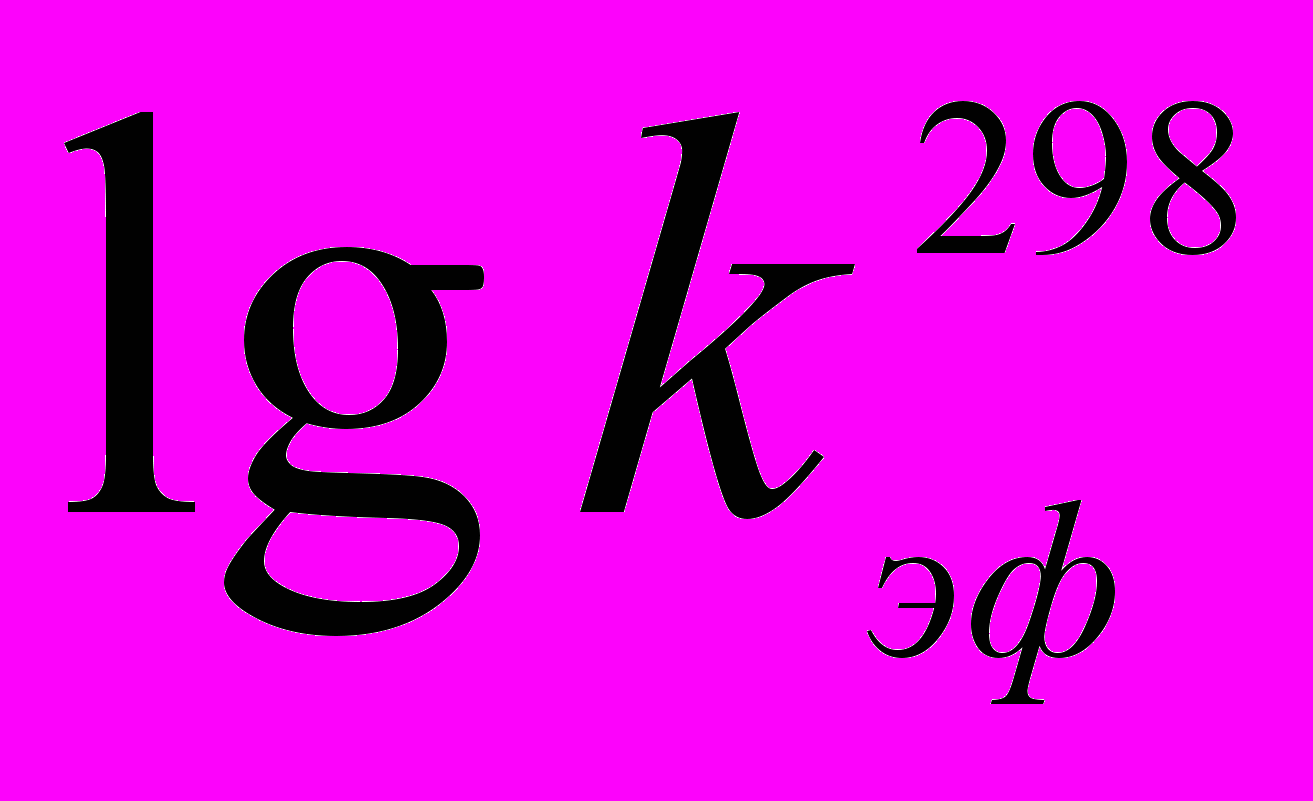 с величиной функции кислотности H0 смешанного растворителя с различным тангенсом угла наклона прямых для разных комплексов.
с величиной функции кислотности H0 смешанного растворителя с различным тангенсом угла наклона прямых для разных комплексов.По реакционной способности при окислении PdP располагаются в ряд (9), вероятно соответствующий росту окислительных потенциалов комплексов. Вывод сделан на базе известных редокс-потенциалов порфириновых лигандов и подтверждает природу химической реакции PdP с кислотой в среде AcOH – H2SO4.
PdTetPOEP > PdOEP > Pd5,15DPOEP > PdMPOEP (9)
Место PdTetPOEP в ряду (9) определено качественно по спектру его свежеприготовленного раствора, принадлежащему π-катион-радикальной форме.
V.2. Состояние палладий(II)порфиринов в концентрированной серной кислоте. Кинетика и механизм реакции окисления аэрированной серной кислотой.
Состояние PdP в концентрированной H2SO4 изучено на примере PdTetPOEP. Комплекс находится в серной кислоте в виде Н-ассоциата, о чем свидетельствует характерный двухполосный ЭСП (рис.5, линия 2). Впервые в химии порфиринов удалось выделить исходный PdTetPOEP при переосаждении его Н-ассоциированной формы из серной кислоты на лед (рис.5, линия 1). При 343–363 К PdTetPOEP, находясь в растворе в виде ассоциата с протоном, подвергается необратимому превращению. Продукт реакции (рис.5, линия 3) представляет собой -катион-радикальную форму исходного PdTetPOEP. Окисленную форму в неизменном виде удалось выделить переосаждением из серной кислоты и экстракцией в CHCI3 (рис.5 , линия 4).
По этим данным записана суммарная реакция (10).
PdP…H+…R + О2 + Н+ PdP+• + НО2•+ R (10)
Кинетика реакции (10) изучена в политермических условиях в зависимости от
 в воде. Найден первый порядок по концентрации PdP и второй порядок по равновесной концентрации H2SO4 в её смесях с водой (рис. 6):
в воде. Найден первый порядок по концентрации PdP и второй порядок по равновесной концентрации H2SO4 в её смесях с водой (рис. 6):–dCPdP/d = k . [PdP] . [H2SO4]2 (11)
 | 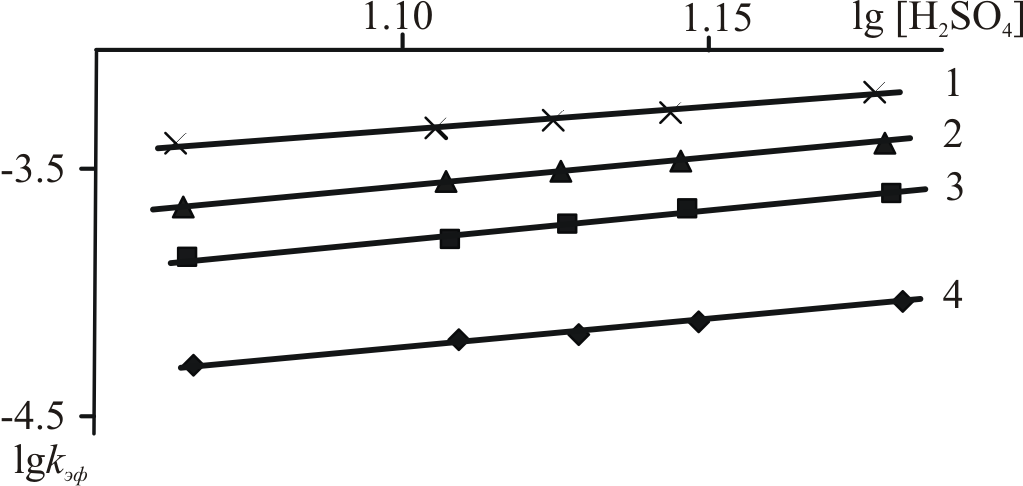 |
| Рис. 5. ЭСП PdTetPOEP в CHCl3 (1); в конц. H2SO4 при 298 K (2); в конц. H2SO4 при 343 – 363 K (3) и продукта реакции с H2SO4, переосажденного из кислоты, в CHCl3 (4). | Рис. 6. Зависимость lgkэф от lg[H2SO4] для PdTetPOEP в H2SO4. T, K: 1 – 363, 2 – 358, 3 – 353, 4 – 343. |
Значения кинетических параметров реакции приведены в таблице 2.
Предполагаемая схема превращений и вывод уравнения скорости представлены в диссертации. Кинетически значимыми являются лимитирующая стадия одноэлектронного окисления металлопорфирина координированным молекулярным кислородом при содействии H+solv и равновесие неполного протонирования макроциклического комплекса. Обосновывается вывод о том, что устойчивость PdTetPOEP к окислению (по сравнению с PdTPP) определяется повышением электронной плотности в макроцикле при -этильном замещении и более слабым удерживанием координированного O2, через который происходит передача электрона с макроцикла на пергидроксил-радикал.
Таблица 2. Константы скорости (k) параметры активации (Е, ΔS) реакции PdTetPOEP с концентрированной H2SO4.
| Т, К | k·106, моль–2л2 с–1 | Е, кДж/моль | –ΔS, Дж/(моль.K) |
| 343 | 0.39 ± 0.01 | | |
| 353 | 1.05 ± 0.03 | | |
| 358 | 1.74 ± 0.03 | 104 ± 3 | 70 ± 10 |
| 363 | 2.87 ± 0.04 | | |
| 298а | 1.83 . 10–3 | | |
Примечание: а найдено экстраполяцией зависимости lgk – 1/T.
Глава VI. Каталитические свойства порфириновых комплексов меди(II) и палладия(II) на примере реакции диспропорционирования пероксида водорода. Порфириновые модели природных каталаз.
В главе изложены результаты исследования каталитических свойств комплексов меди и палладия в реакции разложения пероксида водорода в системе ДМФА – КОН – Н2О. Установлено, что каталитическая активность CuP и PdP определяется способностью катиона металла в составе органического комплекса координировать пероксид водорода в виде H2O2 или HO2- и легкостью образования устойчивых -катион-радикальных форм катализатора.
VI.1. Кинетика и механизм диспропорционирования пероксида водорода в присутствии медь(II)порфиринов с различной природой замещения в ароматическом макроцикле.
Среди комплексов меди(II) (стр.5) Cu5,10DPOEP и CuTPP наиболее существенно понижают энергию активации и повышают скорость реакции разложения пероксида водорода (табл. 3). Каталитическая реакция имеет нулевой порядок по О2, первый – по КОН и Н2О2 и может протекать в гомогенных и гетерогенных условиях в зависимости от природы катализатора. Из анализа кинетики процесса и данных по спектральным свойствам растворов смесей катализатора с KOH или H2O2, КОН + Н2О2 обоснован стехиометрический ион-молекулярный механизм реакции (схема 1).
Таблица 3. Скорость разложения H2O2 в присутствии медь(II)порфиринов при 298 K,
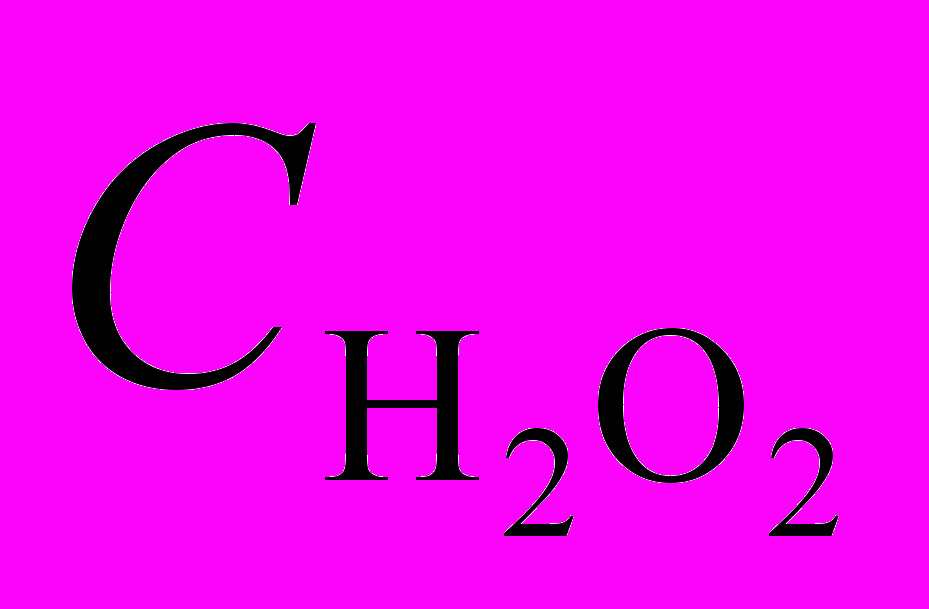 = 3.98 моль/л и CKOH = 0.018 моль/л и параметры активации E и S.
= 3.98 моль/л и CKOH = 0.018 моль/л и параметры активации E и S. Комплекс | Скат..105, моль/л | W а, мл О2/мин. | A, с-1 | E, кДж/моль |
| Без катализатора | | 0.018 ± 0.004 | | 72 ± 4 |
| CuCl2 | 8.80 | 0.11 ± 0.02 | 0.07 ± 0.01 | 52 7 |
| CuOEP | 3.80 | 0.19 ± 0.04 | 0.30 ± 0.06 | 39 3 |
| CuD5,10POEP | 1.08 | 0.66 ± 0.08 | 3.8 ± 0.4 | 17 2 |
| CuTrPOEP | 1.24 | 0.062 ± 0.008 | 0.29 ± 0.04 | 54 2 |
| CuTPOEP | 2.39 | 0.18 ± 0.03 | 0.45 ± 0.07 | 39 5 |
| CuTPP | 1.40 | 0.48 ± 0.07 | 2.0 ± 0.3 | 27 3 |
Примечание: а найдены методом экстрополяции зависимости W - 1/T.
 | Механизм включает координацию Н2О2 органическим комплексом, разложение координированной Н2О2 с её двухэлектронным окислением, кислотно-основное равновесие пероксида и восстановление катализатора при взаимодействии со второй молекулой пероксида (в виде HO2-). |
| Схема 1. Схема элементарных реакций в системе CuP – H2O2 – KOH в водно-органической среде. |
Обсуждается аналогия изученного каталитического процесса с функционированием природной каталазы и возможность использования его в качестве модели.
VI.2. Кинетика и механизм диспропорционирования пероксида водорода в присутствии палладий(II)порфиринов. Влияние строения органической части молекул и природы ее связей с катионом палладия.
Среди изученных комплексов палладия (стр. 5) наиболее каталитически активным в реакции разложения Н2О2 является PdOEP. Для остальных PdP активность изменяется в ряду (12).

(12)
Каталитическая реакция характеризуется нулевым порядком по кислороду и по катализатору и первым порядком по KOH. Порядок по пероксиду - первый или второй в зависимости от интервала концентраций пероксида (рис. 7). В диссертации обоснован ион-молекулярный механизм реакции разложения Н2О2,
 | включающий равновесную кислотно-основную и равновесную и неравновесную редокс реакции. В отличие от реакции при низких 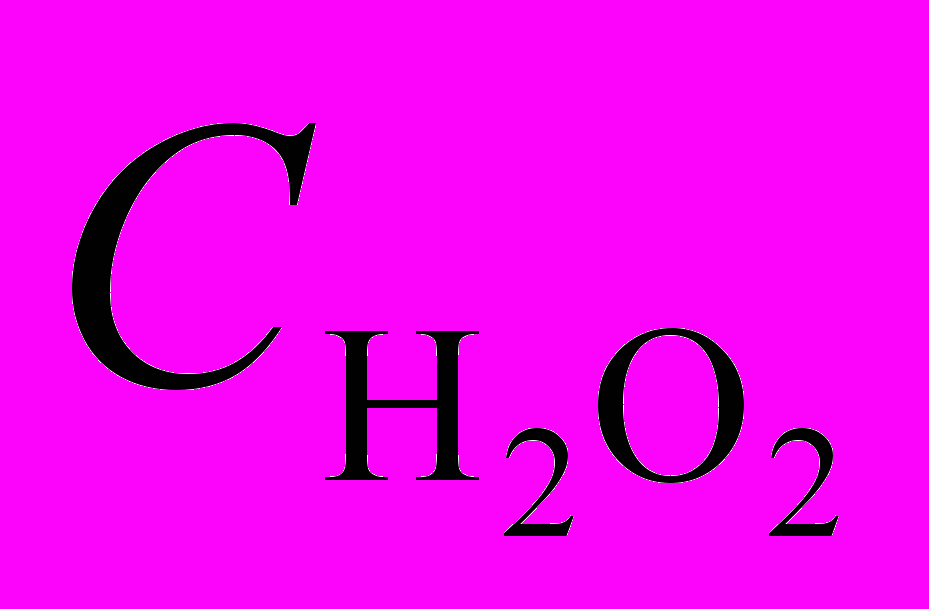 , при высоких , при высоких 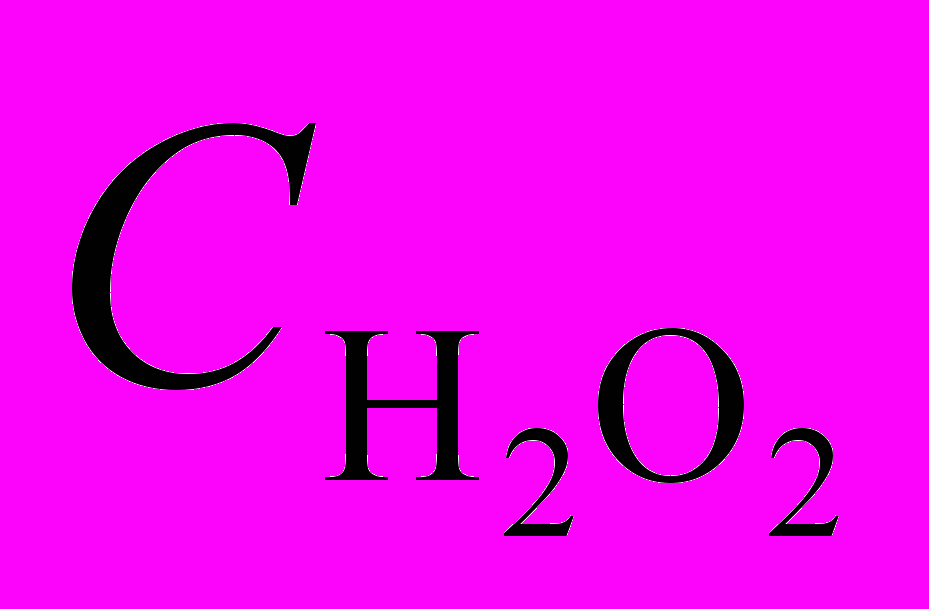 координация второй молекулы пероксида (в виде HO2-) происходит в равновесном процессе, и лишь затем продукт медленно разрушается с восстановлением PdP и окислением HO2-. координация второй молекулы пероксида (в виде HO2-) происходит в равновесном процессе, и лишь затем продукт медленно разрушается с восстановлением PdP и окислением HO2-. |
| Рис. 7. Зависимость логарифма скорости разложения H2O2 от логарифма ее концентрации в присутствии Pd5,10DPOEP. Ckt =2.90.10-5 моль/л. СKOH = 0.018 моль/л. T = 343 K. |
Для первого интервала
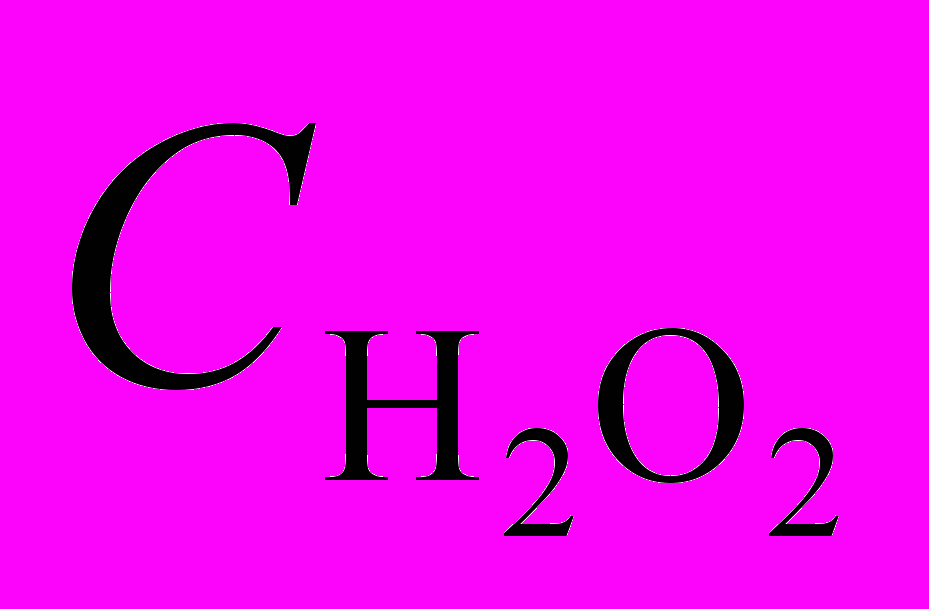 удалось решить кинетическое уравнение относительно константы скорости лимитирующей стадии и константы кислотно-основного равновесия H2O2, из которого следует хорошее согласие рассчитанной и экспериментальной констант скорости.
удалось решить кинетическое уравнение относительно константы скорости лимитирующей стадии и константы кислотно-основного равновесия H2O2, из которого следует хорошее согласие рассчитанной и экспериментальной констант скорости. ВЫВОДЫ
- Совместное исследование кинетической устойчивости металлопорфиринов и кинетики катализируемых ими редокс-реакций (на примере разложения Н2О2) в зависимости от вариаций в структуре органического комплекса позволяет обосновать механизмы и на их основе объяснить каталитический эффект металлопорфиринов. Среди изученных органических производных меди(II) и палладия(II) наилучшими каталитическими свойствами в отношении реакции разложения Н2О2 обладают CuTPP, Cu5,10DPOEP и PdOEP.
- В смешанных растворителях AcOH - H2SO4 медь(II)октаэтил-порфирины с частичным мезо-фенильным замещением диссоциируют в соответствии с кинетическим уравнением третьего порядка, включающим концентрацию H2SO4 во второй степени. Положение в ряду устойчивости органических комплексов с октаэтилпорфином с постепенным мезо-фенильным замещением (вплоть до исчерпывающего) определяется -I-эффектом фенильных заместителей. Из-за нарастающего искажения макроцикла и специфики электронной конфигурации CuII 3d9 вклад дативных -связей в устойчивость отсутствует.
- Аналогичные комплексы PdII в среде AcOH - H2SO4 подвергаются без разрушения связей Pd-Nмедленному одноэлектронному окислению по ароматической части молекулы молекулярным кислородом в среде сильной кислоты с первым порядком по PdP и переменным – по кислоте. Высокая устойчивость -катион-радикальной формы комплексов имеет важное значение для катализа на PdP. В водной концентрированной H2SO4 PdTetPOEP вступает в реакцию окисления в форме Н-ассоциата. Кинетически значимыми являются лимитирующая стадия одноэлектронного окисления PdTetPOEP молекулярным кислородом при содействии H+solv и равновесие образования Н-ассоциата.
4. Медь(II)тетрафенилпорфин, медные и палладиевые производные октаэтилпорфина и его мезо-фенилзамещенных с различным количеством фенилов катализируют реакцию разложения Н2О2 в гомогенной или гетерогенной среде, повышая скорость реакции (до 36 раз) и понижая энергию активации по сравнению с некаталитическим процессом. Наиболее активны среди комплексов Cu гомогенные катализаторы CuTPP и Cu5,10DPOEP, проявляющие умеренную устойчивость по связям металл-органический лиганд, среди комплексов Pd – PdOEP, имеющий высокую реакционную способность при окислении до -катион-радикала аэрированной серной кислотой.
5. По спектральным и кинетическим данным механизм катализируемых медь(II)порфиринами реакций – ион-молекулярный, включающий координацию Н2О2 органическим комплексом, разложение координированной Н2О2 с её двухэлектронным окислением, равновесие кислотной ионизации пероксида и восстановление катализатора при взаимодействии со второй молекулой пероксида (в виде HO2-). Признаки ион-радикального механизма отсутствуют.
6. Механизм гетерогенного катализа разложения Н2О2 палладийпорфиринами изменяется при изменении концентрации Н2О2. Реакция имеет первый и второй порядки по Н2О2 при

 = 0.93.6 и 3.67.2 моль/л соответственно. Вторая молекула пероксида координируется медленно и необратимо и быстро до состояния равновесия соответственно при низких и высоких
= 0.93.6 и 3.67.2 моль/л соответственно. Вторая молекула пероксида координируется медленно и необратимо и быстро до состояния равновесия соответственно при низких и высоких  .
.7. Ион-молекулярная природа катализа разложения Н2О2 изученными металлопорфиринами, участие в каталитическом процессе двух молекул пероксида (в виде Н2О2 и НО2-) и активирование пероксида путем координации на металле в органическом комплексе означает возможность использования замещенных медь(II) и палладий(II)порфиринов в качестве простых синтетических моделей природной каталазы. При этом варьирование заместителей в органической части катализатора и металла можно использовать как способ регулирования каталитической активности.
Основное содержание работы изложено в следующих публикациях:
- Тимофеева (Косарева) О. В. Каталазная активность комплексов меди(II) с тетрафенил- и октаэтилпорфиринами // Вестник молодых ученых ИвГУ. Иваново: ИвГУ, 2002. Вып. 2. С. 32 – 34.
- Клюева М. Е., Косарева О. В., Ломова Т. Н., Суслова Е. Е. Структура и кинетическая устойчивость комплексов меди(II) с мезо- фенилпроизводными октаэтилпорфина // Институт химии растворов РАН, Иваново. Рукопись деп. в ВИНИТИ. 13.02.04. N. 251 – B2004, 15 С.
- Ломова Т. Н., Клюев М. В., Клюева М. Е., Киселева Е. Н., Косарева О. В. Высокозамещенные порфирины в бионеорганической химии // Российский химический журнал (Ж. Рос. хим. об-ва им. Д. И. Менделеева), 2004. Т. XLVIII. № 4. С. 35 – 51.
- Косарева О. В., Клюева М. Е., Ломова Т. Н., Суслова Е. Е. Влияние строения органической части молекул медь(II) порфиринов на их реакционную способность по отношению к кислотам // Журн. общ. химии, 2005. Т. 75. № 3. С. 497-503.
- Ломова Т. Н., Клюева М. Е., Клюев М. В., Косарева О. В. Порфириновые модели природных каталаз //Изв. АН. Серия химическая, 2007. № 4. С. 719 - 724.
- Klyueva M. E., Kosareva O. V., Kiseleva E. N., Klyuev M. V., Lomova T. N. Structure – reactivity relationship for copper(II) and manganese(III) meso- phenylsubstituted octaalkylporphyrins // J. Porphyrins Phthalocyanines, 2004. V. 8. N. 6. P. 728.
- Klyueva M. E., Kosareva O. V., Lomova T. N., Klyuev M. V. Metalloporphyrin models of catalases // J. Porphyrins Phthalocyanines, 2006. V. 10. N. 4. 5&6. P. 714.
- Тимофеева (Косарева) О. В. Исследование каталазной активности комплексов тетрафенилпорфина с медью и марганцем. / Тез. докл. Всерос.. науч. конф. «Актуальные проблемы современного естествознания». Иваново, 2002. С. 28.
- Косарева О. В., Клюева М. Е., Ломова Т. Н. Синтез и исследование несимметричных мезо- фенилзамещенных октаэтилпорфиринов меди // Тез. докл. V школы – конференции молодых ученых стран СНГ по химии порфиринов и родственных соединений. СПб, 2002. С. 57 – 58.
- Клюева М. Е., Косарева О. В., Киселева Е. Н. Реакционная способность комплексов монофениоктаметилпорфина // Тез. XXI Междунар. Чугаевской конф. по координационной химии. Киев, 2003. С. 272 - 273.
- Косарева О. В., Ломова Т. Н., Клюева М. Е., Клюев М. В. Каталитические свойства мезо-фенилзамещенных октаалкилпорфиринов меди(II) // Труды IX Междунар. конф. по химии порфиринов и их аналогов. Иваново, 2003.
С. 107 – 108.
- Клюева М. Е., Киселева Е. Н., Косарева О. В., Ломова Т. Н., Клюев М. В. Реакции пероксида водорода с металлопорфиринами // Тез. XI Междунар. конф. по химии органических и элементоорганических пероксидов. Москва, 2003. С. 281 - 283.
- Киселева Е. Н., Косарева О. В., Клюева М. Е., Ломова Т. Н. Комплексы полифункциональных замещенных порфиринов с медью и марганцем // Тез. IX Междунар. конф. «Проблемы сольватации и комплексообразования в растворах». Иваново, 2004. С. 278.
- Суслова Е. Е., Клюева М. Е., Косарева О. В., Ломова Т. Н. Эффект ступенчатого мезо-фенилзамещения в реакционной способности медь(II)порфиринов // Тез. докл. XXV научной сессии Российского семинара по химии порфиринов и их аналогов. Иваново, 2004. С. 62 – 63.
- Клюева М. Е., Косарева О. В., Ломова Т. Н. Устойчивость и каталитические свойства новых медь(II)порфиринов // Тез. докл. VI школы – конференции молодых ученых стран СНГ по химии порфиринов и родственных соединений. СПб, 2005. С. 56 - 57.
- Косарева О. В., Клюева М. Е., Ломова Т. Н., Клюев М. В. Механизм диспропорционирования пероксида водорода на органических комплексах переходных металлов // Материалы междунар. конф. по орг. химии «От Бутлерова и Бельштейна до современности». СПб., 2006. С. 602 – 603.
- Киселева Е.Н., Косарева О.В., Клюева М.Е., Ломова Т.Н. Вариации структуры палладий(II)порфирина и их проявления в спектральных свойствах // Тез.докл. XXIX научной сессии Рос. семинара по химии порфиринов и их аналогов «Достижения и перспективы развития координационной химии порфиринов. Итоги 50-летних исследований». Иваново, 2006. С. 60 - 61
- Тюляева Е. Ю., Косарева О.В., Клюева М.Е., Ломова Т.Н. Комплексы палладия с тетрафенил- и тетрафенилоктаэтилпорфином. Состояние и реакции в растворах серной кислоты // Тез.докл. XXIX научной сессии Рос. семинара по химии порфиринов и их аналогов «Достижения и перспективы развития координационной химии порфиринов. Итоги 50-летних исследований». Иваново, 2006. С. 95 - 96.
- Косарева О. В., Ломова Т. Н. , Клюева М. Е. , Клюев М. В. Комплексы меди(II) с мезо-фенилзамещенными октаалкилпорфиринами в реакции разложения пероксида водорода // Тез. докл. Всерос. Науч. Конф. «Природные макроциклические соединения и их синтетические аналоги», Сыктывкар, 2007. С. 70 - 71.
- Kosareva O. V., Ovchenkova E. N., Lomova T. N., Klueva M. E. Metalloporphyrin catalysts of hydrogen peroxide decomposition // Abstracts of X International conference on the problems of solvation and complex formation in solution. Suzdal, 2007. V. II. P. 588 - 589.
- Тюляева Е. Ю., Косарева О. В., Ломова Т. Н. Влияние строения ароматического макроцикла на свойства палладий(II)порфиринов // Тез. докл. XXIII Междунар. Чугаевской конф. по координационной химии. Киев, 2007.
С. 692.
- Ломова Т. Н., Клюева М. Е., Клюев М. В., Овченкова Е. Н., Косарева О. В. Синтетические каталазы на основе порфиринов // Тез. XVIII Менделеевского съезда по общей и прикладной химии, Москва, 2007. Т. 2, С. 367.
