«Фуллерены углеродные нанотрубки графен»
| Вид материала | Документы |
- Углеродные наноматериалы (Фуллерены, нанотрубки и материалы на их основе) симпозиум, 518.27kb.
- Е. В. Жариков Российский химико-технологический университет им. Д. И. Менделеева, Москва, 258.98kb.
- С. М. Планкина «Углеродные нанотрубки», 175.71kb.
- Вступительный экзамен в магистратуру для специальности «5М074000 –наноматериалы и нанотехнологии», 74.37kb.
- N-01-tisncm-2 Паспорт совместного российско-американского проекта, 87.7kb.
- Аннотационный отчет за 2010 год по Программе II «Наноструктурные слои и покрытия: оборудование,, 461.05kb.
- Информационный бюллетень наноструктуры сверхпроводники фуллерены Том 8, выпуск, 324.75kb.
- 6-ая международная конференция, 47.17kb.
- Власов А. В., Литвинов В. В, 80.85kb.
- Информационный бюллетень наноструктуры сверхпроводники фуллерены Том 10, выпуск 13/14, 277.29kb.
1.3Родственные соединения
Родственные соединения и аналоги фуллерена пока немногочисленны. Самый известный аналог – С70 – был получен практически одновременно с С60. Получение его в чистом виде связано с большими трудностями, и потому он изучен меньше. По форме он близок к эллипсоиду и из-за слегка вытянутой формы получил название «регбибол». Таким образом, продолжен стиль названий фуллерена С60 (футболен, бакибол).
В регбиболе имеются вершины пяти типов, например вершины, где сходятся три шестиугольные грани.
На удлиненных концах яйцеобразной молекулы находятся две пятиугольные грани. К ним примыкают наиболее реакционноспособные связи, по свойствам близкие к кратным.
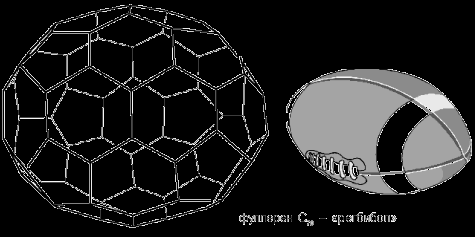
Рисунок 4. Регбибол
Так же, как и футболен С60, регбибол образует p-комплексное соединение с металлом, в данном случае с иридием, при участии одной из кратных связей. Образуется хорошо кристаллизующийся комплекс, рентгеноструктурные данные которого позволили определить все параметры молекулы С70.
В углеродном каркасе атомы C характеризуются sp2-гибридизацией, причем каждый атом углерода связан с тремя соседними атомами. Валентность 4 реализуется за счет p-связей между каждым атомом углерода и одним из его соседей. Естественно, предполагается, что p-связи могут быть делокализованы, как в ароматических соединениях. Такие структуры могут быть построены при n≥20 для любых четных кластеров. В них должно содержаться 12 пентагонов и (n-20)/2 гексагонов. Низший из теоретически возможных фуллеренов C20 представляет собой не что иное, как додекаэдр – один из пяти правильных многогранников, в котором имеется 12 пятиугольных граней, а шестиугольные грани вовсе отсутствуют. Молекула такой формы имела бы крайне напряженную структуру, и поэтому ее существование энергетически невыгодно.
С точки зрения стабильности, фуллерены могут быть разбиты на два типа. Границу между ними позволяет провести т.н. правило изолированных пентагонов (Isolated Pentagon Rule, IPR). Это правило гласит, что наиболее стабильными являются те фуллерены, в которых ни одна пара пентагонов не имеет смежных ребер. Другими словами, пентагоны не касаются друг друга, и каждый пентагон окружен пятью гексагонами. Если располагать фуллерены в порядке увеличения числа атомов углерода n, то C60 является первым представителем, удовлетворяющим правилу изолированных пентагонов, а С70 - вторым. Среди молекул фуллеренов с n>70 всегда есть изомер, подчиняющийся IPR, и число таких изомеров быстро возрастает с ростом числа атомов. Найдено 5 изомеров для С78, 24 - для С84 и 40 - для C90. Изомеры, имеющие в своей структуре смежные пентагоны, существенно менее стабильны.
1.4Химические свойства фуллерена
Если обратиться к С60, то в нем присутствует два типа связей: более короткие (1.39 Å) связи, пролегающие вдоль общих ребер соседствующих шестиугольных граней, и более длинные (1.45 Å), расположенные по общих ребрам пяти- и шестиугольных граней. При этом ни шестичленные, ни, тем более, пятичленные циклы не обнаруживают ароматических свойств в том смысле, в каком их проявляют бензол или иные плоские сопряженные молекулы. Поэтому обычно более короткие связи в С60 считают двойными, более длинные же – одинарными. Одна из важнейших особенностей фуллеренов состоит в наличии у них необычно большого числа эквивалентных реакционных центров, что нередко приводит к сложному изомерному составу продуктов реакций с их участием. Вследствие этого большинство химических реакций с фуллеренами не являются селективными, и синтез индивидуальных соединений бывает весьма затруднен.
У фуллерена невозможны реакции замещения, т. к. у атомов углерода нет никаких боковых заместителей. Обилие изолированных кратных связей позволяет считать фуллерен полиолефиновой системой. Для него наиболее типично присоединение по кратной связи.
Фуллерен является ярко выраженным акцептором электронов и при действии сильных восстановителей (щелочные металлы) может принимать до шести электронов, образуя анион С606–. Кроме того, он легко присоединяет нуклеофилы и свободные радикалы.
Химические свойства фуллерена показаны на рис. 5. Фуллерен гидрируется до С60Н36 (реакция 1), галогенируется подобно олефинам (реакции 2, 3). Продукты галогенирования легко вступают в реакции нуклеофильного замещения (реакция 4). При окислении кислородом (при УФ-облучении) образуется оксид фуллерена (реакция 5). В связи с этим растворы фуллерена в органических растворителях рекомендуется хранить и работать с ними в инертной атмосфере. Фуллерен арилируется в присутствии AlCl3 (реакция 6). Рассмотренное выше присоединение оксида осмия является, по существу, окислением, которое проходит по раскрывающейся двойной связи (реакция 7). Так же с раскрытием двойных связей фуллерена присоединяются амины (реакция 8), аминокислоты (реакция 9) и цианиды (реакция 10). Фуллерен, содержащий несколько аминогрупп, водорастворим.
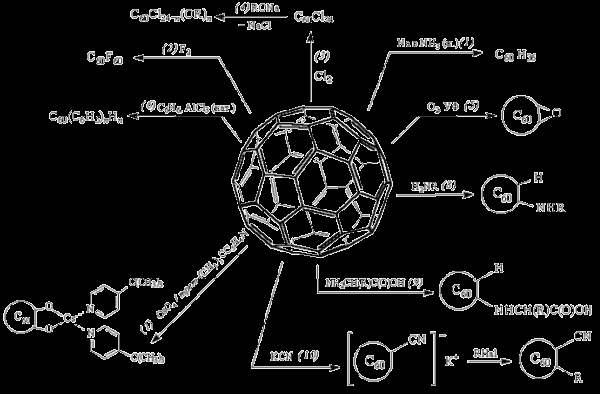
Рисунок 5. Химические свойства фуллерена
При восстановлении щелочными металлами (например, цезий или рубидий) происходит перенос электрона от атома металла к фуллерену. Образующиеся соединения обладают низкотемпературной сверхпроводимостью, критическая температура появления сверхпроводимости 33 К.
Поскольку в фуллерене есть кратные связи, то химия p-комплексных соединений (см. в главе о ферроцене) должна быть к нему приложима. Естественно, это сразу было проверено. Подобно олефинам, фуллерен образует p-комплексы с переходными металлами. Например, он вытесняет этилен из платинового комплекса (см. рис.6).
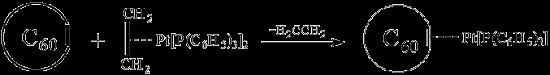
Рисунок 6. Вытеснение фуллереном этилена из платинового комплекса
Продукты присоединения такого же типа получены с палладием и иридием.
Для фуллерена есть еще необычная возможность образовывать соединения, используя внутреннюю полость углеродного шара, диаметр которого достаточен, чтобы в нем мог поместиться атом металла или небольшая молекула. Таким образом, открывается путь к получению химических соединений совершенно нового типа, где атом механически удерживается внутри замкнутой ячейки.
Способ введения атома металла во внутреннюю полость фуллерена практически не отличается от способа получения самого фуллерена. Графит перед испарением пропитывают солями металлов. В продуктах реакции обнаружены соединения состава С60La, С60Y, С60U. Внутрь заранее сформированной полости сквозь стенку удалось пока ввести лишь атом гелия (благодаря его небольшим размерам) путем бомбардировки фуллерена ионами гелия в газовой фазе.
