Палладийсодержащие аквакомплексные системы в реакциях каталитического окисления неорганических и органических веществ. Кинетика и механизм реакций
| Вид материала | Автореферат |
- Работников образования Кафедра естествознания реферат на тему: классификация химических, 424.08kb.
- Тема лекций и их содержание, 19.16kb.
- Обмен веществ основное жизненное свойство организма, с прекращением обмена веществ, 105.04kb.
- Iii кинетика и механизм гетерогенных каталитических реакций, влияние реакционной среды, 1807.15kb.
- Рабочая программа по дисциплине "Химическая технология неорганических веществ " Направление:, 112.47kb.
- «показатели качества воды и их определение» введение, 948.44kb.
- Предмет, задачи, методы цитологии, 128.36kb.
- Гоу впо «Московский государственный открытый университет», 483.26kb.
- Программа вступительного экзамена по специальным дисциплинам для магистрантов специальности, 87.1kb.
- Задачи урока: Образовательные: Закрепить на практике знания о классах неорганических, 211.06kb.
Глава 11. Тетрааквакомплекс Pd(II) прекурсор образования наночастиц палладия. Роль наночастиц Pd в каталитическом окислении олефинов.
11.1. Окисление олефинов в присутствии тетрааквакомплекса Pd(II)
Частицы палладия, обуславливающие катализ при окислении спиртов с участием тетрааквакомплекса Pd(II), могут участвовать в той или иной степени и при окислении олефинов. При контакте этилена, пропена или 1-бутена с каталитическим раствором, содержащим Pd(II)aq и Fe(III)aq, наблюдается быстрое выпадение палладиевой черни в течение нескольких минут. Вместе с этим происходит количественное восстановление железа(III) в железо(II) и образование соответствующего карбонильного соединения (ацетальдегид, ацетон и метилэтилкетон) в соответствии с реакцией (66).
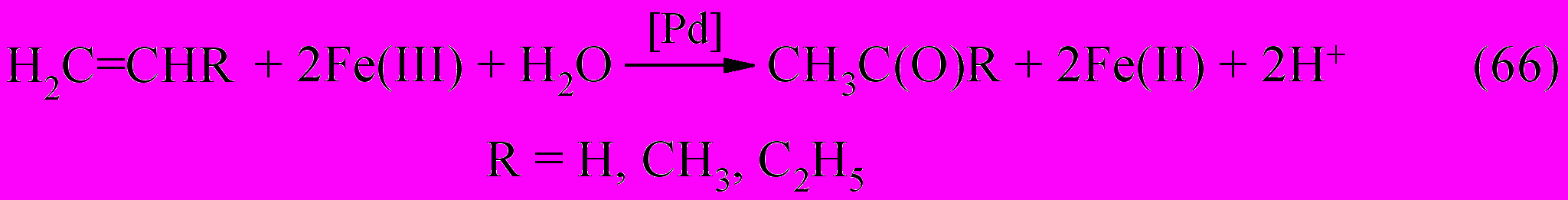
На основании материального баланса реакции (66) было показано, что количество образовавшегося карбонильного соединения превышает в несколько раз начальную концентрацию Pd(II). Это указывает на каталитический характер реакции (66), где при определенных условиях число циклов доходит до 250.
Было обнаружено, что раствор после отделения палладиевой черни сохраняет каталитическую активность. Анализ, сделанный после проведения реакции (66) и отделения палладиевой черни, показал, что концентрация палладия в растворе составляет (1-5)·10-5М (при выполнении анализа к раствору была добавлена концентрированная азотная кислота).
TEM фотография раствора, полученного после окисления этилена и отделения палладиевой черни декантированием, показывает присутствие наночастиц палладия (рис. 6). Трансмиссионная электронная микроскопия (TEM) была выполнена на 100 кВ микроскопе JEOL 1200 EXII. Из 1 мл анализируемого раствора (вместо хлорной кислоты была использована серная кислота) под вакуумом удаляли растворитель и затем добавляли 5 мл этанола. Полученный раствор подвергали ультразвуковой обработке, отфильтровывали и наносили на медную подложку.
 Рис. 6. TEM фотография раствора после окисления этилена. [Pd2+aq]=5 mM, [Fe3+aq]=30 mM, [HClO4]=0.5M. | Распределение частиц по размерам определяли с использованием увеличенного TEM изображения, выполненного при увеличении X100K. Для достижения хорошей статистики были проанализированы три согласующихся между собой диаграммы (как минимум с двумястами наночастицами). Таким образом, наночастицы Pd, образующиеся при окислении олефинов тетрааквакомплексом Pd(II), являются ответственными за катализ в реакции (66). |
11.2. Окисление олефинов в присутствии палладий нанесенного металлического катализатора
Применение гомогенных катализаторов в промышленности ограничено вследствие трудности отделения продуктов реакции от раствора катализатора. В настоящей работе предпринята попытка гетерогенезировать наночастицы палладия, образующиеся при восстановлении тетрааквакомплекса Pd(II). В качестве носителей были выбраны носители оксидного типа – ZrO2, Al2O3 и SiO2, кислотные центры которых должны способствовать закреплению наночастиц палладия, являющихся слабым основанием льюисовского типа. В основе приготовления Pd-нанесенного металлического катализатора лежала реакция восстановления тетрааквакомплекса Pd(II) аквакомплексом Fe(II). Анализ методом XRD при 2 в диапазоне 10-600 полученных таким образом Pd-содержащих гетерогенных катализаторов показал отсутствие каких-либо состояний палладия, отличных от фазы металлического палладия. Удельная поверхность катализаторов была измерена методом BET и составила в случае Pd/ZrO2 374м2/г., Pd/Al2O3 – 165м2/г и Pd/SiO2 – 602м2/г. Каталитическую активность тестировали путем окисления этилена, пропена и 1-бутена акваионами Fe(III) в водном хлорнокислом растворе.
В результате окисления олефинов железо(III) восстанавливается в железо(II). В случае этилена степень конверсии железа при 650С и продолжительности окисления 90 мин составила 80%, а число циклов по палладию превысило 26. Мольное соотношение между окисленным олефином и восстановленным железом составило 2, независимо от олефина и глубины протекания реакции. Этилен селективно окисляется в ацетальдегид, пропен – в ацетон, бутен-1 – в метилэтилкетон. При одинаковых начальных условиях скорость окисления олефинов увеличивается в ряду: C2H4
Таким образом, в присутствии палладий металлического катализатора, нанесенного на носитель оксидного типа, имеет место каталитическая реакция (66).
Наблюдаемая последовательность изменения скорости окисления олефинов указывает на гомогенный характер протекания изучаемых процессов, в ходе которых образуется электрофильная частица Pd(II). Иначе, если окисление было бы обусловлено хемосорбцией олефина на частицах Pd(0), т.е. гетерогенно, то в случае этилена, как более слабого нуклеофила в ряду олефинов, скорость была бы наибольшей.
Кинетика окисления исследованных олефинов характеризуется индукционным периодом, который обусловлен взаимодействием среды реакционного раствора с палладием в исходном катализаторе Pd/ZrO2. Под воздействием среды часть палладия из гетерогенной фазы катализатора переходит в раствор. Окисление олефина, происходит на гомогенном палладиевом катализаторе. Подтверждением данного вывода являются результаты следующих экспериментов.
 Рис. 7. Кинетические кривые окисления этилена железом(III) (0.03М) 650C после экспозиции 1%-Pd/ZrO2 (40 мг) в HClO4 (0.5М). 1 - гомогенный; 2 – гетерогенный | Навеску исходного 1%-Pd/ZrO2 выдерживали в 0.5М растворе хлорной кислоты в аргоне при температуре 650С в течение часа. Затем смесь отфильтровали. К фильтрату и к осадку добавили Fe(III) (0.03М). Полученные таким образом «гомогенный» и «гетерогенный» растворы соединяли с этиленом. В случае «гетерогенного» раствора окисление этилена происходило с меньшей скоростью, чем в системе до экспозиции Pd/ZrO2 в хлорной кислоте. «Гомогенный» раствор характеризовался активностью сравнимой с исходным Pd-нанесенным катализатором (рис. 7). |
Абсолютно противоположная картина наблюдалась после экспозиции 1%–Pd/ZrO2 в воде при рН=7. Здесь, в случае гомогенного раствора окисление этилена акваионами железа(III) не происходило, а в гетерогенном растворе скорость реакции соответствовала значению скорости окисления этилена Fe(III) на свежеприготовленном 1%-Pd/ZrO2.
В случае 1-бутена параллельно окислению происходит позиционная изомеризация двойной связи, доказанная методом ЯМР 1Н и хромато-масс-спектрометрии, приводящая к образованию 2-бутена. Так, при 550С за 70 мин. 30% 1-бутена превращается в 2-бутен, в том числе 10% в цис-2-бутен и 20% в транс-2-бутена, и только 3% 1-бутена окисляется с образованием метилэтилкетона. Позиционная изомеризация двойной связи наблюдается только в присутствии Pd/ZrO2 и Fe(III). Считается, что катализатором миграции двойной связи в олефине является палладий в промежуточной степени окисления. Наблюдаемая нами позиционная изомеризация указывает на протекание реакций, вследствие которых Pd(0) из металлического катализатора Pd/ZrO2 переходит в промежуточное окисленное состояние, катализирующее изомеризацию. Частичная изомеризация 1-бутена в 2-бутен, по всей видимости, объясняет меньшую скорость окисления бутена по сравнению с пропеном. Как известно, окисляемость 2-бутена ниже, чем 1-бутена.
Полученные результаты убедительно свидетельствуют, что под воздействием хлорной кислоты палладий из твердой фазы исходного катализатора переходит в раствор. Это также нашло подтверждение данными TEM анализа.
Результаты TEM анализа раствора, полученного после экспозиции 1%–Pd/ZrO2 0.25М раствором серной кислоты (вместо хлорной кислоты была взята серная кислота) в атмосфере аргона доказывают образование наночастиц палладия в растворе со средним размером 5 нм.
Существенная роль кислоты в образовании наночастиц палладия в растворе следует из того, что с увеличением концентрации хлорной кислоты скорость каталитического окисления олефина увеличивается.
Было установлено, что при взаимодействии 1%-Pd/ZrO2 с ионами Fe(III) при температуре 700С в растворе 0.5М хлорной кислоты в течение 30 минут в раствор переходит до 75% палладия в окисленной форме. Важно отметить, что палладиевая чернь при этих условиях не окисляется железом(III). При окислении Pd(0), нанесенного на γ-Al2O3, выход Pd(II) в полтора раза меньше, чем в случае носителя ZrO2, при прочих равных условиях.
Палладий, нанесенный на носитель оксидного типа, восстановлением тетрааквакомплекса Pd(II), можно перевести в раствор не только окислением акваионами Fe(III), но и молекулярным кислородом. Окисляемость палладия увеличивается с ростом кислотности среды. Так, в течение 100 минут при концентрации хлорной кислоты 0.46М окисление Pd(0) молекулярным кислородом при температуре 700С прошло с выходом Pd(II) 50%, а в 2М хлорной кислоте – 80%. Были найдены оптимальные условия, при которых этилен в присутствии Pd/ZrO2 окислялся кислородом с образованием ацетальдегида. Наилучший результат был получен при содержании этилена в кислородно-углеводородном газе не более 10%(об). Увеличение концентрации углеводорода в смеси газов приводит к снижению скорости и прекращению реакции.
Скорость окисления этилена акваионами Fe(III) в присутствии 1%-Pd/ZrO2 примерно в 100 раз больше скорости окисления наночастиц Pd(0) акваионами Fe(III) при тех же начальных условиях (температура, концентрация Fe(III), содержание Pd). При таком существенном различии скоростей каталитический цикл при окислении олефина не должен быть обусловлен регенерацией Pd(II) окислением частиц Pd(0).
Полученные данные позволяют заключить, что окисление олефина акваионами Fe(III) в присутствии катализатора Pd/ZrO2 происходит гомогенно – в растворе, где каталитическую роль выполняют частицы палладия в промежуточной степени окисления, и включает следующие стадии.
В водной среде на поверхности носителя образуются кислотные центры бренстедовского типа. Частицы металлического палладия взаимодействуют с такими центрами, образуя аддукт типа [Pd–H]+, в котором частицы палладия принимают частично положительный заряд
 .
. Взаимодействие палладиевого аддукта с ионами Fe(III) приводит к образованию частиц Pd с промежуточной степенью окисления (+1). В дальнейшем на активном центре Pd-содержащей частицы происходит быстрое окисление олефина в соответствующее карбонильное соединение через стадию образования палладийвинильного соединения или -аллильного комплекса в случае пропена или 1-бутена.
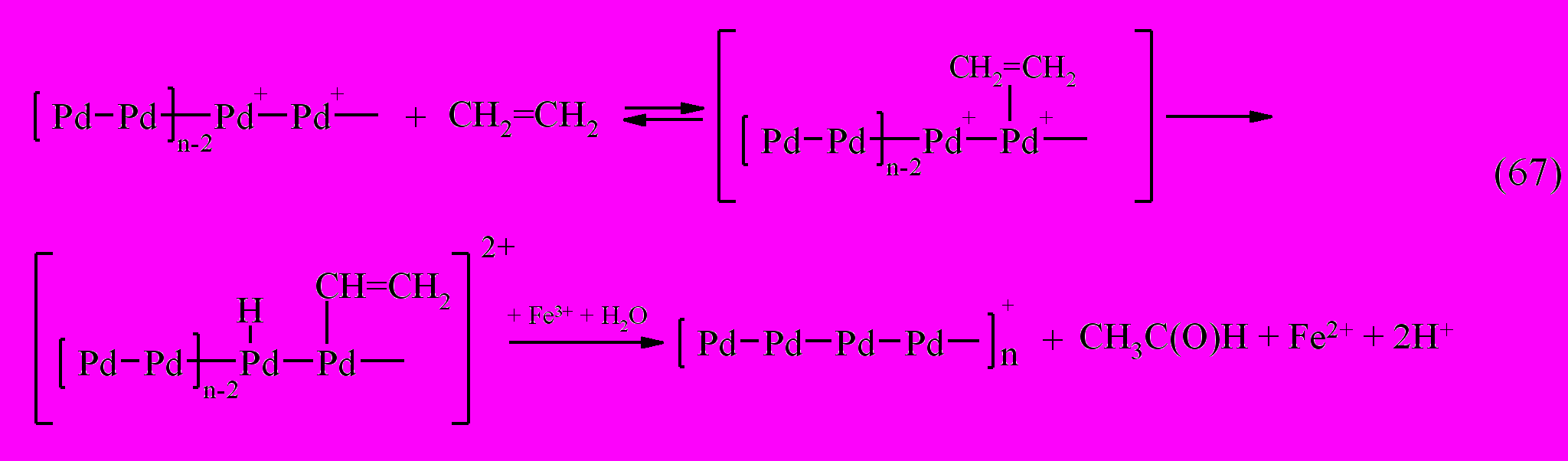
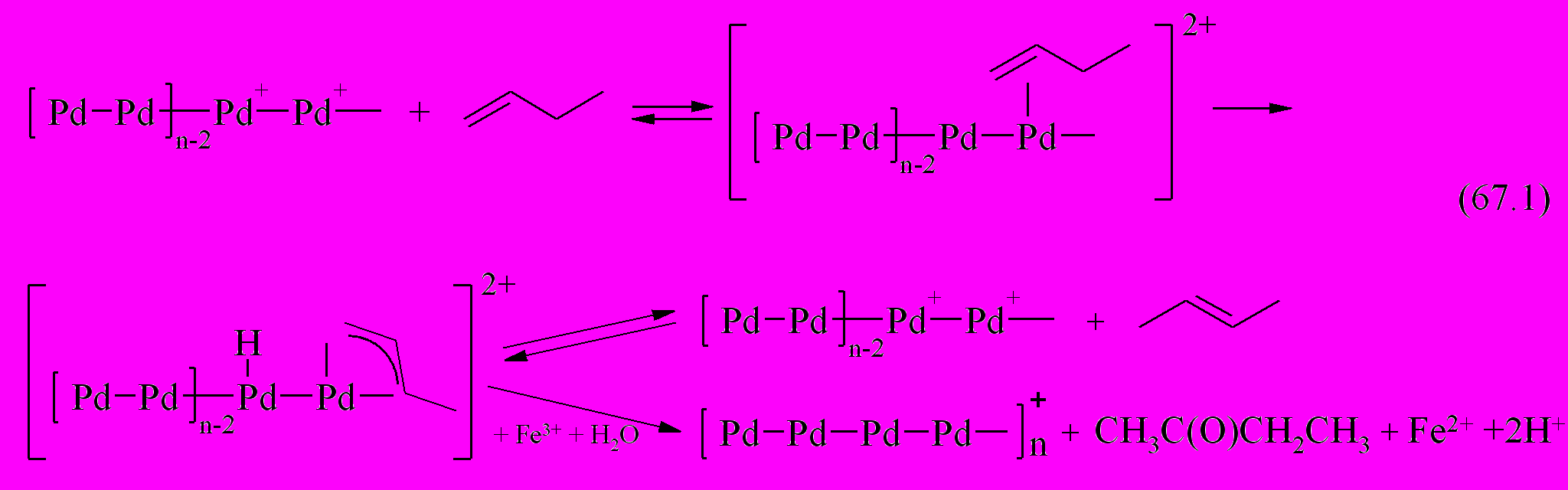
После реакции (67) каталитический цикл повторяется вновь.
Таким образом, каталитический цикл в окислении олефинов Fe(III) или молекулярным кислородом в Pd-содержащей системе обусловлен окислением не частиц Pd(0), а частиц Pd(I).
Выводы
- Проведено систематическое изучение кинетики и механизма окислительно-восстановительных превращений тетрааквакомплекса Pd(II) в реакциях со спиртами и олефинами, ионами переходных металлов и пероксида водорода. Установлено, что тетрааквакомплекс Pd(II) является прекурсором образования высокоактивных каталитических частиц палладия - наночастицы Pd(0) и Pdn2+ (n≥2), которые обуславливают катализ в процессах окисления молекулярным кислородом аква-ионов Fe(II) в Fe(III) и/или аквакомплексом Fe(III) алифатических спиртов и олефинов в соответствующие карбонильные соединения и определяют скорость, направление каталитических превращений субстратов. Реакции протекают без участия свободных радикалов. Хлорид-ион ингибирует окислительную способность тетрааквакомплекса Pd(II).
- Разработаны палладийсодержащие каталитические системы: Pd(II)aq-Fe(III)aq, Pd(II)aq-Fe(III)aq-PhX (ароматическое производное), не содержащие ацидолигандов (например, хлорид- или ацетат-ионы), окисления спиртов молекулярным кислородом в водно-кислотных средах в карбонильные соединения с селективностью близкой к теоретической.
- Установлено, что при каталитическом окислении спиртов и аква-ионов Fe(II) молекулярным кислородом производные бензола, содержащие нитрильную, карбонильную или нитрогруппу стабилизируют промежуточные частицы палладия, увеличивая число каталитических циклов (60 и выше) в окислении спиртов кислородом. Активность производных бензола уменьшается в ряду: 2-цианотолуол > нитрил фенилуксусной кислоты, бензонитрил >> нитробензол > ацетофенон.
- Установлено, что в каталитических системах Pd(II)aq-Fe(III)aq, Pd(II)aq-Fe(III)aq-PhX (ароматическое производное) Fe(III) является эффективным соокислителем при окислении спиртов и олефинов в водном хлорнокислом растворе, принимая активное участие в окислении субстратов в карбонильные соединения и ионов палладия в промежуточной степени окисления в Pd(II), препятствуя образованию палладиевой черни.
- Впервые установлено, что в присутствии тетрааквакомплекса Pd(II) в хлорнокислой среде происходит каталитическое окисление аквакомплекса Fe(II) молекулярным кислородом. Катализ обусловлен активацией молекулы кислорода соединением палладия в промежуточной степени окисления. Реакция происходит по ионно-цепному механизму. Скоростьопределяющей стадией образования катализатора является реакция между ионами Pd(II) и Fe(II).
- Окисление первичных и вторичных спиртов тетрааквакомплексом Pd(II), проявляющим электрофильные свойства, определяется лимитирующей стадией взаимодействия Pd(II) с С-Н-связью при атоме углерода, связанного с гидроксильной группой. Установлено, что вторичные спирты окисляются медленнее, чем изомерные им первичные и располагаются в ряд: CH3OH ~ CH3CH(OH)CH3 < CH3CH2OH ~ CH3CH(OH)CH2CH3 < CH3CH2CH2OH < CH3(CH2)2CH2OH << PhCH2OH
- Установлено, что взаимодействие тетрааквакомплекса Pd(II) с третичными спиртами (2-метил-2-пропанолом, 2-метил-2-бутанолом, 2-метил-2-пентанолом, 1-метил-циклогексанолом-1 и 1-этилциклогексанолом-1) в хлорнокислой среде приводит к образованию аллильных комплексов палладия. Реакция протекает региоселективно с преимущественным образованием комплекса с отсутствием заместителя у центрального атома аллильного лиганда. В случае циклических спиртов были получены аллильные комплексы экзоциклического типа. Введение в реакционную смесь ионов Fe(III) приводит к значительному увеличению выходов аллильных комплексов палладия. Наряду с аллильными комплексами палладия образуются продукты окисления спиртов - насыщенные альдегиды и кетоны.
- Впервые установлено, что алкилароматические спирты в присутствии тетрааквакомплекса Pd(II) в атмосфере аргона в сильнокислой среде не только окисляются, но и участвуют в диспропорционировании с образованием карбонильных соединений и алкилароматических углеводородов. Катализатором реакции являются наночастицы Pd(0).
- Изучена кинетика и механизм каталитического разложения пероксида водорода в присутствии тетрааквакомплекса Pd(II) в водном растворе при температуре 40-700С. Установлено, что реакция протекает по гетеролитическому механизму без выпадения палладиевой черни. Каталитический распад пероксида водорода сопровождается образованием супероксид-аниона.
- Показано, что частицы Pd(0), полученные восстановлением тетрааквакомплексом Pd(II) и нанесенные на носители оксидного типа (ZrO2, Al2O3 и SiO2), под действием кислоты переходят в раствор, образуя наночастицы палладия, которые окисляются акваионами Fe(III) и молекулярным кислородом. Окисление олефинов (С2-С4) в присутствии Pd-нанесенных металлических катализаторов протекает предпочтительно в гомогенной фазе с образованием карбонильных соединений. При окислении бутена-1 на Pd-нанесенном катализаторе параллельно окислению происходит позиционная изомеризация двойной связи, катализируемая восстановленной формой палладия. Позиционная изомерия двойной связи косвенно подтверждает образование в каталитической системе Pd(II)aq-Fe(III)aq частиц палладия в промежуточной степени окисления.
- Выявленные кинетические характеристики взаимодействия активного состояния палладия(0), отличного от палладиевой черни, нанесенного на носитель и в растворе представляющего собой наночастицы палладия, с окислителями различной природы акваионы железа(III) и молекулярный кислород показали, что в условиях каталитического окисления спиртов и олефинов «круговорот» палладия в каталитическом цикле не обусловлен окислением частиц Pd(0) железом(III) или молекулярным кислородом. Окислению подвергаются частицы палладия в промежуточной степени окисления.
Основное содержание работы отражено в следующих публикациях:
1. Потехин В.В., Украинцев В.Б., Антонов Н.Г., Бельский В.К., Скворцов Н.К. Образование π-аллильного комплекса при взаимодействии трет-бутилового спирта с тетрааквакомплексом палладия (II). Молекулярная структура (3-металлил) дипиридилпалладий перхлората // Журн. общей химии. 1997. Т.67. Вып.8. С.1233-1236.
2. Украинцев В.Б., Потехин В.В. Кинетика и маршруты окисления спиртов тетрааквакомплексом палладия(II) // Журн. общей химии. 1997. Т.67. Вып.10. С.1606-1610.
3. Мацура В.А. Украинцев В.Б., Куклин П.Ф., Потехин В.В. Окислительно-восстановительные превращения бензилового спирта в присутствии коллоидного палладия in situ // Тез. докл. ХIХ всероссийского Чугаевского совещания по химии комплексных соединений. – М.: 1999. С. 399.
4. Потехин В.В., Мацура В.А., Украинцев В.Б. Изучение окислительно-восстановительных превращений органических соединений в присутствии коллоидного палладия in situ. Часть I. Диспропорционирование бензилового спирта // Журн. общей химии. 2000. Т.70. Вып. 6. С.886-890.
5. V.V. Potechin, N.Y. Ryadinskaya, V.M. Potechin, N.K. Skvortcov. The preparation of palladium allylic complex from tertiary alcohols and tetraaquacomplex of palladium(II). Book of Abstracts of the International conference Metallorganic compounds – the materials of the future (III Razuvaev lectures) (Nizhniy Novgorod). 2000.- С.119.
6. Matsura V.А., Platonov V.V., Tacenko О.М., Ukraintsev V.B., Khohrykov К.А., Potekhin V.V Transformations of allyl and benzylic alcohols in palladium colloid in situ presence // Book of Abstracts of the International conference Metallorganic compounds – the materials of the future (III Razuvaev lectures) (Nizhniy Novgorod). 2000. P.188.
7. Рядинская Н.Ю., Скворцов Н.К. Потехин В.М., Потехин В.В. Кинетика образования π-аллильного комплекса палладия на основе 2-метил-2-пропанола // Журн. общей химии. 2000. Т.70. Вып. 7. С. 1153-1157.
8. Мацура В.А., Украинцев В.Б., Потехин В.В. Окисление молекулярным кислородом и гидрирование бензилового спирта в присутствии коллоидного палладия in situ// Журн. общей химии. 2000. Т.70. Вып. 12. С. 2058.
9. Рядинская Н.Ю., Потехин В.М., Потехин В.В. Реакции третичных спиртов с тетрааквакомплексом палладия(II). Образование π-аллильных комплексов палладия // Журн. общей химии. 2001. Т.71. Вып. 8. С. 1242-1248.
10. Мацура В.А., Украинцев В.Б., Потехин В.В. Кинетика и механизм гидрирования аллилового спирта в присутствии коллоидного палладия in situ // Тез. докл. XVII Черняевское совещание по химии координационных соединений. – М.: 2001. С 261.
11. Потехин В.В., Мацура В.А., Украинцев В.Б. Изучение кинетики гидрирования и окисления бензилового спирта в присутствии коллоидного палладия in situ // Журн. общей химии. 2002. Т.72. Вып. 1. С. 113-117.
12. Рядинская Н.Ю., Скворцов Н.К., Потехин В.М., Потехин В.В. Образование π-аллильных комплексов палладия на основе третичных спиртов // Журн. общей химии. 2002. Т.72. Вып. 6. С. 1004-1010.
13. Matsura V.А., Platonov V.V., Tacenko О.М., Ukraintsev V.B., Khohrykov К.А., Potekhin V.V. The catalytic activity of the palladium colloid in situ in the processes of hydrogenation and oxidation of the some benzylic and allyl alcohols // Book of Abstracts of the 13th International Symposium on Homogeneous Catalysis. -Tarragona: 2002. P.185.
14. Мацура В.А., Платонов В.В., Таценко О.М., Украинцев В.Б., Хохряков К.А., Потехин В.В. Изучение гидрирования и окисления аллилового спирта в присутствии коллоидного палладия in situ // Журн. общей химии. 2003. Т.73. Вып. 12. С.2009-2012.
15. Украинцев В.Б., Потехин В.В., Мацура В.А., Платонов В.В., Таценко О.М., Хохряков К.А. Кинетика реакции между кислородом и водородом в воде в присутствии соединений, содержащих палладий(0) // Журн. общей химии. 2003. Т.73. Вып. 11. С.1767-1771.
16. Potekhin V.V., Solov’eva S.N., Potekhin V.М. Catalytic partial oxidation of low aliphatic alcohols in the palladium(II) tetraaquacomplex – iron(III) – oxygen system // Book of Abstracts of the 39th IUPAC Congress and 86th Conference of the Canada Society for Chemistry. – Ottawa: 2003. P. 282.
17. Потехин В.В., Соловьева С.Н., Потехин В.М. Изучение каталитического окисления алифатических спиртов в системе тетрааквакомплекс палладия(II)–железо(III)–кислород // Изв. РАН. Сер. химическая. 2003. №12. С. 2420-2427.
18. Потехин В.В., Мацура В.А., Соловьева С.Н., Потехин В.М., О механизме реакции аквакомплексов палладия(II) и железа(II) в среде HClO4. // Кинетика и катализ. 2004. Т.45. Вып.3. С. 407- 410.
19. Потехин В.В., Соловьева С.Н., Потехин В.М. Каталитическое окисление аквакомплекса железа(II) кислородом в присутствии тетрааквакомплекса палладия(II) // Журн. общей химии. 2004. Т.74. Вып. 5. С. 709-712.
20. Потехин В.В., Соловьева С.Н., Фугхалья А. Тетрааквакомплекс Pd(II) – прекатализатор селективного гомогенного окисления алифатических спиртов и бензилового спирта кислородом в карбонильные соединения в водном растворе // Тез. декл. IV Всероссийской конференции по химии кластеров (КЛАСТЕРЫ – 2004). Полиядерные системы и активация малых молекул.– Иваново: 2004. С. 68–69.
21. Потехин В.В., Соловьева С.Н., Потехин В.М. Влияние ароматических соединений на каталитическое окисление спиртов в системе тетрааквакомплекс Pd(II)–акваион Fe(III) // Журн.общей химии. 2004. Т.74. Вып. 5. С. 866-867.
22. Мацура В.А., Панина Н.С., Украинцев В.Б., Хохряков К.А., Платонов В.В., Таценко О.М., Панин А.И., Потехин В.В. Квантовохимическое исследование диссоциации молекулы H2 на кластерах палладия // Журн. общей химии. 2004. Т.74. Вып.7. С.1057-1062.
23. Потехин В.В., Соловьева С.Н., Потехин В.М. Кинетика и механизм разложения пероксида водорода в присутствии тетрааквакомплекса палладия(II) // Изв.РАН. Сер. химическая. 2005. № 5. С.1077-1082.
24. Потехин В.В., Мацура В.А. Наночастицы палладия в гомо- и гетерогенном окислении низших олефинов акваионами железа(III) в бесхлоридной системе // Журн. общей химии. 2005. Т.75. вып.9. С. 1508-1509.
25. Мацура В.А., Украинцев В.Б., Потехин В.В., Платонов В.В., Таценко О.М., Хохряков К.А. Влияние постоянного магнитного поля на скорость каталитического гидрирования и окисления в присутствии коллоидного палладия in situ. // Журн. общей химии. 2005. Т.75. вып.8. С. 1329-1332.
26. Потехин В.В., Мацура В.А. Кинетика окисления низших олефинов акваионами железа(III) в присутствии прекатализатора Pd/ZrO2/SO4 в бесхлоридной системе // Журн. общей химии. 2006. Т.76. Вып.6. С. 895-901.
27. Потехин В.В. Pd-содержащие аквакомплексные системы в реакциях каталитического окисления. Кинетика и механизм. // Тез. докл. XVIII Международная Черняевская конференция по химии, аналитике и технологии платиновых металлов 9–13 октября 2006 г. – Москва, 2006. – С. 187.
28. Потехин В.В., Соловьева С.Н., Потехин В.М. Каталитическое окисление акваионов Fe(II) кислородом в присутствии тетрааквакомплекса Pd(II) и ароматического производного // Журн. общей химии. 2006. Т.76. Вып.5. С. 730-737.
29. Потехин В.В., Мацура В.А. Образование наночастиц палладия при окислении олефинов акваионами железа(III) в присутствии металлического катализатора Pd/ZrO2/SO4 // Изв. РАН. Сер. химическая. 2006. № 4. С. 627-632.
30. Потехин В.В. Pd-катализируемое окисление низших алифатических спиртов кислородом в присутствии ароматических нитрилов в водной среде // Журн. общей химии. 2006. Т.76. Вып.9. С. 1469-1476.
30. Потехин В.В. Об образовании низковалентных частиц палладия при окислении спиртов тетрааквакомплексом палладия(II) // Журн. общей химии. 2006. Т.76. Вып.9. С.1477-1480.
32. Потехин В.В. Окисление низших олефинов в водном растворе на Pd/ZrO2 катализаторе, полученном осаждением наночастиц палладия восстановлением тетрааквакомплекса Pd(II). // Перспективы развития химической переработки горючих ископаемых (ХПГИ-2006). 12-15 сентября 2006 г. – С.-Петербург, 2006, - С. 154.
33. Потехин В.В. Pd-содержащая аквасистема при каталитическом окислении спиртов кислородом в карбонильные соединения. Кинетика и механизм // Изв. РАН. Сер. химическая. 2007.№ 5. С. 842-848.
34. Мацура В.А., Панина Н.С., Платонов В.В., Потехин В.В., Таценко О.М., Украинцев В.Б., Хохряков К.А. Способ воздействия на скорость автокаталитической реакции // Патент РФ № 2238143 Б.И. № 29, 20.10.2004. C. 62.
35. Потехин В.М., Потехин В.В. Основы теории химических процессов технологии органических веществ и нефтепереработки// Учебник для ВУЗов; СПб.: Химиздат. 2005. С.911.
36. Потехин В.М, Потехин В.В. Основы теории химических процессов технологии органических веществ и нефтепереработки. 2-е издание, СПб: Химиздат, 2007, 944 с.
