Палладийсодержащие аквакомплексные системы в реакциях каталитического окисления неорганических и органических веществ. Кинетика и механизм реакций
| Вид материала | Автореферат |
Содержание4.2. Роль олефинов в реакции образования π-аллильных комплексов Pd 4.3. Влияние переходных металлов на образовании π-аллильных комплексов |
- Работников образования Кафедра естествознания реферат на тему: классификация химических, 424.08kb.
- Тема лекций и их содержание, 19.16kb.
- Обмен веществ основное жизненное свойство организма, с прекращением обмена веществ, 105.04kb.
- Iii кинетика и механизм гетерогенных каталитических реакций, влияние реакционной среды, 1807.15kb.
- Рабочая программа по дисциплине "Химическая технология неорганических веществ " Направление:, 112.47kb.
- «показатели качества воды и их определение» введение, 948.44kb.
- Предмет, задачи, методы цитологии, 128.36kb.
- Гоу впо «Московский государственный открытый университет», 483.26kb.
- Программа вступительного экзамена по специальным дисциплинам для магистрантов специальности, 87.1kb.
- Задачи урока: Образовательные: Закрепить на практике знания о классах неорганических, 211.06kb.
Глава 4. Взаимодействие тетрааквакомплекса Pd(II) с третичными спиртами
В качестве объектов исследования были взяты 2-метил-2-пропанол, 2-метил-2-бутанол, 2-метил-2-пентанол, 1-метилциклогексанол-1 и 1-этилциклогексанол-1.
4.1. Образование π-аллильных комплексов и кинетические закономерности реакции третичных спиртов с Pd(II)
При взаимодействии исследуемых третичных спиртов с тетрааквакомплексом Pd(II) происходит образование аллильных комплексов палладия, выход которых составляет от 1 до 57% в зависимости от условий проведения реакции и природы спирта (уравнения 10, 11).
P
 d2+aq + CnH2n+1OH [(3CnH2n-1)Pd]+ + H3O+, (10)
d2+aq + CnH2n+1OH [(3CnH2n-1)Pd]+ + H3O+, (10)P
 d2+aq + cyclo-CmH2mOH [(3CmH2m-2)Pd]+ + H3O+, (11)
d2+aq + cyclo-CmH2mOH [(3CmH2m-2)Pd]+ + H3O+, (11)где n=4- 6, m=7,8 в зависимости от структуры спирта.
Синтез аллильных комплексов палладия проводили при следующих начальных концентрациях реагентов: Pd(II)–5mМ, спирта – 0.1М (в случае 1-этилциклогексанола-1 его концентрация составляла 0.05М вследствие плохой растворимости в воде), хлорной кислоты – 0.5М. Аллильные комплексы палладия были выделены добавлением избытка 2,2-дипиридила (dipy) к реакционному раствору после окончания реакции и охарактеризованы методом ЯМР-спектроскопии (1Н и 13С), рентгеноструктурного анализа, а также данными элементного анализа.
При взаимодействии тетрааквакомплекса Pd(II) с 2-метил-2-пропанолом был идентифицирован комплекс (I), с 2-метил-2-бутанолом – смеси изомеров (II) и (III) в соотношении 5:1, с 2-метил-2-пентанолом-комплекса (IV), с 1-метилциклогексанолом-1-комплекса (V), а с 1-этилциклогексанолом-1-комплекса (VI).
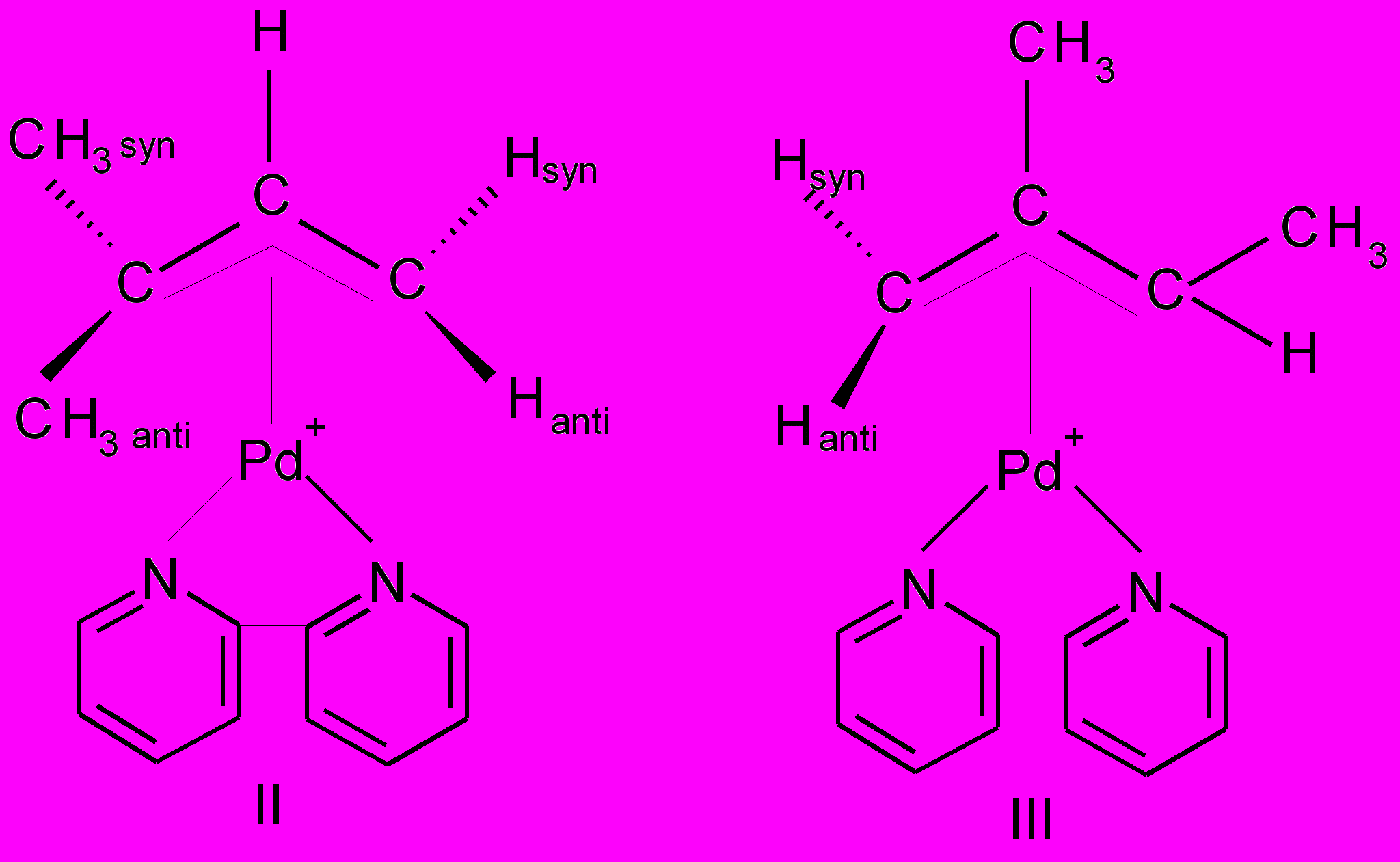
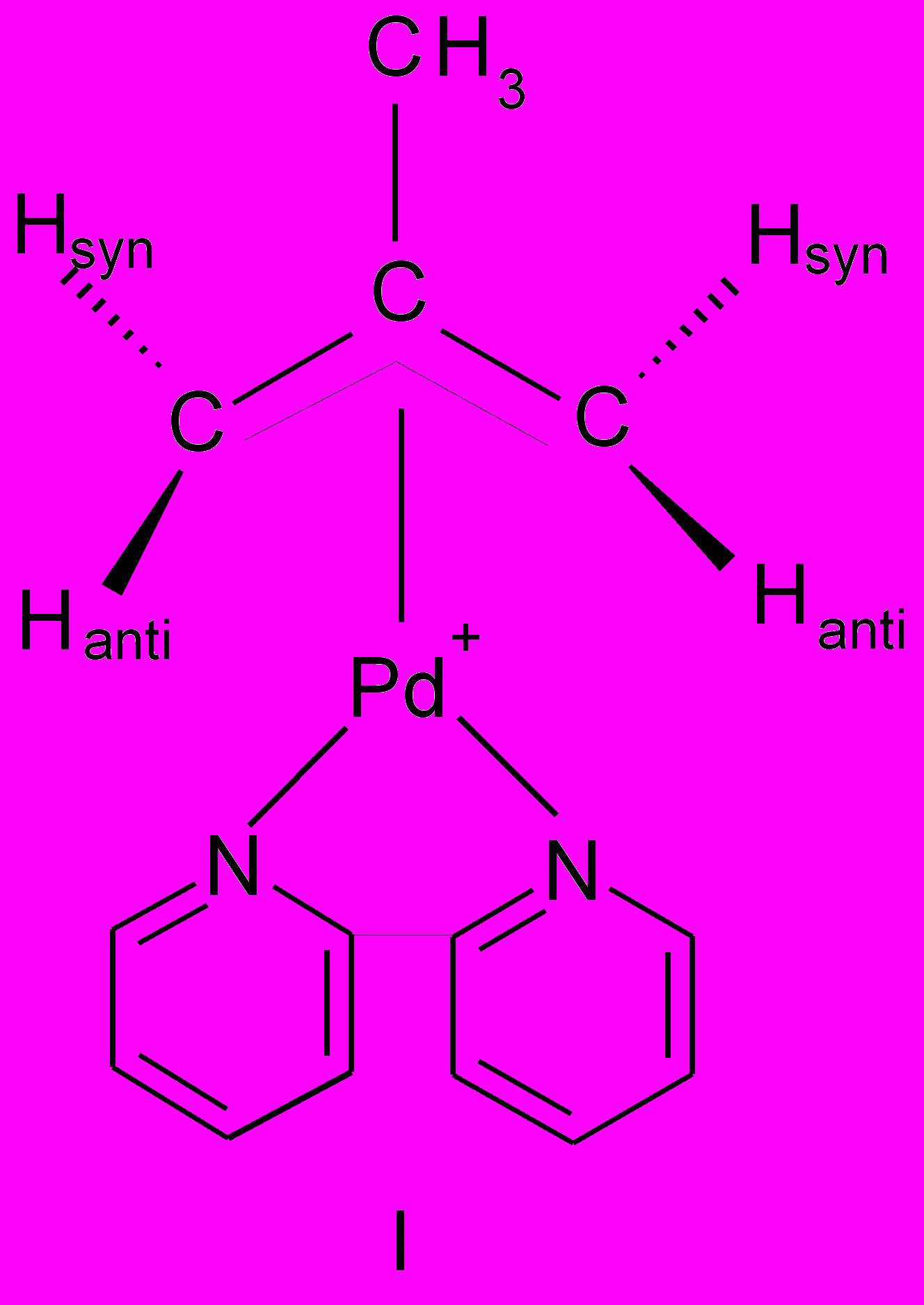
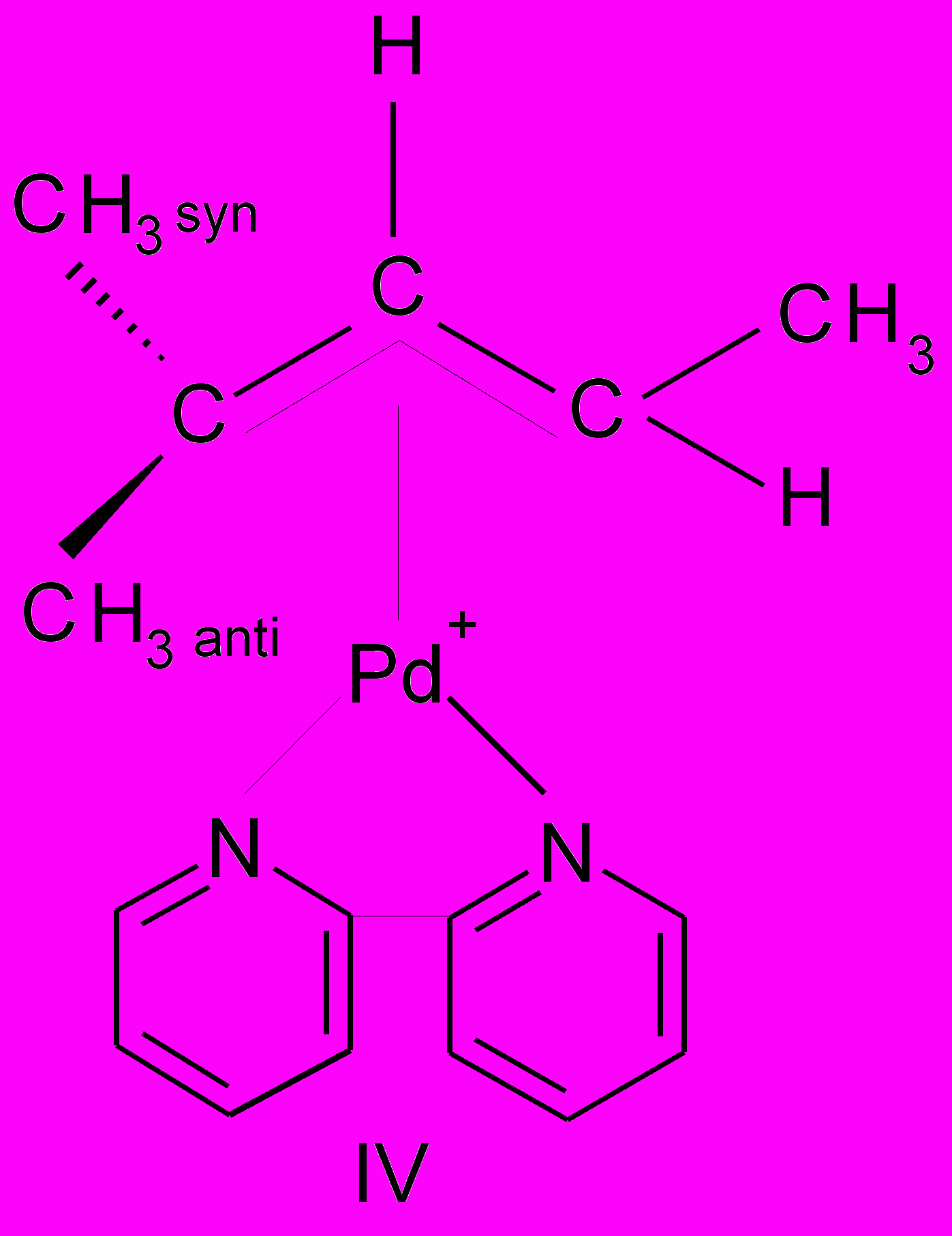
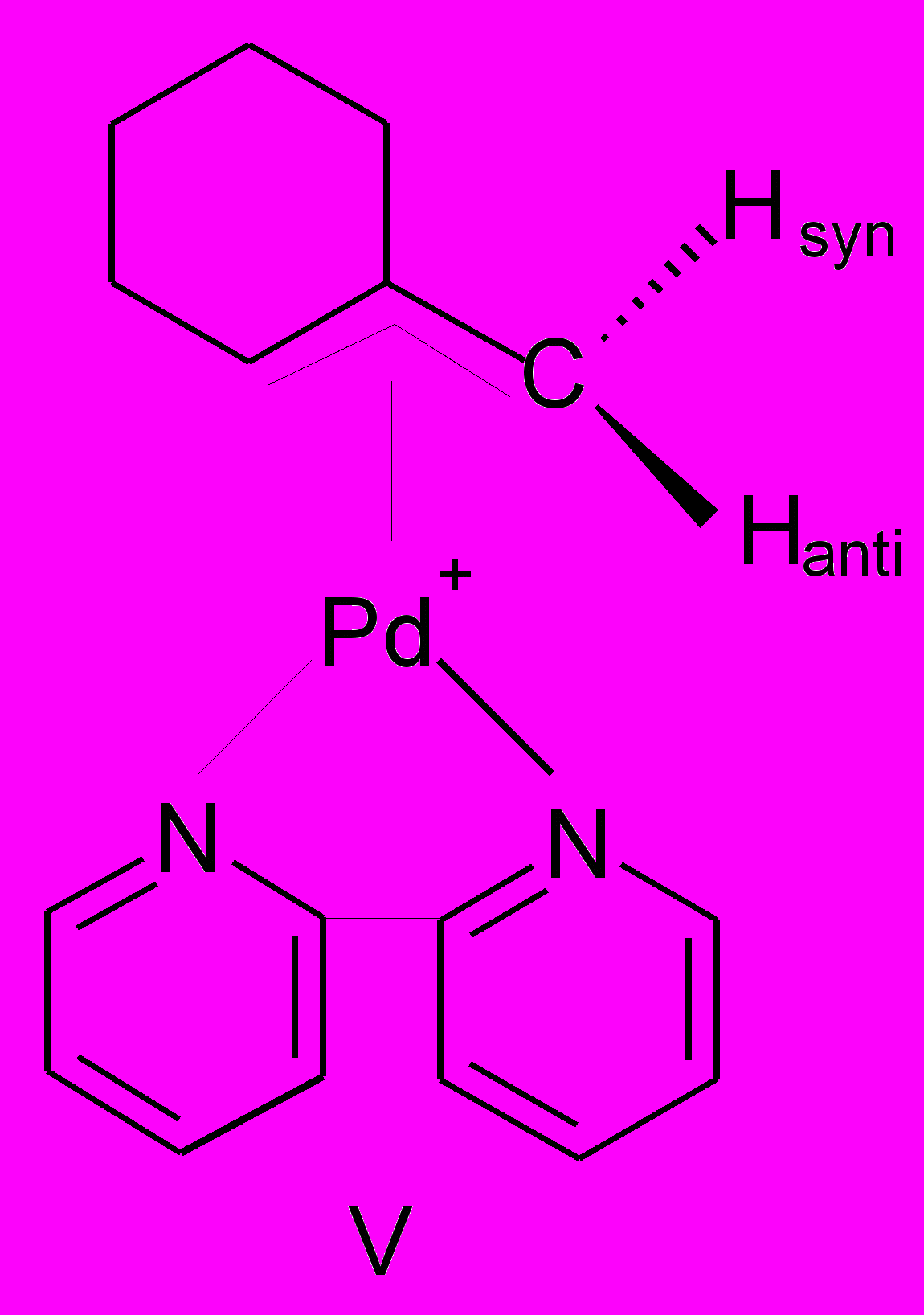
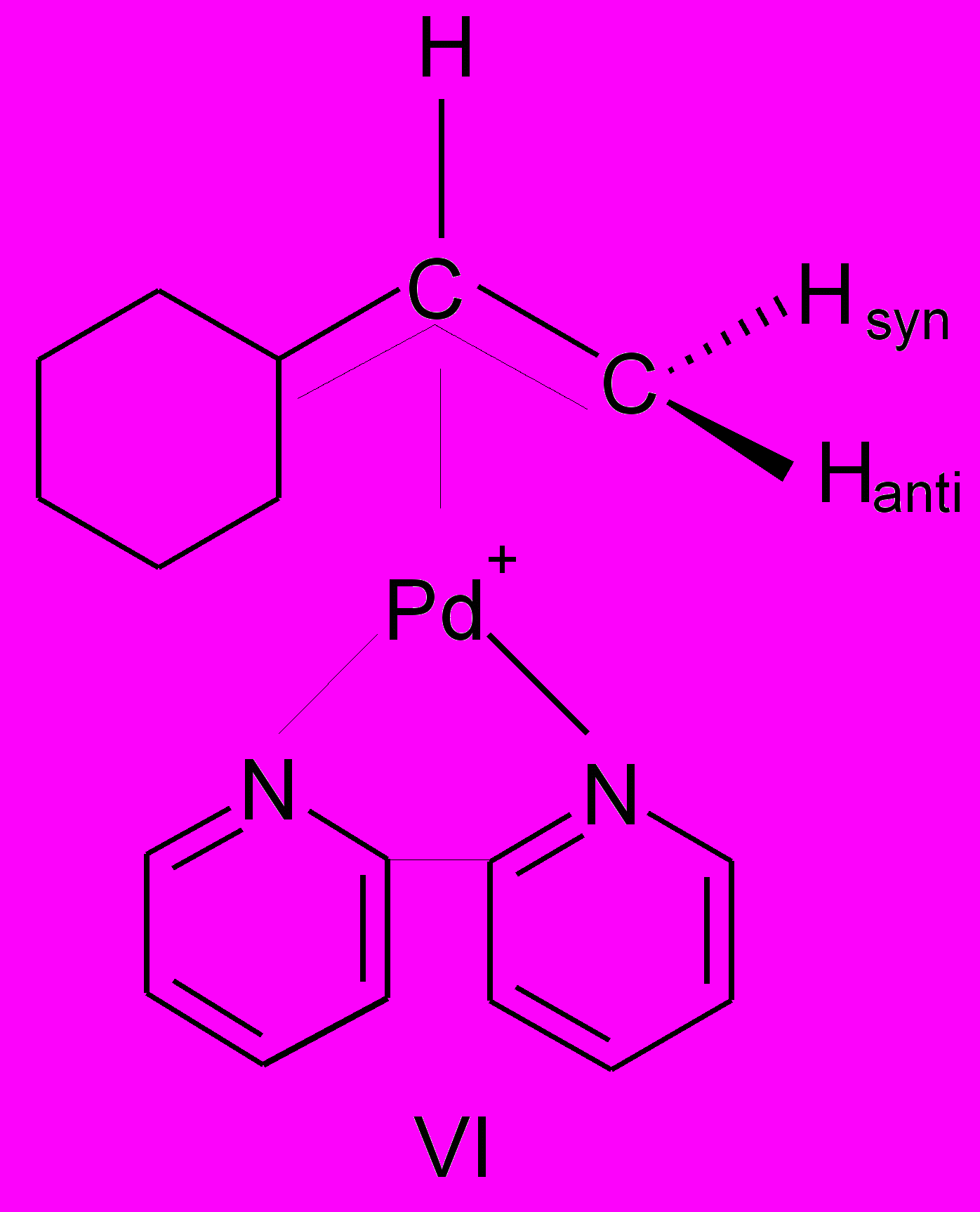
Из данных ЯМРспектроскопии следует, что метильные группы и атомы водорода, связанные с терминальным атомом углерода аллильного лиганда, не являются эквивалентными и характеризуются химическим сдвигом в диапазоне 1.4- 1.8 м.д. для метильных групп и в районе 3.5- 4.5 м.д. для атомов водорода. Протон, связанный с центральным атомом углерода аллильного лиганда, характеризуется химическим сдвигом в область слабых полей, равным 5.5 м.д.
Геминальное спин-спиновое взаимодействие терминальных протонов очень мало (2JHH=1.2 Гц). Константа спин-спинового взаимодействия центрального протона с протоном Hanti аллильной группы (3JHHanti=13Гц) отличается от константы вицинального взаимодействия этого протона с Hsyn (3JHHsyn=7.6Гц). В спектрах 13С-ЯМР концевые атомы углерода резонируют в районе С=58.5– 62.1м.д., терминальные атомы углерода аллильного лиганда, имеющие заместители – в области С=89.5 – 101.6 м.д., а сигнал центрального атома углерода находится в диапазоне С=112.7–137.8 м.д. в более слабом поле, чем атомы углерода соответствующих спиртов (С=7 – 46 м.д.).
Полученные факты находятся в соответствии с приведёнными в литературных источниках данными, касающимися структуры аллильных комплексов палладия. Таким образом, можно считать доказанным образование аллильных комплексов структуры (I – VI).
Изучение кинетики взаимодействии 2-метил-2-пропанола с тетрааквакомплексом Pd(II) показало, что начальная скорость реакции характеризуется нулевым порядком по Pd(II) и прямопропорциональна концентрации хлорной кислоты. Зависимость начальной скорости реакции от концентрации 2-метил-2-пропанола носит сложный характер. В области высоких концентраций спирта скорость стремится к предельному значению.
На основании полученных кинетических закономерностей взаимодействие третичного спирта с тетрааквакомплексом Pd(II) протекает по следующим стадиям.
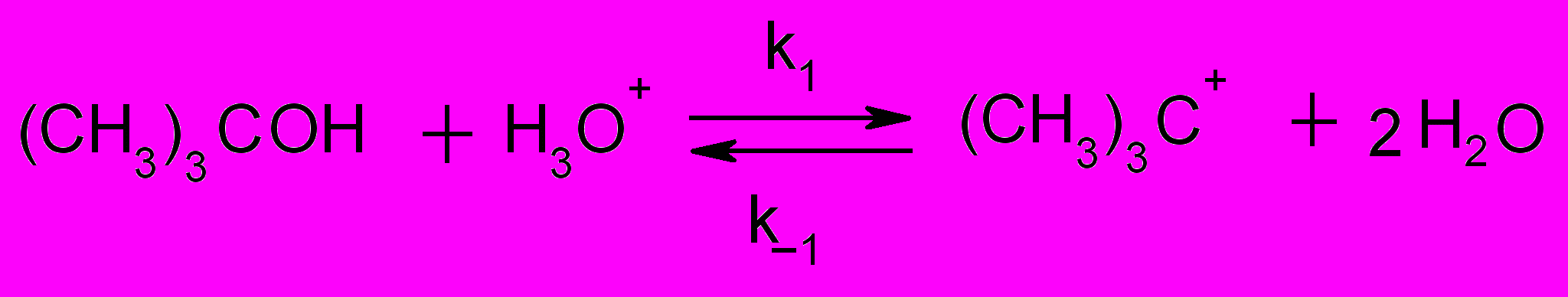 | (12) |
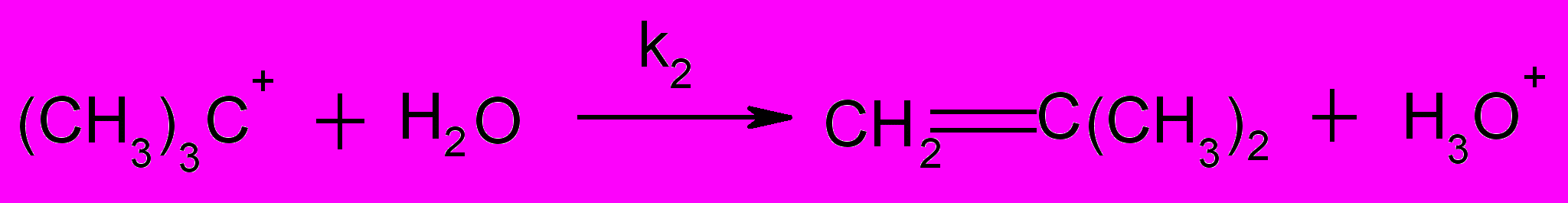 | (13) |
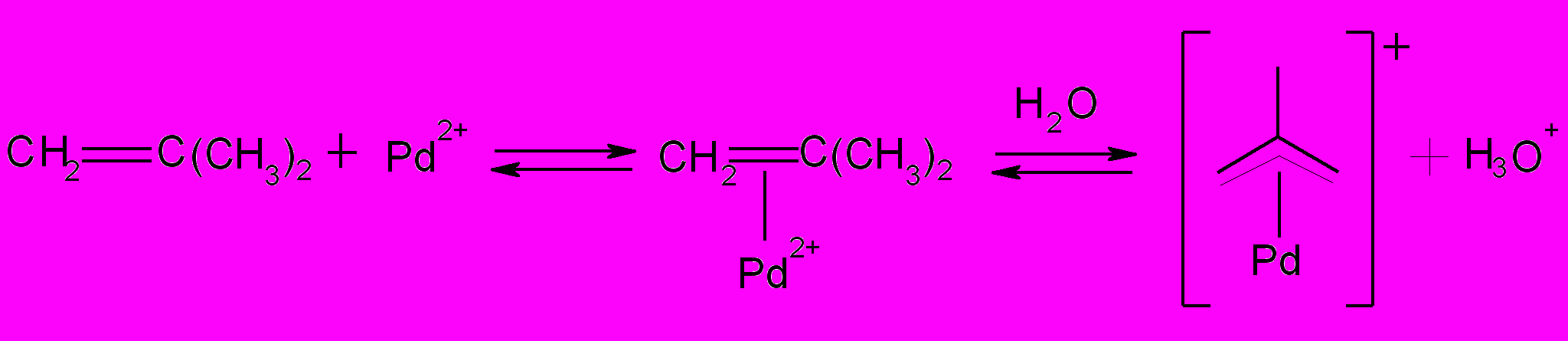 | (14) |
Реакция (13), является лимитирующей, на что указывает отсутствие зависимости начальной скорости реакции от концентрации Pd(II). На основании предложенного механизма можно записать следующее кинетическое уравнение, которое хорошо описывает полученные экспериментальные данные:
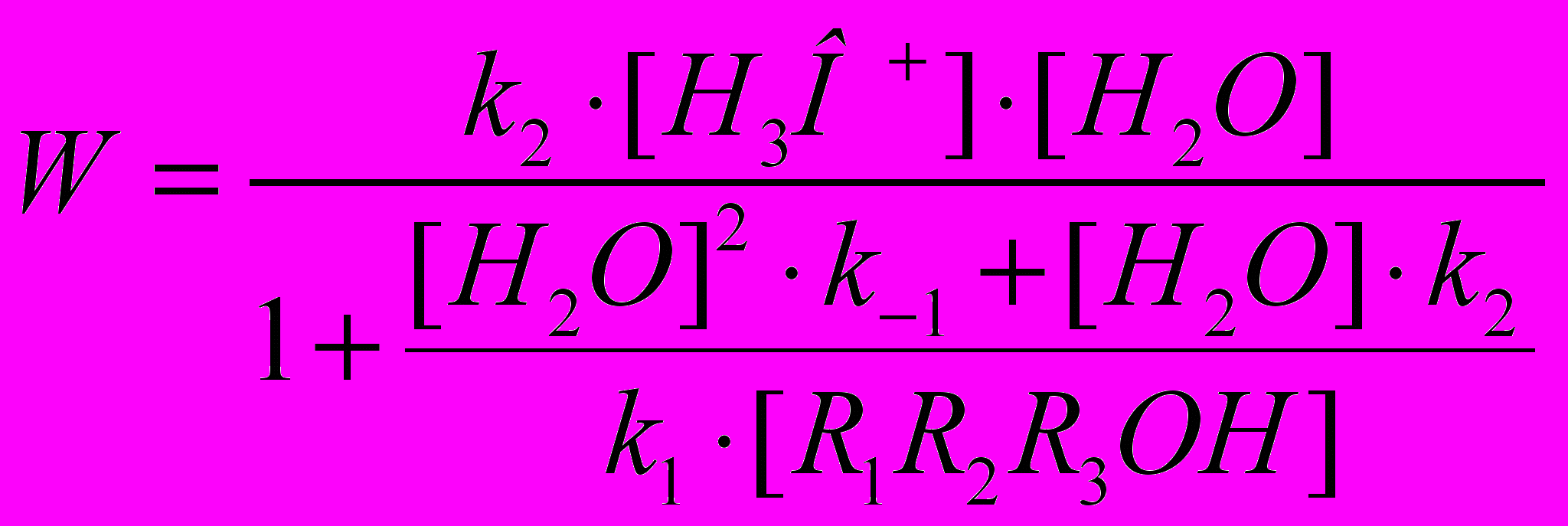 (15)
(15)k2=(1.90.1)10-7 л/(мольс) при t=55С.
Выход аллильного комплекса при взаимодействии 2-метил-2-пропанола с тетрааквакомплексом Pd(II) при 55С достигает 58%, что значительно превосходит выход подобного хлоридного аллильного комплекса в результате реакции 2-метилпропена с хлоридом Pd(II) (27% при 90С).
Вид кинетических зависимостей и характер влияния различных факторов на скорость реакции и выход аллильных комплексов палладия аналогичен для всех исследуемых спиртов, что позволяет говорить о сходстве механизмов их взаимодействия с тетрааквакомплексом Pd(II). Однако зависимость скорости от начальной концентрации 2-метил-2-бутанола, 2-метил-2-пентанола, 1-метилциклогексанола-1 и 1-этил-циклогексанола-1 характеризуется первым порядком. Отсутствие стремления скорости реакции к предельному значению (как в случае 2-метил-2-пропанола), вероятно, обусловливается невозможностью достижения более высоких концентраций спиртов вследствие их незначительной растворимости в воде.
Выход аллильных комплексов возрастает с увеличением избытка спиртов по отношению к Pd(II), а также с ростом концентрации хлорной кислоты.
С ростом углеродной цепи исходных спиртов наблюдается увеличение скорости реакции в ряду: 2-метил-2-пропанол < 2-метил-2-бутанол < 2-метил-2-пентанол < 1-метилцилогексанол-1< 1-этилциклогексанол-1.
4.2. Роль олефинов в реакции образования π-аллильных комплексов Pd
Селективное образование олефинов из соответствующих третичных спиртов: 2-метил-2-бутанола – 2-метил-2-бутена, 2-метил-2-пентанола – 2-метил-2-пентена, 1-метилциклогексанола-1 – 1-метилциклогексена-1, 1-этилциклогексанола-1 – 1-этил-циклогексена-1, было установлено методом хроматомасс-спектрометрии. Образование олефина в отсутствие Pd(II) протекает с постоянной скоростью. Однако во время реакции спиртов с комплексом [Pd(H2O)4]2+ наблюдался период, в течение которого олефин не был обнаружен, как в случае 2-метил-2-пропанола, или его содержание было незначительно, как для реакционных систем с другими третичными спиртами.
Необходимо отметить, что в процессе расходования спирта и по мере уменьшения концентрации тетрааквакомплекса Pd(II) скорость накопления олефина возрастает и после полного расходования тетрааквакомплекса Pd(II) достигает постоянного предельного значения, которое отвечает скорости образования олефина из спирта в системе без Pd(II) в кислой среде.
Непосредственное участие олефинов в образовании аллильных комплексов палладия указывают экспериментальные данные, приведенные в таблице 4.
Таблица 4
Выход аллильных комплексов палладия, при взаимодействии олефинов с
Pd(II) при 200С. [олефин]=0.1M; [Pd(II)]=5.5mM; [HCIO4]=0.6M
| Олефин | Время, мин | Выход ,% |
| 2-метил-2-бутен | 30 | 90 |
| 2-метил-2-пентен | 15 | 56 |
| 1-метилциклогексен-1 | 10 | 15 |
Взаимодействие тетрааквакомплекса Pd(II) с олефинами приводит к более высокому выходу аллильных комплексов палладия, чем с третичными спиртами. 3Аллильные комплексы, полученные взаимодействием олефинов с [Pd(H2O)4]2+, были выделены из реакционного раствора посредством 2,2-дипиридила. Анализ спектров ЯМР показал, что структура комплексов аналогична структуре соединений(II, III, IV, V).
На основании полученных экспериментальных данных механизм взаимодействия третичных спиртов с тетрааквакомплексом Pd(II) на примере превращений 2-метил-2-бутанола можно представить в следующей схемой:
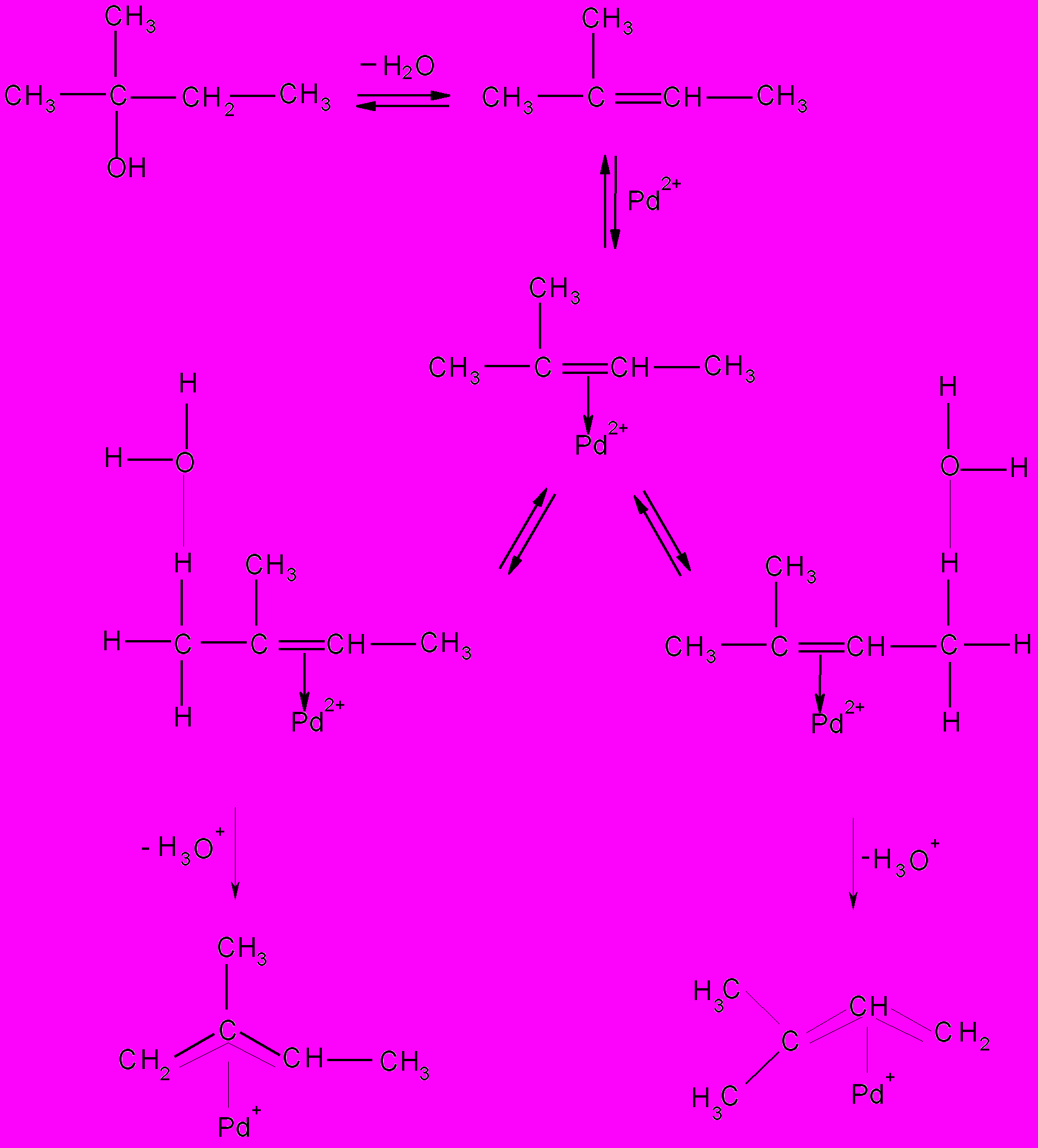 | В процессе образования аллильных комплексов (V) и (VI) из соответствующих комплексов палладия, содержащих в качестве лигандов 1-метилциклогексен-1 или 1-этилциклогексен-1, происходит отщепление протона метильной группы. По-видимому, определяющую роль в механизме образования комплексов играет стерический фактор. В основном получаются комплексы при отсутствии заместителя у центрального атома углерода аллильного лиганда, что является отличительной чертой предложенного нами метода синтеза аллильных соединений. |
4.3. Влияние переходных металлов на образовании π-аллильных комплексов
Взаимодействие тетрааквакомплекса Pd(II) с третичными спиртами сопровождается выпадением палладиевой черни, что свидетельствует о протекании окислительно-восстановительных реакций.
Как известно, с целью увеличения выхода продуктов окисления олефинов ионами Pd(II) применяют различные окислители (Ox)-соокислители для регенерации Pd(II) в каталитическом цикле. В работе экспериментально было показано, что введение ионов Cu(II) и n-бензохинона не оказает влияния на выход аллильных комплексов палладия. Только в присутствии акваионов Fe(III) (E0 Fe3+/Fe2+=0.771B), независимо от природы третичного спирта, выход аллильных комплексов палладия существенно увеличивается и при этом также уменьшается количество выпавшей палладиевой черни (табл. 5).
Приведённые данные свидетельствуют о каталитическом характере процесса взаимодействия третичных спиртов с тетрааквакомплексом Pd(II) в присутствии акваионов Fe(III). Ионы Fe(III) регенерируют окисленную форму палладия.
Таблица 5
Влияние ионов Fe(III) на выход аллильных комплексов палладия ()
[спирт]=0.1М; [Pd(II)]=5.5mM; [HCIO4]=0.5M;
| спирт | t,С | Выход без Fe(III), % | C0Fe3+103, М | Выход , % | Количество Pd(0), % (на превращённый Pd) | |
| | | | | | В отсутствии Fe(III) | В присутствии Fe(III) б) |
| 2-метил-2-пропанол | 55 | 58 | 325 | 100 | 40 | 0 |
| 2-метил-2-бутанол | 45 | 50 | 3 | 77 | 51 | 5 |
| 5.5 | 87 | |||||
| 30 | 93 | |||||
| 2-метил-2-пентанол | 40 | 16 | 13 | 42 | 56 | 25 |
| 30 | 39 | |||||
| 60 | 48 | |||||
| 120 | 54 | |||||
| 1-метил-циклогексанол-1 | 35 | - | 10 | 1 | 87 | 7 |
| 60 | 37 | |||||
| 120 | 41 | |||||
| 1-этилцикло-гексанол-1 а) | 35 | 1 | 13 | 28 | 96 | 7 |
| 30 | 52 | |||||
| 60 | 58 | |||||
| 120 | 79 | |||||
Примечание: а) С0сп=0.05М; б) при концентрации Fe(III) 310-3 М и выше.
При взаимодействии третичных спиртов с тетрааквакомплексом Pd(II) как с участием, так и в отсутствие Fe(III) наряду с образованием аллильных комплексов палладия побочно накапливаются различные карбонильные соединения, выход которых составляет от 4 до 14 % на превращённый палладий и возрастает до 20% при проведении реакции в присутствии Fe(III). Так, в реакции тетрааквакомплекса Pd(II) с 2-метил-2-пропанолом были обнаружены 2-метил-2-пропеналь и 2-метилпропаналь, а при взаимодействии с 2-метил-2-бутанолом - 2-метил-4-бутаналь и 3-метил-2-бутанон. В реакции 1-метилциклогексанола и 1-этилциклогексанола с комплексом Pd(II) было обнаружено образование метилбензола и этилбензола соответственно (селективность 50%), а также изомеры циклоалкилкетонов.
