Для самостоятельного изучения «Биохимия как наука. Этапы развития биохимии. Методы биохимических исследований» (Скоробогатова З. М.)
| Вид материала | Методические рекомендации |
- Для самостоятельного изучения Биохимия как наука. Этапы развития биохимии, 2094.45kb.
- Основы биохимии спорта, 1521.5kb.
- Председатель цикловой методической комиссии, 42.51kb.
- Тема строение белков и ферментативный катализ вопросы лекции, 137.02kb.
- Лекция №6. Структура биологии как науки. Ранние этапы эволюции жизни, 433.89kb.
- Планирование будущего развития с использованием техники сценариев, 15.36kb.
- Тематический план лекций по общей биохимии для студентов 2-го курса лечебного, педиатрического, 1643.39kb.
- Резюмируя можно сказать, что объектом ее изучения являются химические элементы, 71.81kb.
- Курс (8 семестр) 2010/2011уч год специальность «Стоматология» Календарно-тематический, 183.27kb.
- 1. История как наука: этапы становления, предмет, методы исследования, функции исторического, 609.65kb.
Найти материал для освоения этих вопросов можно в одном из следующих источников:
Обязательная литература
1.Губський Ю.Г. Біологічна хімія.- Київ-Тернопіль:Укрмедкнига, 2000.-С.88-89, 98-112
2.Тестовые задания по биологической химии/ Под ред.Б.Г.Борзенко.-Донецк,2000.-С.5-24
3. Лекции по биохимии.
4. Граф логической структуры (Приложение 1).
5. Инструкция к практическому занятию
Дополнительная литература
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия.-М.: Медицина, 1998.-С.129-165
2. Березов Т.Т., Коровкин Б.Ф. Биологическая химия.-М.: “Медицина”,1990.-С.105-112,
115-124, 126-128.
3. Николаев А.Я. Биологическая химия. -М.: ООО «Медицинское информационное агентство»,
1998.-С.70-81, 84-89
4. Кушманова О.Д., Ивченко Г.М. Руководство к лабораторным занятиям по биохимии.-
М.: Медицина, 1983. - С.69-70
После изучения вышеперечисленных вопросов для самопроверки усвоения материала по изучаемой теме Вам предлагается решить целевые обучающие задачи.
Целевые обучающие задачи
Задача 1. Ферментативный гидролиз жиров протекает в сто раз быстрее неферментативного процесса за счет образования промежуточного фермент-субстратного комплекса. Какие связи стабилизирует этот комплекс?
А. Прочные ковалентные
В. Ионные
С. Пептидные
D. N -гликозидные
Е. Сложноэфирные
Задача 2.Методом ИК-спектроскопии изучали природу связей между субстратом и связывающим участком активного центра фермента. В чем заключается взаимодействие фермента и субстрата по Кошленду?
А. Изменяется только конфигурация активного центра фермента
В. Изменяется только конфигурация молекулы субстрата
С. В молекуле фермента изменяется конфигурация аллостерического
центра под действием субстрата
D. При образовании фермент-субстратного комплекса в ферменте и
субстрате одинаково изменяется напряжение химических связей
Е. Активный центр подходит к субстрату, как ключ к замку
Задача 3. Лекарственные препараты на основе салицилатов являются обратимыми не конкурентными ингибиторами фермента глутаматдегидрогеназы. Предложите метод, который можно использовать для снижения степени ингибирования:
А. Увеличить концентрацию субстрата
В. Снизить концентрацию ингибитора
С. Изменить значение рН среды
D. Ввести структурный аналог субстрата
Е. Снизить концентрацию субстрата.
Задача 4. Больной С., 42 лет, после приема внутрь 20 мл метанола доставлен в клинику в тяжелом состоянии. Больному назначено внутривенно этиловый спирт в количестве, которое у здорового человека вызывает интоксикацию. Объясните, почему такое лечение оказывается эффективным, учитывая, что высокая токсичность метанола обусловлена действием продукта его метаболизма формальдегида, образующегося в печени под действием алькогольдегидрогеназы.
А. Этанол – конкурентный ингибитор алькогольдегидрогеназы
В. Этанол вызывает денатурацию фермента
С. Вследствие изменения рН среды
D. Происходит частичный протеолиз молекулы фермента
Е. Этанол связывает формальдегид.
Задача 5. При лечении опухолей мочеполовой системы в клинике применяется препарат метотрексат, обратимый конкурентный ингибитор дегидрофолатредуктазы, катализирующий синтез тетрагидрофолиевой кислоты. На взаимодействии с каким компонентом основан механизм действия этого препарата?
А. Апоферментом
В. Активным центром фермента
С. Аллостерическим центром фермента
D. Простетической группой
Е. Субстратом
Задача 6.Кроме Н+ и углекислого газа связывание кислорода гемоглобином регулируется бисфосфоглицератом, который присоединяется к белку в участках, пространственно удаленных от гема. Как называется такой вид регуляции?
А. Регуляция по принципу обратной связи
В. Частичный протеолиз молекулы фермента
С. Присоединение или отщепление белка-регулятора
D. Присоединение или отщепление низкомолекулярного эффектора (модулятора)
Е. Фосфорилирование молекулы
Задача 7.В клетках Е. соli синтез пиримидиновых нуклеотидов осуществляется по схеме метаболического пути: СО2+ NН3+2АТФ→ Р1→Р2→УТФ→ЦТФ. Конечный продукт является эффектором для фермента, катализирующего первую реакцию. При увеличении в клетке концентрации ЦТФ синтез пиримидиновых нуклеотидов прекращается. Какой вид регуляции описан?
А. Аллостерическая регуляция
В. Частичный протеолиз
С. Фосфорилирование молекулы фермента
D. Присоединение белков ингибиторов
Е. Отщепление белков ингибиторов
Задача 8. При панкреатитах нарушается переваривание жиров в желудочно-кишечном тракте, вследствие снижения активности панкреатической липазы, катализирующей гидролиз жиров. К какому классу относится этот фермент.
А. Оксидоредуктазы
В. Трансферазы
С. Гидролазы
D. Лиазы
Е. Изомеразы.
Задача 9.При обследовании больного установлено повышение в крови активности изоферментов креатинкиназы ММ1 и ММ3. К какому классу относится этот фермент?
А. Оксидоредуктазы
В. Трансферазы
С. Лиазы
D. Гидролазы
Е. Изомеразы
Правильность решения проверьте, сопоставив их с эталонами ответов.
Эталоны ответов к решению целевых обучающих задач:
3 – В, 4 – А, 5 – В, 7 – А.
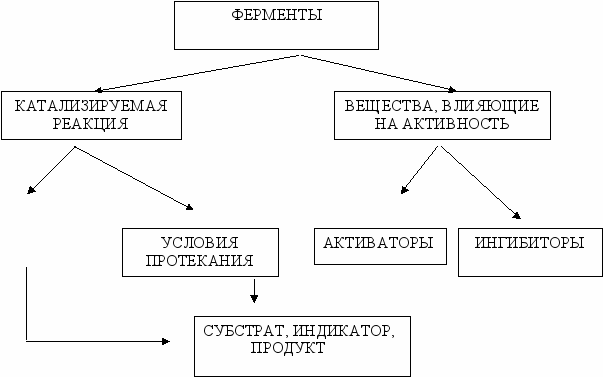
Инструкция к практическому занятию: “ Определение активности ферментов, исследование кинетики ферментативного катализа и влияния активаторов и ингибиторов“
Принцип работы:
Активаторы действуют на пространственную конфигурацию белковых молекул, помогая формированию активного центра и, тем самым, активируют фермент. В отличие от коферментов они не принимают непосредственного участия в реакции.
Активаторы некоторых ферментов : для амилазы слюны - хлорид натрия (NaCL), для пепсина- ионы водорода хлористоводородной кислоты, для липазы- желчные кислоты, для аденозинтрифосфатазы - ионы магния и марганца.
Ингибиторы также влияют на активный центр фермента, но при этом снижают каталитическую активность фермента. Нередко они являются конечными продуктами реакций какого либо биохимического процесса. Действие ингибиторов специфично для определенных ферментов или групп ферментов.
Материальное обеспечение: пробирки, 1% раствор крахмала, амилаза, 1% раствор NaCL, 1% раствор CuSO 4 , реактив Люголя
Работа 1.
Ход работы:
Разводят 1 мл слюны в 10 раз. В три пробирки наливают по 1 мл предварительно разведенной слюны. По предложенной ниже схеме ставят опыт:
№№ Фермент Субстрат Исследуемое Количество
(амилаза), слюна (р-р крахмала) соединение разв. 1:10

1. 1мл 1мл дист.вода 0,5мл
2. 1мл 1мл 1% NaCL 0,5мл
3
 . 1мл 1мл 1% CuSO 4 0,5мл
. 1мл 1мл 1% CuSO 4 0,5мл
Все пробирки инкубируют 10 минут при температуре 25 градусов.
- Определяют влияние исследуемых соединений на каталитическую функцию амилазы. Для этого проводят качественную реакцию на крахмал (субстрат). Во все пробирки добавляют по 1 капле реактива Люголя, содержащего йод, перемешивают, наблюдают окраску и определяют, в какой пробирке действует активатор или ингибитор. Целесообразно в каждую пробирку добавить до 2 мл дист. воды и перемешать. Окраска будет более наглядной.
ВЫВОДЫ:
Работа 2. Выполните лабораторную работу по индивидуальному заданию, полученному у преподавателя.
ВЫВОДЫ:
Подпись преподавателя:
Приложение 1
Граф логической структуры
СУБСТРАТ
ТЕМА 1.4. ИССЛЕДОВАНИЕ РОЛИ КОФАКТОРОВ И КОФЕРМЕНТНЫХ ФОРМ ВИТАМИНОВ В КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ ФЕРМЕНТОВ
Актуальность темы
Значение витаминов для нормальной жизнедеятельности организма не вызывает сомнений. Витамины являются составным компонентом сложных ферментов, образуя небелковую часть фермента – кофермент. Без кофермента сложный фермент не может функционировать, т.к кофермент, как правило, непосредственно контактирует с субстратом и является переносчиком электронов, атомов или групп атомов (аминогрупп, метильных групп и др.), тем самым участвуя в катализе определенных типов метаболических реакций. Знание коферментной функции витаминов необходимо для последующего изучения метаболизма органов и тканей в курсе биохимии, а также при изучении фармакологии, клинических и гигиенических дисциплин.Теперь ознакомьтесь с целями занятия.
Общая цель
Уметь обосновать биологическую функцию витаминов как структурных компонентов ферментов для использования на последующих кафедрах при объяснении нарушений метаболизма и их клинических проявлений при недостатке (избытке) витаминов в организме, а также для понимания принципов применения антивитаминов в лечебной практике.
. Конкретные цели: Цели исходного уровня:
Уметь:
| 1.Интерпретировать структуру витаминов и их коферментных форм. | 1.Интерпретировать структуру мононуклеотидов, сложных эфиров (каф. медицинской и фармацевтической химии). |
| 2.Анализировать причины нарушения синтеза коферментов. | 2. Интерпретировать принцип метода определения пирувата в биологических жидкостях (каф. медицинской и фармацевтической химии). |
| 3.Анализировать роль витаминов в обменных реакциях. | 3. Интерпретировать принцип метода определения лактата в биологических жидкостях(кафедра медицинской и фармацевтической химии). |
| 4.Интерпретировать метаболические нару- шения при отсутствии витаминов. | |
| 5.Интерпретировать конкурентное действие антивитаминов. | |
Для проверки исходного уровня Вам предлагается выполнить ряд заданий.
Задания для самопроверки и самокоррекции исходного уровня.
Задание 1. Студенту предложили синтезировать сложный эфир, предоставив следующие вещества: спирт, кислоту, альдегид, амин. Что он использовал, выполнив задание?
А. Кислоту и амин
В. Только кислоту
С. Только спирт
D. Спирт и альдегид
Е. Спирт и кислоту
Задание 2. Лабораторный анализ после гидролиза вещества выявил в гидролизате аденин, рибозу и фосфорную кислоту. Какой структуры исходное вещество?
А. Пептид
В. Нуклеозид
С. Мононуклеотид
D. Пентозофосфат
Е. Гликозаминогликан
Задание 3. Для определение пирувата его нужно превратить в гидразон по реакции:
СН3 NH-NH 2


 I I NO2
I I NO2 С=О + O2 N
С=О + O2 NI → гидразон
СООН
Какими функциональными группами реагируют вещества?
А. -СООН группой пирувата и -NO2 группой гидразина
В. О
II
-С- группой пирувата и -NO2 группой гидразина
C. -СООН группой пирувата и -NН2 группой гидразина
D. О группой пирувата и -NН2 группой гидразина
II
-C-


Е. О группой пирувата и - группой гидразина
II
-С-
